
- •1.Функції печінки
- •2. Панкреатичне і кишкове травлення. Роль жовчі в механізмі травлення
- •3.Синтез гема
- •4. Вторинні месенджери та їх роль в механізмах гормонального впливу на клітини-мішені
- •5. Нормальні і патологічні складові сечі
- •6.Катаболізм пуринових нуклеотидів
- •1.Види жовтяниць. Причини виникнення
- •2. Блокування біосинтезу білка дифтерійним токсином (адф-рибозилювання факторів трансляції)
- •3. Джерело енергії для м’язового скорочення. Атф, креатинфорфат. Особливості обміну в серцевому м’язі.
- •4. Всмоктування вуглеводів. Порушення травлення і всмоктування. Недостатність лактази
- •5. Орнітиновий цикл сечоутворення. Послідовність реакцій
- •6. Порушення обміну медіаторів і модуляторів головного мозку при психічних розладах. Нейрохімічні механізми дії психотропних препаратів
- •Розпад гема
- •Паренхіматозна жовтяниця. Причини. Біохімічні показники
- •Молекулярні механізми дії тиреоїдних гормонів.
- •Молекулярні механізми м’язового скорочення та розслаблення м’язів
- •Нейромедіатори. Рецептори для нейромедіаторів та фізіологічно активних сполук
- •Білковосинтезуюча система. Особливості генетичного коду
- •Орнітиновий цикл сечоутворення.
- •Обтураційна жовтяниця
- •Білки плазми крові. Альбуміни. Глобуліни. Фібриноген.
- •Біологічний ефект альдостерону.
- •Особливості метаболізму нервової тканини
- •Значення обміну мінеральних солей.
- •Механізм активації й функціонування каскадної системи згортання крові.
- •Види жовтяниць
- •Молекулярні механізми м’язового скорочення та розслаблення м’язів
- •Енергетичний обмін в головному мозку людини. Значення аеробного окислення глюкози.
- •Мікросомальне окислення і реакції кон’югації в печінці. Компоненти окислення. Роль цитохрома р-450
- •Розпад гема. Жовчні пігменти.
- •Молекулярні механізми м’язового скорочення та розслаблення м’язів
- •Всмоктування вуглеводів. Порушення травлення і всмоктування.
- •Класифікація гормонів: за місцем синтезу, хімічною природою, механізмом дії.
- •Біосинтез піримідинових нуклеотидів
- •Жіночі статеві гормони. Механізм дії
- •Загальна схема біосинтезу днк. Ферменти реплікації днк у прокаріотів та еукаріотів.
- •Розпад гема.
- •Біохімія нейромедіаторів та фізіологічно активних сполук.
- •Роль печінки в обміні білків, жирів та вуглеводів
- •Потреба в ліпідах, роль лейкотрієпів, простагландинів, тромбоксанів. Ліпіди і захворювання.
- •Етапи та механізми трансляції. Ініціація. Елонгація. Термі нація.
- •Гормони гіпофіза
- •2.Технологія трансплантації генів.
- •Дія стероїдних та тиреоїдних гормонів.
- •Дія гормонів білково-пептидної природи та катехоламінів
- •Транспортні рнк. Активація ак, Аміноацил-тРнк-синтетази. Кодони рнк
- •Гормони на обмін кальцію та фосфатів
- •Єдиний нейрогуморальний механізм регуляції
- •Цтк і механізми, що контролюють його у мозку
- •Катаболізм піримідинових нуклеотидів
- •Порушення гомеостазу кальцію
- •Хімічний склад поперечно-смугастих мязів.
- •3. Експресія генів на рівні транскрипції.
- •Гормони підшлункової. Цукровий діабет.
- •Травлення в шлунку.
- •Антибіотики
- •Сполучна тканина
2. Блокування біосинтезу білка дифтерійним токсином (адф-рибозилювання факторів трансляції)
П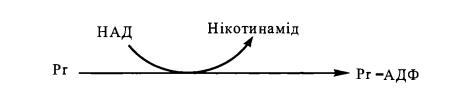 ри
АДФ-рибозилуванні відбувається приєднання
до білка, що підлягає ковалентній
модифікації, АДФ-рибозильного радикалу,
який відщеплюється від складної молекули
нікотинамідаденіндинуклеотиду (НАД)
ри
АДФ-рибозилуванні відбувається приєднання
до білка, що підлягає ковалентній
модифікації, АДФ-рибозильного радикалу,
який відщеплюється від складної молекули
нікотинамідаденіндинуклеотиду (НАД)
АДФ-рибозилування білків є механізмом регуляції багатьох видів клітинної активності, зокрема, експресії ядерного генетичного апарату. Особливим прикладом біологічного ефекту такої модифікації ферментного білка є дія холерного токсину, каталітична субодиниця якого АДФ-рибозилує аденілатциклазу мембран ентероцитів. Це, у свою чергу, супроводжується стимуляцією фосфорилування та активацією хлорного каналу мембран, який є відповідальним за транспорт у просвіт кишківника іонів СІ" та води, що і призводить до важкої діареї - головного клінічного прояву холери.
3. Джерело енергії для м’язового скорочення. Атф, креатинфорфат. Особливості обміну в серцевому м’язі.
м'язове скорочення, в основі якого лежить переміщення товстих і тонких філаментів, потребує участі АТФ; циклічне перетворення АТФ в АДФ є необхідною передумовою як скорочення, так і
розслаблення м'язів. Гідроліз АТФ до АДФ та Фн здійснюється завдяки АТФ-азній активності
глобулярних головок S1 міозину.
A. У м'язі, що перебуває в стані спокою, S1-головки міозину не сполучені з актиновими філамен-тами. Продукти гідролізу АТФ (АДФ та Фн) зв'язані з міозином.
B. При збудженні м'яза S1-головки зсуваються в напрямку тонких філаментів і сполучаються з
нитками актину (G-субодиницями). Фн вивільняється з комплексу з міозином.
C. Вивільнення АДФ з комплексу з міозином супроводжується конформаційним зсувом у
просторовому розташуванні головки S1, що зв'язана з актином (зміщенням кута між головкою і віссю міофібрили з 90° на 45°).
D. Взаємодія з актином молекули АТФ супроводжується розривом зв'язку між актином і міозином. S1-головка знову віддаляється від тонкого філамента.
E. АТФ, що вивільнився, гідролізується до АДФ та Фн, завдяки АТФ-азній активності вільних головок міозину. Продукти гідролізу знову сполучаються з міозином. Актинові та міозинові філамента готові до нового циклу взаємодії та пересування.

Генерація АТФ із креатинфосфату є найбільш швидким механізмом утворення АТФ при потребі термінового включення процесу м'язового скорочення. За рахунок дії креатинфосфокіназного (КФК) механізму можливе забезпечення інтенсивної роботи м'язів протягом 2-5 с - періоду, необхідного для підключення інших біоенергетичних механізмів. У період розслаблення м'язів відбувається ресинтез креатинфосфату за рахунок зворотної течії креатинкіназної реакції.
Міокард за своєю структурою та біохімічними властивостями близький до смугастих м'язів, зокрема до червоної скелетної мускулатури. Особливістю енергетичного обміну в міокарді є майже повністю аеробний характер, що зумовлює його високу чутливість до порушень у постачанні кисню, зокрема внаслідок звужень у коронарних артеріях. Як субстрат біологічного окислення міокард використовує здебільшого жирні кислоти, на окислення яких витрачається близько 70 % 02, що споживає серцевий м'яз (А. Я. Николаев, 1998). Частка жирних кислот у забезпеченні міокарда АТФ дещо зменшується після споживання їжі, а також в умовах фізичного навантаження; в зазначених умовах зростає окислення глюкози та молочної кислоти, відповідно.Регуляція м'язового скорочення в міокарді відбувається за механізмами, близькими до скелетних м'язів. Проте, на відміну від скелетних м'язів, головним джерелом Са2+ для скорочення кардіоміцитів є екстрацелюлярний кальцій, який при збудженні міокарда надходить у саркоплазму через канали плазматичних мембран.
