
- •Предисловие
- •Введение
- •Глава 1. Кинематика материальной точки и твердого тела
- •1.1. Кинематика поступательного движения материальной точки и твердого тела
- •1.2. Кинематика вращательного движения материальной точки
- •Контрольные вопросы:
- •Глава 2. Динамика материальной точки и поступательного движения твёрдого тела
- •2.1. Принцип относительности Галилея
- •2.2. Основные величины динамики
- •2.3. Законы Ньютона
- •Глава 3. Законы сохранения энергии и импульса
- •3.1. Сохраняющиеся величины
- •3.2. Работа. Мощность. Коэффициент полезного действия
- •3.3. Понятие поля. Консервативные силы. Потенциальная энергия
- •Пример 1.
- •Пример 2.
- •3.4. Кинетическая энергия
- •3.5. Закон сохранения механической энергии системы невзаимодействующих частиц
- •3.6. Закон сохранения полной механической энергии
- •3.7. Закон сохранения импульса
- •3.8. Применение законов сохранения энергии и импульса
- •Неупругий удар
- •Упругий удар
- •Явление отдачи при вылете снаряда из орудия
- •Контрольные вопросы:
- •Глава 4. Силы в природе
- •4.1. Взаимодействие в природе. Закон всемирного тяготения
- •4.2. Сила тяжести. Вес тела. Невесомость
- •Движение тела под действием силы тяжести
- •1. Движение тела вверх:
- •2. Движение тела вниз:
- •Движение тела по горизонтали:
- •4.3. Упругие силы
- •4.4. Силы трения
- •Трение покоя
- •Контрольные вопросы:
- •Глава 5. Динамика твердого тела
- •5.1. Движение твердого тела
- •5.2. Степени свободы
- •5.3. Центр масс
- •5.4. Момент импульса
- •5.5. Главные моменты инерции
- •Теорема Гюйгенса – Штейнера
- •5.6. Момент силы
- •5.7. Кинетическая энергия вращающегося твердого тела
- •Глава 6. Закон сохранения момента импульса
- •6.1. Закон сохранения момента импульса
- •6.2. Условие сохранения момента импульса относительно оси для незамкнутой системы
- •6.3. Закон сохранения момента импульса для вращающейся системы тел
- •6.4. Применение закона сохранения момента импульса
- •Контрольные вопросы:
- •Глава 7. Колебательное движение
- •7.1. Классификация колебательного движения
- •7.2. Гармонические колебания
- •7.3. Математический маятник
- •7.4. Физический маятник
- •7.5. Сложение колебаний Сложение одинаково направленных колебаний
- •Сложение взаимно перпендикулярных колебаний
- •7.6. Затухающие колебания
- •7.7. Вынужденные колебания
- •Контрольные вопросы:
- •Глава 8. Молекулярная физика
- •8.1. Основные положения молекулярно-кинетической теории
- •Основные величины, характеризующие массу, размер и число молекул в веществе:
- •8.2. Уравнение состояния идеального газа
- •Уравнение состояния идеального газа
- •8.3. Основное уравнение молекулярно-кинетической теории
- •Основное уравнение мкт:
- •8.4. Взаимодействие молекул
- •8.5. Реальные газы. Уравнение Ван-дер-Ваальса Фазовые равновесия и переходы
- •8.6. Характеристики жидкого состояния
- •5. Жидкости с водородными связями (h2o);
- •Свойства жидкостей:
- •Контрольные вопросы:
- •Глава 9. Равновесная термодинамика
- •9.1. Внутренняя энергия
- •9.2. Работа. Количество теплоты
- •9.3. Термодинамические системы
- •9.4. Первое начало термодинамики
- •9.4. Первое начало термодинамики
- •9.5. Второе и третье начало термодинамики
- •Второе начало термодинамики
- •Третье начало термодинамики
- •9.6. Теплоёмкость идеального газа
- •9.7. Применение первого начала термодинамики для вывода уравнения адиабатного процесса
- •Уравнение адиабатного процесса в параметрах t,V:
- •9.8. Работа, совершаемая газом при различных процессах
- •9.9. Графическое изображение термодинамических процессов
- •9.10. Применение законов термодинамики для расчета круговых процессов
- •К. П. Д. Идеальной тепловой машины Карно
- •Теорема Карно:
- •Контрольные вопросы:
- •Глава 10. Элементы статистической физики
- •10.1. Статистический вес
- •10.2. Энтропия
- •10.3. Распределение Гиббса
- •10.4. Распределение молекул по скоростям Максвелла
- •10.5. Распределение Больцмана молекул в потенциальном поле. Барометрическая формула
- •Контрольные вопросы:
- •Глава 11. Электростатическое поле
- •11.1. Закон сохранения заряда
- •11.2. Взаимодействие зарядов. Закон Кулона
- •Закон Кулона
- •Принцип суперпозиции сил
- •11.3. Напряженность электрического поля
- •Принцип суперпозиции напряженностей
- •Контрольные вопросы:
- •Глава 12. Теорема остроградского-гаусса для электростатического поля
- •12.1. Теорема Остроградского-Гаусса для электростатического поля в вакууме
- •12.2. Применение теоремы Остроградского - Гаусса для расчета электростатического поля равномерно заряженного сферического проводника
- •12.3. Применение теоремы Остроградского - Гаусса для расчета электростатического поля бесконечной заряженной плоскости
- •12.4. Применение теоремы Остроградского - Гаусса для расчета электростатического поля бесконечного заряженного цилиндра
- •Г 153 лава 13. Работа электрического поля. Потенциал.
- •13.1. Работа электрического поля по перемещению заряда
- •13.2. Потенциальная энергия взаимодействия зарядов
- •13.3. Электрический потенциал
- •13.4. Потенциал заряженной сферы, плоскости, цилиндра
- •Потенциал электрического поля заряженной плоскости:
- •Потенциал электрического поля заряженного цилиндра:
- •Глава 14. Диэлектрики в электростатическом поле
- •14.1. Проводники и диэлектрики
- •14.2. Типы диэлектриков
- •14.3. Поляризация диэлектриков
- •14.4. Напряженность электрического поля и электрическое смещение
- •Контрольные вопросы:
- •Глава 15. Проводники в электростатическом поле
- •15.1. Распределение зарядов в проводниках
- •15.2. Электроемкость проводников
- •Электроемкость сферического проводника
- •15.3. Конденсаторы
- •Электроемкость плоского конденсатора
- •15.4. Энергия заряженных проводников и конденсаторов. Энергия электрического поля
- •Глава 16. Постоянный ток закон ома
- •16.1. Электрический ток
- •16.2. Разность потенциалов, напряжение и электродвижущая сила
- •16.3. Закон Ома. Сопротивление проводников
- •16.4. Закон Ома для участка цепи и замкнутой цепи. Закон Ома для плотности тока
- •Контрольные вопросы:
- •Глава 17. Работа электрического тока. Мощность. Закон джоуля – ленца
- •17.1. Работа электрического тока
- •17.2. Мощность электрического тока
- •17.3. Закон Джоуля - Ленца для участка цепи
- •17.4. Применение закона Джоуля – Ленца
- •Контрольные вопросы:
- •Глава 18. Релятивистская кинематика
- •18.1. Теория относительности Эйнштейна
- •Преобразования Лоренца для координат и времени
- •18.2. Следствия из преобразований Лоренца
- •18.3. Интервал между двумя событиями. Абсолютность интервала
- •18.4. Преобразование скоростей
- •Глава 19. Релятивисткая динамика
- •19.1. Принцип наименьшего действия Гамильтона
- •19.2. Импульс частицы
- •19.3. Сила
- •19.4. Энергия
- •19.5. Связь между энергией и импульсом
- •19.6. Четырехмерные векторы
- •19.7. Законы сохранения в релятивистской механике
- •Список литературы
- •Содержание предисловие 3 введение 4
- •Список литературы 215
10.2. Энтропия
Для характеристики вероятности состояния вводят энтропию:
![]() (10.1)
(10.1)
где k - постоянная Больцмана.
Пусть
![]() статистические веса различных подсистем
среды, тогда система будет иметь число
микросостояний:
статистические веса различных подсистем
среды, тогда система будет иметь число
микросостояний:
![]()
Отсюда находим энтропию замкнутой системы:
![]()
Энтропия
сложной системы равна сумме энтропий
её частей. В нашем примере мы рассматривали
только одну подсистему, статистический
вес которой
![]() зависит от энергии подсистемы
зависит от энергии подсистемы
![]() .
Энтропия также является функцией от
энергии:
.
Энтропия также является функцией от
энергии:
![]()
Величина, обратная производной энтропии системы S по её энергии называется абсолютной температурой:
![]() (10.2)
(10.2)
отсюда следует
![]() (10.3)
(10.3)
Равновесным называется состояние, имеющее наибольший статистический вес. Равновесное состояние не изменяется со временем.
В
рассмотренном примере последовательно
изучаются равновесные состояния
(статистический вес изменяется от
до![]() образующие стадии равновесного процесса
перехода системы в наиболее вероятное
из макросостояний. Этот процесс является
необратимым, т.к. процесс, обратный ему,
является маловероятным. Так, если из
одной комнаты газ проник в другую, то
невозможно представить, чтобы он через
какое - то время опять вернулся в первую
комнату.
образующие стадии равновесного процесса
перехода системы в наиболее вероятное
из макросостояний. Этот процесс является
необратимым, т.к. процесс, обратный ему,
является маловероятным. Так, если из
одной комнаты газ проник в другую, то
невозможно представить, чтобы он через
какое - то время опять вернулся в первую
комнату.
Вероятность
состояния
![]() системы, находящейся в тепловом контакте
со средой, имеющей постоянную температуру
T,
связана со статистическим весом
системы, находящейся в тепловом контакте
со средой, имеющей постоянную температуру
T,
связана со статистическим весом
![]() соотношением:
соотношением:
![]()
где
постоянная нормировки A
определяется из условия:
![]() (вероятность, что система будет находиться
в одном из возможных состояний равна
1).
(вероятность, что система будет находиться
в одном из возможных состояний равна
1).
Статистический вес связан с энтропией данного состояния:
![]() ,
,
а энтропия при Т = const описывается соотношением:
![]() . (10.4)
. (10.4)
10.3. Распределение Гиббса
Каноническое распределение Гиббса, связывающее вероятность состояния и энергию:
![]() (10.5)
(10.5)
где
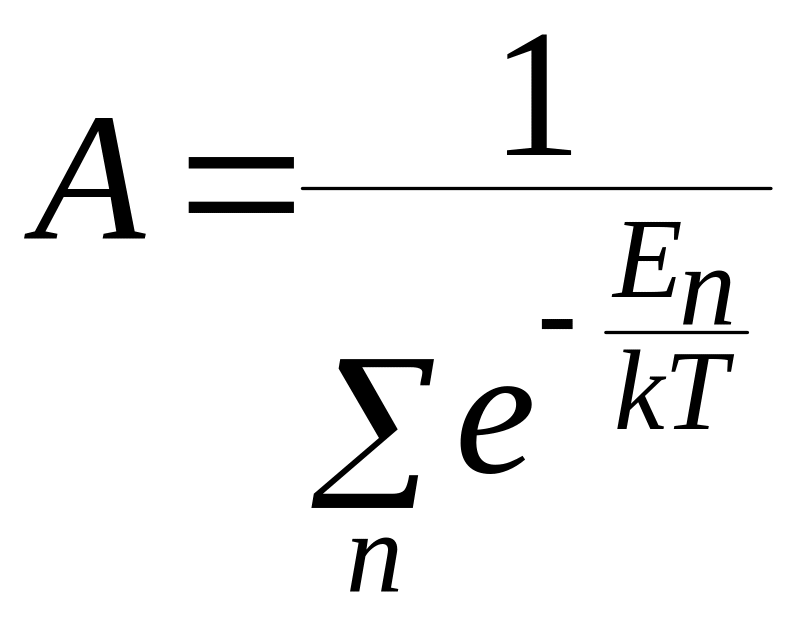 .
.
Здесь
![]() - полная энергия, равная сумме кинетической
- полная энергия, равная сумме кинетической
![]() и потенциальной
и потенциальной
![]() энергии всех молекул, образующих
систему:
энергии всех молекул, образующих
систему:
![]()
Энергия
зависит от координат q
и импульсов p
молекул:
![]() В дифференциальной форме распределение
Гиббса имеет вид:
В дифференциальной форме распределение
Гиббса имеет вид:
![]() (10.6)
(10.6)
10.4. Распределение молекул по скоростям Максвелла
Если внешнее поле отсутствует, то полная энергия в распределении Гиббса равна кинетической энергии , которая может быть записана в виде:
![]() (10.7)
(10.7)
В
частном случае
![]() из распределения Гиббса следует
распределение молекул по скоростям,
полученное Максвеллом:
из распределения Гиббса следует
распределение молекул по скоростям,
полученное Максвеллом:
![]() ,
,
где
 - функция распределения молекул по
скоростям;
- функция распределения молекул по
скоростям;
- число частиц в единице объёма;
![]() -
масса частиц;
-
масса частиц;
- абсолютная температура;
- постоянная Больцмана.
Рассмотрим
пространство, где вместо координат по
осям отложены скорости молекул
![]() (рис.10.2). Точка в этом пространстве
соответствует определённой скорости
молекулы.
(рис.10.2). Точка в этом пространстве
соответствует определённой скорости
молекулы.
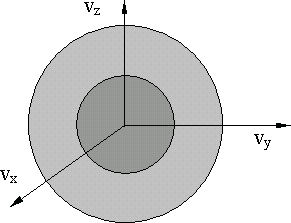
Рис. 10.2.
Распределение
точек относительно начала координат
в среднем можно считать симметричным,
следовательно, плотность частиц в
пространстве скоростей
зависит только от модуля скорости
![]() :
:
![]()
Найдём
количество частиц, находящихся в объёме
![]() заключённом между двумя сферами с
радиусами
и
заключённом между двумя сферами с
радиусами
и
![]()
Распределение
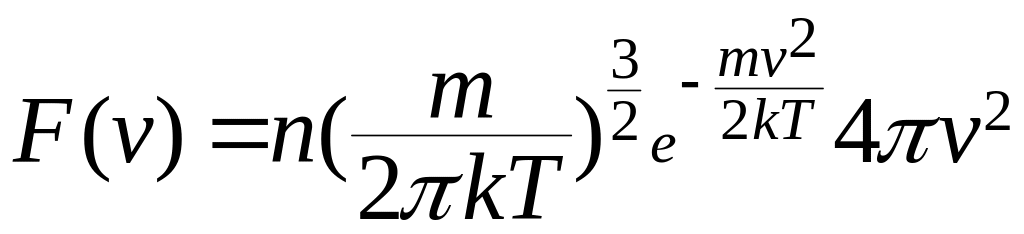 (10.8)
(10.8)
называется распределением Максвелла по абсолютным значениям скоростей (рис. 10.3).
Максимальное
значение функции распределения
![]() соответствует наиболее вероятной
скорости молекул:
соответствует наиболее вероятной
скорости молекул:
 (10.9)
(10.9)
Распределение Максвелла позволяет найти среднюю арифметическую скорость:
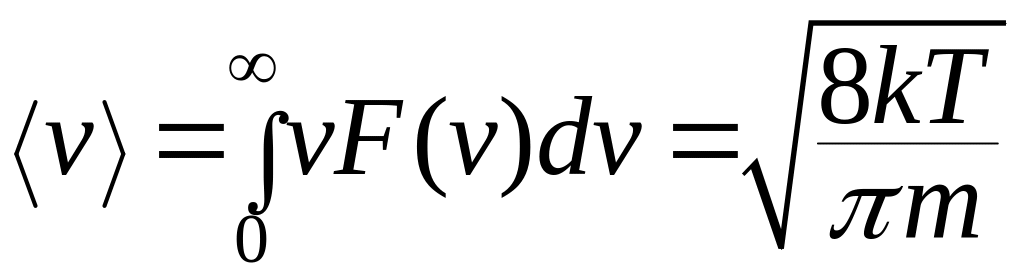 (10.10)
(10.10)
и среднюю квадратичную скорость:
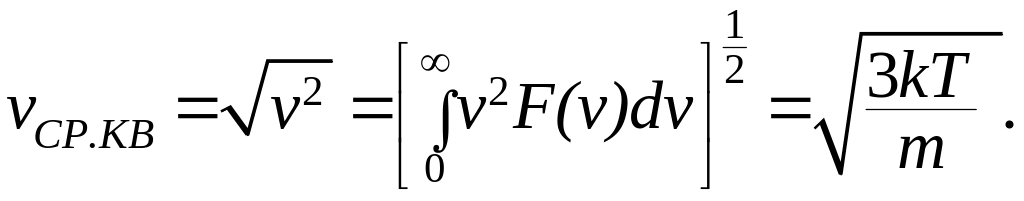 (10.11)
(10.11)
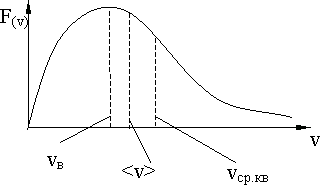
Рис. 10.3.
В опытах О. Штерна распределение Максвелла подтверждено экспериментально. С поверхности нити, покрытой серебром и помещённой вдоль оси вращающегося цилиндра, при нагревании испарялись молекулы. В зависимости от скорости, молекулы попадали в различные точки внутренней поверхности цилиндра.
