
- •Предисловие
- •Введение
- •Глава 1. Кинематика материальной точки и твердого тела
- •1.1. Кинематика поступательного движения материальной точки и твердого тела
- •1.2. Кинематика вращательного движения материальной точки
- •Контрольные вопросы:
- •Глава 2. Динамика материальной точки и поступательного движения твёрдого тела
- •2.1. Принцип относительности Галилея
- •2.2. Основные величины динамики
- •2.3. Законы Ньютона
- •Глава 3. Законы сохранения энергии и импульса
- •3.1. Сохраняющиеся величины
- •3.2. Работа. Мощность. Коэффициент полезного действия
- •3.3. Понятие поля. Консервативные силы. Потенциальная энергия
- •Пример 1.
- •Пример 2.
- •3.4. Кинетическая энергия
- •3.5. Закон сохранения механической энергии системы невзаимодействующих частиц
- •3.6. Закон сохранения полной механической энергии
- •3.7. Закон сохранения импульса
- •3.8. Применение законов сохранения энергии и импульса
- •Неупругий удар
- •Упругий удар
- •Явление отдачи при вылете снаряда из орудия
- •Контрольные вопросы:
- •Глава 4. Силы в природе
- •4.1. Взаимодействие в природе. Закон всемирного тяготения
- •4.2. Сила тяжести. Вес тела. Невесомость
- •Движение тела под действием силы тяжести
- •1. Движение тела вверх:
- •2. Движение тела вниз:
- •Движение тела по горизонтали:
- •4.3. Упругие силы
- •4.4. Силы трения
- •Трение покоя
- •Контрольные вопросы:
- •Глава 5. Динамика твердого тела
- •5.1. Движение твердого тела
- •5.2. Степени свободы
- •5.3. Центр масс
- •5.4. Момент импульса
- •5.5. Главные моменты инерции
- •Теорема Гюйгенса – Штейнера
- •5.6. Момент силы
- •5.7. Кинетическая энергия вращающегося твердого тела
- •Глава 6. Закон сохранения момента импульса
- •6.1. Закон сохранения момента импульса
- •6.2. Условие сохранения момента импульса относительно оси для незамкнутой системы
- •6.3. Закон сохранения момента импульса для вращающейся системы тел
- •6.4. Применение закона сохранения момента импульса
- •Контрольные вопросы:
- •Глава 7. Колебательное движение
- •7.1. Классификация колебательного движения
- •7.2. Гармонические колебания
- •7.3. Математический маятник
- •7.4. Физический маятник
- •7.5. Сложение колебаний Сложение одинаково направленных колебаний
- •Сложение взаимно перпендикулярных колебаний
- •7.6. Затухающие колебания
- •7.7. Вынужденные колебания
- •Контрольные вопросы:
- •Глава 8. Молекулярная физика
- •8.1. Основные положения молекулярно-кинетической теории
- •Основные величины, характеризующие массу, размер и число молекул в веществе:
- •8.2. Уравнение состояния идеального газа
- •Уравнение состояния идеального газа
- •8.3. Основное уравнение молекулярно-кинетической теории
- •Основное уравнение мкт:
- •8.4. Взаимодействие молекул
- •8.5. Реальные газы. Уравнение Ван-дер-Ваальса Фазовые равновесия и переходы
- •8.6. Характеристики жидкого состояния
- •5. Жидкости с водородными связями (h2o);
- •Свойства жидкостей:
- •Контрольные вопросы:
- •Глава 9. Равновесная термодинамика
- •9.1. Внутренняя энергия
- •9.2. Работа. Количество теплоты
- •9.3. Термодинамические системы
- •9.4. Первое начало термодинамики
- •9.4. Первое начало термодинамики
- •9.5. Второе и третье начало термодинамики
- •Второе начало термодинамики
- •Третье начало термодинамики
- •9.6. Теплоёмкость идеального газа
- •9.7. Применение первого начала термодинамики для вывода уравнения адиабатного процесса
- •Уравнение адиабатного процесса в параметрах t,V:
- •9.8. Работа, совершаемая газом при различных процессах
- •9.9. Графическое изображение термодинамических процессов
- •9.10. Применение законов термодинамики для расчета круговых процессов
- •К. П. Д. Идеальной тепловой машины Карно
- •Теорема Карно:
- •Контрольные вопросы:
- •Глава 10. Элементы статистической физики
- •10.1. Статистический вес
- •10.2. Энтропия
- •10.3. Распределение Гиббса
- •10.4. Распределение молекул по скоростям Максвелла
- •10.5. Распределение Больцмана молекул в потенциальном поле. Барометрическая формула
- •Контрольные вопросы:
- •Глава 11. Электростатическое поле
- •11.1. Закон сохранения заряда
- •11.2. Взаимодействие зарядов. Закон Кулона
- •Закон Кулона
- •Принцип суперпозиции сил
- •11.3. Напряженность электрического поля
- •Принцип суперпозиции напряженностей
- •Контрольные вопросы:
- •Глава 12. Теорема остроградского-гаусса для электростатического поля
- •12.1. Теорема Остроградского-Гаусса для электростатического поля в вакууме
- •12.2. Применение теоремы Остроградского - Гаусса для расчета электростатического поля равномерно заряженного сферического проводника
- •12.3. Применение теоремы Остроградского - Гаусса для расчета электростатического поля бесконечной заряженной плоскости
- •12.4. Применение теоремы Остроградского - Гаусса для расчета электростатического поля бесконечного заряженного цилиндра
- •Г 153 лава 13. Работа электрического поля. Потенциал.
- •13.1. Работа электрического поля по перемещению заряда
- •13.2. Потенциальная энергия взаимодействия зарядов
- •13.3. Электрический потенциал
- •13.4. Потенциал заряженной сферы, плоскости, цилиндра
- •Потенциал электрического поля заряженной плоскости:
- •Потенциал электрического поля заряженного цилиндра:
- •Глава 14. Диэлектрики в электростатическом поле
- •14.1. Проводники и диэлектрики
- •14.2. Типы диэлектриков
- •14.3. Поляризация диэлектриков
- •14.4. Напряженность электрического поля и электрическое смещение
- •Контрольные вопросы:
- •Глава 15. Проводники в электростатическом поле
- •15.1. Распределение зарядов в проводниках
- •15.2. Электроемкость проводников
- •Электроемкость сферического проводника
- •15.3. Конденсаторы
- •Электроемкость плоского конденсатора
- •15.4. Энергия заряженных проводников и конденсаторов. Энергия электрического поля
- •Глава 16. Постоянный ток закон ома
- •16.1. Электрический ток
- •16.2. Разность потенциалов, напряжение и электродвижущая сила
- •16.3. Закон Ома. Сопротивление проводников
- •16.4. Закон Ома для участка цепи и замкнутой цепи. Закон Ома для плотности тока
- •Контрольные вопросы:
- •Глава 17. Работа электрического тока. Мощность. Закон джоуля – ленца
- •17.1. Работа электрического тока
- •17.2. Мощность электрического тока
- •17.3. Закон Джоуля - Ленца для участка цепи
- •17.4. Применение закона Джоуля – Ленца
- •Контрольные вопросы:
- •Глава 18. Релятивистская кинематика
- •18.1. Теория относительности Эйнштейна
- •Преобразования Лоренца для координат и времени
- •18.2. Следствия из преобразований Лоренца
- •18.3. Интервал между двумя событиями. Абсолютность интервала
- •18.4. Преобразование скоростей
- •Глава 19. Релятивисткая динамика
- •19.1. Принцип наименьшего действия Гамильтона
- •19.2. Импульс частицы
- •19.3. Сила
- •19.4. Энергия
- •19.5. Связь между энергией и импульсом
- •19.6. Четырехмерные векторы
- •19.7. Законы сохранения в релятивистской механике
- •Список литературы
- •Содержание предисловие 3 введение 4
- •Список литературы 215
8.3. Основное уравнение молекулярно-кинетической теории
Молекулярно-кинетическая теория объясняет давление газа на стенки сосуда как результат соударения молекул со стенками. Рассмотрим движение молекул одноатомного идеального газа (рис. 8.4). При упругом соударении со стенкой молекула передает ей импульс:
![]() .
.
В
объеме
![]() находится число молекул:
находится число молекул:
![]() ,
,
где - число молекул в единице объема;
![]() -
площадь поверхности стенки;
-
площадь поверхности стенки;
![]() -
путь, пройденный молекулой за время
-
путь, пройденный молекулой за время
![]() .
.
Молекулы движутся во всех направлениях. Вдоль данного направления движется 1/6 часть молекул, т.е.
![]() .
.
Молекулы передают стенке суммарный импульс:
![]() .
.
По второму закону Ньютона изменение импульса во времени вызывает появление силы:
![]() .
.
Давлением
называется физическая величина Р, равная
пределу отношения численного значения
нормальной силы![]() ,
действующей на участок поверхности
тела площадью
,
к величине
при
,
действующей на участок поверхности
тела площадью
,
к величине
при
![]()
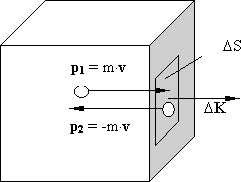
Рис. 8.4.
![]()
Давление,
оказываемое на стенку сосуда:
![]() В этом выражении
В этом выражении
![]() - среднеквадратичная скорость, поскольку
молекулы движутся с различными скоростями.
- среднеквадратичная скорость, поскольку
молекулы движутся с различными скоростями.
Основное уравнение мкт:
![]() (8.10)
(8.10)
где
![]() -
средняя кинетическая энергия
поступательного движения молекул газа.
-
средняя кинетическая энергия
поступательного движения молекул газа.
Кинетическая энергия одной молекулы одноатомного идеального газа:
![]() (8.11)
(8.11)
Подставим (8.11) в уравнение (8.10) , находим:
![]() (8.12)
(8.12)
Давление Р прямо пропорционально концентрации частиц и средней кинетической энергии движения молекул. Абсолютная температура Т является мерой средней кинетической энергии поступательного движения молекул идеального газа:
![]() (8.13)
(8.13)
Температура характеризует степень нагретости тела, она может измеряться косвенным путем с помощью термометров, имеющих различную шкалу:
1.
Шкала Цельсия:![]() ;
;
2.
Шкала Фаренгейта:
![]() ;
;
Связь
температуры по шкале Цельсия с температурой
по шкале Фаренгейта:
![]() .
.
3
101![]() .
Кельвин равен по величине 1 градусу
шкалы Цельсия.
.
Кельвин равен по величине 1 градусу
шкалы Цельсия.
Для
практических целей используется
Международная практическая температурная
шкала:
![]() .
Самой низкой является температура
абсолютного нуля: самой высокой -
температура на Солнце и других звездах:
.
Самой низкой является температура
абсолютного нуля: самой высокой -
температура на Солнце и других звездах:
![]() .
В кондитерских печах
.
В кондитерских печах
![]() ,
в металлургии
,
в металлургии
![]() .
.
8.4. Взаимодействие молекул
В
зависимости от температуры вещество
может находиться в газообразном, жидком
или твердом состоянии. При высоких
температурах,
![]() ,
происходит ионизация и вещество переходит
в состояние плазмы. Плазма – частично
или полностью ионизованный газ, в целом
нейтральный, т. к. плотности положительных
и отрицательных зарядов одинаковы.
,
происходит ионизация и вещество переходит
в состояние плазмы. Плазма – частично
или полностью ионизованный газ, в целом
нейтральный, т. к. плотности положительных
и отрицательных зарядов одинаковы.
Для характеристики состояния вещества определяющую роль играет взаимодействие молекул. В идеальном газе взаимодействием молекул можно пренебречь. При увеличении плотности газа и температуры уже нельзя пренебречь процессами столкновения, поэтому необходимо учитывать размеры молекул и их взаимодействие. Молекулярное взаимодействие имеет электромагнитную и квантовую природу.
П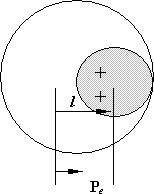 ри
сближении на расстояние
ри
сближении на расстояние
![]() возникают силы притяжения, называемые
ван – дер – ваальсовыми силами.
возникают силы притяжения, называемые
ван – дер – ваальсовыми силами.
Э
Рис. 8.5.![]() направлен от центра отрицательного к
центру положительного заряда (рис. 8.5).
направлен от центра отрицательного к
центру положительного заряда (рис. 8.5).
Если молекулы обладают дипольным электрическим моментом Pe, или более высокого порядка – квадрупольным Qe и т. д., то сила взаимодействия между молекулами называется ориентационной.
Поскольку молекула в целом нейтральна, то на большом расстоянии от центра молекулы электрическое поле равно нулю.
Потенциал системы зарядов:
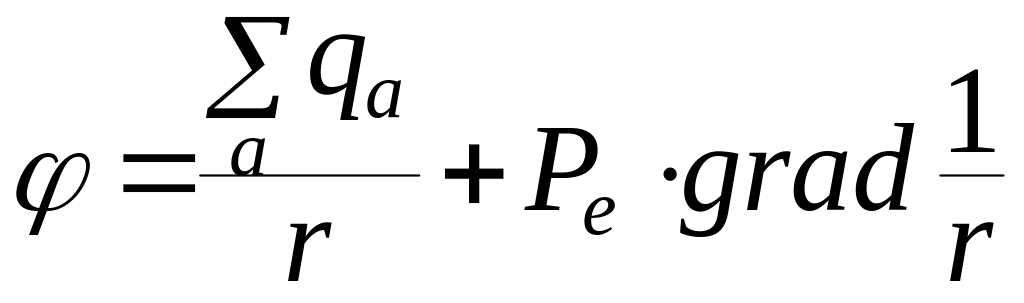 (8.14)
(8.14)
где r – расстояние от центра молекулы. Для нейтральной системы
![]() ,
тогда потенциал
,
тогда потенциал
![]() .
.
Найдем напряженность электрического поля:
![]() (8.15)
(8.15)
В направлении , перпендикулярном к оси диполя напряженность электрического поля:
![]() (8.16)
(8.16)
Электрическое поле молекулы действует на заряженные частицы соседней молекулы, что приводит к ориентации дипольных моментов. Сила взаимодействия двух диполей:
![]() (8.17)
(8.17)
где r – расстояние между центрами молекул.
Молекулы, не обладающие дипольным моментом, деформируются в электрическом поле соседней молекулы, т. к. смещаются центры положительного и отрицательного зарядов. Между молекулами возникают индукционные силы:
![]() (8.18)
(8.18)
где - поляризуемость молекулы.
Колебания электронов в молекуле возбуждают колебания электронов в другой молекуле. Когерентные колебания, происходящие с одинаковой частотой и в одинаковой фазе, приводят к дисперсному взаимодействию, которое характеризуется силой:
![]() (8.19)
(8.19)
где I – потенциал ионизации молекулы.
При
сближении молекул на расстояние
![]() возникает квантовое обменное
взаимодействие, приводящее к образованию
химической связи или к отталкиванию:
возникает квантовое обменное
взаимодействие, приводящее к образованию
химической связи или к отталкиванию:
![]() (8.20)
(8.20)
Результирующая сила:
![]() (8.21)
(8.21)
где
постоянные
![]() и
и
![]() - характеристики, зависящие от
поляризуемости и от потенциала ионизации
молекул.
- характеристики, зависящие от
поляризуемости и от потенциала ионизации
молекул.
Энергия
молекул складывается из кинетической
энергии
![]() и потенциальной энергии взаимодействия
вз.:
и потенциальной энергии взаимодействия
вз.:
![]() (8.22)
(8.22)
Пусть
одна из молекул покоится. На значительном
расстоянии от нее энергия движущейся
молекулы равна кинетической энергии:
![]() .
При сближении молекул появляется
потенциальная энергия:
.
При сближении молекул появляется
потенциальная энергия:
![]() (8.23)
(8.23)
При
движении в области потенциальной ямы
возрастает скорость молекулы (![]() )
и кинетическая энергия
,
но полная энергия системы молекул
остается постоянной. При дальнейшем
сближении начинается действие сил
отталкивания. В состоянии равновесия
энергия взаимодействия имеет минимальную
величину.
)
и кинетическая энергия
,
но полная энергия системы молекул
остается постоянной. При дальнейшем
сближении начинается действие сил
отталкивания. В состоянии равновесия
энергия взаимодействия имеет минимальную
величину.
Минимальное расстояние сближения молекул называется эффективным диаметром молекулы: dэфф. (r > dэфф. – притяжение, r < dэфф. – отталкивание). Молекулярные силы не зависят от числа молекул, т.к. имеет значение воздействие на молекулу только ее ближайшего окружения, вследствие короткодействия молекулярных сил.
