
- •Предисловие
- •Введение
- •Глава 1. Кинематика материальной точки и твердого тела
- •1.1. Кинематика поступательного движения материальной точки и твердого тела
- •1.2. Кинематика вращательного движения материальной точки
- •Контрольные вопросы:
- •Глава 2. Динамика материальной точки и поступательного движения твёрдого тела
- •2.1. Принцип относительности Галилея
- •2.2. Основные величины динамики
- •2.3. Законы Ньютона
- •Глава 3. Законы сохранения энергии и импульса
- •3.1. Сохраняющиеся величины
- •3.2. Работа. Мощность. Коэффициент полезного действия
- •3.3. Понятие поля. Консервативные силы. Потенциальная энергия
- •Пример 1.
- •Пример 2.
- •3.4. Кинетическая энергия
- •3.5. Закон сохранения механической энергии системы невзаимодействующих частиц
- •3.6. Закон сохранения полной механической энергии
- •3.7. Закон сохранения импульса
- •3.8. Применение законов сохранения энергии и импульса
- •Неупругий удар
- •Упругий удар
- •Явление отдачи при вылете снаряда из орудия
- •Контрольные вопросы:
- •Глава 4. Силы в природе
- •4.1. Взаимодействие в природе. Закон всемирного тяготения
- •4.2. Сила тяжести. Вес тела. Невесомость
- •Движение тела под действием силы тяжести
- •1. Движение тела вверх:
- •2. Движение тела вниз:
- •Движение тела по горизонтали:
- •4.3. Упругие силы
- •4.4. Силы трения
- •Трение покоя
- •Контрольные вопросы:
- •Глава 5. Динамика твердого тела
- •5.1. Движение твердого тела
- •5.2. Степени свободы
- •5.3. Центр масс
- •5.4. Момент импульса
- •5.5. Главные моменты инерции
- •Теорема Гюйгенса – Штейнера
- •5.6. Момент силы
- •5.7. Кинетическая энергия вращающегося твердого тела
- •Глава 6. Закон сохранения момента импульса
- •6.1. Закон сохранения момента импульса
- •6.2. Условие сохранения момента импульса относительно оси для незамкнутой системы
- •6.3. Закон сохранения момента импульса для вращающейся системы тел
- •6.4. Применение закона сохранения момента импульса
- •Контрольные вопросы:
- •Глава 7. Колебательное движение
- •7.1. Классификация колебательного движения
- •7.2. Гармонические колебания
- •7.3. Математический маятник
- •7.4. Физический маятник
- •7.5. Сложение колебаний Сложение одинаково направленных колебаний
- •Сложение взаимно перпендикулярных колебаний
- •7.6. Затухающие колебания
- •7.7. Вынужденные колебания
- •Контрольные вопросы:
- •Глава 8. Молекулярная физика
- •8.1. Основные положения молекулярно-кинетической теории
- •Основные величины, характеризующие массу, размер и число молекул в веществе:
- •8.2. Уравнение состояния идеального газа
- •Уравнение состояния идеального газа
- •8.3. Основное уравнение молекулярно-кинетической теории
- •Основное уравнение мкт:
- •8.4. Взаимодействие молекул
- •8.5. Реальные газы. Уравнение Ван-дер-Ваальса Фазовые равновесия и переходы
- •8.6. Характеристики жидкого состояния
- •5. Жидкости с водородными связями (h2o);
- •Свойства жидкостей:
- •Контрольные вопросы:
- •Глава 9. Равновесная термодинамика
- •9.1. Внутренняя энергия
- •9.2. Работа. Количество теплоты
- •9.3. Термодинамические системы
- •9.4. Первое начало термодинамики
- •9.4. Первое начало термодинамики
- •9.5. Второе и третье начало термодинамики
- •Второе начало термодинамики
- •Третье начало термодинамики
- •9.6. Теплоёмкость идеального газа
- •9.7. Применение первого начала термодинамики для вывода уравнения адиабатного процесса
- •Уравнение адиабатного процесса в параметрах t,V:
- •9.8. Работа, совершаемая газом при различных процессах
- •9.9. Графическое изображение термодинамических процессов
- •9.10. Применение законов термодинамики для расчета круговых процессов
- •К. П. Д. Идеальной тепловой машины Карно
- •Теорема Карно:
- •Контрольные вопросы:
- •Глава 10. Элементы статистической физики
- •10.1. Статистический вес
- •10.2. Энтропия
- •10.3. Распределение Гиббса
- •10.4. Распределение молекул по скоростям Максвелла
- •10.5. Распределение Больцмана молекул в потенциальном поле. Барометрическая формула
- •Контрольные вопросы:
- •Глава 11. Электростатическое поле
- •11.1. Закон сохранения заряда
- •11.2. Взаимодействие зарядов. Закон Кулона
- •Закон Кулона
- •Принцип суперпозиции сил
- •11.3. Напряженность электрического поля
- •Принцип суперпозиции напряженностей
- •Контрольные вопросы:
- •Глава 12. Теорема остроградского-гаусса для электростатического поля
- •12.1. Теорема Остроградского-Гаусса для электростатического поля в вакууме
- •12.2. Применение теоремы Остроградского - Гаусса для расчета электростатического поля равномерно заряженного сферического проводника
- •12.3. Применение теоремы Остроградского - Гаусса для расчета электростатического поля бесконечной заряженной плоскости
- •12.4. Применение теоремы Остроградского - Гаусса для расчета электростатического поля бесконечного заряженного цилиндра
- •Г 153 лава 13. Работа электрического поля. Потенциал.
- •13.1. Работа электрического поля по перемещению заряда
- •13.2. Потенциальная энергия взаимодействия зарядов
- •13.3. Электрический потенциал
- •13.4. Потенциал заряженной сферы, плоскости, цилиндра
- •Потенциал электрического поля заряженной плоскости:
- •Потенциал электрического поля заряженного цилиндра:
- •Глава 14. Диэлектрики в электростатическом поле
- •14.1. Проводники и диэлектрики
- •14.2. Типы диэлектриков
- •14.3. Поляризация диэлектриков
- •14.4. Напряженность электрического поля и электрическое смещение
- •Контрольные вопросы:
- •Глава 15. Проводники в электростатическом поле
- •15.1. Распределение зарядов в проводниках
- •15.2. Электроемкость проводников
- •Электроемкость сферического проводника
- •15.3. Конденсаторы
- •Электроемкость плоского конденсатора
- •15.4. Энергия заряженных проводников и конденсаторов. Энергия электрического поля
- •Глава 16. Постоянный ток закон ома
- •16.1. Электрический ток
- •16.2. Разность потенциалов, напряжение и электродвижущая сила
- •16.3. Закон Ома. Сопротивление проводников
- •16.4. Закон Ома для участка цепи и замкнутой цепи. Закон Ома для плотности тока
- •Контрольные вопросы:
- •Глава 17. Работа электрического тока. Мощность. Закон джоуля – ленца
- •17.1. Работа электрического тока
- •17.2. Мощность электрического тока
- •17.3. Закон Джоуля - Ленца для участка цепи
- •17.4. Применение закона Джоуля – Ленца
- •Контрольные вопросы:
- •Глава 18. Релятивистская кинематика
- •18.1. Теория относительности Эйнштейна
- •Преобразования Лоренца для координат и времени
- •18.2. Следствия из преобразований Лоренца
- •18.3. Интервал между двумя событиями. Абсолютность интервала
- •18.4. Преобразование скоростей
- •Глава 19. Релятивисткая динамика
- •19.1. Принцип наименьшего действия Гамильтона
- •19.2. Импульс частицы
- •19.3. Сила
- •19.4. Энергия
- •19.5. Связь между энергией и импульсом
- •19.6. Четырехмерные векторы
- •19.7. Законы сохранения в релятивистской механике
- •Список литературы
- •Содержание предисловие 3 введение 4
- •Список литературы 215
Второе начало термодинамики
Энтропия изолированной системы может только возрастать, а затем, по достижении максимального значения, оставаться неизменной:
![]() (9.19)
(9.19)
При
протекании обратимого процесса энтропия
возрастает:
![]() В состоянии равновесия изолированной
системы энтропия максимальна,
В состоянии равновесия изолированной
системы энтропия максимальна,
![]() Если в системе протекает обратимый
процесс, сопровождающийся сообщением
системе количества теплоты
(модель 1), энтропия растёт по закону:
Если в системе протекает обратимый
процесс, сопровождающийся сообщением
системе количества теплоты
(модель 1), энтропия растёт по закону:
![]() (9.20)
(9.20)
где T - температура системы в процессе передача тепла.
Если в системе протекает необратимый процесс, сопровождающийся сообщением тепла , то энтропия растёт как за счёт необратимости процесса, так и за счёт сообщения системе тепла:
![]()
или
![]() (9.21)
(9.21)
Большинство
реальных процессов, происходящих в
природе, являются необратимыми. Если
молекулы находились сначала в одной
половине сосуда, а затем равномерно
распределились по некоторому объёму
(необратимый процесс), то обратный
процесс, когда они сосредоточатся снова
в половине сосуда, мало вероятен. Пусть
тело помещено в термостат (модель 2) и
обменивается теплом с газом, находящимся
внутри цилиндра. В результате произойдёт
охлаждение тела до температуры
![]() равной температуре газа и процесс
прекратится. Если температура тела
была ниже, чем температура газа, то
направление протекания процесса,
сопровождающееся охлаждением, запрещается
вторым началом
термодинамики в формулировке Р. Клаузиуса
(1850 г.):
равной температуре газа и процесс
прекратится. Если температура тела
была ниже, чем температура газа, то
направление протекания процесса,
сопровождающееся охлаждением, запрещается
вторым началом
термодинамики в формулировке Р. Клаузиуса
(1850 г.):
Невозможны такие процессы, единственным конечным результатом которых был бы переход тепла от тела, менее нагретого, к телу, более нагретому.
Подчеркнём, что при этом не должно происходить изменение энергии внешней среды.
Если
же возможен обмен теплом с внешней
средой (модели 1 и 4), то процессы с
уменьшением энтропии (![]() )вполне
возможны. Поддержание жизни требует
постоянной борьбы с ростом энтропии.
Для этого используется энергия химических
реакций, в которых энтропия возрастает.
)вполне
возможны. Поддержание жизни требует
постоянной борьбы с ростом энтропии.
Для этого используется энергия химических
реакций, в которых энтропия возрастает.
Если система помещена в термостат, то единственным обратимым процессом, сопровождающимся теплообменом с другими телами системы, является изотермический процесс: T2 = T1. При отсутствии теплообмена между телами обратимым будет адиабатический процесс, при котором энтропия остаётся постоянной ( ).
Применяя первое начало термодинамики, запишем изменение энтропии изолированной системы: тело, нагретое до температуры в газе с температурой :
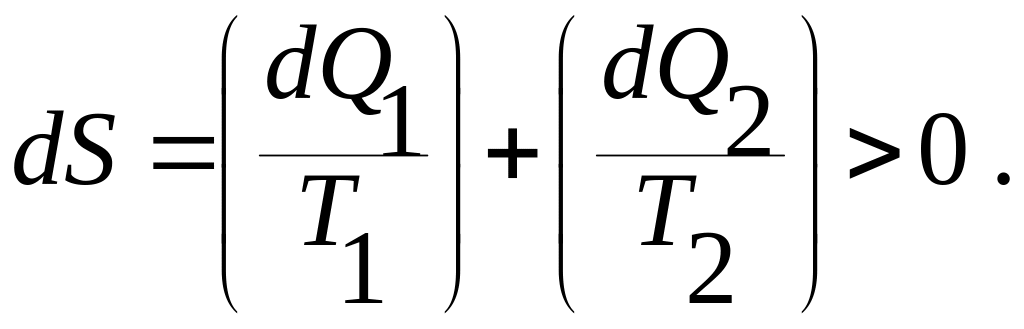 (9.22)
(9.22)
Между
телом и газом происходит теплообмен,
следовательно
![]() Пусть
Пусть
![]() а
а
![]() Таким образом, процесс не запрещается
вторым началом термодинамики, если
выполняется условие:
Таким образом, процесс не запрещается
вторым началом термодинамики, если
выполняется условие:
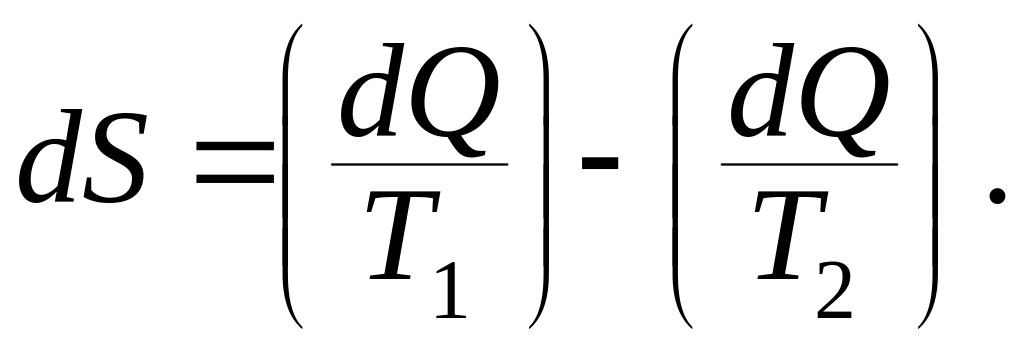 Отсюда
следует
Отсюда
следует
![]() или
или
![]() При установлении теплового равновесия
При установлении теплового равновесия
![]() и
и
Третье начало термодинамики
Энтропия любой системы стремится к нулю при стремлении к нулю температуры:
![]() (9.23)
(9.23)
Эта теорема принадлежит В. Нернсту (1906 г.). Поскольку достижение абсолютного нуля невозможно, т.к. всегда существуют какие – либо формы движения материи, то невозможно нулевое значение энтропии.
9.6. Теплоёмкость идеального газа
Основные законы термодинамики были установлены опытным путём. Можно показать, что такие характеристики системы, как теплоёмкость, внутренняя энергия, энтропия и др. могут быть получены методами термодинамики и методами статистической физики.
Число
степеней свободы системы i
– количество
независимых координат, с помощью которых
можно полностью описать положение
системы в пространстве. Так, для
одноатомной молекулы i
= 3, т.к.
необходимо задать три координаты
молекулы, например, координаты x,
y,
z
в декартовой системе. Для двухатомной
молекулы i
= 3+3-1=5, т.к. число степеней свободы
уменьшается на число жёстких связей
между атомами, в данном случае на единицу.
Если молекула может совершать колебательное
и вращательное движения, то число
степеней свободы увеличивается: i
= nпост+nвращ+2nколеб.
Опытным путём в термодинамике было
доказано, что на каждую степень свободы
приходится энергия
![]() .
Рассчитываем, например, внутреннюю
кинетическую энергию системы из N
молекул идеального газа, учитывая, что
поступательному движению отдельной
молекулы соответствует 3 степени свободы:
.
Рассчитываем, например, внутреннюю
кинетическую энергию системы из N
молекул идеального газа, учитывая, что
поступательному движению отдельной
молекулы соответствует 3 степени свободы:
![]() (9.24)
(9.24)
Методами статистической физики было доказано, что внутренняя энергия идеального газа равна суммарной средней кинетической энергии движения молекул:
![]() (9.25)
(9.25)
Средняя кинетическая энергия молекул:
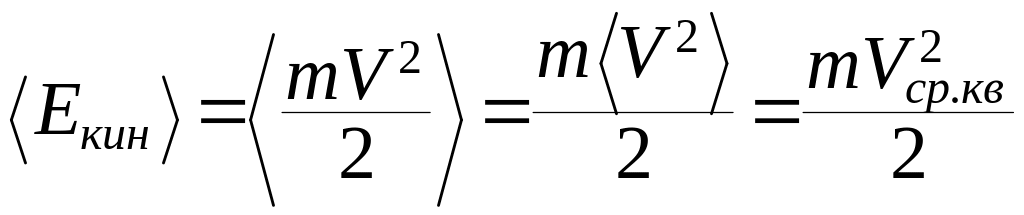 (9.26)
(9.26)
где Vср.кв – среднеквадратичная скорость молекул.
Из распределения Максвелла частиц по скоростям следует, что квадрат среднеквадратичной скорости пропорционален абсолютной температуре:
![]() (9.27)
(9.27)
Подставим (9.26) и (9.27) в соотношение (9.25) и находим:
![]() (9.28)
(9.28)
Таким образом, термодинамическими и статистическими методами мы пришли к одинаковому результату. В общем случае внутренняя энергия молей идеального газа:
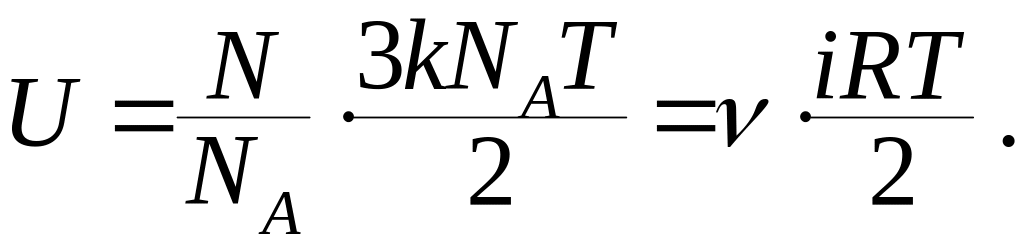 (9.29)
(9.29)
где
![]() - количество молей газа,
- количество молей газа,
![]() - универсальная газовая постоянная.
- универсальная газовая постоянная.
Применим первое начало термодинамики для получения теплоемкости идеального газа. Пусть имеется 1 моль идеального газа. Теплоемкость, по определению, равна количеству теплоты, необходимому для изменения температуры системы на один Кельвин:
![]() (9.30)
(9.30)
Молярной
теплоемкостью называется теплоемкость
одного моля вещества. Размерность
молярной теплоемкости
![]() Удельной называется теплоемкость
единицы массы вещества:
Удельной называется теплоемкость
единицы массы вещества:![]() Размерность удельной теплоемкости:
Размерность удельной теплоемкости:
![]() .
Между удельной и молярной теплоемкостями
существует связь
.
Между удельной и молярной теплоемкостями
существует связь
![]() где
- молярная масса вещества.
где
- молярная масса вещества.
При
протекании изохорного процесса (![]() )
теплоемкость одного моля вещества:
)
теплоемкость одного моля вещества:
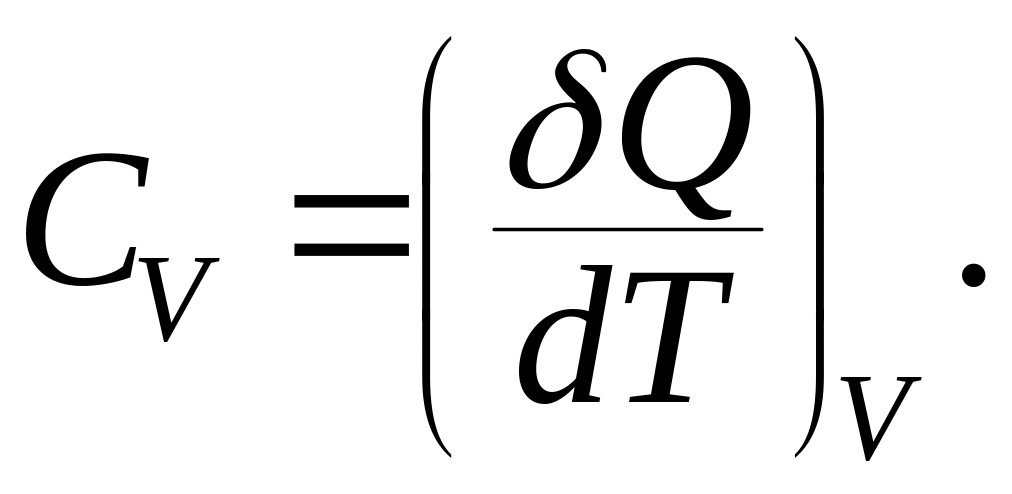
Из первого начала термодинамики следует:
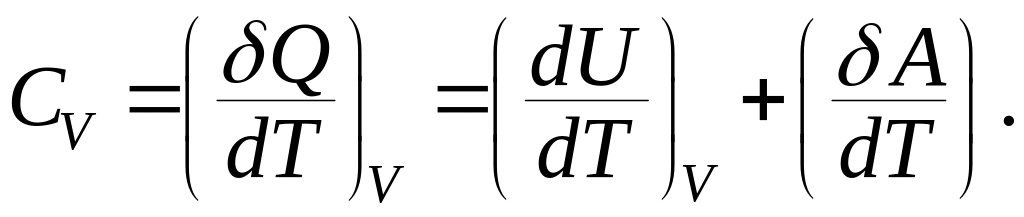
В
изохорном процессе газ не совершает
работы,
![]() отсюда следует:
отсюда следует:
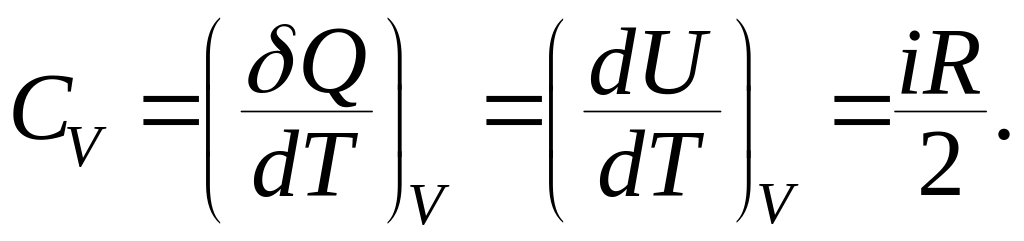 (9.31)
(9.31)
Изменение внутренней энергии в изохорном процессе для произвольного количества вещества:
![]() (9.32)
(9.32)
При протекании изобарного процесса (P = const), теплоемкость одного моля вещества:
![]() (9.33)
(9.33)
Из уравнения Менделеева – Клапейрона для одного моля газа находим:
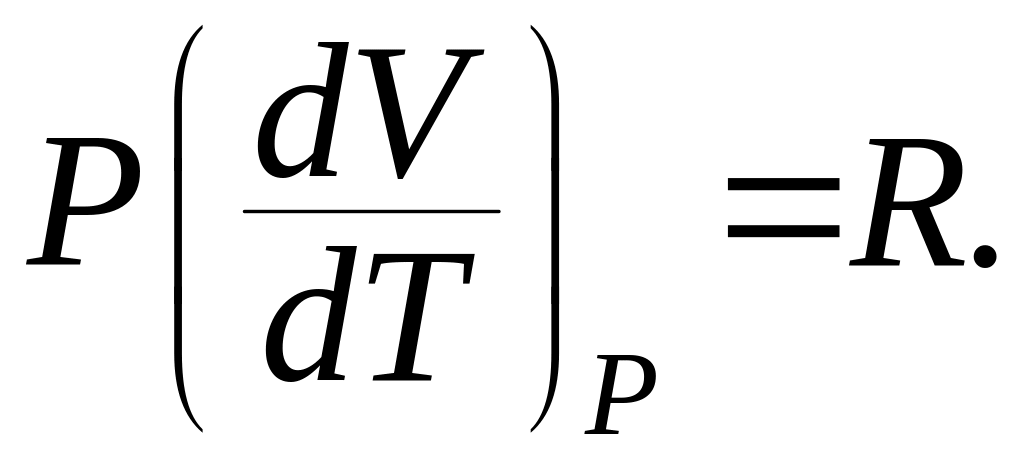 (9.34)
(9.34)
Из (9.33) и (9.34) следует, что теплоемкость идеального газа при постоянном давлении:
![]() (9.35)
(9.35)
Уравнение, связывающие молярные теплоемкости CP и CV называется уравнением Роберта – Майера:
![]() (9.36)
(9.36)
