
- •Предисловие
- •Введение
- •Глава 1. Кинематика материальной точки и твердого тела
- •1.1. Кинематика поступательного движения материальной точки и твердого тела
- •1.2. Кинематика вращательного движения материальной точки
- •Контрольные вопросы:
- •Глава 2. Динамика материальной точки и поступательного движения твёрдого тела
- •2.1. Принцип относительности Галилея
- •2.2. Основные величины динамики
- •2.3. Законы Ньютона
- •Глава 3. Законы сохранения энергии и импульса
- •3.1. Сохраняющиеся величины
- •3.2. Работа. Мощность. Коэффициент полезного действия
- •3.3. Понятие поля. Консервативные силы. Потенциальная энергия
- •Пример 1.
- •Пример 2.
- •3.4. Кинетическая энергия
- •3.5. Закон сохранения механической энергии системы невзаимодействующих частиц
- •3.6. Закон сохранения полной механической энергии
- •3.7. Закон сохранения импульса
- •3.8. Применение законов сохранения энергии и импульса
- •Неупругий удар
- •Упругий удар
- •Явление отдачи при вылете снаряда из орудия
- •Контрольные вопросы:
- •Глава 4. Силы в природе
- •4.1. Взаимодействие в природе. Закон всемирного тяготения
- •4.2. Сила тяжести. Вес тела. Невесомость
- •Движение тела под действием силы тяжести
- •1. Движение тела вверх:
- •2. Движение тела вниз:
- •Движение тела по горизонтали:
- •4.3. Упругие силы
- •4.4. Силы трения
- •Трение покоя
- •Контрольные вопросы:
- •Глава 5. Динамика твердого тела
- •5.1. Движение твердого тела
- •5.2. Степени свободы
- •5.3. Центр масс
- •5.4. Момент импульса
- •5.5. Главные моменты инерции
- •Теорема Гюйгенса – Штейнера
- •5.6. Момент силы
- •5.7. Кинетическая энергия вращающегося твердого тела
- •Глава 6. Закон сохранения момента импульса
- •6.1. Закон сохранения момента импульса
- •6.2. Условие сохранения момента импульса относительно оси для незамкнутой системы
- •6.3. Закон сохранения момента импульса для вращающейся системы тел
- •6.4. Применение закона сохранения момента импульса
- •Контрольные вопросы:
- •Глава 7. Колебательное движение
- •7.1. Классификация колебательного движения
- •7.2. Гармонические колебания
- •7.3. Математический маятник
- •7.4. Физический маятник
- •7.5. Сложение колебаний Сложение одинаково направленных колебаний
- •Сложение взаимно перпендикулярных колебаний
- •7.6. Затухающие колебания
- •7.7. Вынужденные колебания
- •Контрольные вопросы:
- •Глава 8. Молекулярная физика
- •8.1. Основные положения молекулярно-кинетической теории
- •Основные величины, характеризующие массу, размер и число молекул в веществе:
- •8.2. Уравнение состояния идеального газа
- •Уравнение состояния идеального газа
- •8.3. Основное уравнение молекулярно-кинетической теории
- •Основное уравнение мкт:
- •8.4. Взаимодействие молекул
- •8.5. Реальные газы. Уравнение Ван-дер-Ваальса Фазовые равновесия и переходы
- •8.6. Характеристики жидкого состояния
- •5. Жидкости с водородными связями (h2o);
- •Свойства жидкостей:
- •Контрольные вопросы:
- •Глава 9. Равновесная термодинамика
- •9.1. Внутренняя энергия
- •9.2. Работа. Количество теплоты
- •9.3. Термодинамические системы
- •9.4. Первое начало термодинамики
- •9.4. Первое начало термодинамики
- •9.5. Второе и третье начало термодинамики
- •Второе начало термодинамики
- •Третье начало термодинамики
- •9.6. Теплоёмкость идеального газа
- •9.7. Применение первого начала термодинамики для вывода уравнения адиабатного процесса
- •Уравнение адиабатного процесса в параметрах t,V:
- •9.8. Работа, совершаемая газом при различных процессах
- •9.9. Графическое изображение термодинамических процессов
- •9.10. Применение законов термодинамики для расчета круговых процессов
- •К. П. Д. Идеальной тепловой машины Карно
- •Теорема Карно:
- •Контрольные вопросы:
- •Глава 10. Элементы статистической физики
- •10.1. Статистический вес
- •10.2. Энтропия
- •10.3. Распределение Гиббса
- •10.4. Распределение молекул по скоростям Максвелла
- •10.5. Распределение Больцмана молекул в потенциальном поле. Барометрическая формула
- •Контрольные вопросы:
- •Глава 11. Электростатическое поле
- •11.1. Закон сохранения заряда
- •11.2. Взаимодействие зарядов. Закон Кулона
- •Закон Кулона
- •Принцип суперпозиции сил
- •11.3. Напряженность электрического поля
- •Принцип суперпозиции напряженностей
- •Контрольные вопросы:
- •Глава 12. Теорема остроградского-гаусса для электростатического поля
- •12.1. Теорема Остроградского-Гаусса для электростатического поля в вакууме
- •12.2. Применение теоремы Остроградского - Гаусса для расчета электростатического поля равномерно заряженного сферического проводника
- •12.3. Применение теоремы Остроградского - Гаусса для расчета электростатического поля бесконечной заряженной плоскости
- •12.4. Применение теоремы Остроградского - Гаусса для расчета электростатического поля бесконечного заряженного цилиндра
- •Г 153 лава 13. Работа электрического поля. Потенциал.
- •13.1. Работа электрического поля по перемещению заряда
- •13.2. Потенциальная энергия взаимодействия зарядов
- •13.3. Электрический потенциал
- •13.4. Потенциал заряженной сферы, плоскости, цилиндра
- •Потенциал электрического поля заряженной плоскости:
- •Потенциал электрического поля заряженного цилиндра:
- •Глава 14. Диэлектрики в электростатическом поле
- •14.1. Проводники и диэлектрики
- •14.2. Типы диэлектриков
- •14.3. Поляризация диэлектриков
- •14.4. Напряженность электрического поля и электрическое смещение
- •Контрольные вопросы:
- •Глава 15. Проводники в электростатическом поле
- •15.1. Распределение зарядов в проводниках
- •15.2. Электроемкость проводников
- •Электроемкость сферического проводника
- •15.3. Конденсаторы
- •Электроемкость плоского конденсатора
- •15.4. Энергия заряженных проводников и конденсаторов. Энергия электрического поля
- •Глава 16. Постоянный ток закон ома
- •16.1. Электрический ток
- •16.2. Разность потенциалов, напряжение и электродвижущая сила
- •16.3. Закон Ома. Сопротивление проводников
- •16.4. Закон Ома для участка цепи и замкнутой цепи. Закон Ома для плотности тока
- •Контрольные вопросы:
- •Глава 17. Работа электрического тока. Мощность. Закон джоуля – ленца
- •17.1. Работа электрического тока
- •17.2. Мощность электрического тока
- •17.3. Закон Джоуля - Ленца для участка цепи
- •17.4. Применение закона Джоуля – Ленца
- •Контрольные вопросы:
- •Глава 18. Релятивистская кинематика
- •18.1. Теория относительности Эйнштейна
- •Преобразования Лоренца для координат и времени
- •18.2. Следствия из преобразований Лоренца
- •18.3. Интервал между двумя событиями. Абсолютность интервала
- •18.4. Преобразование скоростей
- •Глава 19. Релятивисткая динамика
- •19.1. Принцип наименьшего действия Гамильтона
- •19.2. Импульс частицы
- •19.3. Сила
- •19.4. Энергия
- •19.5. Связь между энергией и импульсом
- •19.6. Четырехмерные векторы
- •19.7. Законы сохранения в релятивистской механике
- •Список литературы
- •Содержание предисловие 3 введение 4
- •Список литературы 215
9.7. Применение первого начала термодинамики для вывода уравнения адиабатного процесса
Адиабатным
называется процесс обмена теплом
системой с внешней средой при условии
![]()
Запишем первое начало термодинамики в виде
![]() (9.37)
(9.37)
Для одного моля получим уравнение
![]() (9.38)
(9.38)
Из уравнения Менделеева – Клапейрона для одного моля найдем давление
![]() (9.39)
(9.39)
Подставим полученное соотношение в (9.38):
![]() (9.40)
(9.40)
Разделим обе части уравнения на CVT, находим:
![]()
Мы получили
![]() ,
,
откуда следует:
![]() (9.41)
(9.41)
Введем показатель адиабаты:
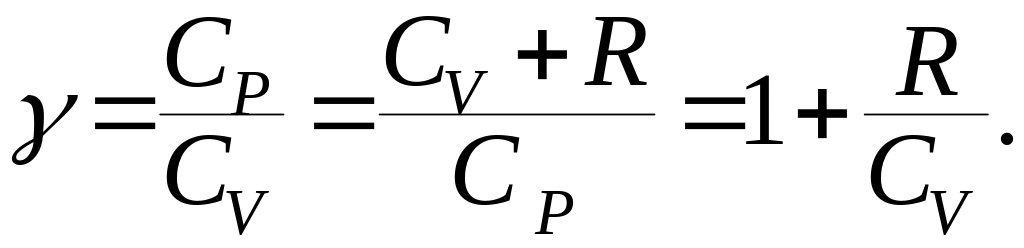 (9.42)
(9.42)
Теплоемкость при постоянном объеме:
![]() (9.43)
(9.43)
Подставим (9.43) в (9.41):
![]()
отсюда следует
![]()
Уравнение адиабатного процесса в параметрах t,V:
![]() (9.44)
(9.44)
Из
уравнения Менделеева – Клапейрона
находим
![]() подставим в (9.44) и получим уравнение
адиабатного процесса в параметрах P,V:
подставим в (9.44) и получим уравнение
адиабатного процесса в параметрах P,V:
![]() (9.45)
(9.45)
9.8. Работа, совершаемая газом при различных процессах
Докажем, что работа не является функцией состояния системы и зависит от вида процесса. При изменении объема системы от V1 до V2 совершается работа против внешних сил:
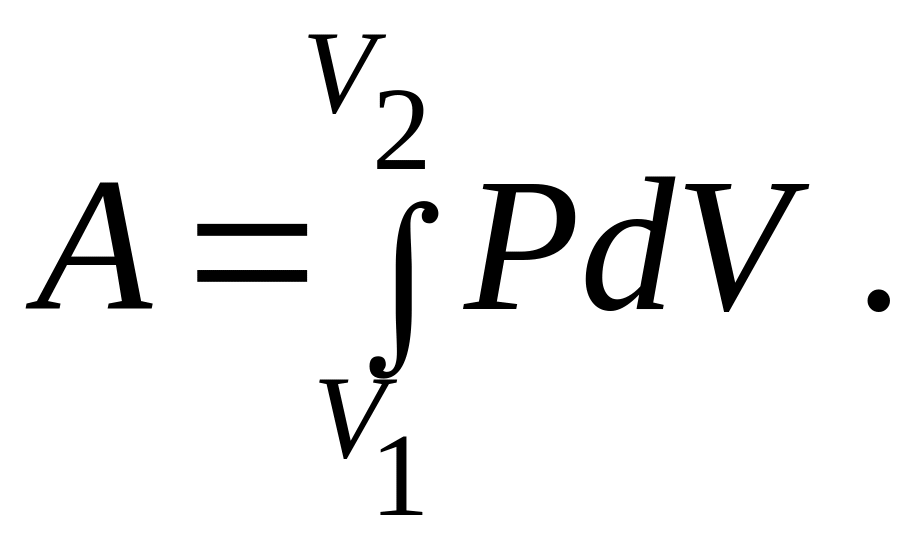 (9.46)
(9.46)
1. При изохорном процессе A = 0, т.к. V= const.
2. При изобарном процессе (P = const) из (9.46) следует
![]() (9.47)
(9.47)
3. Работу
при изотермическом процессе (T
= const) найдем, подставив в уравнение
(9.46) давление, полученное из уравнения
Менделеева – Клапейрона:
![]() :
:
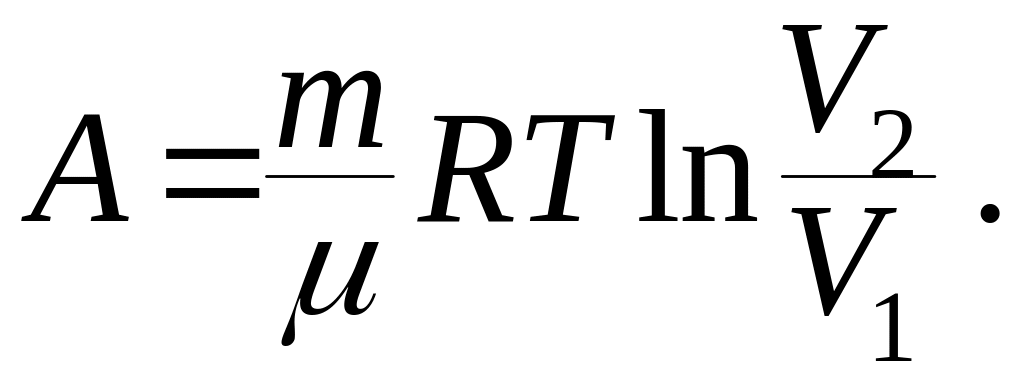 (9.48)
(9.48)
4. В
адиабатном процессе
![]() ,
поэтому работа равна изменению внутренней
энергии, взятому с отрицательным знаком:
,
поэтому работа равна изменению внутренней
энергии, взятому с отрицательным знаком:
![]() (9.49)
(9.49)
Из
(9.45) найдем давление
![]() подставим в (9.46) и запишем работу в виде:
подставим в (9.46) и запишем работу в виде:
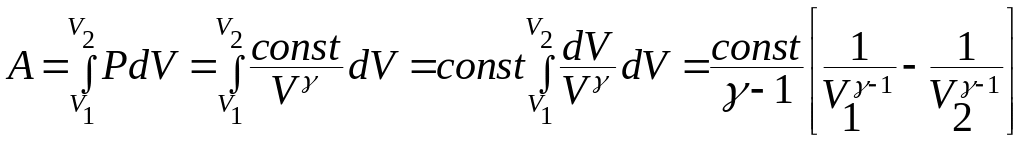 (9.50)
(9.50)
Находим работу при адиабатном процессе:
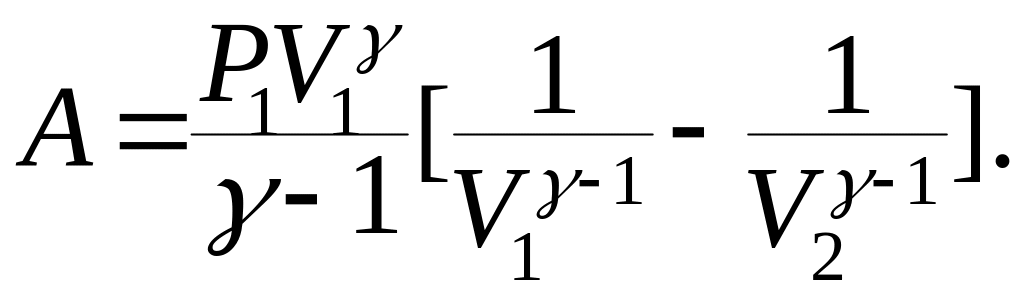 (9.51)
(9.51)
9.9. Графическое изображение термодинамических процессов
Термодинамические процессы могут изображаться графически в различных координатных системах: P,V – диаграмма применяется для расчета работы, совершаемой системой, а диаграмма T,S более удобна для расчета количества теплоты, которое подводится к системе или отводится от нее.
Если система не находится в равновесном состоянии, то графическое изображение процессов в такой системе является условным. Равновесное состояние на диаграммах изображается точкой, а равновесный процесс – линией.
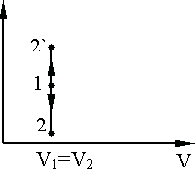
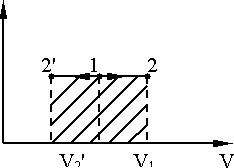
Рис. 9.5. Рис. 9.6.
И
129
Изобарный
процесс, P =
const, изображается
на диаграмме P,V
прямой, параллельной оси абсцисс, при
нагревании направленной от точки 1 к
точке 2, а при охлаждении – к точке
![]() (рис.9.6). Работа, совершаемая при изобарном
процессе, изображается заштрихованной
площадью под линией 1–2:
(рис.9.6). Работа, совершаемая при изобарном
процессе, изображается заштрихованной
площадью под линией 1–2:
![]() .
.
Изотермический процесс, T = const, изображается в координатах P,V гиперболической кривой 1 – 2 (рис. 9.7).
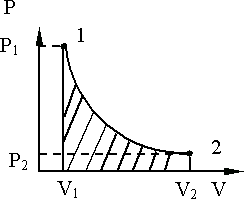
Рис. 9.7.
Работа в изотермическом процессе изображается заштрихованной площадью под гиперболической кривой 1 – 2.
А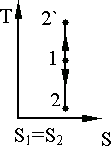 диабатный
процесс на диаграмме P,V
изображается кривой, которая идет более
круто, чем изотерма.
диабатный
процесс на диаграмме P,V
изображается кривой, которая идет более
круто, чем изотерма.
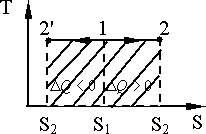
Рис. 9.8. Рис. 9.9.
На
T,S
диаграмме вдоль оси ординат откладывается
абсолютная температура Т,
а вдоль оси абсцисс - энтропия S
. Изотермический процесс на T,
S диаграмме
изображается прямой, параллельной оси
абсцисс. Расширение соответствует линии
1 – 2,
![]() ,
сжатие соответствует линии 1 –
,
сжатие соответствует линии 1 –![]() ,
(рис. 9.8). Площадь под линией изображает
количество теплоты
,
(рис. 9.8). Площадь под линией изображает
количество теплоты![]() Если в процессе теплота подводится к
системе, то
Если в процессе теплота подводится к
системе, то
![]() и
,
т. е. энтропия возрастает. Если
и
,
т. е. энтропия возрастает. Если
![]() то
то
![]() - энтропия уменьшается.
- энтропия уменьшается.
Адиабатный процесс на диаграмме T,S изображается вертикальной линией 1 – 2 (расширение) или 1 - (сжатие) (рис. 9.9).
Произвольный обратимый процесс изображается, например, линией 1 – 2 (рис. 9.10).
Площадь под кривой 1 – 2 изображает количество теплоты:
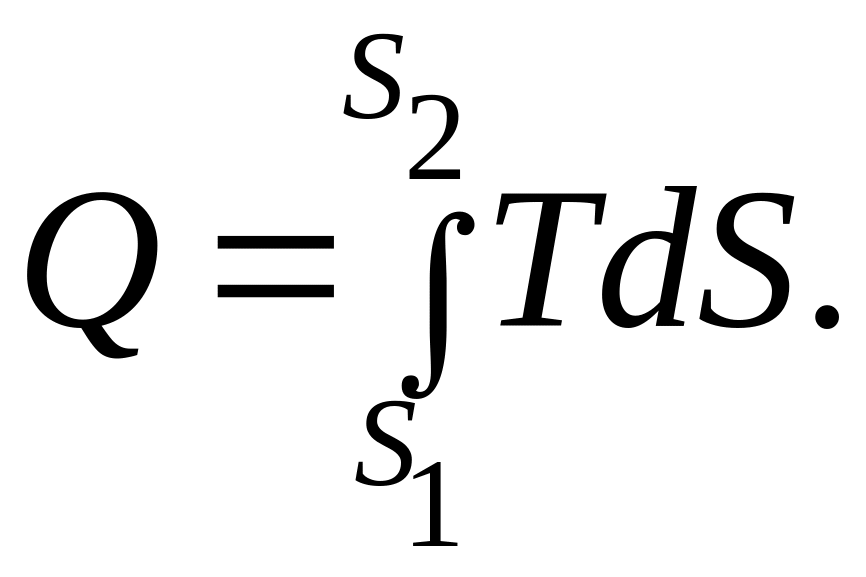

Рис. 9.10.
