
- •Предисловие
- •Введение
- •Глава 1. Кинематика материальной точки и твердого тела
- •1.1. Кинематика поступательного движения материальной точки и твердого тела
- •1.2. Кинематика вращательного движения материальной точки
- •Контрольные вопросы:
- •Глава 2. Динамика материальной точки и поступательного движения твёрдого тела
- •2.1. Принцип относительности Галилея
- •2.2. Основные величины динамики
- •2.3. Законы Ньютона
- •Глава 3. Законы сохранения энергии и импульса
- •3.1. Сохраняющиеся величины
- •3.2. Работа. Мощность. Коэффициент полезного действия
- •3.3. Понятие поля. Консервативные силы. Потенциальная энергия
- •Пример 1.
- •Пример 2.
- •3.4. Кинетическая энергия
- •3.5. Закон сохранения механической энергии системы невзаимодействующих частиц
- •3.6. Закон сохранения полной механической энергии
- •3.7. Закон сохранения импульса
- •3.8. Применение законов сохранения энергии и импульса
- •Неупругий удар
- •Упругий удар
- •Явление отдачи при вылете снаряда из орудия
- •Контрольные вопросы:
- •Глава 4. Силы в природе
- •4.1. Взаимодействие в природе. Закон всемирного тяготения
- •4.2. Сила тяжести. Вес тела. Невесомость
- •Движение тела под действием силы тяжести
- •1. Движение тела вверх:
- •2. Движение тела вниз:
- •Движение тела по горизонтали:
- •4.3. Упругие силы
- •4.4. Силы трения
- •Трение покоя
- •Контрольные вопросы:
- •Глава 5. Динамика твердого тела
- •5.1. Движение твердого тела
- •5.2. Степени свободы
- •5.3. Центр масс
- •5.4. Момент импульса
- •5.5. Главные моменты инерции
- •Теорема Гюйгенса – Штейнера
- •5.6. Момент силы
- •5.7. Кинетическая энергия вращающегося твердого тела
- •Глава 6. Закон сохранения момента импульса
- •6.1. Закон сохранения момента импульса
- •6.2. Условие сохранения момента импульса относительно оси для незамкнутой системы
- •6.3. Закон сохранения момента импульса для вращающейся системы тел
- •6.4. Применение закона сохранения момента импульса
- •Контрольные вопросы:
- •Глава 7. Колебательное движение
- •7.1. Классификация колебательного движения
- •7.2. Гармонические колебания
- •7.3. Математический маятник
- •7.4. Физический маятник
- •7.5. Сложение колебаний Сложение одинаково направленных колебаний
- •Сложение взаимно перпендикулярных колебаний
- •7.6. Затухающие колебания
- •7.7. Вынужденные колебания
- •Контрольные вопросы:
- •Глава 8. Молекулярная физика
- •8.1. Основные положения молекулярно-кинетической теории
- •Основные величины, характеризующие массу, размер и число молекул в веществе:
- •8.2. Уравнение состояния идеального газа
- •Уравнение состояния идеального газа
- •8.3. Основное уравнение молекулярно-кинетической теории
- •Основное уравнение мкт:
- •8.4. Взаимодействие молекул
- •8.5. Реальные газы. Уравнение Ван-дер-Ваальса Фазовые равновесия и переходы
- •8.6. Характеристики жидкого состояния
- •5. Жидкости с водородными связями (h2o);
- •Свойства жидкостей:
- •Контрольные вопросы:
- •Глава 9. Равновесная термодинамика
- •9.1. Внутренняя энергия
- •9.2. Работа. Количество теплоты
- •9.3. Термодинамические системы
- •9.4. Первое начало термодинамики
- •9.4. Первое начало термодинамики
- •9.5. Второе и третье начало термодинамики
- •Второе начало термодинамики
- •Третье начало термодинамики
- •9.6. Теплоёмкость идеального газа
- •9.7. Применение первого начала термодинамики для вывода уравнения адиабатного процесса
- •Уравнение адиабатного процесса в параметрах t,V:
- •9.8. Работа, совершаемая газом при различных процессах
- •9.9. Графическое изображение термодинамических процессов
- •9.10. Применение законов термодинамики для расчета круговых процессов
- •К. П. Д. Идеальной тепловой машины Карно
- •Теорема Карно:
- •Контрольные вопросы:
- •Глава 10. Элементы статистической физики
- •10.1. Статистический вес
- •10.2. Энтропия
- •10.3. Распределение Гиббса
- •10.4. Распределение молекул по скоростям Максвелла
- •10.5. Распределение Больцмана молекул в потенциальном поле. Барометрическая формула
- •Контрольные вопросы:
- •Глава 11. Электростатическое поле
- •11.1. Закон сохранения заряда
- •11.2. Взаимодействие зарядов. Закон Кулона
- •Закон Кулона
- •Принцип суперпозиции сил
- •11.3. Напряженность электрического поля
- •Принцип суперпозиции напряженностей
- •Контрольные вопросы:
- •Глава 12. Теорема остроградского-гаусса для электростатического поля
- •12.1. Теорема Остроградского-Гаусса для электростатического поля в вакууме
- •12.2. Применение теоремы Остроградского - Гаусса для расчета электростатического поля равномерно заряженного сферического проводника
- •12.3. Применение теоремы Остроградского - Гаусса для расчета электростатического поля бесконечной заряженной плоскости
- •12.4. Применение теоремы Остроградского - Гаусса для расчета электростатического поля бесконечного заряженного цилиндра
- •Г 153 лава 13. Работа электрического поля. Потенциал.
- •13.1. Работа электрического поля по перемещению заряда
- •13.2. Потенциальная энергия взаимодействия зарядов
- •13.3. Электрический потенциал
- •13.4. Потенциал заряженной сферы, плоскости, цилиндра
- •Потенциал электрического поля заряженной плоскости:
- •Потенциал электрического поля заряженного цилиндра:
- •Глава 14. Диэлектрики в электростатическом поле
- •14.1. Проводники и диэлектрики
- •14.2. Типы диэлектриков
- •14.3. Поляризация диэлектриков
- •14.4. Напряженность электрического поля и электрическое смещение
- •Контрольные вопросы:
- •Глава 15. Проводники в электростатическом поле
- •15.1. Распределение зарядов в проводниках
- •15.2. Электроемкость проводников
- •Электроемкость сферического проводника
- •15.3. Конденсаторы
- •Электроемкость плоского конденсатора
- •15.4. Энергия заряженных проводников и конденсаторов. Энергия электрического поля
- •Глава 16. Постоянный ток закон ома
- •16.1. Электрический ток
- •16.2. Разность потенциалов, напряжение и электродвижущая сила
- •16.3. Закон Ома. Сопротивление проводников
- •16.4. Закон Ома для участка цепи и замкнутой цепи. Закон Ома для плотности тока
- •Контрольные вопросы:
- •Глава 17. Работа электрического тока. Мощность. Закон джоуля – ленца
- •17.1. Работа электрического тока
- •17.2. Мощность электрического тока
- •17.3. Закон Джоуля - Ленца для участка цепи
- •17.4. Применение закона Джоуля – Ленца
- •Контрольные вопросы:
- •Глава 18. Релятивистская кинематика
- •18.1. Теория относительности Эйнштейна
- •Преобразования Лоренца для координат и времени
- •18.2. Следствия из преобразований Лоренца
- •18.3. Интервал между двумя событиями. Абсолютность интервала
- •18.4. Преобразование скоростей
- •Глава 19. Релятивисткая динамика
- •19.1. Принцип наименьшего действия Гамильтона
- •19.2. Импульс частицы
- •19.3. Сила
- •19.4. Энергия
- •19.5. Связь между энергией и импульсом
- •19.6. Четырехмерные векторы
- •19.7. Законы сохранения в релятивистской механике
- •Список литературы
- •Содержание предисловие 3 введение 4
- •Список литературы 215
9.2. Работа. Количество теплоты
Работа
в механическом понимании совершается,
если на тело действует сила
![]() ,
вызывающая перемещение
:
,
вызывающая перемещение
:
![]() (9.6)
(9.6)
где - угол между вектором силы и вектором перемещения .
Рассмотрим цилиндр с поршнем, внутри цилиндра находится какой либо газ. Под действием внешней силы F поршень переместится на . Поскольку направление действия силы и направление перемещения совпадают, запишем работу внешней силы
![]() (9.7)
(9.7)
Разделим это выражение слева на площадь основания цилиндра S и умножим на эту величину, находим:
![]() (9.8)
(9.8)
где
![]() - давление газа;
- давление газа;
![]() -
изменение объёма, занимаемого газом в
цилиндре.
-
изменение объёма, занимаемого газом в
цилиндре.
Мы
получили формулу для определения работы
![]() ,
совершенной над термодинамической
системой.
,
совершенной над термодинамической
системой.
В дифференциальной форме элементарная работа:
![]() .
.
Полная
работа, совершаемая при сжатии газа от
объёма
![]() до объёма
до объёма
![]() :
:
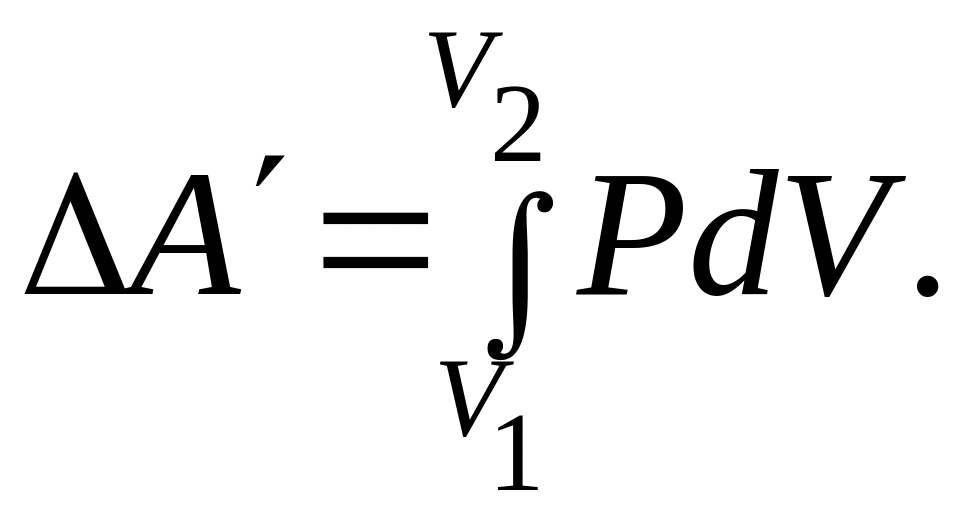 (9.9)
(9.9)
Работа самой термодинамической системы против внешних сил равна по величине и противоположна по знаку работе внешних сил:
![]() .
.
Нельзя говорить о количестве работы, запасённой термодинамической системой, правильнее говорить об изменении работы.
Работа, совершаемая системой, зависит от пути перехода системы из начального до конечного состояния. Так, например, работа идеального газа в изотермическом процессе меньше, чем в изобарном процессе при одинаковом изменении объема. Работа при изотермическом процессе зависит от изменения объема, занимаемого газом. Если система возвратится в исходное состояние, характеризуемое параметрами P, V, T, n, то совершенная при этом работа будет зависеть от хода процесса, поэтому работа не является функцией состояния. Работа является одной из форм энергии и может полностью переходить в другие формы энергии: теплоту и внутреннюю энергию.
На замкнутую систему могут не действовать внешние силы, но она может обмениваться энергией с внешней средой путём теплообмена. Количество теплоты, переданное термодинамической системе, зависит от теплоёмкости:
![]() (9.10)
(9.10)
Поскольку
теплоёмкость системы зависит от условий,
при которых происходит передача тепла,
то количество теплоты также не является
функцией состояния. Так, например, в
изохорном процессе идеального газа
количество теплоты, воспринятое системой
![]() меньше, чем в изобарном процессе
меньше, чем в изобарном процессе
![]() т.к.
т.к.
![]() где
где
![]() - молярная масса газа;
- молярная масса газа;
![]() -
универсальная газовая постоянная.
Элементарное количество теплоты
-
универсальная газовая постоянная.
Элементарное количество теплоты
![]() не является полным дифференциалом, т.к.
при возвращении системы в состояние с
исходными параметрами
не является полным дифференциалом, т.к.
при возвращении системы в состояние с
исходными параметрами
![]() запасённое количество теплоты не
обязательно принимает первоначальную
величину. Количество теплоты
запасённое количество теплоты не
обязательно принимает первоначальную
величину. Количество теплоты
![]() ,
как одна из форм энергии, может полностью
переходить в другие формы энергии:
работу
,
как одна из форм энергии, может полностью
переходить в другие формы энергии:
работу
![]() и внутреннюю энергию
и внутреннюю энергию
![]() .
.
Механический эквивалент количества тепла был установлен Д. Джоулем (1843 г.): 1 кал = 4,1868 Дж.
9.3. Термодинамические системы
Рассмотрим примеры термодинамических систем. На основе этих моделей мы будем изучать как равновесные, так и неравновесные процессы.
Модель 1. Неизолированная замкнутая система.
Цилиндрический
сосуд, в котором находится газ (рис.
9.1). Под действием поршня газ может
сжиматься или расширяться. Система не
изолирована от окружающей среды. Если
нет обмена веществом со средой, то она
является также замкнутой. При передаче
системе тепла
![]() может увеличиваться внутренняя энергия
системы и совершаться работа. Энтропия
системы в обоих случаях возрастает:
может увеличиваться внутренняя энергия
системы и совершаться работа. Энтропия
системы в обоих случаях возрастает:
![]() .
При возвращении системы в исходное
состояние энтропия S
принимает прежнее значение.
.
При возвращении системы в исходное
состояние энтропия S
принимает прежнее значение.
Модель 2. Адиабатическая замкнутая система.
Цилиндрический
сосуд с поршнем изолирован от окружающей
среды (рис. 9.2). Система является
адиабатической и замкнутой, т.к. не
происходит тепловой обмен с окружающей
средой:
![]() и нет обмена веществом со средой. Процесс
сжатия или расширения газа происходит
без изменения энтропии,
и нет обмена веществом со средой. Процесс
сжатия или расширения газа происходит
без изменения энтропии,
![]() .
Изменение внутренней энергии системы
равно работе, совершенной против внешних
сил и взятой с обратным знаком:
.
Изменение внутренней энергии системы
равно работе, совершенной против внешних
сил и взятой с обратным знаком:
![]() (9.11)
(9.11)
Если
система совершает цикл и возвращается
в исходное состояние, то
![]() .
Внутренняя энергия системы принимает
первоначальное значение. Изменение
внутренней энергии не зависит от пути
перехода системы из точки 1 в точку 2:
.
Внутренняя энергия системы принимает
первоначальное значение. Изменение
внутренней энергии не зависит от пути
перехода системы из точки 1 в точку 2:
![]()
Изменение энтропии не зависит от пути, пройденного термодинамической системой:
![]() (9.12)
(9.12)
Из
рассмотренных примеров следует, что
внутренняя энергия
![]() и энтропия
и энтропия
![]() являются функциями состояния. Они могут
быть выбраны в качестве термодинамических
функций, а давление P,
объём V,
температура T
и концентрация n
являются параметрами состояния.
являются функциями состояния. Они могут
быть выбраны в качестве термодинамических
функций, а давление P,
объём V,
температура T
и концентрация n
являются параметрами состояния.
Модель 3. Теплоизолированная незамкнутая система.
Система теплоизолирована от внешней среды: , но возможен обмен веществом со средой (рис. 9.3). Энтропия и внутренняя энергия системы могут изменяться.
Модель 4. Открытая система.
В
термодинамической системе возможен
обмен энергией и веществом со средой,
такая система является открытой (рис.
9.4). Все термодинамические функции:
![]() а также параметры P,
V, T,
n могут
изменяться. Энтропия системы увеличивается,
если в системе протекает необратимый
процесс. Например, вещество диффундирует
из области с большей концентрацией n1
в область с меньшей концентрацией n2
а также параметры P,
V, T,
n могут
изменяться. Энтропия системы увеличивается,
если в системе протекает необратимый
процесс. Например, вещество диффундирует
из области с большей концентрацией n1
в область с меньшей концентрацией n2
![]()


Рис. 9.1. Рис. 9.2.
В равновесной термодинамике изучаются установившиеся процессы в неизолированной замкнутой системе (модель 1) и в теплоизолированной замкнутой системе (модель 2). Равновесным, как известно, называется процесс, проходящий через ряд равновесных состояний. При медленном движении поршня (модель 1) газ в сосуде успевает придти в состояние однородной концентрации, а при медленном нагревании успевает выровняться температура во всех точках. С другой стороны, равновесным может считаться адиабатический процесс, который протекает так быстро, что не изменяется количество теплоты системы (модель 2).
Возможны различные виды равновесий: тепловое, механическое, равновесие концентраций.
«
117
Если две системы находятся в тепловом равновесии с третьей системой, то они находятся в тепловом равновесии между собой, характеризующимся равенством температур во всех точках этих систем.

Рис. 9.3. Рис. 9.4.
Можно распространить «нулевой» закон на другие виды равновесия. Например, если дверь из кухни открыта в столовую, то аппетитный запах испечённого пирога распространится в столовой, а затем перейдёт в кабинет. Если концентрация ароматических веществ одинакова в кухне и столовой, а также в столовой и кабинете, то она будет одинаковой в кухне и кабинете. Термодинамическое стационарное состояние возникает, если постоянный поток вещества или энергии не прекращается.
Так, если пирог ещё печётся в духовке, то, начиная с момента готовности, запах будет постоянно доноситься из кухни, концентрация ароматических веществ будет нарастать. Если не доводить до крайности, когда пирог начнёт подгорать, этот пример можно рассматривать как иллюстрацию термодинамического стационарного состояния.
А вот ещё пример: в живой клетке постоянно происходит процесс обмена веществом и энергией с внешней средой (модель 4). Если количество поступающего в клетки вещества или энергии равно количеству отдаваемого во внешнюю среду, то наступает баланс массы или энергии.
