
- •Предисловие
- •Введение
- •Глава 1. Кинематика материальной точки и твердого тела
- •1.1. Кинематика поступательного движения материальной точки и твердого тела
- •1.2. Кинематика вращательного движения материальной точки
- •Контрольные вопросы:
- •Глава 2. Динамика материальной точки и поступательного движения твёрдого тела
- •2.1. Принцип относительности Галилея
- •2.2. Основные величины динамики
- •2.3. Законы Ньютона
- •Глава 3. Законы сохранения энергии и импульса
- •3.1. Сохраняющиеся величины
- •3.2. Работа. Мощность. Коэффициент полезного действия
- •3.3. Понятие поля. Консервативные силы. Потенциальная энергия
- •Пример 1.
- •Пример 2.
- •3.4. Кинетическая энергия
- •3.5. Закон сохранения механической энергии системы невзаимодействующих частиц
- •3.6. Закон сохранения полной механической энергии
- •3.7. Закон сохранения импульса
- •3.8. Применение законов сохранения энергии и импульса
- •Неупругий удар
- •Упругий удар
- •Явление отдачи при вылете снаряда из орудия
- •Контрольные вопросы:
- •Глава 4. Силы в природе
- •4.1. Взаимодействие в природе. Закон всемирного тяготения
- •4.2. Сила тяжести. Вес тела. Невесомость
- •Движение тела под действием силы тяжести
- •1. Движение тела вверх:
- •2. Движение тела вниз:
- •Движение тела по горизонтали:
- •4.3. Упругие силы
- •4.4. Силы трения
- •Трение покоя
- •Контрольные вопросы:
- •Глава 5. Динамика твердого тела
- •5.1. Движение твердого тела
- •5.2. Степени свободы
- •5.3. Центр масс
- •5.4. Момент импульса
- •5.5. Главные моменты инерции
- •Теорема Гюйгенса – Штейнера
- •5.6. Момент силы
- •5.7. Кинетическая энергия вращающегося твердого тела
- •Глава 6. Закон сохранения момента импульса
- •6.1. Закон сохранения момента импульса
- •6.2. Условие сохранения момента импульса относительно оси для незамкнутой системы
- •6.3. Закон сохранения момента импульса для вращающейся системы тел
- •6.4. Применение закона сохранения момента импульса
- •Контрольные вопросы:
- •Глава 7. Колебательное движение
- •7.1. Классификация колебательного движения
- •7.2. Гармонические колебания
- •7.3. Математический маятник
- •7.4. Физический маятник
- •7.5. Сложение колебаний Сложение одинаково направленных колебаний
- •Сложение взаимно перпендикулярных колебаний
- •7.6. Затухающие колебания
- •7.7. Вынужденные колебания
- •Контрольные вопросы:
- •Глава 8. Молекулярная физика
- •8.1. Основные положения молекулярно-кинетической теории
- •Основные величины, характеризующие массу, размер и число молекул в веществе:
- •8.2. Уравнение состояния идеального газа
- •Уравнение состояния идеального газа
- •8.3. Основное уравнение молекулярно-кинетической теории
- •Основное уравнение мкт:
- •8.4. Взаимодействие молекул
- •8.5. Реальные газы. Уравнение Ван-дер-Ваальса Фазовые равновесия и переходы
- •8.6. Характеристики жидкого состояния
- •5. Жидкости с водородными связями (h2o);
- •Свойства жидкостей:
- •Контрольные вопросы:
- •Глава 9. Равновесная термодинамика
- •9.1. Внутренняя энергия
- •9.2. Работа. Количество теплоты
- •9.3. Термодинамические системы
- •9.4. Первое начало термодинамики
- •9.4. Первое начало термодинамики
- •9.5. Второе и третье начало термодинамики
- •Второе начало термодинамики
- •Третье начало термодинамики
- •9.6. Теплоёмкость идеального газа
- •9.7. Применение первого начала термодинамики для вывода уравнения адиабатного процесса
- •Уравнение адиабатного процесса в параметрах t,V:
- •9.8. Работа, совершаемая газом при различных процессах
- •9.9. Графическое изображение термодинамических процессов
- •9.10. Применение законов термодинамики для расчета круговых процессов
- •К. П. Д. Идеальной тепловой машины Карно
- •Теорема Карно:
- •Контрольные вопросы:
- •Глава 10. Элементы статистической физики
- •10.1. Статистический вес
- •10.2. Энтропия
- •10.3. Распределение Гиббса
- •10.4. Распределение молекул по скоростям Максвелла
- •10.5. Распределение Больцмана молекул в потенциальном поле. Барометрическая формула
- •Контрольные вопросы:
- •Глава 11. Электростатическое поле
- •11.1. Закон сохранения заряда
- •11.2. Взаимодействие зарядов. Закон Кулона
- •Закон Кулона
- •Принцип суперпозиции сил
- •11.3. Напряженность электрического поля
- •Принцип суперпозиции напряженностей
- •Контрольные вопросы:
- •Глава 12. Теорема остроградского-гаусса для электростатического поля
- •12.1. Теорема Остроградского-Гаусса для электростатического поля в вакууме
- •12.2. Применение теоремы Остроградского - Гаусса для расчета электростатического поля равномерно заряженного сферического проводника
- •12.3. Применение теоремы Остроградского - Гаусса для расчета электростатического поля бесконечной заряженной плоскости
- •12.4. Применение теоремы Остроградского - Гаусса для расчета электростатического поля бесконечного заряженного цилиндра
- •Г 153 лава 13. Работа электрического поля. Потенциал.
- •13.1. Работа электрического поля по перемещению заряда
- •13.2. Потенциальная энергия взаимодействия зарядов
- •13.3. Электрический потенциал
- •13.4. Потенциал заряженной сферы, плоскости, цилиндра
- •Потенциал электрического поля заряженной плоскости:
- •Потенциал электрического поля заряженного цилиндра:
- •Глава 14. Диэлектрики в электростатическом поле
- •14.1. Проводники и диэлектрики
- •14.2. Типы диэлектриков
- •14.3. Поляризация диэлектриков
- •14.4. Напряженность электрического поля и электрическое смещение
- •Контрольные вопросы:
- •Глава 15. Проводники в электростатическом поле
- •15.1. Распределение зарядов в проводниках
- •15.2. Электроемкость проводников
- •Электроемкость сферического проводника
- •15.3. Конденсаторы
- •Электроемкость плоского конденсатора
- •15.4. Энергия заряженных проводников и конденсаторов. Энергия электрического поля
- •Глава 16. Постоянный ток закон ома
- •16.1. Электрический ток
- •16.2. Разность потенциалов, напряжение и электродвижущая сила
- •16.3. Закон Ома. Сопротивление проводников
- •16.4. Закон Ома для участка цепи и замкнутой цепи. Закон Ома для плотности тока
- •Контрольные вопросы:
- •Глава 17. Работа электрического тока. Мощность. Закон джоуля – ленца
- •17.1. Работа электрического тока
- •17.2. Мощность электрического тока
- •17.3. Закон Джоуля - Ленца для участка цепи
- •17.4. Применение закона Джоуля – Ленца
- •Контрольные вопросы:
- •Глава 18. Релятивистская кинематика
- •18.1. Теория относительности Эйнштейна
- •Преобразования Лоренца для координат и времени
- •18.2. Следствия из преобразований Лоренца
- •18.3. Интервал между двумя событиями. Абсолютность интервала
- •18.4. Преобразование скоростей
- •Глава 19. Релятивисткая динамика
- •19.1. Принцип наименьшего действия Гамильтона
- •19.2. Импульс частицы
- •19.3. Сила
- •19.4. Энергия
- •19.5. Связь между энергией и импульсом
- •19.6. Четырехмерные векторы
- •19.7. Законы сохранения в релятивистской механике
- •Список литературы
- •Содержание предисловие 3 введение 4
- •Список литературы 215
Основные величины, характеризующие массу, размер и число молекул в веществе:
1.
Относительная атомная масса:
 -
отношение массы атома к одной двенадцатой
части массы атома изотопа углерода
-
отношение массы атома к одной двенадцатой
части массы атома изотопа углерода
![]() .
Это безразмерная величина, она
характеризует число протонов и нейтронов
в атоме, т.к. масса электрона значительно
меньше массы нуклона.
.
Это безразмерная величина, она
характеризует число протонов и нейтронов
в атоме, т.к. масса электрона значительно
меньше массы нуклона.
2.
Относительная молекулярная масса:
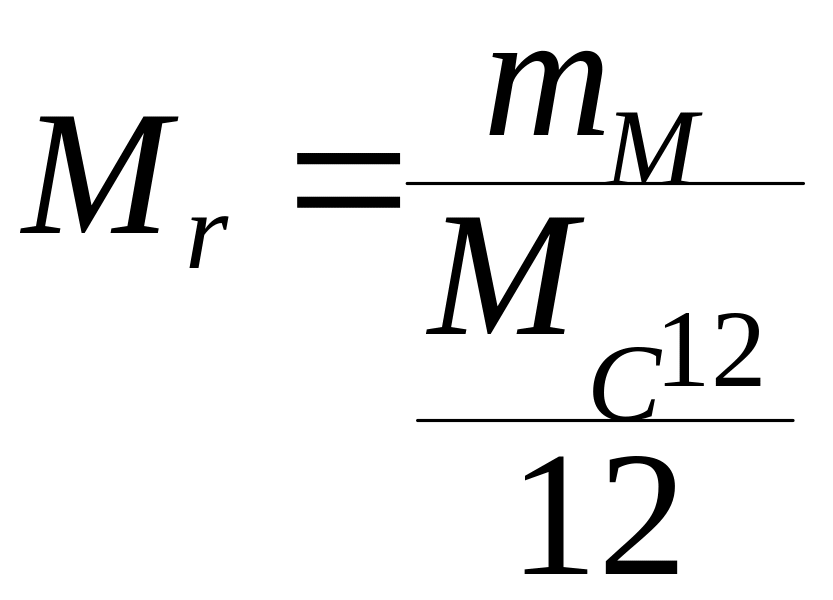 - это отношение массы молекулы
- это отношение массы молекулы
![]() к одной двенадцатой части массы изотопа
углерода
.
Относительная молекулярная масса также
является безразмерной величиной.
к одной двенадцатой части массы изотопа
углерода
.
Относительная молекулярная масса также
является безразмерной величиной.
3.
Относительная
молекулярная масса вещества, состоящего
из нескольких химических элементов:
![]() ,
где
,
где
![]() -
число атомов i
- го химического элемента;
-
число атомов i
- го химического элемента;
![]() - относительная атомная масса этого
элемента.
- относительная атомная масса этого
элемента.
Пример:
Относительная молекулярная масса
углекислого газа
![]() :
:
![]() .
.
4.
Число Авогадро
![]() число атомов в двенадцати граммах
изотопа углерода
:
число атомов в двенадцати граммах
изотопа углерода
:
5.
Количество вещества
- это отношение числа атомов или молекул
в веществе к числу Авогадро:
![]() или
или
![]() .
Размерность количества вещества:
.
Размерность количества вещества:
![]() моль. Моль - количество вещества, в
котором содержится число частиц, равное
числу Авогадро.
моль. Моль - количество вещества, в
котором содержится число частиц, равное
числу Авогадро.
6.
Молярная масса
- масса моля вещества:
![]() .
Молярная масса численно равна относительной
молекулярной массе, но является размерной
величиной. Размерность молярной массы:
.
Молярная масса численно равна относительной
молекулярной массе, но является размерной
величиной. Размерность молярной массы:
![]() .
.
7.
Эффективный диаметр молекулы
![]() -
наименьшее расстояние между центрами
молекул при их сближении. Размер молекул
составляет несколько Ангстрем (
-
наименьшее расстояние между центрами
молекул при их сближении. Размер молекул
составляет несколько Ангстрем (![]() ).
).
8.
Концентрация молекул
n
- отношение числа молекул в веществе к
занимаемому объему V:
![]() .
Размерность
.
Размерность
![]() .
.
9.
Плотность вещества
- масса единицы объема вещества:![]() .
Размерность
.
Размерность
![]() .
.
8.2. Уравнение состояния идеального газа
Одним из первых достижений молекулярной физики является создание теории идеальных газов. Если взаимодействием между молекулами можно пренебречь, то газ называется идеальным Близок к идеальному реальный газ при низких температурах, невысоких давлениях и малой концентрации частиц.
Состояние
идеального газа можно описать с помощью
трех параметров: давления, абсолютной
температуры и объема. Эти характеристики
являются результатом усреднения по
большому числу частиц системы. Давление
измеряется в Паскалях:
![]() ,
абсолютная температура измеряется в
Кельвинах:
,
абсолютная температура измеряется в
Кельвинах:
![]() ,
размерность объема:
,
размерность объема:
![]()
Уравнение состояния идеального газа
![]() (8.1)
(8.1)
Для
1 моля вещества,
![]() где
где
![]() - универсальная газовая постоянная.
- универсальная газовая постоянная.

Рис. 8.1.
Запишем
газовые законы для изопроцессов,
происходящих при условии, что один из
параметров: температура
![]() ,
давление P
или объём
,
давление P
или объём
![]() остаются постоянными.
остаются постоянными.
Закон Бойля-Мариотта (изотермический процесс: T = const, m = const): При неизменных температуре и массе произведение численных значений давления и объёма газа постоянно:
![]() (8.2)
(8.2)
или для двух состояний газа:
![]()
График
изотермы на диаграмме
![]() приведён
на рис. 8.1.
приведён
на рис. 8.1.
Закон
Гей – Люссака
(изобарный
процесс:
![]() ,
,
![]() ):
При постоянном
давлении объём данной массы газа прямо
пропорционален его абсолютной температуре:
):
При постоянном
давлении объём данной массы газа прямо
пропорционален его абсолютной температуре:
![]() (8.3)
(8.3)
или для двух различных состояний:
 .
.
График
изобары на диаграмме
![]() приведён на рис. 8.2.
приведён на рис. 8.2.


Рис. 8.2. Рис. 8.3.
Закон Шарля (изохорный процесс: V = const, m = const): При постоянном объёме давление данной массы газа прямо пропорционально его абсолютной температуре:
![]() (8.4)
(8.4)
или для двух состояний:
 .
.
График изохоры на диаграмме РТ приведён на рис. 8.3.
Уравнение состояния идеального газа для произвольного количества вещества называется уравнением Менделеева - Клапейрона:
![]() (8.5)
(8.5)
Найдём
число молекул, содержащихся в единице
объёма идеального газа. Запишем уравнение
Менделеева – Клапейрона в виде:
![]() ,
откуда находим:
,
откуда находим:
![]() (8.6)
(8.6)
где
![]() - постоянная Больцмана:
- постоянная Больцмана:
![]() .
.
Менделеев Дмитрий Иванович (1834 - 1907), русский учёный, родился в Тобольске. Окончил Главный педагогический институт в Петербурге. Открыл в 1862 г. один из фундаментальных законов природы - периодический закон химических элементов, нашёл общее уравнение состояния идеального газа (уравнение Менделеева-Клапейрона). Сконструировал барометр. В 1888 г. выдвинул идею подземной газификации угля.
Клапейрон Бенуа Поль Эмиль (1799 - 1864), французский физик и инженер, родился в Париже. Окончил Политехническую школу. Физические исследования посвящены теплоте, пластичности и равновесию твёрдых тел. Ввёл в термодинамику метод диаграмм, в частности, предложил систему координат . В 1834 г. вывел уравнение состояния идеального газа и уравнение, устанавливающее связь между температурой плавления и кипения вещества и давлением - уравнение Клапейрона - Клаузиуса.
Для смеси идеальных газов выполняется закон Дальтона:
![]() (8.7)
(8.7)
где
![]() - парциальное давление компонентов
смеси;
- парциальное давление компонентов
смеси;
![]() - число компонентов смеси;
,
- установившиеся объем и температура
смеси газов.
- число компонентов смеси;
,
- установившиеся объем и температура
смеси газов.
Парциальным давлением i-го компонента смеси называется давление газа при условии, что установившийся объем заполнен только этим компонентом и температура равна температуре смеси.
Количество вещества смеси газов:
 ,
,
или
![]() (8.8)
(8.8)
где
![]() - количество вещества, число молекул,
масса и молярная масса i-го
компонента смеси, соответственно.
- количество вещества, число молекул,
масса и молярная масса i-го
компонента смеси, соответственно.
Молярная масса смеси газов:
![]() (8.9)
(8.9)
