
- •1. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
- •1.1. Квазистатические процессы
- •1.3. Первое начало термодинамики для системы в адиабатической оболочке
- •1.4. Количество тепла. математическая формулировка первого начала термодинамики
- •1.5.Закон Гесса
- •1.6. Теплоемкость
- •1.7.Внутренняя энергия идеального газа. закон Джоуля
- •1.8. Уравнение Роберта Майера
- •1.9.Адиабатический процесс. Уравнение Пуассона
- •1.10. Определение СР/СV методом Клемана и Дезорма
- •1.11. Скорость звука в газах
- •1.12.Уравнение Бернулли
- •2. II НАЧАЛО ТЕРМОДИНАМИКИ
- •2.1. Различные формулировки основного постулата, выражающего второе начало термодинамики
- •Второе начало термодинамики в формулировках Кельвина и Клаузиуса
- •2.2. Обратимые и необратимые процессы
- •2.3. Цикл Карно и теорема Карно
- •2.3. Термодинамическая шкала температур
- •2.4.Тождественность термодинамической шкалы температур со шкалой идеально-газового термометра
- •2.5. Преобразование теплоты в механическую работу при изотермическом процессе. Вторая теорема Карно
- •2.6. Энтропия
- •2.7. Закон Возрастания Энтропии
- •2.8. Парадокс Гиббса при диффузии газов
- •2.9.Термодинамические функции
- •2.10. Cоотношения Максвелла.
- •2.11.Соотношения между термодинамическими производными. Правила Якобианов
- •2.12. Уравнения Гиббса — Гельмгольца
- •2.13.Максимальная работа и свободная энергия
- •3. УСТОЙЧИВОСТЬ ТЕРМОДИНАМИЧЕСКИХ СИСТЕМ.
- •3.1.Основные критерии устойчивости
- •3.2.Принцип Ле-Шателье — Брауна и устойчивость термодинамического равновесия
- •4. ТЕПЛОПРОВОДНОСТЬ
- •4.1. Уравнение теплопроводности
- •, то (1) можно переписать в виде:
- •4.2.Стационарные задачи на теплопроводность
- •4.3.Температурные волны
- •5. Фазовые переходы
- •5.1. Условия равновесия фаз
- •5.2. Правило фаз Гиббса
- •5.3. Фазовые переходы первого рода
- •5.4. Фазовые переходы второго рода
- •6.Основные положения молекулярно-кинетической теории.
- •6.1.Введение
- •6.3. Молекулярно-кинетический смысл температуры. Теорема о равнораспределение энергии по степеням свободы.
- •6.4. Броуновское движение
- •6.5. Барометрическая формула. Закон Больцмана
- •6.6. Понятие о вероятности
- •6.7. Распределение молекул по скоростям
- •Поскольку вместо r мы используем v, тогда интеграл представим в виде:
- •6.8.Распределение Максвелла. Наиболее вероятная, средняя и среднеквадратичная скорости молекул
- •6.9. Границы применимости классических распределений. Температура вырождения
- •7. ЭНТРОПИЯ И ВЕРОЯТНОСТЬ
- •7.1.Энтропия
- •Плотность функции распределения
- •Свойства плотности функции распределения
- •Можно показать: Плотность вероятности остается постоянной при движении системы по своей фазовой траектории.
- •7.3.Связь энтропии с функцией распределения. Классический случай
- •8. ИДЕАЛЬНЫЕ ГАЗЫ
- •8.1 Распределение Больцмана
- •8.2 Термодинамические функции и уравнение состояния идеального газа
- •8.4 Распределение Ферми-Дирака и Бозе-Энштейна
- •8.5 Вырожденный электронный газ
- •9. Третий закон термодинамики и его следствия
- •9.1.Теорема Нернста
- •10.СВОЙСТВА ЖИДКОСТЕЙ
- •10.1.Введение. Сопоставление газа и жидкости
- •10.2.Изотермы Ван-дер-Ваальса. Критические точки. Фазовые переходы. Правило рычага
- •10.3.Объемные свойства жидкостей
- •10.4.Соотношение между коэффициентами сжимаемости и объемного теплового расширения
- •10.5.Теплоемкость жидкостей
- •10.6. Явления на границе жидкости
- •10.7.Условия равновесия на границе двух сред. Краевой угол
- •10.9.Силы, возникающие на кривой поверхности жидкости
- •10.9.Капиллярные явления

103
3/ 2 |
∞ |
|
mv2 |
3/ 2 |
v π 2 π |
|
mv2 |
||||
( |
m |
) |
−∞ |
e− |
|
dv x dvy dvz =( |
m |
) |
∫∫∫0 0 0 |
e− |
|
2 kT |
2 kT |
||||||||||
2 π kT |
2 π kT |
|
|||||||||
∂(x, y ,z) |
- якобиан перехода |
|
|
|
|
|
|||||
∂(v ,θ ,ϕ) |
|
|
|
|
|
|
|
|
|
||
Для сферической системы координата
{z=r cos(θ)
y=rsin (θ)sin(ϕ) x=r sin(θ)cos(ϕ)
Молекулярная физика
∂(x , y ,z) dr d θd ϕ
∂(v, θ, ϕ)
Используя эти соотношения можно рассчитать якобиан перехода
∂(x , y, z)=r2 sin θ
∂(r ,θ ,ϕ)
Поскольку вместо r мы используем v, тогда интеграл представим в виде:
|
m |
3/ 2 |
|
∞ |
|
mv2 |
|
π |
2 π |
|
m |
3/ 2 |
∞ |
mv2 |
||||||||
|
|
|
|
|
∫e− |
|
|
v2 dr∫sin(θ)d θ∫d ϕ=4 π |
|
|
∫e− |
|
v2 dr=1 |
|||||||||
|
|
|
|
|
2 kT |
|
2 kT |
|||||||||||||||
(2 π kT ) |
(2 π kT ) |
|||||||||||||||||||||
0 |
|
|
|
|
0 |
0 |
0 |
|
|
|||||||||||||
Из последней формулы следует |
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
3/ 2 |
|
mv2 |
|
|
|
|
|
|
|
||||
|
4 |
|
( |
m |
) |
e− |
|
v2 |
|
|
|
|
|
|
|
|||||||
f (v )= |
|
2 kT |
|
|
|
|
|
|
|
|||||||||||||
√ |
π |
|
2 kT |
|
|
|
|
|
|
|
||||||||||||
6.8.Распределение Максвелла. Наиболее вероятная, средняя и среднеквадратичная скорости молекул
Величина
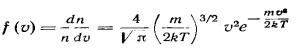 (1) представляет собой функцию распределения молекул по скоростям.
(1) представляет собой функцию распределения молекул по скоростям.
Она определяет долю молекул единицы объема газа, скорости которых заключены в интервале скоростей, равном единице, включающем данную скорость.
Графически вид функции распределения Максвелла представлен на рис. 1.
Рис.1.
Как и следовало ожидать, она обращается в нуль при v = 0 и при v → ∞ в газе нет

104 |
Молекулярная физика |
неподвижных молекул и нет молекул с бесконечно большими скоростями. Как видно из кривой рис. 1, функция распределения имеет максимум при некотором значении скорости vH. Это значит, что наибольшая доля всех молекул газа движется со скоростями, значения которых близки к vн, встречаются у молекул газа чаще других, что вероятность того, что скорость молекулы близка к vН, —наибольшая. Поэтому скорость vН , которой соответствует максимум кривой распределения Максвелла, называется наивероятнейшей скоростью.
Пользуясь кривой распределения молекул по скоростям, можно графически найти долю молекул — в единице объема газа, скорости которых лежат в заданном интервале скоростей dv. Она равна площади заштрихованной полосы на рис. 1 с основанием dv и высотой f(v).
dnn = f (v)dv
Ясно, что вся площадь, ограниченная кривой распределения и осью скоростей, дает нам общее число молекул в единице объема.
Как видно из формулы , вид кривой распределения зависит от природы газа (в формулу входит масса молекулы m и от температуры. На рис. 2 приведены кривые распределения молекул азота по скоростям при различных температурах.
Рис.2 Из них видно, что при повышении температуры скорости молекул возрастают, так что вся
кривая смещается в сторону больших скоростей. Но площади, ограниченные кривыми и осью скоростей, остаются, конечно, неизменными. Вследствие этого максимум кривой при повышении температуры уменьшается.
Больцман показал, что если газ находится в состоянии, в котором его молекулы распределены по скоростям не по Максвеллу, то такой газ, благодаря столкновениям молекул, сам собой переходит в состояние с максвелловским распределением.
Распределение Максвелла (иногда говорят: распределение Максвелла — Больцмана) — это равновесное распределение.
Молекулярные движения, происходящие в газе, мы все время называли хаотическими. Теперь мы можем дать точное определение понятию хаотичности тепловых движений: движение молекул полностью беспорядочно (хаотично), если скорости молекул распределены по закону Максвелла.
Такие вполне хаотические движения молекулы совершают, когда газ находится в состоянии равновесия. Это состояние характеризуется величиной температуры, которая в свою очередь определяется средней кинетической энергией движения молекул. Отсюда следует, что температура определяется средней кинетической энергией именно хаотических движений. Всякое же направленное движение молекул, каковы бы ни были их скорости в таком движении, никакого отношения к температуре не имеет.
Как бы велика ни была скорость воздуха, образующего сильный ветер, она не сделает его горячим. Ветры, даже самые сильные, могут быть и теплыми и холодными, потому что температура газа определяется не направленной скоростью ветра, а теми хаотическими движениями, которые молекулы совершают наряду с направленным движением газа как

105 |
Молекулярная физика |
целого и независимо от него.
Средние скорости молекул
Пользуясь функцией распределения Максвелла, можно вычислить ряд величин, важных для молекулярной физики. Здесь в качестве примеров мы приведем вычисления средней
-арифметической скорости |
|
v м), средней квадратичной скорости |
||||||||||||||||||||||
скорости vН. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
df =0 |
|||||||
v= v f (v)dv |
, |
v2 = v2 |
f (v )dv |
|
|
|||||||||||||||||||
|
∞ |
|
|
|
|
|
|
|
|
|
|
∞ |
|
|
|
|
|
(dv )vН |
||||||
|
∫ |
|
|
|
|
|
|
|
|
|
|
∫ |
|
|
|
|
|
|||||||
0 |
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
||||
Вычислим |
|
|
|
|
|
|
|
|
|
|
3 / 2 |
|
|
|
mv2 |
|||||||||
|
∞ |
|
|
|
|
|
|
4 |
|
|
m |
|
|
∞ |
|
|
||||||||
v=∫v f (v)dv = |
|
|
|
|
|
∫v v2 e− |
|
|
||||||||||||||||
|
|
|
|
|
2 kT |
dv = |
||||||||||||||||||
√ π |
( |
|
2kT ) |
|||||||||||||||||||||
0 |
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|||||||
|
|
mv2 |
|
2 |
|
2kT |
|
|
|
|
|
kT |
|
dx |
||||||||||
|
|
|
=x , v |
= m |
|
x , |
vdv= m |
|
||||||||||||||||
2 kT |
|
|
||||||||||||||||||||||
4 |
|
|
m |
3 /2 |
1 |
|
2kT |
2 |
∞ |
|
|
dx=√ |
|
|
||||||||||
|
|
|
|
−x |
8 kT |
|||||||||||||||||||
= |
|
|
( |
|
) |
2 ( |
m |
) |
∫0 |
xe |
|
|
π m |
|||||||||||
√ π |
2kT |
|
|
|||||||||||||||||||||
v=√8 kT
π m
Для среднеквадратичной скорости было получено соотношение: m2v2 = 32 kT
|
|
|
|
|
kT |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
кв =√ |
|
|
kT |
|
|
|||||
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
v |
=3 |
|
m |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V |
3 |
|
m |
|
|||||||||
|
|
|
|
|
|
|
|
|
∞ |
|
|
|
|
|
4 |
|
|
|
m |
|
3/ 2 |
∞ |
|
mv2 |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
=∫v2 f (v)dv= |
|
|
|
|
|
∫v2 v2 e− |
|
dv = |
|
||||||||||||||||
|
|
|
|
|
|
|
v2 |
|
|
|
|
2 kT |
|
||||||||||||||||||||
|
|
|
|
|
|
|
√ |
π |
|
(2kT ) |
|
||||||||||||||||||||||
|
|
mv2 |
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
2kT |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
2, |
|
2 |
|
2 |
|
|
|
|
|
|
|
m |
|
|
|
|
|
|
|
2kT |
|
||||||
|
|
|
|
|
=x |
|
v |
= |
|
x |
, |
|
|
|
|
|
|
|
dv=dx , |
|
dv |
= |
|
|
|
dx |
|||||||
2 kT |
|
|
|
|
|
|
√2 kT |
|
√ m |
||||||||||||||||||||||||
|
|
m |
3 /2 |
|
|
m 5 /2 ∞ |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
= |
4 |
( |
) |
(2kTm ) |
∫0 |
x4 e− x2 dx |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
√ π |
2kT |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
Если взять интеграл по частям, то получим (4).
v2 и наивероятнейшей
(2)
(3)
(4)
Вычислим теперь наивероятнеишую скорость молекул — скорость, около которой группируются скорости наибольшего числа молекул газа. Этой скорости соответствует максимум кривой распределения Максвелла. Поэтому, чтобы найти эту скорость, нужно приравнять нулю производную от функции распределения:
Это равенство будет выполнено, если
Проведя дифференцирование, получим:

106 |
Молекулярная физика |
Это равенство выполняется либо при v = 0, либо при v = ∞, либо при условии, что
Ясно, что первые два условия не соответствуют максимуму кривой распределения. Следовательно, значение vH определяется из условия
(4а)
Сравнивая выражения A4.3), A4.6) и A5.1), находим соотношение между тремя вычисленными значениями скоростей:
vН /V кв=√2 /3=√2/3=0,816= 1,221
Свойства Г-функции
∞ |
|
|
∫ |
e−t tα−1 dt , Г (1)=1, |
Г (1/2)=√ π , Г (n+1)=n! , Г (α)=(α−1) Г (α−1) |
Г (α)= |
||
0 |
|
|
6.9. Границы применимости классических распределений. Температура вырождения
Задача о распределении молекул газа по скоростям, как она сформулирована выше, а также методы решения ее, приводимые дальше, являются чисто классическими. Поэтому необходимо прежде всего выяснить границы применимости такого классического рассмотрения.
Если не обращать внимания на малосущественные численные коэффициенты порядка единицы, то ответ можно получить из наглядных соображений, хотя бы с помощью принципа неопределенности Гайзенберга (род. 1901). Выделим в газе маленький кубик со сторонами х, у, z, на который в среднем приходится одна частица. Если выполнены условия
xpx h , ypy h, zpz h
то движение частицы в этом кубике можно рассматривать классически.
Действительно, согласно принципу неопределенности Гайзенберга, произведение квантовых неопределенностей координаты и импульсы частицы порядка h, а потому при соблюдении указанных условий эти неопределенности существенной роли не играют.
Перемножив эти три неравенства, можно заменить их одним:
Vp3 h3 ,
где V = хуz — объем кубика, а р — некоторый средний импульс, характеризующий движение частиц газа. Если п — число частиц в единице объема, тогда
V = 1/n, так что предыдущее соотношение принимает вид
n (h/ p)3 1 .
Величина
λ= hp = mvh
называется длиной волны де-Бройля и играет исключительно важную роль в квантовой механике.

107 |
Молекулярная физика |
С введением к условие применимости классического рассмотрения газа принимает вид |
|
n λ3 1 |
(5) |
Оно означает, что среднее число частиц газа в объеме |
λ3 должно быть мало по сравнению |
с единицей. |
|
Для оценки порядка величины λ , воспользуемся какой-либо средней скоростью, характеризующей тепловое движение молекул газа. Используем наивероятнейшую скорость (4а).
Для этого перепишем (5) в виде:
(n λ3 )2/ 3 1 , или n2/ 3 λ2 1 |
|
|
|
|
Поскольку v2=2kТ/m , то λ2= |
h2 |
= |
h2 |
|
m2 v2 |
2 kT m |
|||
|
|
Тогда можно получить: |
|
|
||
n2/ 3 |
h2 |
1 |
|
|
2 kT m |
|
|
||
|
|
|
|
|
Используя ее, придадим условию (5) вид |
|
|
||
|
|
Т>>Тg, |
||
где введено обозначение |
h2 |
|
||
|
|
Tg= |
n2 /3 |
|
|
|
2 k m |
||
Величина Tg называется температурой вырождения газа. Таким образом, классический способ рассмотрения применим при температурах, значительно превышающих температуру вырождения.
При более строгом рассмотрении за температуру вырождения принимают величину
Tg= 2 hk2m (38 nπ )2/ 3
(6)
(7)
(8)
Она примерно втрое меньше предыдущего выражения. Газы ниже температуры вырождения называются вырожденными. К ним классический способ рассмотрения не применим. Вычислим температуру вырождения для двух крайних случаев.
Для электронного газа в серебре п ~ 6 1022 см3, масса электрона т = 9,11 10-28 г. По формуле
(8) получаем для электронного газа в серебре Tg ~ 6,5 104 К. Подобные же значения получаются для всех других хорошо проводящих металлов. При таких высоких температурах ни один металл в твердом состоянии существовать не может. Отсюда следует, что электронный газ в хорошо проводящих металлах всегда полностью вырожден.
Возьмем теперь другой крайний случай — гелий. Масса атома гелия т = 6,6 10-24 г, а концентрация при нормальных условиях n = 2,7-1019 см3.
Вычисление по формуле (8) дает Tg = 0,05 К. У всех остальных газов (за исключением водорода) масса атомов еще больше, а следовательно, Tg ниже, чем у гелия (концентрация п при нормальных условиях одна и та же для всех идеальных газов). При столь низких температурах ни одно вещество не может находиться в газообразном состоянии. Поэтому все молекулярные газы достаточно далеки от вырождения, и их не только можно, но и следует рассматривать как классические системы.
