
- •1. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
- •1.1. Квазистатические процессы
- •1.3. Первое начало термодинамики для системы в адиабатической оболочке
- •1.4. Количество тепла. математическая формулировка первого начала термодинамики
- •1.5.Закон Гесса
- •1.6. Теплоемкость
- •1.7.Внутренняя энергия идеального газа. закон Джоуля
- •1.8. Уравнение Роберта Майера
- •1.9.Адиабатический процесс. Уравнение Пуассона
- •1.10. Определение СР/СV методом Клемана и Дезорма
- •1.11. Скорость звука в газах
- •1.12.Уравнение Бернулли
- •2. II НАЧАЛО ТЕРМОДИНАМИКИ
- •2.1. Различные формулировки основного постулата, выражающего второе начало термодинамики
- •Второе начало термодинамики в формулировках Кельвина и Клаузиуса
- •2.2. Обратимые и необратимые процессы
- •2.3. Цикл Карно и теорема Карно
- •2.3. Термодинамическая шкала температур
- •2.4.Тождественность термодинамической шкалы температур со шкалой идеально-газового термометра
- •2.5. Преобразование теплоты в механическую работу при изотермическом процессе. Вторая теорема Карно
- •2.6. Энтропия
- •2.7. Закон Возрастания Энтропии
- •2.8. Парадокс Гиббса при диффузии газов
- •2.9.Термодинамические функции
- •2.10. Cоотношения Максвелла.
- •2.11.Соотношения между термодинамическими производными. Правила Якобианов
- •2.12. Уравнения Гиббса — Гельмгольца
- •2.13.Максимальная работа и свободная энергия
- •3. УСТОЙЧИВОСТЬ ТЕРМОДИНАМИЧЕСКИХ СИСТЕМ.
- •3.1.Основные критерии устойчивости
- •3.2.Принцип Ле-Шателье — Брауна и устойчивость термодинамического равновесия
- •4. ТЕПЛОПРОВОДНОСТЬ
- •4.1. Уравнение теплопроводности
- •, то (1) можно переписать в виде:
- •4.2.Стационарные задачи на теплопроводность
- •4.3.Температурные волны
- •5. Фазовые переходы
- •5.1. Условия равновесия фаз
- •5.2. Правило фаз Гиббса
- •5.3. Фазовые переходы первого рода
- •5.4. Фазовые переходы второго рода
- •6.Основные положения молекулярно-кинетической теории.
- •6.1.Введение
- •6.3. Молекулярно-кинетический смысл температуры. Теорема о равнораспределение энергии по степеням свободы.
- •6.4. Броуновское движение
- •6.5. Барометрическая формула. Закон Больцмана
- •6.6. Понятие о вероятности
- •6.7. Распределение молекул по скоростям
- •Поскольку вместо r мы используем v, тогда интеграл представим в виде:
- •6.8.Распределение Максвелла. Наиболее вероятная, средняя и среднеквадратичная скорости молекул
- •6.9. Границы применимости классических распределений. Температура вырождения
- •7. ЭНТРОПИЯ И ВЕРОЯТНОСТЬ
- •7.1.Энтропия
- •Плотность функции распределения
- •Свойства плотности функции распределения
- •Можно показать: Плотность вероятности остается постоянной при движении системы по своей фазовой траектории.
- •7.3.Связь энтропии с функцией распределения. Классический случай
- •8. ИДЕАЛЬНЫЕ ГАЗЫ
- •8.1 Распределение Больцмана
- •8.2 Термодинамические функции и уравнение состояния идеального газа
- •8.4 Распределение Ферми-Дирака и Бозе-Энштейна
- •8.5 Вырожденный электронный газ
- •9. Третий закон термодинамики и его следствия
- •9.1.Теорема Нернста
- •10.СВОЙСТВА ЖИДКОСТЕЙ
- •10.1.Введение. Сопоставление газа и жидкости
- •10.2.Изотермы Ван-дер-Ваальса. Критические точки. Фазовые переходы. Правило рычага
- •10.3.Объемные свойства жидкостей
- •10.4.Соотношение между коэффициентами сжимаемости и объемного теплового расширения
- •10.5.Теплоемкость жидкостей
- •10.6. Явления на границе жидкости
- •10.7.Условия равновесия на границе двух сред. Краевой угол
- •10.9.Силы, возникающие на кривой поверхности жидкости
- •10.9.Капиллярные явления
46 |
Молекулярная физика |
изотермически перевести из состояния с объемом V2 в состояние с объемом V1. При этом над газом совершается работа и он будет отдавать тепло нагревателю; Для изотермического процесса
δQ=PdV =RT dVV dS=RT dVV
1 |
V1 |
dV |
|
V 1 |
|
∫dS=−R∫ |
V |
S1−S2=R ln |
|
||
V 2 |
|||||
2 |
V2 |
|
|||
S2−S1=R ln V 2 >0 V 1
Энтропия возросла. Поэтому адиабатическое расширение газа в пустоту — необратимый процесс.
2.8. Парадокс Гиббса при диффузии газов
Пусть два идеальных газа 1 и 2 заключены в закрытом сосуде с твердыми адиабатическими стенками, так что объем сосуда V остается неизменным. В начальный момент газы отделены один от другого непроницаемой перегородкой и имеют общую температуру Т.
Затем перегородка убирается, и начинается необратимый процесс смешения газов. В конце концов он прекращается, и система переходит в равновесное состояние, в котором оба газа равномерно перемешаны. Температура в конечном состоянии будет такая же, что и в начальном состоянии, так как система изолирована, а газы — идеальные. Как изменится энтропия системы после смешения?
При термодинамическом определении энтропии задача сводится к вычислению интеграла ∫ δTQ для процесса, переводящего систему из начального состояния в
конечное. Этот процесс может быть любым, но обязательно квазистатическим. Действительно происходящий процесс смешения, возникающий после удаления перегородки, не годится, так как он не квазистатический. Однако принципиально возможно смешать оба газа квазистатически, если только газы не тождественны.
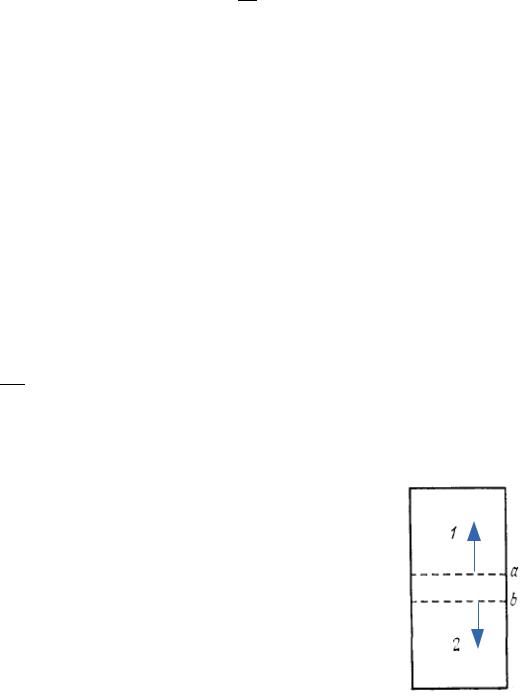
Это можно сделать, например, следующим образом. |
|
|
Допустим, что перегородка, разделяющая газы в начальном |
V1 |
|
состоянии, состоит из двух идеальных полупроницаемых |
||
|
||
перегородок а и b, сложенных вместе. Перегородка а |
|
|
беспрепятственно пропускает газ 1, но абсолютно непроницаема |
|
|
для газа 2. Перегородка б, напротив, пропускает газ 2, но |
|
|
непроницаема для газа 1. Идеальные полупроницаемые |
|
|
перегородки в действительности не существуют, но они допустимы |
|
|
в рассуждениях, применяющихся в мысленных экспериментах *). |
|
*) В принципе подобные процессы имеются. Например водород может

47 Молекулярная физика
достаточно эффективно проникать через медную фольгу, а более тяжелые газы нет.
а b, V2
Сложная перегородка, состоящая из перегородок и очевидно, непроницаема и для газа 1 и для газа 2. Устранив адиабатическую изоляцию системы, приведем ее в тепловой контакт с термостатом, температура которого поддерживается постоянной и равной Т.
Затем перемещением перегородки b заставим газ 1 квазистатически расширяться от первоначального объема V1 до конечного объема V. При таком расширении газ 1 совершает работу, и для поддержания температуры постоянной к нему надо подводить тепло. Приращение энтропии газа 1 можно вычислить по формуле как в случае задачи о расширении в пустоту
1 S=ν1 R ln VV1
где v1 — число молей первого газа.
Состояние газа 2 при этом меняться не будет. Теперь будем таким же образом перемещать полупроницаемую перегородку а, чтобы газ 2 квазистатически заполнил весь объем сосуда. Состояние газа 1 при этом не изменится, а энтропия газа 2 получит приращение
2 S=ν2 R ln VV2
Приращение энтропии всей системы равно
S=ν1 R ln |
V |
|
+ν2 R ln |
V |
|
(1) |
|
V |
1 |
V |
2 |
||||
|
|
|
Оно положительно, так как V1 < V и V2 < V. Энтропия возросла.
Это доказывает, что самопроизвольный процесс смешения газов в адиабатической оболочке, описанный в начале этого параграфа, действительно необратим.
Формула (1) приводит к парадоксальному выводу, называемому парадоксом Гиббса (1839—1903). Допустим, что газы 1 и 2 тождественны. Тогда по формуле (1) возрастание энтропии по-прежнему остается.
Однако, конечное состояние системы макроскопически ничем не отличается от начального. Энтропия возросла, а состояние системы не изменилось. В этом и состоит парадокс Гиббса.
Для понимания парадокса Гиббса существенно заметить, что формула (1) доказана нами только для случая, когда смешивающиеся газы 1 и 2 существенно различны. Для тождественных газов наши рассуждения не применимы.
Перегородки, проницаемые или непроницаемые для газа 1, останутся таковыми же и для газа 2, тождественного с ним. Принципиально невозможно перемешать тождественные газы квазистатическим
Для тождественных газов S = 0, и формула (1) неприменима.
Однако парадокс Гиббса имеет более глубокий смысл.
Этой формулой можно пользоваться всегда, когда атомы или молекулы смешивающихся газов различны, хотя бы это различие и было сколь угодно малым. Теоретически допустим предельный переход, в котором свойства
48 |
Молекулярная физика |
атомов одного газа неограниченно приближаются к свойствам атомов другого газа. Возрастание энтропии должно было бы сохраниться и при таком предельном переходе. Эйнштейн (1879 1955) видел в этом определенную трудность, свойственную классическому описанию явлений природы.
Такой трудности не существует в квантовой физике, где состояния физических систем— дискретны. В частности, число различных типов атомов конечно, а потому нельзя выполнить такой предельный переход, в котором бы свойства одного атома непрерывно переходили в свойства другого.
49 |
Молекулярная физика |
Различные понимания второго начала термодинамики
Термин «второе начало термодинамики» употребляется в физике уже более ста лет. Однако до сих лор разные авторы вкладывают в него различное содержание.
Наиболее логично поступают те авторы, которые понимают под вторым началом основной постулат: постулат Клаузиуса или эквивалентные им утверждения.
Другие авторы сводят содержание второго начала термодинамики к двум положениям, являющимся следствиями основного постулата: 1) существованию энтропии S как функции состояния системы; 2) принципу возрастания энтропии.
2.9.Термодинамические функции
Наряду с энтропией можно пользоваться множеством других, связанных с ней функций состояния. Рассмотрим главнейшие из них.
Если процесс — квазистатический, то |
|
δQ = TdS. |
|
Для такого процесса уравнение первого начала |
|
δQ=dU+PdV |
(1) |
можно переписать в виде |
|
dU = TdS-PdV. |
(2) |
Если ввести энтальпию |
|
I=U+PV, |
(3) |
то можно исключить U и получить |
|
dI=TdS+VdP. |
(3а) |
Это можно сделать с.о.
dI= dU + d(PV)=TdS-PdV+PdV+VdP=TdS+VdP
Так как TdS = δQ, то при постоянном давлении dI = δQ. Отсюда видно, что энтальпия есть такая функция состояния, приращение которой в квазистатическом процессе при постоянном давлении дает количество тепла Q, полученное системой. По этой причине энтальпию называют также тепловой функцией или теплосодержанием.
Особенно важное значение в термодинамике имеют две функции состояния:
свободная энергия F, введенная Гельмгольцем, и термодинамический потенциал Ф, введенный Гиббсом. Эти функции состояния определяются выражениями
F=U-TS, |
(4) |
Ф=F+PV=U-TS+PV |
(5) |
Для их дифференциалов получим соотношения dF=dU-d(TS)=TdS-PdV-TdS-SdT=-SdT-PdV
dФ=dF+d(PV)=-SdT-PdV+PdV+VdP= -SdT + V dP

50 |
Молекулярная физика |
dF=-SdT-PdV, |
(6) |
dФ=-SdT+VdP. |
(7) |
При изотермическом процессе dT = 0, а потому dF= -PdV =-dA
Отсюда А =F1-F2 Следовательно, свободная энергия есть функция состояния системы, убыль которой в квазистатическом изотермическом процессе дает работу, произведенную системой.
Рассмотрим функцию 2-х переменных f=f(x,y)
df =(∂∂ xf )y dx +(∂∂ fy )x dy=a dx+bdy
отсюда следует:
dU = TdS-PdV Þ U=U(S,V)
dI=TdS+VdPÞ I=I(S,P)
dF=-SdT-PdV Þ F=F(T,V), dФ=-SdT+VdP Þ Ф=Ф(T,P)
Т.е внутренняя энергия U как функцию аргументов S и V, энтальпия I как функцию S и Р,
свободная энергия F как функцию Т и V,
термодинамический потенциал Гиббса Ф — как функцию Т и Р:
Такого рода соотношения называются каноническими уравнениями состояния вещества.
Они были введены в термодинамику Гиббсом. Гиббс отметил, что каждое из канонических уравнений состояния дает более богатую информацию о свойствах вещества, чем термическое или калорическое уравнения состояния в отдельности.
Каноническое уравнение состояния, в какой бы из четырех форм оно ни было взято, содержит полные сведения о термических и калорических свойствах вещества.
Например
dU = TdS-PdV
dU =(∂∂US )V dS +(∂∂UV )S dV
T =( |
∂U |
)V |
, |
P=−( |
∂ U |
)S |
.(8) |
∂ S |
∂V |
Таким образом зная функцию U(S,V) можно вычислить температуру и давление, т. е. То, что можно получить из термического уравнения состояния.
Далее из уравнения dQ=dU+PdV вычислим dQ и затем найдем теплоемкость.
