
- •Дефекты кристаллического строения металлов.
- •4. Объёмные дефекты.
- •Фазовый состав сплавов.
- •Правило фаз (закон Гиббса) и правило определения состава и количества фаз (правило отрезков).
- •Р авновесная диаграмма состояния сплавов, образующих твердые растворы с неограниченной растворимостью.
- •Диаграмма состояния сплавов, компоненты которых ограниченно растворимы в твердом состоянии и образуют эвтектику.
- •Компоненты и фазы в системе железо-углерод.
- •Диаграмма Fе – Fе3с. Основные области и линии
- •Фазы и структуры углеродистых сталей в твердом состоянии.
- •Разновидности чугунов и их свойства.
- •Основные цели термической обработки металлических сплавов.
- •Отжиг 1 -го рода для уменьшения напряженней
- •Рекристаллизационный отжиг. Влияние нагрева на структуру и свойства деформируемого металла.
- •Отжиг 2-го рода. Фазовые превращения при нагреве сталей.
- •Аустенитное зерно.
- •Превращение (распад) аустенита при медленном охлаждении.
- •Диаграмма изотермического распада аустенита эвтектоидной стали.
- •Термокинетическая диаграмма распада аустенита (непрерывное охлаждение),
- •Отжиг 2-го рода доэвтектоидных сталей.
- •Сфероидизирующий отжиг заэвтектоидных сталей (инструментальный).
- •Закалка сталей. Условия проведения закалки.
- •Мартенсит. Изменение свойств при закалке на мартенсит.
- •Температуры мартенситного превращения
- •Изменение свойств стали при закалке на мартенсит
- •Способы закалки. Дефекты закалки
- •Бейнитное превращение. Механические свойства стали с бейнитной структурой.
- •Отпуск закаленных сталей, его параметры.
- •Структура и свойства отпущенной при разных температурах стали.
- •Прокаливаемость стали. Влияние прокаливаемости на свойства стали.
- •Химико-термическая обработка сталей и ее назначение. Основные методы насыщения и стадии хто.
- •Цементация сталей. Механизм образования, строение и свойства цементованного слоя.
- •Способы цементации.
- •Термическая обработка цементованных изделий.
- •Контроль качества цементованных изделий.
- •Нитроцементация и цианирование. Особенности совместной диффузии в стали с и n.
- •Структура и свойства нитроцементованного слоя. Дефекты нитроцементации.
- •Азотирование стали. Формирование диффузионного слоя и его строение.
- •Легированные стали. Цели легирования. Маркировка.
- •Влияние легирующих элементов на полиморфное превращение железа. Фазы в легированной стали.
- •В свободном состоянии.
- •В форме растворов в железе.
- •Влияние легирующих элементов на превращения в сталях.
- •Классификация легированных сталей.
- •Машиностроительные (конструкционные) стали.
- •Требования предъявляемые к подшипникам. Классификация подшипниковых сталей.
- •Улучшаемые конструкционные легированные стали.
- •Пружинные конструкционные стали.
- •Высокопрочные конструкционные стали.
- •Износостойкая аустенитная сталь.
- •С тали для строительных конструкций.
- •Дефекты легированных сталей.
- •Коррозионностойкие стали ферритного, мартенситного и аустенитного класса.
- •Инструментальные материалы. Стали для режущего инстумента.
- •Быстрорежущие стали. Термическая обработка быстрорежущих сталей.
- •Спеченные твердые сплавы.
- •Стали для измерительных инструментов.
- •Штамповые стали.
- •Полиморфизм металлов.
- •54.Постоянные примеси сталей
- •56. Обратимая и необратимая отпускная хрупкость.
- •57. Классификация алюминиевых сплавов.
- •58. Деформируемые алюминиевые сплавы и их термическая обработка.
- •59. Литейные и ковочные алюминиевые сплавы.
- •60. Спеченные алюминиевые сплавы.
- •61. Титан и его сплавы. Термическая обработка титановых сплавов.
- •62. Медь и её сплавы. Общая характеристика и классификация медных сплавов.
- •63. Бронзы – состав, свойства.
- •64. Латуни – состав, свойства.
- •65. Характеристика и классификация композиционных материалов.
Дефекты кристаллического строения металлов.
В металлах встечается большое количество деффектов кристаллического строения, которые оказывают влиянте на свойство материалов.
Виды дефектов:
1 .
Точечные
дефекты
малы
во всех измерениях и размеры их не
превышают нескольких атомных диаметров.
К точечным относятся:
.
Точечные
дефекты
малы
во всех измерениях и размеры их не
превышают нескольких атомных диаметров.
К точечным относятся:
а) Вакансии (дефекты Шотки) – узлы решётки, в которых атомы отстутствуют.
б) Межузельные атомы (дефекты Френгеля)(переход атома из узла в междоузлие – такие атомы называются дислоцированными).
В обеих случаях наблюдается искажение/искривление кристаллической решётки.
Точечные дефекты влияют на электропроводимость, магнитные свойства, на фазовые превращения в металлах и сплавах.
2. Линейные дефекты.
Имеют малые размеры в 2х измерениях и большую протяжённость в 3м измерении. Эти несовершенства называются дислокациями.
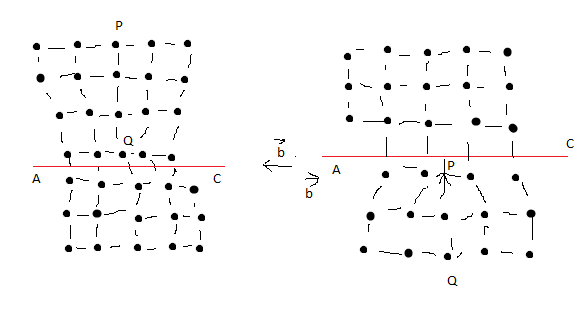
АС – плоскость скольжения, по которой дислокация перемещается, b – вектор сдвига.
Дислокации представляют собой локализованное искажение кристаллической решётки, вызванное наличием в ней «лишней атомной полуплоскости» (экстраплоскости), перпендикулярные плоскости чертежа PQ.
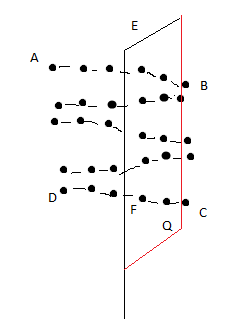
Винтовая дислокация - это прямая линия EF, вокруг которой атомные плоскости изогнуты по винтовой поверхности, т.е. в этом случае кристалл можно рассматривать как состоящей из одной атомной плоскости, закрученной в виде винтовой поверхности.
Основной
характеристикой дислокации является
величина плотности дислокации,
обозначается ρ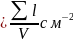 .
(суммарная длинна плотности дислокации
приходящаяся на единицу объёма)
.
(суммарная длинна плотности дислокации
приходящаяся на единицу объёма)
3. Поверхностные дефекты
П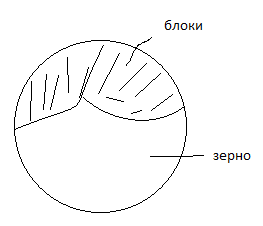 од
поверхностными дефектами понимают
такие нарушения в кристаллической
решётке, которые обладают большой
протяжённостью в двух измерениях, и
протяжённостью лишь в несколько атомных
расстояний в третьем измерении.
Поверхностные (плоские) дефекты
представляют собой поверхности раздела
между отдельными зёрнами или их блоками
(субзёрнами) поли-кристаллического
материала.
од
поверхностными дефектами понимают
такие нарушения в кристаллической
решётке, которые обладают большой
протяжённостью в двух измерениях, и
протяжённостью лишь в несколько атомных
расстояний в третьем измерении.
Поверхностные (плоские) дефекты
представляют собой поверхности раздела
между отдельными зёрнами или их блоками
(субзёрнами) поли-кристаллического
материала.
П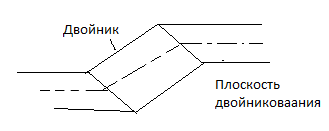 од
дефектами упаковки подразумевают
локальные изменения расположения
плотноупакованных плоскостей в кристалле.
Двойникованием (образование двойников)
называют симметричную переориентацию
областей. Решётка внутри двойниковой
прослойки является зеркальным отображением
решётки в остальной части кристалла.
од
дефектами упаковки подразумевают
локальные изменения расположения
плотноупакованных плоскостей в кристалле.
Двойникованием (образование двойников)
называют симметричную переориентацию
областей. Решётка внутри двойниковой
прослойки является зеркальным отображением
решётки в остальной части кристалла.
4. Объёмные дефекты.
Это те, которые имеют размеры в 3х измерениях: несплошности, пустоты, поры, неметаллические включения, трещины макро и микро, остаточные напряжения и так далее.
Фазовый состав сплавов.
Металлы в чистом виде применяются редко, чаще используются сплавы. При сплавлении 2х и более компонентов в результате их взаимодействия могут образовываться различные фазы. Фаза – однородная часть системы (сплава), которая характеризуется определённым составом, типом кристаллической решётки, своими свойствами и отделена от других фаз границей раздела.
В сплавах возможно присутствие следующих фаз: Жидкий раствор; Твёрдые/чистые металлы; Твёрдые растворы; Химические соединения.
В жидких растворах компоненты неограниченно растворимы. В твёрдом состоянии могут образовываться твёрдые растворы ограниченной и неограниченной растворимости. Компонент, в котором растворяется другой компонент, называется растворителем, а что растворяется – растворённым веществом.
Твёрдые растворы имеют решётку элемента растворителя. Две или несколько фаз в твёрдом состоянии могут образовывать между собой механические смеси.
Твёрдые растворы
Существует 2 вида твёрдых растворов: твёрдые растворы замещения и твёрдые растворы внедрения.
Т вёрдые
растворы замещения
могут быть переменного состава, а так
же число замещенных атомом может меняться
в широких пределах. Обозначаются эти
растворы α,
β,
γ
и так далее. Твёрдые растворы замещения
образуются в тех системах, если размеры
атомных радиусов компонентов отличаются
не более, чем на 15%. Наличие растворённых
атомов будет приводить к искажениям
кристаллической решётки, что будет
приводить к изменению периода
кристаллической решётки и изменению
свойств, т.е. будут иметь большую прочность
но меньшую пластичность. Растворимость
компонентов резко уменьшается в твердом
состоянии при увеличении различия
атомных радиуов.При образовании твёрдых
растворов замещения возможно неограниченная
растворимость если выполняется размерный
фактор, и компоненты имеют один тип
решётки. Пример: Cu-Ni,
Cu-Au.
вёрдые
растворы замещения
могут быть переменного состава, а так
же число замещенных атомом может меняться
в широких пределах. Обозначаются эти
растворы α,
β,
γ
и так далее. Твёрдые растворы замещения
образуются в тех системах, если размеры
атомных радиусов компонентов отличаются
не более, чем на 15%. Наличие растворённых
атомов будет приводить к искажениям
кристаллической решётки, что будет
приводить к изменению периода
кристаллической решётки и изменению
свойств, т.е. будут иметь большую прочность
но меньшую пластичность. Растворимость
компонентов резко уменьшается в твердом
состоянии при увеличении различия
атомных радиуов.При образовании твёрдых
растворов замещения возможно неограниченная
растворимость если выполняется размерный
фактор, и компоненты имеют один тип
решётки. Пример: Cu-Ni,
Cu-Au.
Т вёрдые
растворы внедрения
вёрдые
растворы внедрения
Твёрдые растворы внедрения получают при растворении металлов с неметаллами, имеющими малый атомный радиус (С, B, H, N в качестве компонента В). В данном случае внедрённые атомы размещаются в порах, и они образуются растворителем только твёрдые растворы ограниченные, т.е. в определённом интервале концентраций. При образовании твёрдых растворов внедрения искажения кристаллической решётки ещё больше, и изменение свойств так же больше, по сравнению с твёрдыми растворами замещения.
Химические соединения. Фазы внедрения. Твердые растворы вычитания. Интерметаллиды. Электронные соединения.
Образуются между металлами и между металлами и неметаллами. Характерной особенностью всех химических соединений является их существенное отличие от твёрдых растворов:
Кристаллическая решётка химического соединения отличается от решёток элементов, образующих химические соединения. Атомы в решётках располагаются упорядоченно друг относительно друга, и в определённом количестве.
В химических соединениях всегда сохраняются простые кратные весовые соотношения элементов. Это позволяет выразить их состав формулой: AnBm.
Резкое отличие свойств химических соединений от свойств образующих их элементов.
Постоянная температура плавления.
Образование химического соединения сопровождается значительным тепловым эффектом.
Химические соединения обычно образуются между компонентами, имеющими большое различие в электронном строении атомов и кристаллических решёток. Наиболее важные химические соединения, образующиеся в сплавах:
Фазы внедрения.
Переходные металлы Fe,
Mn,
Mo,
Cr
и другие образуют с С, N,
B,
H,
т.е. элементами, имеющими малый атомный
радиус, соединения: карбиды, нитриды,
бориды, гидриды. Они имеют общность
строения и называются фазами
внедрения. Их
можно описать формулами:
 .
Кристаллическая структура фаз внедрения
определяется соотношением атомных
радиусов не металла
.
Кристаллическая структура фаз внедрения
определяется соотношением атомных
радиусов не металла
 и металла
и металла
 .
Если
.
Если
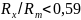 ,
то атомы металлов в этих фазах расположены
по типу одной из простых кристаллических
решёток: кубической или гексагональный,
в которую внедряются атомы не металла,
занимая в ней определённые поры. Примером
MX
является: TiC,
NbX,
WC,
VC,
MoC,
TiN.
,
то атомы металлов в этих фазах расположены
по типу одной из простых кристаллических
решёток: кубической или гексагональный,
в которую внедряются атомы не металла,
занимая в ней определённые поры. Примером
MX
является: TiC,
NbX,
WC,
VC,
MoC,
TiN.
 :
:
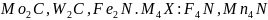 .
Эти соединения обладают высокой
электропроводностью и высокой твёрдостью
и высокой температурой плавления.
.
Эти соединения обладают высокой
электропроводностью и высокой твёрдостью
и высокой температурой плавления.
Если
 ,
например для форбида железа, марганца
или хрома, то образуются соединения с
более сложными решётками, называемые
твёрдыми
растворами вычитания,
или твёрдые растворы с дефектной
решёткой. В
твёрдых растворах вычитания часть узлов
решётки, которые должны быть заняты
атомами одного из компонентов, оказываются
свободными в избытке, по сравнению со
стехиометрическим соотношением
,
например для форбида железа, марганца
или хрома, то образуются соединения с
более сложными решётками, называемые
твёрдыми
растворами вычитания,
или твёрдые растворы с дефектной
решёткой. В
твёрдых растворах вычитания часть узлов
решётки, которые должны быть заняты
атомами одного из компонентов, оказываются
свободными в избытке, по сравнению со
стехиометрическим соотношением
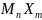 имеется другой компонент. К ним относятся
карбиды:
имеется другой компонент. К ним относятся
карбиды:
 .
Такие растворы вычитания имеют более
низкую температуру плавления.
.
Такие растворы вычитания имеют более
низкую температуру плавления.
Между металлами и
металлами образуются химические
соединения, которые называются
интерметаллиды
или интерметаллические соединения,
которые имеют высокую твёрдость и могут
образовываться в разных системных
компонентах. Химическая связь между
атомами интерметаллидов чаще металлическая.
Пример: соединения магния с элементами
4-6-й группы периодической системы:
 .
.
Электронные
соединения.
Образуются между валентными Cu,
Mg,
Au,
Li,
Na
или металлами переходных групп (Mn,
Fe,
Co)
с одной стороны и простыми металлами с
валентностью от 2 до 5 (Be,
Mg,
Zn,
Cd,
Al).
Особенно часто электронные соединения
встречаются в сплавах Cu,
Au,
Ag.
У электронных соединений определённое
отношение числа валентных электронов
к числу атомов, т.е. они имеют определённую
электронную концентрацию такую, как
3:2, 21:13, 7:4. Каждому из указанных соотношений
соответствует и определённые типы
кристаллической решётки, отличные от
кристаллической решётки образующих
компонент. Примером может являться
сплав Cu
с Zn
(латунь): CuZn
(3:2) (β-соединение),
 .
Β-соединение имеет ОЦК решётку или
гранецентрированную решётку.
.
Β-соединение имеет ОЦК решётку или
гранецентрированную решётку.
