
- •Дефекты кристаллического строения металлов.
- •4. Объёмные дефекты.
- •Фазовый состав сплавов.
- •Правило фаз (закон Гиббса) и правило определения состава и количества фаз (правило отрезков).
- •Р авновесная диаграмма состояния сплавов, образующих твердые растворы с неограниченной растворимостью.
- •Диаграмма состояния сплавов, компоненты которых ограниченно растворимы в твердом состоянии и образуют эвтектику.
- •Компоненты и фазы в системе железо-углерод.
- •Диаграмма Fе – Fе3с. Основные области и линии
- •Фазы и структуры углеродистых сталей в твердом состоянии.
- •Разновидности чугунов и их свойства.
- •Основные цели термической обработки металлических сплавов.
- •Отжиг 1 -го рода для уменьшения напряженней
- •Рекристаллизационный отжиг. Влияние нагрева на структуру и свойства деформируемого металла.
- •Отжиг 2-го рода. Фазовые превращения при нагреве сталей.
- •Аустенитное зерно.
- •Превращение (распад) аустенита при медленном охлаждении.
- •Диаграмма изотермического распада аустенита эвтектоидной стали.
- •Термокинетическая диаграмма распада аустенита (непрерывное охлаждение),
- •Отжиг 2-го рода доэвтектоидных сталей.
- •Сфероидизирующий отжиг заэвтектоидных сталей (инструментальный).
- •Закалка сталей. Условия проведения закалки.
- •Мартенсит. Изменение свойств при закалке на мартенсит.
- •Температуры мартенситного превращения
- •Изменение свойств стали при закалке на мартенсит
- •Способы закалки. Дефекты закалки
- •Бейнитное превращение. Механические свойства стали с бейнитной структурой.
- •Отпуск закаленных сталей, его параметры.
- •Структура и свойства отпущенной при разных температурах стали.
- •Прокаливаемость стали. Влияние прокаливаемости на свойства стали.
- •Химико-термическая обработка сталей и ее назначение. Основные методы насыщения и стадии хто.
- •Цементация сталей. Механизм образования, строение и свойства цементованного слоя.
- •Способы цементации.
- •Термическая обработка цементованных изделий.
- •Контроль качества цементованных изделий.
- •Нитроцементация и цианирование. Особенности совместной диффузии в стали с и n.
- •Структура и свойства нитроцементованного слоя. Дефекты нитроцементации.
- •Азотирование стали. Формирование диффузионного слоя и его строение.
- •Легированные стали. Цели легирования. Маркировка.
- •Влияние легирующих элементов на полиморфное превращение железа. Фазы в легированной стали.
- •В свободном состоянии.
- •В форме растворов в железе.
- •Влияние легирующих элементов на превращения в сталях.
- •Классификация легированных сталей.
- •Машиностроительные (конструкционные) стали.
- •Требования предъявляемые к подшипникам. Классификация подшипниковых сталей.
- •Улучшаемые конструкционные легированные стали.
- •Пружинные конструкционные стали.
- •Высокопрочные конструкционные стали.
- •Износостойкая аустенитная сталь.
- •С тали для строительных конструкций.
- •Дефекты легированных сталей.
- •Коррозионностойкие стали ферритного, мартенситного и аустенитного класса.
- •Инструментальные материалы. Стали для режущего инстумента.
- •Быстрорежущие стали. Термическая обработка быстрорежущих сталей.
- •Спеченные твердые сплавы.
- •Стали для измерительных инструментов.
- •Штамповые стали.
- •Полиморфизм металлов.
- •54.Постоянные примеси сталей
- •56. Обратимая и необратимая отпускная хрупкость.
- •57. Классификация алюминиевых сплавов.
- •58. Деформируемые алюминиевые сплавы и их термическая обработка.
- •59. Литейные и ковочные алюминиевые сплавы.
- •60. Спеченные алюминиевые сплавы.
- •61. Титан и его сплавы. Термическая обработка титановых сплавов.
- •62. Медь и её сплавы. Общая характеристика и классификация медных сплавов.
- •63. Бронзы – состав, свойства.
- •64. Латуни – состав, свойства.
- •65. Характеристика и классификация композиционных материалов.
Влияние легирующих элементов на полиморфное превращение железа. Фазы в легированной стали.
Влияние легирующих элементов на полиморфное превращение железа
В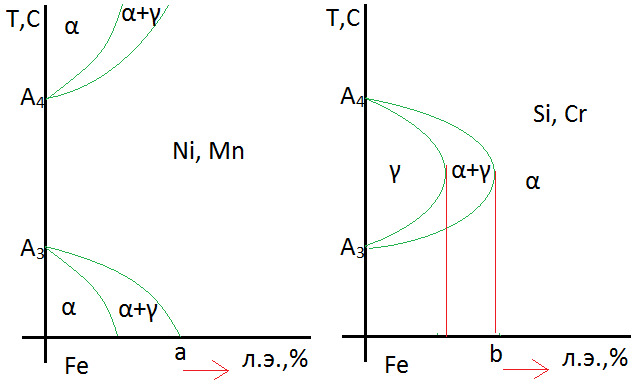 се
элементы, которые растворяются в железе
влияют на температурный интервал
существования его аллотропических
модификаций, т.е. сдвигают точки А3
и А4
по температурной шкале. Такие легирующие
элементы, как Niи
Mn,
снижают по мере увеличения элементов
температуру А3,
и повышают критическую температуру А4.
И таким образом расширяют область
существования γ-фаз.
При содержании легирующих элементов
больше концентрации точки а, γ-фаза
существует от комнатной температуры
до температуры плавления. Такие сплавы
с железом называются аустенитными.
Такие элементы, как Si,
Cr,
W,
Mo,
Vсужают
γ-область
по мере их увеличения до концентрации
в точкеb.
При этом А4
– уменьшается, А3
– увеличивается.При содержании легирующих
элементов больше точки b,
структура будет состоять из α-фазы
железа от комнатнойтемпературы до
температуры плавления. Такие сплавы
называются ферритными.
се
элементы, которые растворяются в железе
влияют на температурный интервал
существования его аллотропических
модификаций, т.е. сдвигают точки А3
и А4
по температурной шкале. Такие легирующие
элементы, как Niи
Mn,
снижают по мере увеличения элементов
температуру А3,
и повышают критическую температуру А4.
И таким образом расширяют область
существования γ-фаз.
При содержании легирующих элементов
больше концентрации точки а, γ-фаза
существует от комнатной температуры
до температуры плавления. Такие сплавы
с железом называются аустенитными.
Такие элементы, как Si,
Cr,
W,
Mo,
Vсужают
γ-область
по мере их увеличения до концентрации
в точкеb.
При этом А4
– уменьшается, А3
– увеличивается.При содержании легирующих
элементов больше точки b,
структура будет состоять из α-фазы
железа от комнатнойтемпературы до
температуры плавления. Такие сплавы
называются ферритными.
Фазы в легированных сталях
Могут находиться следующие фазы:
В свободном состоянии.
Pb, Ag, Cuне образуют соединений с железом, кроме того Pbи Agне растворимы в твёрдом железе. Растворимость Cu– около 1%. Поэтому они будут находиться в стали в свободном состоянии в виде металлических включений. Такое легирование встречается редко. Например, используется свинец для автоматных сталей для улучшения обрабатываемости.
В форме интерметаллических соединениях с железом и между собой.
Могут образовывать большинство применяемых легирующих элементов, однако эти соединения образуются при больших содержаниях легирующих элементов, т.е. в высоколегированных сталях и сплавах.
В виде оксидов, сульфидов и других неметаллических соединений (включениями).
Оксиды
и другие неметаллические соединения
образуют многие элементы, имеющие
бОльшее сродство кислороду, чем железо.
Эти элементы вводятся для раскисления
стали, и отнимают кислород у железа:
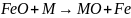 ,
где М – любой элемент – раскислитель.
В результате раскисления образуются
оксиды: Al2O3?
TiO2,
W2O5,
и так далее. Кроме сродства к кислороду
некоторые элементы имеют большее
сродство к сере, чем железо, и при их
введении образуются сульфиды.
,
где М – любой элемент – раскислитель.
В результате раскисления образуются
оксиды: Al2O3?
TiO2,
W2O5,
и так далее. Кроме сродства к кислороду
некоторые элементы имеют большее
сродство к сере, чем железо, и при их
введении образуются сульфиды.
В карбидной фазе – в виде раствора в цементите или в виде самостоятельных соединений с углеродом (специальных карбидов).
Ti |
V |
Cr |
Mn |
Fe |
Co |
Ni |
Cu |
Zr |
Nb |
Mo |
Te |
|
|
|
|
Hf |
Ta |
W |
Re |
|
|
|
|
В форме растворов в железе.
Растворяться в железе в значительных количествах может большинство легирующих элементов, кроме C, Ni, O2, B, удалённых в периодической системе от железа. Элементы, расположенные левее железа, распределяются между железом и карбидами. Элементы правее железа, образуют только растворы с железом и не образуют карбидов.
Таким образом легирующие элементы преимущественно растворяются в основных фазах железоуглеродистых сплавов (феррит, аустенит, цементит), или образуют специальные карбиды – карбиды, образованные с участием карбидообразующих элементов и имеющие отличную от цементита формулу и кристаллическую решётку.
Фазы, которые образуются с введением легирующих элементов
Легированный феррит – многокомпонентный твёрдый раствор внедрения и замещения. Все легирующие элементы, растворяющиеся в феррите, изменяют параметры решётки феррита в тем большей степени, чем больше различаются атомные размеры железа и легирующих элементов. Изменение размеров α решётки вызывает изменение свойств феррита. Атомы легирующих элементов создают в решётке напряжение. Отсюда: прочность повышается, пластичность уменьшается. Например, Cr, Mo, Wупрочняют феррит меньше, чем Ni, Si, Mn. Mo, W, Mnи Siснижают вязкость феррита. Хром уменьшает вязкость значительно слабее всех из перечисленных. Никель не снижает вязкости феррита. Важное значение имеет влияние легирующих элементов на порог хладноломкости. Хром повышает порог хладноломкости, а никель снижает. Никель является особенно ценным, так как упрочняет феррит и не снижает его вязкость.
Хладноломкость – потеря пластичности с понижением температуры. Характеризует склонность стали к хрупкому разрушению при -50° .. +70°С. Порог хладноломкости –интервал температур перехода от вязкого разрушения к хрупкому. В верхнем интервале излом полностью вязкий, а в нижнем – полностью хрупкий. Красноломкость – при температуре красного каления.
Легированный аустенит – твёрдый раствор легирующих элементов в γ-железе. В железо-углеродистых сплавах аустенит является стабильной фазой выше точки А3. В легированных сталях благодаря влиянию легирующих элементов аустенитная структура может быть при комнатной температуре. Эксплуатационные свойства аустенитных сталей определяются в зависимости от того, какой основной аустенит образующий элемент находится в составе. Аустенит, полученный в результате легирования марганцем, будет обладать способностью упрочняться в процессе эксплуатации при воздействии ударных нагрузок. Аустенит, полученный при легировании никелем обладает особыми свойствами – коррозионная стойкость, жаропрочность и так далее.
Карбидная фаза в легированных сталях: по степени сродства легирующих элементов к углероду, по сравнению со сродством к нему железа, различают карбидообразующие и не карбидообразующие элементы. К карбидообразующим элементам относят переходные металлы с недостроенной d оболочкой. Чем больше электронов на оболочке, тем больше сродство углероду. В процессе карбид образования углерод отдаёт свои валентные электроны на заполнение dоболочки атома металла, тогда как у металла валентные электроны образуют металлическую связь, обуславливающую металлические свойства карбидов.
Условия карбид образования в сталях: только элементы с dоболочкой, заполненной меньше, чем у железа, являются карбидообразующими. Активность их как карбид образователей тем сильнее, и устойчивость карбид образующихся фаз тем больше, чем менее достроена dоболочка у металлического атома.
В сталях карбидообразующими являются элементы:(в порядке возрастания свойств) Fe, Mn, Cr, Mo, W, V, Nb, Ti. Не карбидообразующие: Cu, Ni, Co, Si, Al. В сталях могут образовываться следующие карбидные соединения:
Типичные химические соединения, которые имеют сложную кристаллическую решётку и при нагреве растворяются в аустените: Fe3C, (Fe,Cr)3C, Cr7C3, Cr23C6, (Fe,Mn)3C, Fe3Mo3C, Fe3W3C.
Элементы: Mo, W, V, Nb, Tiобразуют с С фазы внедрения. При этом чаще всего карбиды имеют формулу:
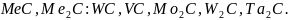 Имеют
простую кристаллическую решётку.
Отличаются очень высокой тугоплавкостью
и практически не растворимы в аустените.
Все карбиды обладают высокой твёрдостью
и высокой температурой плавления. В
чистом виде перечисленные карбиды не
существуют
Имеют
простую кристаллическую решётку.
Отличаются очень высокой тугоплавкостью
и практически не растворимы в аустените.
Все карбиды обладают высокой твёрдостью
и высокой температурой плавления. В
чистом виде перечисленные карбиды не
существуют
