
- •1. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
- •1.1. Квазистатические процессы
- •1.3. Первое начало термодинамики для системы в адиабатической оболочке
- •1.4. Количество тепла. математическая формулировка первого начала термодинамики
- •1.5.Закон Гесса
- •1.6. Теплоемкость
- •1.7.Внутренняя энергия идеального газа. закон Джоуля
- •1.8. Уравнение Роберта Майера
- •1.9.Адиабатический процесс. Уравнение Пуассона
- •1.10. Определение СР/СV методом Клемана и Дезорма
- •1.11. Скорость звука в газах
- •1.12.Уравнение Бернулли
- •2. II НАЧАЛО ТЕРМОДИНАМИКИ
- •2.1. Различные формулировки основного постулата, выражающего второе начало термодинамики
- •Второе начало термодинамики в формулировках Кельвина и Клаузиуса
- •2.2. Обратимые и необратимые процессы
- •2.3. Цикл Карно и теорема Карно
- •2.3. Термодинамическая шкала температур
- •2.4.Тождественность термодинамической шкалы температур со шкалой идеально-газового термометра
- •2.5. Преобразование теплоты в механическую работу при изотермическом процессе. Вторая теорема Карно
- •2.6. Энтропия
- •2.7. Закон Возрастания Энтропии
- •2.8. Парадокс Гиббса при диффузии газов
- •2.9.Термодинамические функции
- •2.10. Cоотношения Максвелла.
- •2.11.Соотношения между термодинамическими производными. Правила Якобианов
- •2.12. Уравнения Гиббса — Гельмгольца
- •2.13.Максимальная работа и свободная энергия
- •3. УСТОЙЧИВОСТЬ ТЕРМОДИНАМИЧЕСКИХ СИСТЕМ.
- •3.1.Основные критерии устойчивости
- •3.2.Принцип Ле-Шателье — Брауна и устойчивость термодинамического равновесия
- •4. ТЕПЛОПРОВОДНОСТЬ
- •4.1. Уравнение теплопроводности
- •, то (1) можно переписать в виде:
- •4.2.Стационарные задачи на теплопроводность
- •4.3.Температурные волны
- •5. Фазовые переходы
- •5.1. Условия равновесия фаз
- •5.2. Правило фаз Гиббса
- •5.3. Фазовые переходы первого рода
- •5.4. Фазовые переходы второго рода
- •6.Основные положения молекулярно-кинетической теории.
- •6.1.Введение
- •6.3. Молекулярно-кинетический смысл температуры. Теорема о равнораспределение энергии по степеням свободы.
- •6.4. Броуновское движение
- •6.5. Барометрическая формула. Закон Больцмана
- •6.6. Понятие о вероятности
- •6.7. Распределение молекул по скоростям
- •Поскольку вместо r мы используем v, тогда интеграл представим в виде:
- •6.8.Распределение Максвелла. Наиболее вероятная, средняя и среднеквадратичная скорости молекул
- •6.9. Границы применимости классических распределений. Температура вырождения
- •7. ЭНТРОПИЯ И ВЕРОЯТНОСТЬ
- •7.1.Энтропия
- •Плотность функции распределения
- •Свойства плотности функции распределения
- •Можно показать: Плотность вероятности остается постоянной при движении системы по своей фазовой траектории.
- •7.3.Связь энтропии с функцией распределения. Классический случай
- •8. ИДЕАЛЬНЫЕ ГАЗЫ
- •8.1 Распределение Больцмана
- •8.2 Термодинамические функции и уравнение состояния идеального газа
- •8.4 Распределение Ферми-Дирака и Бозе-Энштейна
- •8.5 Вырожденный электронный газ
- •9. Третий закон термодинамики и его следствия
- •9.1.Теорема Нернста
- •10.СВОЙСТВА ЖИДКОСТЕЙ
- •10.1.Введение. Сопоставление газа и жидкости
- •10.2.Изотермы Ван-дер-Ваальса. Критические точки. Фазовые переходы. Правило рычага
- •10.3.Объемные свойства жидкостей
- •10.4.Соотношение между коэффициентами сжимаемости и объемного теплового расширения
- •10.5.Теплоемкость жидкостей
- •10.6. Явления на границе жидкости
- •10.7.Условия равновесия на границе двух сред. Краевой угол
- •10.9.Силы, возникающие на кривой поверхности жидкости
- •10.9.Капиллярные явления
84 |
Молекулярная физика |
6.Основные положения молекулярно-кинетической теории.
6.1.Введение
В физике строго научное развитие молекулярной теории началось примерно со второй половины 19-го века, главным образом благодаря трудам Клаузиуса, Максвелла (1831 —1879) и Больцмана ..(184.4—1906)., в которых были заложены основы кинетической теории газов.
Успехи теории были связаны с тем, что теория строилась на основе общих принципов механики Ньютона: законах сохранения импульса и энергии, оправдавших себя не только для макроскопических тел, но и для микроскопических объектов, подчиняющихся квантовой механике. Широко использовались математические методы, в частности, методы математической теории вероятности. Существенно также, что теория развивалась под постоянным контролем опыта.
Основоположники кинетической теории газов пользовались упрощенными, идеализированными моделями этих частиц. Молекулы и атомы они рассматривали как идеально твердые шарики или как материальные точки, взаимодействующие друг с другом центральными силами. Поэтому рамки применения классической физики ограничены.
Атом является сложной системой, состоящей из ядра и окружающей его электронной оболочки. Атомизм проявляется в том, что все атомы, равно как и все простейшие (так называемые элементарные) частицы рассматриваемого вида
абсолютно тождественны и характеризуются вполне определенными признаками — массой, зарядом ядра, излучаемым спектром и пр. Подобной тождественности в области макромира не существует — в макромире нет двух абсолютно одинаковых тел. Атомизм проявляется также в том, что внутренние состояния атомов не непрерывны, а дискретны. Энергия атома, например, может принимать не непрерывный, а лишь дискретный ряд значений. Дискретные значения энергии атома называются его энергетическими уровнями.
Обычно атом находится в так называемом нормальном состоянии, в котором его энергия минимальна. Для того чтобы перевести атом в ближайшее возбужденное состояние, требуется внешнее воздействие и затрата энергии. Если этой энергии недостаточно, то после прекращения воздействия внутреннее состояние атома окажется в точности таким же, каким оно было до воздействия. Дискретность возможных состояний атомных систем и является причиной, которая позволила химикам прийти к представлению о неделимости атомов и дала возможность физикам в кинетической теории газов рассматривать атомы и молекулы как неизменяемые материальные точки или идеально твердые шарики.
Однако при увеличении энергии внешних воздействий, например, при повышении температуры газа, такие представления становятся недействительными. Так, при температурах порядка 1000—3000 К молекулы начинают диссоциировать, т. е. распадаться на атомы. При температурах порядка 10 000К и выше начинается ионизация, т. е. распад атомов на ионы и электроны. При температурах порядка
85 Молекулярная физика
десятков и сотен миллионов Кельвинов начинаются термоядерные реакции, т. е. Процессы слияния и распада атомных ядер.
Классические модели кинетической теории газов применимы при не слишком низких и высоких температурах.
6.2.Давление газа с точки зрения молекулярно-кинетической теории
1.Молекулы взаимодействуют друг с другом посредством молекулярных сил. На далеких расстояниях — это силы притяжения, на близких — силы отталкивания. Расстояние между центрами сблизившихся молекул, на котором силы притяжения равны силам отталкивания, принимается за диаметр молекулы.
В газах при нормальных условиях средние расстояния между молекулами много больше их диаметров. На таких расстояниях молекулярные силы очень слабы и не играют существенной роли. Молекулярные силы проявляются лишь на близких расстояниях порядка диаметров молекул. Взаимодействия молекул на близких расстояниях называют столкновениями. Между двумя последовательными столкновениями молекула газа движется практически свободно, т. е. прямолинейно и равномерно. Можно считать, что при каждом столкновении молекула газа почти мгновенно меняет направление своего движения, а затем движется с новой скоростью опять прямолинейно и равномерно, пока не произойдет следующее столкновение. Если газ в целом находится в покое, то в результате столкновений устанавливается хаотическое движение, в котором все направления движения молекул равновероятны. Оно называется тепловым движением. Чем более разрежен газ, тем длиннее средний
путь, проходимый молекулой между двумя последовательными столкновениями. Для достаточно разреженного газа, заключенного в сосуд, можно в первом приближении пренебречь размерами молекул и столкновениями их друг с другом. Надо учесть только столкновения молекул со стенками сосуда, в который газ заключен. В этом приближении молекулы газа могут рассматриваться как материальные точки, не взаимодействующие между собой и движущиеся прямолинейно и равномерно между каждыми двумя последовательными столкновениями со стенками сосуда. Такая простейшая модель приводит к законам идеальных газов.
Давление газа на стенку сосуда есть результат ударов молекул газа об эту стенку. При каждом ударе молекула газа действует на стенку с определенной (с макроскопической точки зрения бесконечно малой) силой. Обратно направленная сила, с которой действует на молекулу стенка сосуда, заставляет молекулу отражаться oт стенки. Одновременно о стенку сосуда будет ударяться громадное количество молекул. Бесконечно малые силы отдельных ударов складываются в конечную и почти постоянную силу, действующую на стенку. Эта сила, усредненная по времени, и есть давление газа, с которым имеет дело макроскопическая физика.
Вычислим давление газа на стенку сосуда.
Давление определим как силу F, отнесенной к единице площади S поверхности стенки, нормальной к этой силе:
86 Молекулярная физика
P= FS
Удары молекул о стенки приводят к некоторым смещениям частиц материала стенки и, значит, к ее деформации. Деформированная же стенка действует на газ упругой силой, направленной в каждой точке перпендикулярно к стенке. Сила эта равна по абсолютному значению и противоположна по направлению силе, с которой газ действует на стенку.
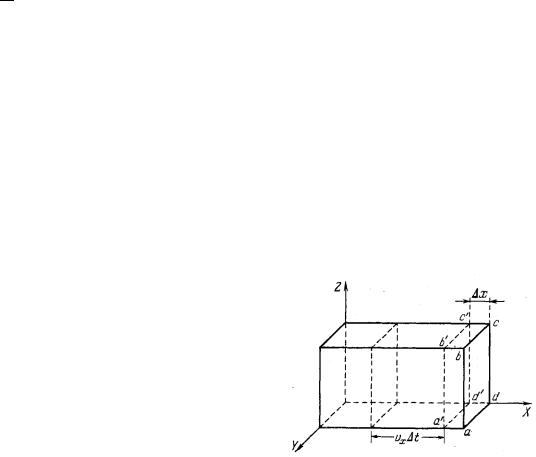
Найдем среднюю силу, возникающую от совокупного действия всех молекул газа. Допустим, что газ заключен в сосуд, имеющий форму параллелепипеда, и что газ находится в состоянии равновесия. В данном случае это означает, что газ как целое покоится относительно стенок сосуда: число молекул, движущихся в каком-нибудь произвольном направлении, в среднем равно числу молекул, скорости которых направлены в противоположную сторону.
Вычислим давление газа на одну из стенок сосуда, например на правую боковую стенку.
Нас будут интересовать только проекции vx скоростей молекул на ось X. Выделим мысленно слой газа толщиной x прилегающий к выбранной стенке. На него со стороны деформированной стенки действует упругая сила F. С такой же по абсолютному значению силой и газ действует на стенку. Па второму закону Ньютона импульс силы F t равен изменению импульса газа в этом слое:
F dt=d P .
Но газ находится в состоянии равновесия, так что слой никакого приращения импульса в направлении импульса силы не должен получить. Причина этого в том, что входящие молекулы несут с собой определенный импульс, а выходящие несут такой же импульс противоположного знака, так что общий импульс, получаемый слоем, равен алгебраической сумме импульсов входящих в слой и выходящих из него молекул и равен нулю. Если бы это было не так, то газ двигался бы как целое.
Найдем число молекул, входящих в наш слой слева за время t.
За время dt со стенкой столкнутся молекулы, которые находятся в объеме
V=Vx t S
Если в единице объема сосуда содержится n молекул, то в указанном объеме находится
N=n V=n(Svx) t
молекул. Но из них лишь половина движется слева направо. Каждая из них обладает импульсом mvx (m — масса молекулы), и общий импульс равен:
p= |
1 |
(m vx )N = |
1 |
(m v x)(n vx S t )= |
1 nm vx2 S t |
|
2 |
|
2 |
|
2 |
За это же время слой покидает, двигаясь справа налево, такое же число молекул с таким же общим импульсом, но обратного знака.

87 |
Молекулярная физика |
Из механики известно, что изменение количества движения системы за некоторый промежуток времени равно импульсу внешних сил, действующих на систему, за тот же промежуток времени.
F=d p/dt
Таким образом, из-за прихода в слой молекул с положительным импульсом и ухода из него молекул с отрицательным импульсом общее изменение импульса слоя равно:
|
1 |
2 |
1 |
2 |
|
2 |
p= |
2 nmv x S |
t−(−2 nm vx |
S |
t)=nm v x S t |
||
F=nm vx S
Разделив обе части этого равенства на S, получаем:
P= FS =nm v2x
До сих пор мы предполагали, что у всех молекул газа одинаковые проекции скорости vx. В действительности это не так. Молекулы двигаются с разными скоростями. Поэтому для каждой молекулы, имеющей скорость vi
Pi=mvix
Далее суммируя по всем молекулам получим:
i |
(n |
i |
) |
P=m∑ vix2 =m n |
1 |
∑vix2 |
=nm vx2 |
т. е. при усреднении по скоростям получаем, что давление пропорционально квадрату скорости движения молекул.
Для скорости v каждой молекулы можно написать:
v2=v2x +v2y+v2z
поэтому
v2 = v2x + v2y + v2z
Из-за полной беспорядочности молекулярных движений можно полагать, что средние значения квадратов проекций скоростей на три оси координат равны друг другу, т. е.
v2x = 13 v2
Иокончательно для давления получим формулу:
P= |
1 nm v2 |
= |
2 n m v2 |
= |
2 n ϵ |
(1) |
|
|
3 |
|
3 |
2 |
|
3 |
|
Следовательно, давление газа равно двум третям средней кинетической энергии молекул ϵ , содержащихся в единице объема газа.
Поскольку число частиц в единице объема n выражается через полное число частиц N в объеме V формулой:
n= |
N |
, |
|
|
|
|
|
|
V |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
То формулу (1) перепишем в виде: |
2 |
N m v2 |
|
2 |
|
|
||
|
|
PV = |
= |
E |
(2) |
|||
|
|
|
3 |
2 |
|
3 |
|
|
