
- •1. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
- •1.1. Квазистатические процессы
- •1.3. Первое начало термодинамики для системы в адиабатической оболочке
- •1.4. Количество тепла. математическая формулировка первого начала термодинамики
- •1.5.Закон Гесса
- •1.6. Теплоемкость
- •1.7.Внутренняя энергия идеального газа. закон Джоуля
- •1.8. Уравнение Роберта Майера
- •1.9.Адиабатический процесс. Уравнение Пуассона
- •1.10. Определение СР/СV методом Клемана и Дезорма
- •1.11. Скорость звука в газах
- •1.12.Уравнение Бернулли
- •2. II НАЧАЛО ТЕРМОДИНАМИКИ
- •2.1. Различные формулировки основного постулата, выражающего второе начало термодинамики
- •Второе начало термодинамики в формулировках Кельвина и Клаузиуса
- •2.2. Обратимые и необратимые процессы
- •2.3. Цикл Карно и теорема Карно
- •2.3. Термодинамическая шкала температур
- •2.4.Тождественность термодинамической шкалы температур со шкалой идеально-газового термометра
- •2.5. Преобразование теплоты в механическую работу при изотермическом процессе. Вторая теорема Карно
- •2.6. Энтропия
- •2.7. Закон Возрастания Энтропии
- •2.8. Парадокс Гиббса при диффузии газов
- •2.9.Термодинамические функции
- •2.10. Cоотношения Максвелла.
- •2.11.Соотношения между термодинамическими производными. Правила Якобианов
- •2.12. Уравнения Гиббса — Гельмгольца
- •2.13.Максимальная работа и свободная энергия
- •3. УСТОЙЧИВОСТЬ ТЕРМОДИНАМИЧЕСКИХ СИСТЕМ.
- •3.1.Основные критерии устойчивости
- •3.2.Принцип Ле-Шателье — Брауна и устойчивость термодинамического равновесия
- •4. ТЕПЛОПРОВОДНОСТЬ
- •4.1. Уравнение теплопроводности
- •, то (1) можно переписать в виде:
- •4.2.Стационарные задачи на теплопроводность
- •4.3.Температурные волны
- •5. Фазовые переходы
- •5.1. Условия равновесия фаз
- •5.2. Правило фаз Гиббса
- •5.3. Фазовые переходы первого рода
- •5.4. Фазовые переходы второго рода
- •6.Основные положения молекулярно-кинетической теории.
- •6.1.Введение
- •6.3. Молекулярно-кинетический смысл температуры. Теорема о равнораспределение энергии по степеням свободы.
- •6.4. Броуновское движение
- •6.5. Барометрическая формула. Закон Больцмана
- •6.6. Понятие о вероятности
- •6.7. Распределение молекул по скоростям
- •Поскольку вместо r мы используем v, тогда интеграл представим в виде:
- •6.8.Распределение Максвелла. Наиболее вероятная, средняя и среднеквадратичная скорости молекул
- •6.9. Границы применимости классических распределений. Температура вырождения
- •7. ЭНТРОПИЯ И ВЕРОЯТНОСТЬ
- •7.1.Энтропия
- •Плотность функции распределения
- •Свойства плотности функции распределения
- •Можно показать: Плотность вероятности остается постоянной при движении системы по своей фазовой траектории.
- •7.3.Связь энтропии с функцией распределения. Классический случай
- •8. ИДЕАЛЬНЫЕ ГАЗЫ
- •8.1 Распределение Больцмана
- •8.2 Термодинамические функции и уравнение состояния идеального газа
- •8.4 Распределение Ферми-Дирака и Бозе-Энштейна
- •8.5 Вырожденный электронный газ
- •9. Третий закон термодинамики и его следствия
- •9.1.Теорема Нернста
- •10.СВОЙСТВА ЖИДКОСТЕЙ
- •10.1.Введение. Сопоставление газа и жидкости
- •10.2.Изотермы Ван-дер-Ваальса. Критические точки. Фазовые переходы. Правило рычага
- •10.3.Объемные свойства жидкостей
- •10.4.Соотношение между коэффициентами сжимаемости и объемного теплового расширения
- •10.5.Теплоемкость жидкостей
- •10.6. Явления на границе жидкости
- •10.7.Условия равновесия на границе двух сред. Краевой угол
- •10.9.Силы, возникающие на кривой поверхности жидкости
- •10.9.Капиллярные явления

76 |
Молекулярная физика |
5. Фазовые переходы
5.1. Условия равновесия фаз
Перейдем к общему рассмотрению систем, состоящих из двух или нескольких фаз. Фазы - это однородные части системы, отличающиеся своими физическими свойствами, которые могут находиться в равновесии друг с другом. Примерами двухфазных систем могут служить жидкость и насыщенный пар, жидкость и соприкасающееся с ним твердое тело, две кристаллических модификации одного вещества и т.д.
В системе, в которой фазы находятся в равновесии, незначительное изменение внешних условий (например, подвод или отвод тепла или изменение объема) приводит к переходу некоторого количества вещества из одной фазы в другую (примерами могут служить кипение или плавление). Поэтому, изучая условия равновесия фаз, мы изучаем условия протекания
фазовых переходов.
Обсудим условия равновесия фаз. Очевидно, что для равновесия фаз, как и для равновесия любых частей системы, должны быть равными их температуры:
T1 = T2. |
(1) |
Кроме того, условие неподвижности границы между фазами требует равенства их давлений:
P1 = P2. |
(2) |
Однако выполнения условий (1) и (2) еще недостаточно для равновесия фаз. Рассмотрим двухфазную систему, в которой температура и давление всюду однородны. Термодинамический потенциал такой системы зависит от Т, Р и чисел молей в обеих фазах
N1 и N2:
Ф = Φ (T, P, N1 N2). |
(3) |
Дифференциал термодинамического потенциала определяется выражением
(4)
- химические потенциалы первой и второй фаз соответственно.
Если температура Т и давление Р поддерживаются постоянными, то
dT = 0, dP = 0

77 |
Молекулярная физика |
и, следовательно,
Пусть состояние системы является неравновесным по отношению к переменным N1 и N2 и в ней происходит процесс выравнивания, выражающийся в переходе некоторого количества вещества из одной фазы в другую. Тогда в силу постоянства общей массы фаз,
N1 + N2 = N = const,
получаем
dN2 = —dN1,
и выражение для dФ принимает вид
При стремлении системы к равновесию термодинамический потенциал уменьшается, dΦ < 0.
Это означает, что наш процесс выравнивания характеризуется неравенством
(5)
Отсюда следует, что |
|
|
dN1 < 0 при μ1>μ2 |
(N1 |
- убывает) |
либо |
|
|
dN1 > 0 при μ1<μ2, |
(N1 |
- возрастает) |
т.е. поток вещества всегда направлен от фазы с большим химическим потенциалом к фазе с меньшим химическим потенциалом.
В состоянии термодинамического равновесия потенциал Ф имеет минимум, т.е. dФ = 0.
Отсюда следует, что равновесие двух фаз достигается при равенстве их химических потенциалов:
μ1(T,P)=μ2(T,P). |
(6) |
При достижении условия (6) поток вещества из одной фазы в другую прекращается и система приходит в состояние равновесия. Таким образом, равновесие двух фаз требует не только равенства их температур и давлений, но и равенства их химических потенциалов.
5.2. Правило фаз Гиббса
Рассмотрим многофазную систему, состоящую из нескольких различных компенент. Свойства каждой такой фазы зависят от температуры, давления и химического состава. Рассмотрим систему из f фаз и n независимых компонент.

78 |
Молекулярная физика |
Условие равновесия выполняется для каждой компоненты (всего n компонент)
(7)
Очевидно, что число этих уравнений равно
Вычислим число независимых компонент, от которых зависят химические потенциалы. Число независимых концентраций в каждой фазе:
n-1.
Это следует из того, что в состоянии равновесии каждая фаза стабильна и между концентрациями в каждой фазе существует связь:
åf N f = N i= 1
Поэтому число независимых переменных в уравнениях (7) с учетом переменных Т и Р, 2 + (n − 1) f.
Вычитая из этого числа число уравнений, накладывающих ограничения на возможные значения переменных, получим число переменных, которые могут принимать произвольные значения:
v = 2+(n−1)f−n(f−1), т.е.
v = 2 + n−f. |
(8) |
Это число независимых переменных, которые в состоянии термодинамического равновесия могут иметь произвольные значения. Остальные переменные определяются из уравнений (7). Поэтому величина v называется числом степеней свободы системы.
Соотношение (8) было получено Гиббсом. Оно составляет правило фаз Гиббса. Несколько примеров, иллюстрирующих правило фаз.
1.Система, состоящая из химически однородной жидкости. Здесь имеется одна фаза, f = 1, и одна компонента, n = 1, так что v = 2. Это означает, что переменные Т и Р могут иметь произвольные значения.
2.Система, представляющая однородную смесь двух газов. Эта система состоит из одной фазы, f = 1, и двух компонент, n = 2, так что число степеней свободы v = 3. В этом случае можно произвольно задать значения Т, Р и отношение чисел молей обоих газов N1/N2.
3.Система из жидкости и ее насыщенного пара. В такой системе имеется две фазы, f = 2, и одна компонента, n = 1. В соответствии с правилом фаз (8), число v = 1. Произвольное значение может иметь только одна из переменных. Например, если задать температуру Т, то давление будет равно давлению насыщенного пара
Р = P(T) .

79 |
Молекулярная физика |
4. Система, состоящая из трех различных фаз одного вещества, например, льда, воды и водяного пара. Эта система имеет три фазы, f = 3 , и одну компоненту, n = 1. Согласно правилу Гиббса, v = 0 , т.е. степеней свободы нет: три различные фазы могут сосуществовать в равновесии только при определенных значениях Т и Р. Этот вывод иллюстрируется
 Давление насыщенного пара над водой
Давление насыщенного пара над водой
 Давление насыщенного пара над льдом
Давление насыщенного пара над льдом
(Р, T)-диаграммой, приведенной на рис. 1. Кривая АВ изображает давление насыщенного пара как функцию Т. В состояниях, соответствующих точкам на этой кривой, вода и пар могут находиться в равновесии. Если, поддерживая температуру постоянной, увеличить давление, то равновесие нарушается и весь пар переходит в воду. Наоборот, при уменьшении давления жидкость испаряется и превращается в пар. Таким образом, в области над кривой АВ устойчива вода, а в области под ней - пар.
Кривая АС изображает давление насыщенного пара надо льдом. Над этой кривой устойчив лед, а под ней - пар.
Итак, вода и пар могут сосуществовать при значениях Т и Р на кривой АВ, а лед и пар - на кривой АС. Поэтому точка, соответствующая равновесию льда, воды и пара, должна совпадать с точкой А, в которой эти две кривые пересекаются. Эта точка называется тройной точкой. В действительности в ней пересекаются три кривые: АВ, АС и AD, которая представляет кривую равновесия льда и воды. Эти три кривые делят плоскость диаграммы на три части, соответствующие областям устойчивости льда, воды и пара.
5.3. Фазовые переходы первого рода
Условие равновесие двух фаз |
|
μ1(T,P)=μ2(T,P). |
(6) |
означает, что равновесие двух фаз возможно не при любых значениях температуры и давления. Если известен явный вид функций
μ1(Т, Р) И μ2(Т, Р), то из уравнения (6) можно выразить давление Р как функцию Т, т.е. найти уравнение кривой фазового равновесия на плоскости (Т, Р). Таким образом, задание одной из этих переменных однозначно определяет вторую.
В общем случае, когда аналитический вид функций μ1(Т, Р) И μ2(Т, Р), неизвестен, уравнение
(6) позволяет получить дифференциальное уравнение кривой фазового перехода. В частности, оно дает возможность найти изменение давления насыщенного пара с температурой (уравнение Клапейрона - Клаузиуса).

80 |
Молекулярная физика |
Замечание 1 Соотношение P1=P2=P справедливо при плоской поверхности. В случае криволинейной поверхности давление может различаться. Это связано с выполнением работы против сил натяжения.
Замечание 2 Поскольку m(Т, Р) функция двух переменных Т и Р, то его можно рассматривать как термодинамический потенциал d μ=s dT +vdp
Уравнение (6) означает, что при фазовом переходе химический потенциал вещества изменяется непрерывно: химический потенциал первой фазы равен химическому потенциалу второй фазы. Однако производные
æ |
¶ m ö |
æ |
¶ m ö |
|
|
|
||
ç |
|
÷ |
= s , ç |
|
÷ |
= v |
(здесь s и v молярные) |
(9) |
|
|
|||||||
è |
¶ T ø P |
è |
¶ P ø |
T |
|
|
||
могут изменяться скачком. Т.е. при таком фазовом переходе молярная энтропия и молярный объем первой фазы отличаются от молярной энтропии и молярного объема второй фазы:
S1¹S2, v1¹v2.
Это - фазовые переходы первого рода.
Интегрируя соотношение
TdS = dQ
при Т = const (фазовый переход происходит при постоянной температуре), вычислим скачок молярной энтропии фазового перехода
T (s2 - s1 ) = ò d Q = L (10)
L - молярной теплота перехода
Таким образом, фазовые переходы первого рода сопровождаются скачкообразным изменением объема и поглощением или выделением теплоты перехода.
В частности, все изменения агрегатного состояния вещества являются фазовыми переходами первого рода.
Выведем из условия фазового равновесия уравнение Клапейрона - Клаузиуса. Для этого переместимся вдоль кривой фазового перехода первого рода из одной точки в другую, бесконечно близкую к первой. Для второй точки условие (6) имеет вид
Разложим функции в ряд до первого порядка малости. Тогда получаем
С учетом (9) и (6) находим
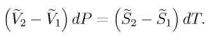 (здесь S , V молярные) После элементарных преобразований с учетом (10)получаем
(здесь S , V молярные) После элементарных преобразований с учетом (10)получаем
