
Nikolls_-_Ot_neyrona_k_mozgu
.pdf
Глава 15. Клеточные механизмы интеграции и поведения |
333 |
Рис. 15.15. Детекторы поляризованного света в глазу пустынного муравья. (А) Пространственная организация фоторецепторов. Рецепторы, воспринимающие поляризованный свет, расположены дорзальнее помеченной линии. Именно эту часть глаза муравей использует для ориентирования и навигации. (В) Снимок глаза муравья, сделанный сканирующим электронным микроскопом. Контактная линза, установленная в дорзальной области глаза, стушевывает границы между фоторецепторами.
Fig. 15.15. Polarized Light Detectors in the |
||
Eye of the Desert Ant. (A) The arrangement |
||
of photo-receptors. The receptors |
for This is the region of the eye that the ant uses to navigate. (B) Scanning |
|
polarized light lie in the region dorsal to the electron micrograph of the eye of the ant. A contact lens was placed over |
||
line marked by triangles. |
part of this eye, blurring the outlines of the photoreceptors. (After |
|
|
Wehner, 1994a.) |
|
|
|
|
|
|
|
Рис. 15.16. Пространственная организация фоторецепторов, воспринимающих поляризованный свет. (А) Электронная микрофотограмма дорэальной области глаза муравья. Микроворсинки омматидии расположены под прямыми углами друг к другу с удивительной точностью. (В) Диаграмма организации микроворсинок. 1-я и 5-я зоны воспринимают преимущественно поляризованный свет, падающий под определенным углом поляризации относительно других зон. В других же областях глаза микроворсинки могут располагаться и под другими углами относительно друг друга.
Fig. 15.16. Arrangement of Photoreceptors Responsive to Polarized Light. (A) Electron micrograph of the dorsal region of the eye of an ant. The microvilli in the ommatidia are orthogonally arranged in a remarkably precise manner.
(B) Diagram of the arrangement of microvilli. The numbers 1 and 5 respond preferentially to polarized light at a direction at right angles to those preferred by the other receptors. Elsewhere in the eye the microvilli are not necessarily at right angles in this way. (Electron micrograph kindly provided by Rudiiger Wehner; В after Wehner, 1996.)
го света будет наиболее эффективно вызывать электрические сигналы в данной фоторецепторной клетке. Более того, молекулы родопсина в четырех различных фоторецепторах одной омматидии дорзального ободка ориентированы таким образом, что образуют углы строго 90° по отношению друг к другу. Такая ориентация фоторецепторов присутствует только в тех зонах, которые ответственны за восприятие поляризованного света. Ортогональная ориентация четырех фоторецепторов в одной омматидии кажется специально созданной для определения угла поляризации. (Одиночный фоторецептор сам по себе не способен различить разницу в интенсивности, длине волны и угле поляризации). Очень сходные по строению образования найдены и в глазах ракообразных.
Доказательством того, что поляризованный свет является основным условием для ориентации у муравьев, служат следующие эксперименты. Во-первых, если глаз покрыть
334 |
Раздел III. Интегративные механизмы |
контактными линзами, пропускающими свет только в области переднего дорзального квадранта, муравей все равно способен находить прямую дорогу домой. Во-вторых, если область дорзального ободка закрыта, поиск обратного пути нарушается. В-третьих, если угол поляризованного света, падающего на глаз муравья, дополнительно сдвигается при помощи подходящих фильтров, на обратном пути муравей отклоняется от правильного направления на строго определенную и поддающуюся расчету величину.
Для успешной навигации информация, получаемая муравьем посредством зрения, должна коррелировать с картой звездного неба, положение солнца на которой определяет направление поляризации света. По мере того как муравей удаляется от гнезда, омматидии обеспечивают его ориентирами относительно довольно запутанного, но тем не менее постоянного неба. На основании этого НС рассчитывает пройденное расстояние и углы поворота. Сложный глаз муравья имеет полусферическую форму, что обеспечивает достоверное пространственное восприятие ориентации поляризованного света, как показано на рис. 15.14. Более того, при анализе распределения омматидии, воспринимающих поляризованный свет определенной ориентации, можно выявить, что расположение этих омматидии и их нервных элементов формирует как бы нейронную «карту», коррелирующую с распределением поляризованного света неба. В результате этого степень соответствия между данной «картой» и поляризацией солнечного света может быть использована для определения направления движения, которое может быть рассчитано как муравьем, так и исследователем.
Стратегии по поиску дороги к гнезду
Проблема заключается в том, что солнце не находится постоянно на одном месте. Следовательно, муравей должен компенсировать перемещение солнца в течение дня. Это было подтверждено в экспериментах, в которых муравей на 1 час помещался в темную камеру вдали от гнезда, а затем выпускался. Муравей, наблюдавший за перемещением солнца по небу в течение хотя бы одного дня, был способен корректировать свою траекторию, как будто он запомнил или знал, каким образом распределяется поляризованный солнечный свет в разное время суток. Кроме поляризованного света, само положение солнца, а также внешние объекты, расположенные вдоль пути, могут помочь в навигации78). Характерные детали ландшафта и различные предметы очень важны на последнем этапе при возвращении в гнездо, вход в которое является всего лишь маленьким отверстием в пустыне. Если вектор по направлению к дому был рассчитан с ошибкой, и муравей не вышел точно к гнезду, он начинает использовать новую стратегию79). Муравей осуществляет серию петлеобразных перемещений, постепенно увеличивающихся в диаметре, но всегда возвращающихся в исходную точку, с целью исследовать окружающее пространство. Это является оптимальной стратегией для точной рекогносцировки без опасности заблудиться.
Нервные механизмы навигации
Одним из важных результатов подобных исследований является получение детальной информации об исходных сенсорных механизмах ориентирования. Поскольку каждая омматидия дорзального ободка содержит два набора фоторецепторов, способных воспринимать плоскость поляризации света, расположенных под определенным углом друг к другу, и поскольку каждая омматидия воспринимает небо под несколько различным углом, набор из множества омматидии обеспечивает мозг информацией о пространственном распределении векторов поляризованного света. Более того, можно рассчитать, каким образом будет реагировать эта система на разного рода нетипичные помехи. При изучении поведения использовались различные объекты, которые помещались на пути движения насекомого, вынуждая его отклоняться от первоначального пути и затем корректировать это отклонение. Другого рода помехой может быть перемещение муравьев в разное время суток, а также разного рода изменения поляризованного света, воспринимаемого ими. Одновременно с этим, точные электрофизиологические эксперименты для выявления интегративных механизмов в нейронах мозга муравья пока не могут быть выполнены по техническим причинам. Поэтому связь между входной сенсорной информацией и моторными командами у муравья остается пока неясной. Тем не менее, используя вычислительный подход на основе известных свойств нейронов, могут быть созданы модели и даже роботы, способные точно копировать ориентирование пустынного муравья при помощи поляризованного света (рис. 15.17).

Глава 15. Клеточные механизмы интеграции и поведения |
335 |
|
||||||||
Рис. |
15.17. |
Мобильный |
|
робот, |
известный как Sa |
|
|
|
||
habot разработанный Венером с коллегами. На |
|
|
|
|||||||
роботе установлено 6 сенсоров поляризованного |
|
|
|
|||||||
света, в виде 3 пар. В каждой паре сенсоры |
|
|
|
|||||||
противопоставлены друг другу, что дает им свойства, |
|
|
|
|||||||
аналогичные свойствам нейронов, показанных на |
|
|
|
|||||||
рис. 15.18А. Каждая пара может быть повернута в |
|
|
|
|||||||
определенном |
направлении. |
Робот |
способен |
|
|
|
||||
ориентироваться |
при |
|
помощи |
поляризованного |
|
|
|
|||
света, с успехом воспроизводя поведение муравья. |
|
|
|
|||||||
Например, если экспериментатор при помощи |
|
|
|
|||||||
дистанционного управления проведет робота по |
|
|
|
|||||||
извилистому маршруту, робот способен сам |
|
|
|
|||||||
вычислить кратчайший путь к начальной точке. |
|
|
|
|||||||
Подобного |
рода |
модели |
демонстрируют |
|
|
|
||||
принципиальную |
возможность |
расчета |
такой |
|
|
|
||||
траектории, хотя, конечно, не помогают нам понять, |
|
|
|
|||||||
каким |
же |
|
образом |
подобные |
расчеты |
|
|
|
||
осуществляются в ЦНС муравья. |
|
|
|
|
|
|||||
Fig. 15.17. Mobile Robot Known as Sahabot devised by |
|
|
|
|||||||
Wehner and his associates. This robot is equipped with |
For example, it can be driven in a |
tortuous path and can |
||||||||
six polarized light sensors arranged in pairs. Each pair |
||||||||||
forms a polarization opponent unit with properties |
then compute the shortest way back |
to the starting point. |
||||||||
resembling those of the neuron shown in Figure 15.18A. |
Such models illustrate the possibility of computing |
|||||||||
Each can be tuned to a specific evoked direction. The |
trajectories in this way but do not of course, provide |
|||||||||
robot is able to navigate with this polarized light |
evidence that this is the system the ant uses. (After |
|||||||||
compass, successfully recreating the behavior of the ant. |
Wehner, 1997; photograph kindly provided by R. Wehner.) |
|||||||||
Так как нейроны муравья очень малы, электрические сигналы были отведены Лабхартом с коллегами от интернейронов сверчка, получающих сигналы от фоторецепторов поляризованного света80). Как и у муравьев и ракообразных, микроворсинки двух фоторецепторов сверчка расположены ортогонально: их отростки направляются к интернейрону с информацией о векторе поляризации света. Электрические сигналы этих клеток показаны на рис. 15.18. Эти сигналы в точности копируют сигналы, предсказанные на основе поведенческих экспериментов с поляризованным светом.
Поляризованный свет и «скрученные» фоторецепторы пчел
(twisted photoreceptors)
Рецепторы поляризованного света есть и у пчел. С одной стороны, упорядоченное расположение микроворсинок позволяет пчеле ориентироваться по поляризованному свету. Но при различении цветов поляризация может вызывать определенные сложности. Во время полета пчеле нужно хорошо различать цветы по окраске их лепестков. Листья и лепестки, однако, сильно различаются по своей способности отражать свет, что определяется свойствами их поверхностей, в зависимости от содержания восковидных веществ. Гладкие и лоснящиеся листья отражают поляризованный свет лучше, чем матовые. Следовательно, угол, под которым лист или лепесток рассматриваются и под которым на них падает свет, будет влиять на величину и направление отраженного поляризованного света.
Зрительные пигменты, необходимые для цветового зрения, располагаются у пчелы (как и у муравья) в микроворсинках специфических рецепторных клеток трех типов, чувствительных к зеленому, синему и ультрафиолетовому спектрам. У пчелы, как и у муравья, зрительные пигменты находятся в стереотипных параллельно расположенных рабдомах. Из-за переменных неучтенных составляющих поляризованного света, сигналы цветовосприятия становятся неоднозначными, так как точность различения цвета зависит не только от длины волны, но и от относительного поглощения света разными классами цветовых фоторецепторов. Как писали Венер и Бернард81): «Это означало бы, что для пчелы цветовые оттенки любой части растения меняются, если приближающаяся пчела вдруг меняет направление своего полета и, следовательно, направление обзора, — эффект совсем нежеланный. Например, зигзагообразно кружа над опушкой, где имеется
336 |
Раздел III. Интегративные механизмы |
|
|
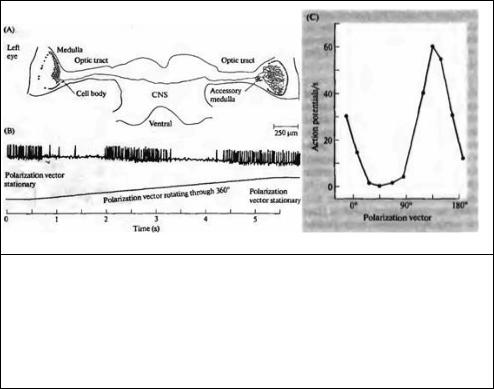
Рис. 15.18. Электрические ответы интернейронов, получающих сигналы с фоторецепторов поляризованного света в ЦНС сверчка. Интернейроны сверчка довольно большие, и в них можно ввести микроэлектрод для регистрации. (А) Реконструкция интернейрона при внутриклеточном введении нейробиотина. Данный нейрон получает сигналы от фоторецепторов левого глаза. (В) Сигналы в таком интернейроне при вращении вектора поляризованного света на 360 градусов. (С) Графическое представление сигналов в зависимости от вектора поляризации (ось абсцисс).
Fig. 15.18. Electrical Responses of Polarization-Sensitive Intemeurons in cricket CNS. These interneurons are large enough to be impaled by microelectrodes. (A) Reconstruction of the interneuron stained by intracellular application of neurobiotin. This neuron receives its input from the left eye. (B) Responses of a neuron of this type to polarized light when the vector is rotated through 360°. (C) Graphical representation of responses plotted against polarization vector.
(After Labhart, 1988.)
множество поверхностей листьев с разной степенью наклона, пчела видела бы удивительно пестрый фейерверк ложных цветов, делающий исключительно трудным, если вообще возможным, процесс определения истинных цветов растений». Чтобы избежать этой проблемы (которая, конечно, не может касаться нас, так как мы не способны воспринимать ориентацию поляризованного света), в сетчатке пчелы расположены «скрученные» рецепторные клетки. При помощи световой и электронной микроскопии было обнаружено, что фоторецепторы скручены вокруг своих продольных осей, что приводит к последовательному смещению в ориентации микроворсинок (рис. 15.19). Виток, величина которого составляет порядка 1°/мкм, приводит к тому, что микроворсинки более не находятся строго параллельно друг другу по всей глубине сетчатки. Поэтому фоторецепторы больше не воспринимают только поляризованный свет определенной ориентации. В течение многих лет изогнутая форма фоторецепторов казалась анатомической особенностью, не имеюшей какого-либо значения.
Глаз пчелы, как и муравья, содержит обычные «нескрученные» рецепторы в зоне дорзального ободка. Они реагируют на плоскополяризованный свет и, значит, могут быть использованы для навигации и ориентирования. Как говорил Лэнд: «Нельзя не поразиться простоте и многосторонности инженерных решений природы в оптике»82).

Глава 15. Клеточные механизмы интеграции и поведения |
337 |
||||||
Рис. 15.19. |
Анатомическое |
|
|
||||
строение |
|
|
завитков |
|
|
||
«скрученных» |
|
|
|
|
|
||
фоторецепторов |
|
глаза |
|
|
|||
пчелы, |
благодаря |
которым |
|
|
|||
минимизируется |
|
влияние |
|
|
|||
поляризованного |
света |
на |
|
|
|||
цветовое |
|
|
приятие. |
|
|
||
Ориентация |
фоторецепторов |
|
|
||||
показана на вставке. Угол |
|
|
|||||
поворота |
увеличивается |
в |
|
|
|||
направлении |
от |
поверхности |
|
|
|||
вглубь. На графике показаны |
|
|
|||||
угловые |
|
|
смещения |
|
|
||
фоторецепторов |
|
вокруг |
|
|
|||
поперечной |
оси |
(TRA) |
|
|
|||
(ордината), расположенных на |
|
|
|||||
разной |
глубине |
омматидия |
|
|
|||
(абсцисса). |
|
Рецепторы |
|
|
|||
дорзального |
ободка |
глаза, |
|
|
|||
чувствительные |
|
|
к |
|
|
||
поляризованному |
свету, |
не |
|
|
|||
имеют |
завитков |
(серые |
|
|
|||
кружки). |
|
В |
результате |
|
|
||
скручивания фоторецепторы, |
|
|
|||||
расположенные |
вне |
области |
|
|
|||
дорзального |
ободка, |
не |
|
|
|||
способны |
воспринимать угол |
|
|
||||
поляризации |
|
падающего |
|
|
|||
света. ВМ = базальная |
|
|
|||||
мембрана |
сложного |
глаза |
The arrangement of the photoreceptors is shown (in the inset) with twists evident at |
||||
пчелы. |
|
|
|
|
|
increasing depth from the surface. In the graph the depth below the tip of the |
|
Fig. 1S.19. Anatomical Twist in |
ommatidium is plotted (abscissa) against the angular position of the transverse axis |
||||||
(TRA) of the photoreceptor (ordinale) |
Receptors in the dorsal rim of the eye, which |
||||||
Bee Photoreceptors |
through |
is sensitive to polarized light show no twist (grey circles). As a result of the twist a |
|||||
which the influence of polarized |
photoreceptor outside the dorsal rim does not respond selectively to polarized light |
||||||
light is minimized. |
|
|
|
of a particular orientation. BM = basement membrane of compound eye. (After |
|||
|
|
|
|
|
|
||
|
|
|
|
|
|
Wehner and Bernard, 1993.) |
|
Использование магнитных полей пчелами в навигации
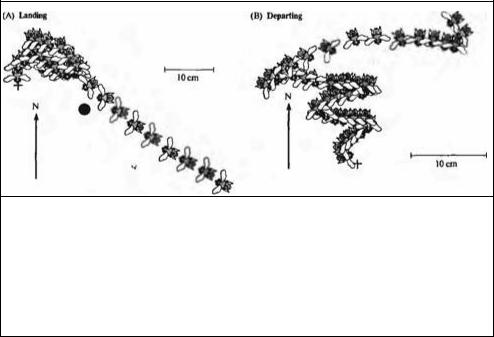
Кроме зрительных ориентиров и поляризованного света83), пчелы также способны использовать магнитный компас для ориентирования при поиске цели. Это было показано в экспериментах Колетта и его коллег, в которых они приучали пчел собирать сахар из маленькой бутылочной пробки, расположенной на доске84). Для облегчения ориентирования пчел они использовали черный цилиндр, который помещался на строго определенном расстоянии от бутылочной пробки и под постоянным углом. Цилиндр и сироп перемещались в разные места доски между сериями экспериментов. Периодически бутылочную пробку вообще убирали, оставляя только цилиндр. То, каким образом пчела производила поиск сиропа и, возвращалась в улей, регистрировалось при помощи видеокамеры. На рис. 15.20 показана траектория пчелы по мере приближения и затем удаления от цилиндра (черный кружок) и источника пищи (крестики). Очевидно, что прежде чем приземлиться, пчела повернулась по направлению к югу, и тотчас после взлета снова ориентировалась на юг. Благодаря этому она видела зрительный ориентир и приманку (сахарный сироп) каждый раз под определенным углом. Объяснить подобное поведение только ориентированием пчелы по звездному небу нельзя. Пчела поворачивается строго на юг и во время дождя, при закрытом облаками небе, когда невозможно использовать небо в качестве ориентира. На основе этих наблюдений можно сделать вывод, что пчела каким--то образом способна различать, где юг, север, восток или запад.
То, что пчелы чувствительны к магнитным полям, было показано в опытах с пчелами при накрытии их брезентом и использовании магнитных полей, смещающих магнитный северный полюс. Пчелы по прежнему ориентировались на «юг», но это направление было «югом» данного (искусственного) магнитного поля. То, каким образом изменение магнит-
338 |
Раздел III. Интегративные механизмы |
|
|
Рис. 15.20. Траектории полета пчелы при приземлении у источника пищи и при взлете. Цилиндр (черный кружок) установлен вблизи от источника пищи, отмеченного крестиком. (А) Сначала (в правом нижнем углу) пчела летит строго по прямой к цилиндру, используя его в качестве ориентира. Однако потом, при подлете к источнику пищи непосредственно перед приземлением у кормушки, она поворачивается строго на юг. (В) При взлете пчела сначала зигзагообразно движется в направлении на север, по постепенно увеличивающемуся радиусу, при этом голова ее ориентирована на юг.
Fig. 15.20. Trajectory of a Bee landing at a food source and departing from it. A cylinder (black circle) is mounted close to the food source indicated by the cross. (A) The orientation of the bee as it arrives at the bottom right of the frame is toward the cylinder, to which it flies in a straight line. Thereafter, it flies to the food source but turns to face south just before landing on the feeder. (B) As the bee departs, it flies north in arcs of increasing radius while it faces south. (After Collett and Baron, 1994.)
него поля приводит к изменению поведения и распознавания пчелою образов, до сих пор неизвестно. Подобного рода сенсорные механизмы отсутствуют у человека, но имеются у таких животных, как птицы, черепахи и у некоторых беспозвоночных.
§4. Зачем нужно изучать нервную систему беспозвоночных?
Много раз в этой книге, в том числе на множестве примеров из этой главы, мы могли убедиться, что нервная система беспозвоночных служила ключевым фактором в исследовании огромного диапазона вопросов, посвященных биофизике, клеточным аспектам биологии и развитию нервных клеток. Удивительно, что фундаментальные механизмы развития и функционирования НС остаются очень схожими от вида к виду в процессе эволюции. Довольно часто в экспериментах, выполненных на беспозвоночных, получали данные, необходимые, чтобы начать изучение данных проблем у млекопитающих. Например, большой рывок в развитии техники тонких срезов головного мозга млекопитающих (slice technique) был сделан благодаря работам, выполненным на ганглиях беспозвоночных, где можно разглядеть в микроскоп отдельные нейроны во время проведения среза. Работы Хартлайна по исследованию глаза мечехвоста (horseshoe crab) стали ключевым стимулом для работ Куффлера на сетчатке кошки85, 86). В то же самое время тщетно надеяться понять, каким же образом зрительные корковые зоны обезьян осуществляют свои функции, при помощи экспериментов с беспозвоночными. В чем же тогда «польза» от подобного рода исследований по навигации пчел и муравьев? Во-первых, можно предположить, что, хотя мы и не способны воспринимать поляризованный свет и магнитные поля, принципы, используемые беспозвоночными для анализа сенсорной информации и перевода их в определенного рода двигательные команды, так или иначе все равно используются в нервных системах более высокоразвитых организмов. Во-вторых, работы на беспозвоночных иллюстрируют общую позицию биологии: т. е. нейробиология занимается изучением не только головного мозга, но и другими широкими проблемами. И, конечно, есть особая прелесть в том, чтобы понять, как крохотный мозг пиявки, пчелы или муравья способен выполнять изумительные сложнейшие расчеты, без которых особь не смогла бы выжить.

Глава 15. Клеточные механизмы интеграции и поведения |
339 |
Выводы
·Беспозвоночные демонстрируют большое разнообразие сложных типов поведения.
·Свойства нейронов и глиальных клеток беспозвоночных аналогичны свойствам клеток позвоночных.
·НС беспозвоночных состоит из сотен или тысяч нейронов.
·Каждый вид беспозвоночных имеет определенные преимущества для изучения тех или иных вопросов нейробиологии.
·Свойства отдельных нервных клеток и синапсов можно использовать для объяснения поведения животного и его изменений.
·Объективное изучение поведения пролило свет на многие фундаментальные принципы нейробиологии.
·Не все работы, выполняемые на ЦНС беспозвоночных, непременно имеют цель понять механизмы работы мозга человека. Некоторые проблемы беспозвоночных сами по себе привлекательны для изучения.
Рекомендуемая литература
Обзоры
оCalabrese, R. L. 1998. Cellular, synaptic, network, and modulatory mechanisms involved in rhythm generation. Curr. Opin. Neunbiol. 8: 710-717.
оCoIIett, T. S. 1996. Insect navigation en-route to the goal—Multiple strategies for the use of landmarks. J. Exp. В/о/. 199: 227-235.
оNeurobiology and development of the leech (Special Issue). 1995. J. Neurobioi. 27 (Pt.3).
« Wehner, R. 1994. The polarization-vision project: Championing organismic biology. Fortschr. Zool. 31: 11-53.
Статьи
«Antonov, I., Kandel, E. R., and Hawkins, R. D. 1999. The contribution of facilitation of monosynaptic PSPs to dtshabituation and sensitization of the Aplysia siphon withdrawal reflex. J. Neurosci. 19: 10438-10450.
о Baccus, S. A. 1998. Synaptic facilitation by reflected action potentials: Enhancement of transmission when nerve impulses reverse direction at axon branch points. Proc. Nail. Acad. Sci. USA 95: 8345-8350.
о Bruns, D., and Jahn, R. 1995. Real-time measurement of transmitter release from single synaptic vesicles. Nature 377: 62-65.
о CoIIett, T. S., and Baron, J. 1994. Biological compasses and the coordinate frame of landmark memories in honeybees. Nature 368: 137-140.
о Gelperin, A. 1999. Oscillatory dynamics and information processing in olfactory systems. J Exp. ВЫ. 18: 1855-1864.
о Gu, X. 1991. Effect of conduction block at axon bifurcations on synaptic transmission to different postsynaptic neurones in the leech. /. Physiol. 441: 755-778.
«Lewis, J. E., and Kristan, W. В., Jr. 1998. Quantitative analysis of a directed behavior in the medicinal leech: Implications for organizing motor output. J. Neurosci. 18: 1571-1582.
о Modney, B. K., Sahley, C. L., and Muller, K. J. 1997. Regeneration of a central synapse restores nonassociative learning. /. Neurosci. 17: 6478-6482.
о Muller, M., and Wehner, R. 1994. The hidden spiral: Systematic search and path integration in desert ants, Cataglyphis fortis. J. Camp. Physiol. [A] 175: 525-530.
о Wang, H., and Macagno, E. R. 1997. The establishment of peripheral sensory arbors in the leech: In vivo time-lapse studies reveal a highly dynamic process. J. Neurosci. 17: 2408-2419.
о Wehner, R., and Bernard, G. D. 1993. Photore-ceptor twist: A solution to the false-color problem.
Proc. Natl. Acad. Sci. USA 90: 4132-4135.
Цитированная литература
1. Hodgkin, J. 1999. Cell 98: 277-280.

340 |
Раздел III. Интегративные механизмы |
2. Boncinelli, E., Mallamaci, A., and Broccoli, V. 1998. Adv. Genet. 38: 1-29.
Adv. Genet. 38: 1-29.
3.Haider, G., Callaerts, P., and Gehring, W. J. 1995. Science 267: 1788-1792.
4.Staras, K., Kemenes, G., and Benjamin, P. R. 1999. /. Neurophysiol. 81: 1261-1273.
5.Garcia, U, et al. 1994. Cell. Mol. Neurobioi. 14: 71-88.
6.Reichert, H., and Boyan, G. I997. Trends Neurosci. 20: 258-264.
7.Edwards, J. S. 1997. Brain Behav. Evol. 50(1): 8-12.
8.Pearson, K. G. 1995. Curr. Opin. Neurobioi. 5: 786-791.
9.Engel, J. E., and Hoy, R. R. 1999. /. Exp. Biol. 202: 2797-2806.
10.Kandel, E. R. 1979. Behavioral Biology o/Aplysia. W. H. Freeman, San Francisco.
11.Muller, K.J., Nicholls, S.C., and Stent, G. S. (cds.). 1981. Neurobiology of the Leech. Cold Spring Harbor Laboratory, Cold Spring Harbor, NY.
12.Alkon, D. 1987. Memory Traces in the Brain. Cambridge University Press, Cambridge.
13.Atwood, H. L. (éd.). 1982. Biology of Crustacea, Vol. 3. Academic Press, New York.
14.Beadle, D. J., Lees, G., and Kater, S. B. 1988. Cell Culture Approaches to" Invertebrate Neuroscience.
Academic Press, London.
15Payton, W. B. 1981. In Neurobiology of the Leech. Cold Spring Harbor Laboratory, Cold Spring Harbor, NY,
pp. 27-34.
16.Kuffler, S.W., and Potter, D. D. 1964. /. Neuro-physiol. 27: 290-320.
17.Stent, G. S., and Weisblat, D. 1982. Sci. Am. 246(1): 136-146.
18.Weisblat, D.A., et al. 1999. Curr. Top. Dev. Biol. 46: 105-132.
19.Calabrese, R. L. 1998. Curr. Opin. Neurobiol. 8(6): 710-717.
20.Szczupak, L., et al. 1998. /. Exp. Biol. 201: 1895-1906.
21.Catarsi, S., and Drapeau, P. 1996. Cell. Mol. Neurobiol. 16:699-713.
22.Kleinhaus, A. L., and Angstadt, J. D. 1995. /. Neurobiol. 27: 419-433.
23.Yu, X, Nguyen, В., and Friesen, W. Ο. Ι999. / Neurosci. 19: 4634-4643.
24.Thompson, W.J., and Stent, G.S. 1976. /. Сотр. Physiol. Ill: 309-333.
25.Kristan, W.B. 1983. Trends Neurosci. 6: 84-88.
26.Coggeshall, R. E., and Fawcett, D. W, 1964. / Neurophysiol. 27: 229-289.
27.Nicholls, J.G., and Baylor, D.A. 1968. / Neurophysiol. 31: 740-756.
28.Stuart, A.E. 1970. /. Physiol. 209: 627-646.
29.Lockery, S. R., and Kristan, W. В., Jr. 1990. / Neurosci. 10: 1816-1829.
30.Blackshaw, S. E. 1981. /. Physiol. 320: 219-228.
31.Yau, K.W. 1976. /. Physiol. 263: 513-538.
32.Wang, H., and Macagno, E. R. 1997. /. Neurosci. 17: 2408-2419.
33.Huang, Y, et al. 1998. /. Сотр. Neural. 397: 394-402.
34.Blackshaw, S. E., and Nicholls, J. G. 1995. /. Neurobiol. 27: 267-276.
35.Blackshaw, S. E., and Thompson, S. W. 1988. /. Physiol. 396: 121-137.
36.Bowling, D., Nicholls, J.G., and Parnas, I. 1978. /. Physiol. 282: 169-180.
37.Blackshaw, S. E., Nicholls, J. G.. and Parnas, I. 1982. /. Physiol. 326: 261-268.
38.Muller, K.J., and McMahan, U.J. 1976. Proc. R. Soc. Land. В 194:481-499.
39.French, K.A., and Muller, K. J. 1986. /. Neurosci. 6:318-324.
40.Macagno, E. R., Muller, K.J., and Pitman, R. M. 1987. / Physiol. 387: 649-664.
41.Nicholls, J.G., and Purves, D. 1972. J. Physiol. 225: 637-656.
Physiol. 225: 637-656.
42.Thorogood, M.S., Almeida, V. W, and Brod-fuehrer, P. D. 1999. / Сотр. Neurol. 405: 334-344.
43.Bruns, D., and Jahn, R. 1995. Nature 377: 62-65.
44.Nadim, E, and Calabrese, R. L. 1997. J. Neurosci. 17:4461-4472.
45.Muller, K.J., and Nicholls, J.G. 1974. /, Physiol. 238: 357-369.
46.Reyes, A., et al. 1998. Nature Neurosci. 1(4): 279-285.
47.Hickie, C., Cohen, L. В., and Balaban, P. M. 1997. Eur. J. Neurosci. 9: 627-636.
48.Walters, E.T., and Cohen, L. B. 1997. Inveriebr. Neurosci. 3: 15-25.
49.Kristan, W. В., Jr., Lockery, S. R., and Lewis, J. E. 1995. J. Neurobiol. 27: 380-389.
Neurobiol. 27: 380-389.
50.Lewis, J. E., and Kristan, W. В., Jr. 1998. Nature 391: 76-79.
51.Ayali, A., and Harris-Warrick, R.M. 1999. /. Neurosci. 19: 6712-6722.
52.Bartos, M., et al. 1999. /. Neurosci. 19: 6650-6660.
53.Elson, R. C., et al. 1999. /. Neurophysiol. 82: 115-122.
54.Nicholls, J. G., and Wallace, B. G. 1978. / Physiol. 281: 157-170.
55.Fernandez-de-Miguel, F., and Drapeau, P. 1995. /. Neurobiol. 27: 367-379.
56.Grossman, Y, Parnas, I., and Spira, M. E. 1979. / Physiol. 295: 307-322.
57.Gu, X. 1991. / Physiol. 441: 755-778.
/ Physiol. 441: 755-778.
58.Gu, X. N., Muller, K. J., and Young, S. R. 1991. /. Physiol. 441: 733-754.
59.Baccus, S.A. 1998. Proc. Natl. Acad. Sci. USA 95: 8345-8350.

Глава 15. Клеточные механизмы интеграции и поведения |
341 |
60.Ban-on, D. H., and Matthews, B. H. C. 1935. / Physiol. 85:73-103.
61.Tsubokawa, H., and Ross, W. N. 1997. /. Neurosci. 17: 5782-5791.
62.Glover, J. C., and Kramer, A. P. 1982. Science 216: 317-319.
63.Brodfuehrer, P. D., et al. 1995. /. Neurobiol. 27: 403-418.
64.Muller, K. J., and Carbonetto, S. 1979. /. Сотр. Neurol. 185:485-516.
65.Sahley, C. L., et al. 1994. /. Neurosci. 14: 6715-6721.
66.Elliott, E. J., and Muller, K.J. 1983. / Neurosci. 3: 1994-2006.
67.Modney, B. K., Sahley, C. L., and Muller, K. J. 1997. /. Neurosci. 17: 6478-6482.
68.Ehrlich, J. S., et
S., et al. 1992. /. Neurobiol. 23:270-279.
al. 1992. /. Neurobiol. 23:270-279.
69.Antonov, I., Kandel, E. R., and Hawkins, R. D. 1999. /. Neurosci. 19: 10438-10450.
Kandel, E. R., and Hawkins, R. D. 1999. /. Neurosci. 19: 10438-10450.
70.Wehner, R., and Menzel, R. 1990. Annu. Rev. Neurosci. 13: 403-414.
71.Wehner, R. 1994. Forlschr. Zoo/. 31: 11-53.
72.Wehner, R. 1997. In Orientation and Communication in Arthropods. Birkhauser, Basel, Switzerland, pp. 145-
73.Collett, M., Collett, T. S., and Wehner, R. 1999. Curr.Blol. 9: 1031-1034.
74.Wehner, R., Marsh, A.C., and Wehner, S. 1992. Nature 586-587.
75.Muller, K.J. 1973. /. Physiol. 232: 573-595.
76.Muller, K. J. 1973. /. Physiol. 232: 573-595.
77.Zollikofer, C, Wehner, R., and Fukushi, T. 1995. /. Exp. Biol. 198: 1637-1646.
78.Collett, M., et al. 1998. Nature 394: 269-272.
79.Muller, M., and Wehner, R. 1994. J. Сотр. Physiol. [A] 175: 525-530.
80.Labhart, T. 1988. Nature 331: 435-437.
81.Wehner, R., and Bernard, G. D. 1993. Proc. Natl. Acad. Sci. USA 90: 4132-4135.
82.Land, M. F. 1993. Nature 363: 581-582.
F. 1993. Nature 363: 581-582.
83.Lehrer, M., and Collett, T. S. 1994. /. Сотр. Physiol. [A] 175: 171-177.
84.Collett, T. S., and Baron, J. 1994. Nature 368: 137-140.
S., and Baron, J. 1994. Nature 368: 137-140.
85.Hartline, H. K. 1940. Am. J. Physiol. 130:690-699.
86.Kuffler, S.W. 1953./. Neurophysiol. 16: 37-68.
Глава 16. Вегетативная (автономная) нервная система
Вегетативная (автономная) нервная система управляет важнейшими функциями тела позвоночных. В частности, нейроны вегетативной нервной системы иннервируют мышцы глаз, легких, кишечника, кровеносных сосудов, мочевого пузыря, половых органов и матки. Они регулируют секрецию желез, кровяное давление, частоту сердцебиений, величину сердечного выброса и температуру тела, а также поступление в организм воды и пищи. В противоположность быстротечным процессам проведения и мышечного сокращения, которые требуются для обеспечения движений конечностей, «поддерживающие» или «вегетативные» функции медленнее развиваются, дольше длятся и обычно менее целенаправлены.
Вегетативная нервная система состоит из четырех различающихся между собой нейронных образований. Симпатический отдел включает нейроны, аксоны которых выходят из спинного мозга в составе вентральных корешков, образуемых грудными и поясничными сегментами. Они формируют синапсы на нервных клетках, находящихся в превертебральных и паравертебральных симпатических ганглиях, расположенных соответственно вблизи или вдали от спинного мозга, а также на хромаффинных клетках мозгового слоя надпочечников. Симпатические постганглионарные аксоны немиелинизированы и проходят на большие расстояния к зонам иннервации. Парасимпатический отдел включает аксоны, выходящие в составе определенных черепномозговых и крестцовых спинномозговых нервов. Они формируют синапсы в ганглиях, расположенных вблизи органов-мишеней. Парасимпатические постганглионарные аксоны, как правило, короче, чем аксоны нейронов симпатической нервной системы. Третий, значительно более сложно организованный отдел, включающий миллионы нервных клеток, расположенных в стенке кишечника, — это энтеральная нервная система. Четвертый отдел объединяет нейроны в спинном мозге, гипоталамусе и стволе мозга. В составе ЦНС границы между вегетативной и соматической системами достаточно условны.
Синаптическая передача в вегетативной нервной системе отличается чрезвычайным разнообразием, включая все известные медиаторы. Принципы передачи и интеграции, установленные на вегетативных синапсах, включают химическую природу синаптической передачи, повторный захват медиатора, ауторецепторы на пресинаптических нервных окончаниях, совместное выделение более чем одного медиатора в одиночной терминали и участие вторичных посредников. Медиаторы, используемые в вегетативных ганглиях, включают ацетилхолин, действующий как на никотиновые, так и на мускариновые рецепторы, пептиды и дофамин. Постганглионарные парасимпатические нервные окончания секретируют ацетилхолин в качестве первичного передатчика, который действует на мускариновые рецепторы в органах-мишенях. Постганглионарные симпатические нейроны секретируют в качестве первичных медиаторов норадреналин, адреналин, ацетилхолин, пурины и пептиды. Симпатические и парасимпатические нейроны помимо основного медиатора высвобождают АТФ и пептиды. Хотя довольно многое уже известно о вегетативной регуляции активности в гладкомышечных и железистых клетках, значительно меньше информации доступно о центральных интегративных механизмах, регулирующих вегетативные функции.
Периодический 24-часовой цикл активности, известный как циркадный ритм, оказывает влияние на многие вегетативные функции. Эксперименты, в которых регистрация активности производилась от специфических нейронов гипоталамуса, позволили выявить один из клеточных механизмов, которые генерируют ритм. Медленные повышения внутриклеточной концентрации хлора в дневные часы приводят к тому, что торможение, обусловленное гамма-аминомасляной кислотой (ГАМК), преобразуется в возбуждение. За счет этого импульсная активность нейронов повышена в течение дня и снижена ночью.
