
Nikolls_-_Ot_neyrona_k_mozgu
.pdfГлава 19. Передача υ кодирование сигнала в сетчатке глаза |
433 |
метаботропными рецепторами глутамата, расположенными на мембранах биполярных клеток, которые действуют через G-белок и вторичные посредники, приводя к уменьшению ионной проводимости56· 57). Таким образом, в темноте в результате активации этих рецепторов ионные каналы, управляемые циклическими нуклеотидами на D-биполярных клетках, закрываются (в отличие от каналов фоторецепторов). После освещения высвобождение глутамата уменьшается, открываются катионные каналы, и биполярные клетки деполяризуются 58).
Структура рецептивных полей биполярных клеток
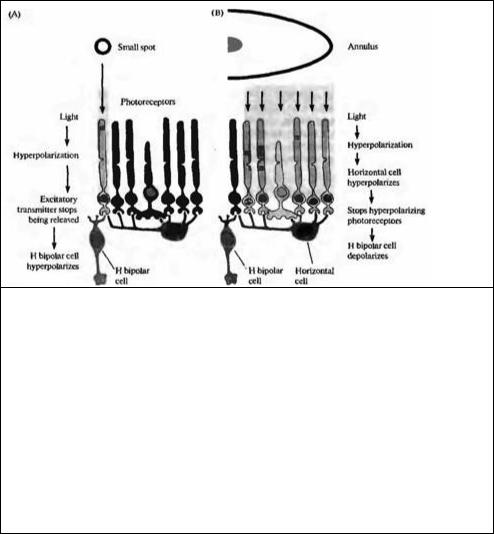
Рецептивное поле гиперполяризующейся Η-биполярной клетки показано на рис. 19.18. Небольшой пучок света, направленный на центральную область поля, вызывает длительную гиперполяризацию. Освещение в форме кольца с темной зоной в центре приводит к деполяризации. Таким образом, рецептивная область подобной клетки состоит из различных по светочувствительности центральной зоны и окружающей ее периферии. Н-биполярная клетка, показанная на рис. 19.18, может быть описана как клетка, имеющая рецептивное поле с "off"-центром, поскольку она деполяризуется, когда поток света исчезает.
D-биполярная клетка имеет рецептивное поле сходной концентрической формы, но освещение центра ее поля приводит к деполяризации, а освещение в форме кольца— к гиперполяризации. Из-за того, что она деполяризуется, когда включается свет, считается, что D-биполярная клетка имеет рецептивное поле с "on"-центром. Терминология "on"- и "off"-клеточных ответов будет активно использоваться нами далее при описании свойств рецептивных полей на следующих этапах зрительной системы. Важным принципом является то, что отдельные фоторецепторы могут одновременно находиться в центре одних рецептивных полей, контролируемых "on"- либо "off"-биполярной клеткой, в то же самое время являясь периферией в других рецептивных полях.
Горизонтальные клетки и ингибирование периферии
Ответы D- и Η-биполярных клеток при освещении периферии рецептивных зон опосредуются горизонтальными клетками. Каждая горизонтальная клетка получает информацию от большого количества фоторецепторов. Горизонтальные клетки, подобно Н-биполярным клеткам, отвечают на освещение фоторецепторов гиперполяризацией (из-за того, что при освещении уменьшается выделение фоторецепторами глутамата). Другой особенностью горизонтальных клеток является то, что они связаны друг с другом посредством электрических синапсов59). Краситель люцеферовый желтый (Lucifer yellow), введенный в одну горизонтальную клетку, распространяется через щелевые контакты в другие нейроны. Таким образом, каждая горизонтальная клетка получает влияние с большой зоны сетчатки, иннервируемой ею и ее ближайшими соседями.
Горизонтальные клетки образуют с биполярными и фоторецепторными клетками тормозные синаптические соединения, в которых медиатором служит ГАМК60)--62). Таким образом, деполяризации фоторецепторов в темноте противостоит тормозное влияние горизонтальных клеток. Освещение фоторецепторов приводит к гиперполяризации горизонтальных клеток, и, следовательно, к уменьшению выделения ими ГАМК. Получается, что гиперполяризации фоторецепторов рассеянным светом противостоит соответствующее уменьшение секреции ГАМК в синапсах между фоторецептором и горизонтальной клеткой. Было высказано предположение, что определенную роль здесь играет оксид азота, синтезируемый как фоторецепторами, так и горизонтальными клетками, которые также вносят вклад в угнетение высвобождения глутамата фоторецепторами63). В итоге отрицательная обратная связь между фоторецепторами и горизонтальными клетками происходит по следующей схеме:
свет
↓
гиперполяризация фоторецепторов
↓
гиперполяризация горизонтальных клеток
↓
деполяризация фоторецепторов.
Соединения клеток в случае центрального "on"- и периферического "off"-ответов биполярных клеток схематично показаны на рис. 19.19. Для простоты центральная зона представлена всего одним фоторецептором, а периферия — несколькими соседними фоторецепторами, связанными с одной горизонтальной клеткой. Сигнал в ответ на осве-
434 |
Раздел III. Интегративные механизмы |
|
|
Рис. 19.19. Соединения между фоторецепторами биполярными и горизонтальными клетками. (А) Свет, падая на отдельную фоторецепторную клетку, вызывает ее гиперполяризацию, результатом чего является прекращение выделения глутамата В результате H биполярная клетка, как показано на рис. 19.18, гиперполяризуется, уменьшая свое возбуждение. (В) Свет, падающий на соседние области в форме кольца, также приводит к тому, что уменьшается высвобождение глутамата фоторецепторами. В результате происходит гиперполяризация горизонтальной клетки, которая предотвращает высвобождение ею тормозного медиатора ГАМК на фоторецептор. Следовательно, фоторецептор, который соединен с Η-биполярный клеткой, деполяризуется (из-за уменьшения тормозного влияния), что вновь приводит к высвобождению медиатора и деполяризации биполярной клетки. При освещении рассеянным светом процессы гиперполяризации и деполяризации гасят друг друга. Таким образом, горизонтальные клетки играют ведущие роли для обеспечения характерных свойств рецептивных полей биполярных клеток.
Fig. 19.19. Connections of Photoreceptors, Bipolar Cells, and Horizontal Cells. The figure illustrates connections required to elicit responses in bipolar cells. (A) Light falling on a single photoreceptor causes it to become hyperpolanzed As a result, glutamate stops being released and the H bipolar cell, as in Figure 19.18, becomes hyperpolarized through loss of excitation. (B) Light falling on the surrounding area in the form of an annulus again prevents glutamate from being released by photoreceptors. As a result, the horizontal cell becomes hyperpolarized; this hyperpolanzation prevents the horizontal cell from releasing its inhibitory transmitter, GABA, onto the photoreceptor. The photoreceptor that is connected to the H bipolar cell therefore becomes depolarized (through removal of inhibition). It once again releases glutamate and depolarizes the bipolar cell. With diffuse light the depolarizing and hyperpolarizing effects cancel each other out. Thus, horizontal cells play an essential part in the construction of the receptive field properties of bipolar cells.
щение центрального фоторецептора очевиден (рис. 19.19А). Активация фоторецептора приводит к его гиперполяризации и, следовательно, к уменьшению высвобождения глутамата, что вызывает гиперполяризацию биполярной клетки. Горизонтальная клетка также получает стимулы к гиперполяризации, однако, так как они поступают только с одного фоторецептора, они имеют небольшой эффект, проявляющийся только в виде отрицательной обратной связи на центральный фоторецептор.
Ответы на освещение периферии (рис. 19.19В) вовлекают дополнительные механизмы. Горизонтальная клетка, получающая сигналы от нескольких фоторецепторов вокруг центральной зоны, при освещении гиперполяризуется. Гиперполяризация уменьшает высвобождение ГАМК горизонтальными клетками, что приводит к уменьшению тормозного влияния на фоторецепторы и к их деполяризации. Этот эффект деполяризации проявляется минимально по отношению к фоторецепторам периферии, так как они сами по себе гиперполяризованы освещением. Однако центральный фоторецептор не находится под освещением, и поэтому единственным влиянием на него является уменьшение ингиби-
Глава 19. Передача и кодирование сигнала в сетчатке глаза |
435 |
рования со стороны горизонтальной клетки. В результате этого центральная клетка деполяризуется, увеличивается высвобождение ею глутамата, что все вместе приводит к деполяризации Η-биполярной клетки. В обзорах подробно описываются свойства терминалей фоторецепторов, терминалей биполярных клеток, а также синапсы обратной связи между горизонтальными и биполярными клетками2· 7· 46).
Значение структуры рецептивных полей биполярных клеток
Какое же физиологическое значение имеет такая структура рецептивных полей биполярных клеток?
D- и Η-биполярные клетки не просто возбуждаются в ответ на освещение. Они начинают анализ информации об элементарных паттернах света. Сигналы биполярных клеток несут информацию о различных падающих на сетчатку пятнах света, окруженных темным полем, либо, наоборот, о темных пятнах, окруженных светом, т. е. они отвечают на контрастные паттерны света и темноты в маленькой области сетчатки.
В дополнение к уже известным нам большим категориям D- и Η-биполярных клеток имеется еще около 11 типов различных биполярных клеток, связанных с колбочками, которые различаются по морфологическим и иммуногистохимическим критериям42). Базируясь на них, можно получить три принципиальных типа клеток:
1.Связанные с колбочками D- и Н-биполярные клетки, лучше всего отвечающие на мельчайшие пятна света или темноты.
2.D- и Η-карликовые биполярные клетки центральной области сетчатки, образующие связи только с одной колбочкой.
3.Биполярные D-клетки, связанные с палочками центрального "on"-ответа, лучше всего реагирующие на малые яркие световые пятна.
§ 6. Рецептивные поля ганглиозных клеток
Эфферентные сигналы сетчатки
Еще за много лет до того, как от фоторецепторов и биполярных клеток сетчатки могли быть отведены электрические ответы, важная информация была получена при регистрации сигналов от ганглиозных клеток. В этих экспериментах был осуществлен первый анализ выходных сигналов в сетчатке, являющихся результатом происходящих там синаптических взаимодействий. Преимуществом изучения ганглиозных клеток является то, что их сигналы являются потенциалами действия и функционируют по принципу «все или ничего». Поэтому было возможно проведение регистрации сигнала при помощи внеклеточного электрода в то время, когда внутриклеточные электроды еще не существовали и пока не были разработаны соответствующие красители. Кроме того, простыми и удобными для изучения делало их то, что отростки ганглиозных клеток направляются из сетчатки в ЦНС. Именно на них были впервые описаны концентрические поля с "on"- и "off"-центрами. И именно они помогли потом понять смысл сигналов, регистрируемых на горизонтальных и биполярных клетках.
Стивен Куффлер был первым, кто выполнил экспериментальные исследования зрительной системы млекопитающих, обратив внимание на структуру рецептивных полей и их значение для зрительной сигнализации у кошки64). В его экспериментах главный интерес состоял в конечных результатах синаптических взаимодействий, нежели в самих синаптических механизмах. Хьюбель65) впоследствии высоко оценил перспективы таких исследований:
Что особенно для меня интересно — это неожиданность результатов, поскольку никто до Куффлера не дошел до предположения о существовании рецептивных полей в виде структуры «центр — периферия» и что зрительный нерв фактически игнорирует любой
раздражитель в виде рассеянного света любой интенсивности.
Принципиально новый подход был обусловлен не только новой техникой исследования, скорее, он обусловлен четкой формулировкой следующего вопроса: каким образом лучше всего стимулировать отдельную ганглиозную клетку? Ответ на этот вопрос привел к использованию отдельных кольцевидных световых пятен для стимулирования отдельных зон сетчатки вместо однородного диффузного освещения. Эти исследования предвосхитили пионерские работы по исследованию глаза простых беспозвоночных: мечехвоста Limulus54) и сетчатки лягушек66· 67).
436 |
Раздел III. Интегративные механизмы |
|
|
|
|
|
|
||||||
|
|
|
|
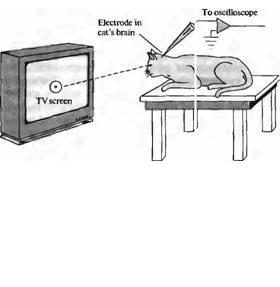
Рис. 19.20. Стимуляция сетчатки при |
|||||||||
|
|
|
|
помощи различных световых образов. |
|||||||||
|
|
|
|
Адаптировавшиеся |
|
глаза |
кошки |
или |
|||||
|
|
|
|
обезьяны, находящейся под наркозом, |
|||||||||
|
|
|
|
направляют |
в |
|
сторону |
кино- |
или |
||||
|
|
|
|
телевизионного |
экрана, |
на |
котором |
||||||
|
|
|
|
показаны различные световые образы, |
|||||||||
|
|
|
|
генерируемые |
компьютером |
|
и/или |
||||||
|
|
|
|
спроецированные проектором. При этом при |
|||||||||
|
|
|
|
помощи |
электрода |
регистрируют |
ответы |
||||||
|
|
|
|
отдельного |
нейрона |
путей |
зрительного |
||||||
|
|
|
|
анализатора. Световые пучки, возникающие |
|||||||||
|
|
|
|
в |
определенной |
|
области |
экрана, |
|||||
|
|
|
|
увеличивают |
или |
уменьшают |
частоту |
||||||
|
|
|
|
разрядов данного нейрона. Таким образом |
|||||||||
|
Fig. 19.20. Stimulation of Retina with Patterns of Light. The eyes of |
|
|||||||||||
|
|
может |
быть |
очерчено |
рецептивное |
поле |
|||||||
|
an anesthetized, light-adapted cat or monkey focus on a movie or a |
|
этой |
клетки |
при |
|
помощи |
определения |
|||||
|
television screen with various patterns of light generated by a |
границ зон на экране, представление |
|||||||||||
|
computer or shone by a projector. An electrode records the |
которых |
вызывает |
изменение |
частоты |
||||||||
|
responses from a single cell in the visual pathway. Light or shadow |
импульсации. |
|
|
В |
|
оригинальных |
||||||
|
falling onto a restricted area of the screen may increase or decrease |
экспериментах Kuffler направлял свет прямо |
|||||||||||
|
the frequency of signals given by the neuron. One can delineate the |
в |
глаз |
при |
|
помощи |
специально |
||||||
|
receptive field of the cell by determining the areas on the screen from |
сконструированного офтальмоскопа. |
|
|
|||||||||
|
which the neuron's firing is influenced. In his original experiments, |
|
|
|
|
|
|
|
|
|
|
||
|
Kuffler shone light directly into the eye by means of a specially |
|
|
|
|
|
|
|
|
|
|
||
|
constructed ophthalmoscope. |
|
|
|
|
|
|
|
|
|
|
|
|
Изначальный выбор Куффлером глаза кошки был удачным: у кролика, к примеру, ситуация гораздо более сложная. Ганглиозные клетки сетчатки кролика имеют рецептивные поля, тонко реагирующие на такие сложные элементы, как края светового пятна и определенное направление его движения68). Также сложны эти механизмы и у низших позвоночных, таких как лягушки. Можно выявить общую закономерность: чем глупее животное, тем умнее у него сетчатка (Д. А. Бейлор, личное сообщение).
Использование дискретных зрительных стимулов для определения рецептивных полей
Главной особенностью ранних экспериментов Куффлера было использование интактного нерассеченного глаза, нормальная рефракция которого использовалась для стимуляции определенных зон сетчатки64). Удобным методом освещения отдельных отделов сетчатки является общая анестезия животного и помещение его перед телевизионным экраном на расстоянии, на котором его глазом осуществляется нормальная рефракция. При этом при появлении на экране монитора отдельных вспышек, светящихся паттернов или созданного компьютером изображения оно хорошо фокусируется на поверхности сетчатки (рис. 19.20).
Организация рецептивных полей ганглиозных клеток
При регистрации сигналов от одной ганглиозной клетки прежде всего важно найти границы ее рецептивного поля. Характерной особенностью большинства ганглиозных клеток и нейронов зрительной системы является то, что они периодически дают редкие разряды в покое, даже при отсутствии освещения. Соответствующие световые стимулы не обязательно вызывают активизацию ганглиозных клеток, они могут просто модулировать спонтанную импульсацию; при этом ганглиозные клетки отвечают либо увеличением, либо уменьшением частоты сигналов.
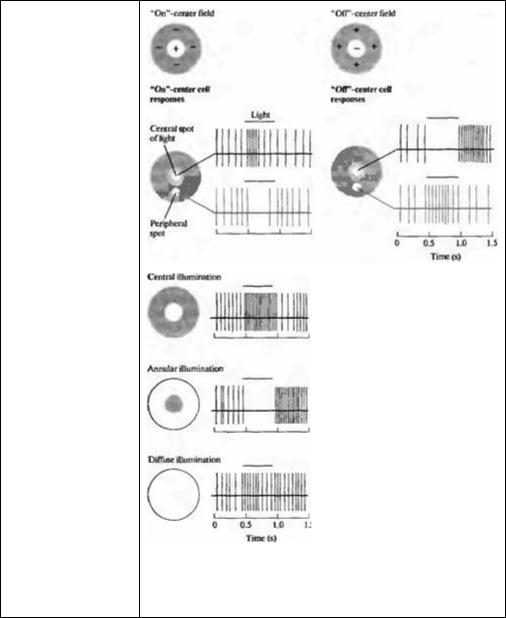
На рис. 19.21 показано, что для ганглиозной клетки маленькое пятнышко света 0,2 мм в диаметре, спроецированное в определенную зону рецептивного поля, способно гораздо лучше вызывать возбуждение, чем рассеянный свет. Более того, то же самое пятнышко света может вызывать и противоположные эффекты, в зависимости от его положения в пределах рецептивного поля. Например, одна зона пятна света возбуждает ганглиозную клетку в течение всего времени освещения. Такого типа "on"-ответ может быстро перейти в "off"-ответ при помощи простого смешения пятна вдоль поверхности сетчатки на 1 мм или менее. Как и в случае биполярных клеток, существуют два основных типа рецептивных полей ганглиозных клеток: имеющие ре-
Глава 19. Передача и кодирование сигнала в сетчатке глаза |
437 |
Рис. 19.21. Рецептивные поля ганглиозных клеток сетчаток кошки и обезьяны, сгруппированные в два основных класса: поля с "on" и поля с "off"-центрами. Клетки с "on"-центральными полями наиболее чувствительны к пятнам света, проецирующимся на центральную зону рецептивного поля. Освещение (показано в виде полоски над сигналами) окружающей области вместе с пятном, а также освещение в виде кольца уменьшают или полностью подавляют разряды, появляющиеся вновь при выключении света. Освещение всего рецептивного поля вызывает слабые ответы из-за того, что центр и окружение проявляют антагонистические эффекты вместе с биполярной клеткой. Клетки с "off" центральными полями уменьшают или прекращают посылать сигналы при освещении центральных зон их рецептивных полей и активируются при выключении света. Свет, падающий на окружающие зоны рецептивных полей с "off"-центром вызывает возбуждение нейрона.
Fig. 19.21. Receptive Fields of Ganglion Cells in the retinas of cats and monkeys are grouped into two main classes: "on"-center and "offcenter fields. "On"-center cells respond best to a spot of light shone onto the central part of the receptive field. Illumination (indicated by the red bar above records) of the surrounding area with a spot or a ring of light reduces or suppresses the discharges and causes responses when
the light is turned off. Illumination of the entire receptive field elicits weak discharges because center and surround antagonize each other's effects, as with bipolar cells. "Off-center cells slow down or stop signaling when the central area of their field is illuminated and accelerate when the light is turned off. Light shone onto the surround of an "off-center receptive field causes excitation of the neuron. (After Kuffler, 1953.)
цептивные поля с "on"- и "off"-центрами. Рецептивные поля обоих типов имеют приблизительно концентрическую форму.
В случае рецептивных полей с "on"-центром свет вызывает наиболее сильный ответ в том случае, если световое пятно полностью заполняет центр, в то время как для наиболее эффективного угнетения импульсации свет должен покрыть всю периферию в виде кольца (случай кольцевидного освещения показан на рис. 19.21). При выключении угнетающего активность кольцевидного освещения ганглиозная клетка отвечает дополнительным "off"-разрядом. Рецептивные поля с "off"-центром имеют противоположное строение: угнетение происходит при освещении центральной зоны. Для обоих типов зон эффекты света на центр и на периферию антагонистичны. Таким образом, если и центр, и периферия одновременно освещаются, эффекты стремятся погасить друг друга.
438 |
Раздел III. Интегративные механизмы |
Размеры рецептивных полей
Соседние ганглиозные клетки собирают информацию от сходных, но не полностью одинаковых областей сетчатки. Даже малейшие (0,1 мм) пятна света на сетчатке покрывают рецептивные поля множества ганглиозных клеток. Некоторые из них при этом ингибируются, другие — возбуждаются. Эта характерная структура, когда соседние группы фоторецепторов посылают свои отростки к соседним ганглиозных клеткам сетчатки, сохраняется на всех уровнях зрительной системы. Во всех отделах нервной системы систематический анализ расположения клеток и их рецептивных полей демонстрирует общий принцип, что нейроны,
обрабатывающие сходную информацию, расположены близко друг от друга. В сенсорных системах это означает, что центральные нейроны, связанные с определенной зоной поверхности, могут взаимодействовать друг с другом в пределах коротких дистанций. Это является удачным решением, так как позволяет «экономить» на длинных связях и упрощает их образование (глава 17).
Размер рецептивного поля ганглиозной клетки зависит от ее расположения в сетчатке. Рецептивные поля клеток, расположенных в центральных зонах сетчатки, имеют гораздо меньшие по размеру центры, чем на периферии; рецептивные поля имеют наименьший размер в области зрительной ямки, где острота зрения максимально высока69, 70). Центральные "on"- и "off"-регионы некоторых ганглиозных клеток, таких как «карликовые» клетки, могут быть образованы всего одной колбочкой, имеющей около 2,5 мкм в диаметре, что составляет 0,5 минуты оптической дуги — меньше, чем одна типографская точка, стоящая в конце данного предложения. Важно отметить, что рецептивные поля могут быть описаны и как зоны сетчатки определенных размеров, так и при помощи угловых величин оптической дуги стимула. В наших глазах 1 мм сетчатки соответствует углу порядка 4 градусов. Для сравнения: изображение луны занимает на сетчатке около 1/8 мм, что соответствует 0,5 градуса или 30 минутам.
Подобные градации характерны также для рецептивных полей в отношении дискриминационной чувствительности и разрешения в зрительной и соматосенсорной системах. Сенсорный нейрон более высокого порядка в головном мозгу, отвечающий за легкое прикосновении к кончику пальца, имеет рецептивное поле гораздо меньшее по размеру по сравнению с нейронами, иннервирующими кожу других областей верхней конечности (глава 18). Поэтому для определения контуров объекта мы используем либо кончики наши пальцев, либо зрительную ямку глаза, а не другие области, способность которых к дискриминации ниже из-за более низкого разрешения их рецептивной поверхности.
Классификация ганглиозных клеток
Базируясь на общей схеме рецептивных полей с "on"- и "off"-центрами, ганглиозные клетки сетчатки обезьяны могут быть сгруппированы в 2 основные категории, названные М- и Р- клетками. Критериями для подобной классификации служат физиологические и анатомические особенности. Терминология М- и Р-клеток основана на анатомических особенностях образования ими связей с латеральным коленчатым ядром и затем с корковыми структурами (глава 20). Р-ганглиозные клетки посылают свои отростки к четырем дорзальным слоям небольших по размеру клеток, входящих в латеральное коленчатое тело (в его мелкоклеточную часть), M-ганглиозные клетки — к большим клеткам, расположенным в двух передних слоях (крупноклеточная часть). Характеристики нейронов, образующих М- и Р-пути, сохраняются на всех последующих уровнях зрительной системы. Р-ганглиозные клетки имеют рецептивные поля с небольшим центром и высокое пространственное разрешение, а также они чувствительны к цвету. Р-клетки несут информацию о тонких и высококонтрастных деталях объектов71). М-клетки имеют большие по размеру рецептивные поля и более чувствительны к малым изменениям контрастности и движению; они посылают импульсы высокой частоты и проводят импульсы быстрее по аксонам большого диаметра. У кошки, которая не имеет цветового зрения, имеется другая классификация ганглиозных клеток, где выделяют группы Х-, Y- и W-клеток72). Х- и Y- по определенным свойствам сходны с Р- и М-клетками, однако, есть и существенные различия, которые не позволяют объединить эти классификации73). Классификация на мелко- и крупноклеточные в зрительной системе обеспечивает удобную и наглядную
Глава 19. Передача υ кодирование сигнала в сетчатке глаза |
439 |
основу для дальнейшего изучения проводящих путей зрительного анализатора.
Синаптические входы на ганглиозные клетки, определяющие организацию рецептивных полей
Синаптические сигналы передаются на ганглиозные клетки с биполярных и амакриновых клеток в области внутреннего плексиформного слоя (см. рис. 19.15). Полное описание этих удивительных связей между фоторецепторами и ганглиозными клетками дано в основательном обзоре Стерлинга2).
Как и ожидалось, деполяризующиеся биполярные клетки колбочек с "on"-центром и гиперполяризую'циеся с "off"-центром образуют химические синапсы с соответствующими ганглиозными клетками, имеющими "on"- и "off"-поля. Эти синапсы являются возбуждающими, следовательно, изменение мембранного потенциала на биполярной клетке приводит к пропорциональному изменению в ту же сторону потенциала связанной с нею ганглиознои клетки. Передача сигнала от палочек к ганглиозным клеткам не столь проста. Одним из путей и являются биполярные клетки палочек, которые, в свою очередь, связаны с особыми амакриновыми клетками (так называемыми А2 амакриновыми клетками)74)--76). Соединения бывают настолько плотны, что палочки и колбочки одной и той же части сетчатки передают сигнал на одну ганглиозную клетку, но через различные промежуточные клетки.
Эффективность работы всей этой сложной цепочки по передаче сигналов от отдельного фоторецептора до ганглиознои клетки была элегантно продемонстрирована Бейлором и Феттиплейсом77). Они изменяли мембранный потенциал отдельного фоторецептора при помощи внешнего тока, подаваемого через внутриклеточный электрод. Одновременно с этим они регистрировали активность ганглиознои клетки, с которой связан фоторецептор посредством биполярных, горизонтальных и амакриновых клеток. Гиперполяризация одного фоторецептора (колбочки, чувствительной к красному свету) изменяла импульсацию в ганглиознои клетке. Этот эксперимент наглядно показал, что гиперполяризация и деполяризация одного фоторецептора достаточна для передачи информации о свете другим клеткам в ЦНС.
Что за информацию передают ганглиозные клетки?
Наиболее удивительной особенностью сигналов ганглиозных клеток является то, что они передают совсем не ту информацию, что первичные фоторецепторные клетки. Они не передают информаиию об абсолютном уровне освещения, ибо они отвечают сходными сигналами на различные уровни фонового освещения. Они игнорируют большую часть информации от фоторецепторов, работа которых напоминает фотопластинку или люксметр. Они, скорее, измеряют различия света в пределах своих рецептивных полей, сравнивая уровни освещенности в центре и на периферии. Особенно хорошо они подходят для восприятия резких световых контрастов и игнорирования постепенных изменений обшей освещенности. Они удивительным образом настроены на выявление контрастов, образующихся на границах контуров изображения, пересекающего разные области нескольких рецептивных полей.
Эксперименты, проведенные на сетчатке саламандры Бейлором, Мейстером и их коллегами, позволяют предполагать, что временные особенности активности ганглиозных клеток могут играть определенную роль в пространственном разр» шении передаваемого в ЦНС сигнала78· 79). На протяжении всей нашей дискуссии активность отдельных нейронов рассматривалась как несвязанные наборы сигналов, анализ которых на предмет закодированной зрительной информации осуществляется в ЦНС. Синхронизация активности двух клеток может, однако, служить дополнительным параметром для анализа80). При регистрации сигналов одновременно от нескольких ганглиозных клеток соседних близкорасположенных зон была обнаружена высокая степень синхронизации при определенных зрительных стимулах, которая отсутствовала при других стимулах. Синхронизация частоты потенциалов действия в парах ганглиозных клеток критически зависела от размера и расположения пятна света. Например, стимуляция при помощи двух пятнышек света двух ганглиозных клеток с "off"-центром, имеющих перекрывающиеся центры полей, приводит к активности в обеих клетках. Для того чтобы обе клетки посылали сигналы синхронно, необходимо, чтобы пучок света был меньше, чем рецептивные поля обеих ганглиозных клеток и чтобы пятно накрывало границу двух рецептивных полей.
440 |
Раздел III. Интегративные механизмы |
В принципе, анализ степени синхронизации для получения информации об освещении сетчатки может быть реализован в более высоких центрах ЦНС, о чем можно косвенно судить при рассмотрении активности двух ганглиозных клеток по отдельности. Известно, что синхронизованность входящих синаптических сигналов способствует значительной интеграции информации, однако пока не известно, использует ли в действительности ЦНС этот параметр при анализе информации об активности ганглиозных клеток.
Нам кажется уместным закончить эту главу цитатой из работы Шеррингтона. Эти слова были им написаны задолго до того, как было найдено первое рецептивное поле отдельной клетки сетчатки. В отличие от Гельмгольца немного туманный стиль Шеррингтона зачастую затрудняет чтение его глубоко оригинальных статей и книг. Следующий абзац также показывает нам поэтичность его взгляда на физиологию зрения81):
К самому изумительному чуду на свете мы еще даже и не прикоснулись. К чуду из чудес, знакомому нам всю жизнь. Оно настолько срослось с нами, что мы все время забываем о нем. А ведь наш глаз, во время того, как мы смотрим, на протяжении всего дня посылает в густой лес меток и волокон нашего мозга постоянные ритмические потоки мельчайших, отделенных друг от друга, эфемерных электрических потенциалов. Эта пульсирующая и текущая по губчатой структуре мозга компания электрических разрядов не имеет никаких видимых признаков сходства с пространственной или временной структурой окружающего мира; она лишь отдаленно напоминает ту крошечную двумерную и, вдобавок, перевернутую картинку окружающего мира, которая возникает в глазу в самом начале нервных волокон, до шторма электрических разрядов. И этот шторм разрядов устроен таким образом, что влияет на работу клеток мозга всех типов. Электрические разряды, сами по себе не несущие даже малейшей зрительной информации, не имеющие, например, ничего общего с такими понятиями, как «расстояние», «право-лево», ни с «вертикальный» или «горизонтальный», ни с «цветом», «яркостью» или «тенью», ни с «округлостью», «квадрат--частью», ни с «контуром», с «прозрачностью» или «непрозрачностью», ни с понятиями «далеко» или «близко», вообще ничего с какой-либо зрительной информацией — тем не менее позволяют нам, словно по волшебству, представить все это. Ливень маленьких разрядов вызывает в моем воображении, когда я смотрю вокруг, панораму окружающего меня места: замок на холме или лицо какого-то моего друга, как далеко они от меня — обо всем об этом мне говорят эти потенциалы. Следуя их словам, я иду вперед, и другие мои чувства подтверждают, что они находятся именно там, где я и предполагал.
Выводы
·Палочки и колбочки способны реагировать на освещение ярким и слабым светом.
·Зрительные пигменты плотно упакованы в мембранах палочек и колбочек.
·Передача сигнала происходит в несколько этапов, с участием G-белка и иГМФ.
·В темноте фоторецепторы деполяризованы и постоянно высвобождают медиатор глутамат.
·Свет приводит к закрытию управляемых цГМФ катионных каналов, гиперполяризации и уменьшению высвобождения глутамата.
·Два основных класса биполярных клеток реагируют на глутамат, высвобождаемый фоторецепторами.
·Η-биполярные клетки деполяризованы в темноте и гиперполяризуются на свету.
·D-биполярные клетки гиперполяризованы в темноте и деполяризуются на свету.
·Рецептивные поля соответствуют зрительным полям или участкам сетчатки, освещение которых вызывает сигналы в клетках зрительной системы.
·Фоторецепторы, горизонтальные клетки и биполяры не способны генерировать потенциал действия.
·Ганглиозные и амакриновые клетки генерируют потенциал действия.
·Биполярные и ганглиозные клетки имеют концентрические рецептивные поля, с "on"- и "off"-центрами и противоположной по функции периферией.
·Ганглиозные клетки плохо отвечают на рассеянный свет.
·Большие ганглиозные клетки, известные как magnocellular или М-клетки, имеют большие рецептивные поля и хорошо отвечают на движение.
·Малые ганглиозные клетки, называемые parvocellular или Р-клетки, имеют небольшие рецептивные поля и способны воспринимать цвет и тонкие детали.

Глава 19. Передача и кодирование сигнала в сетчатке глаза |
441 |
Рекомендуемая литература
Обзоры
оBaylor, D. 1996. How photons start vision. Proc. Nail. Acad. Sci. USA 93: 540-565.
оBoycott, В., and Wàssle, H. 1999. Parallel processing in the mammalian retina: The Proctor Lecture. invest. Ophihalmol. Vis. Sci. 40: 1313-1327.
оDowling, J. E. 1987. The Retina: An Approachable Part of the Brain. Harvard University Press,
оCambridge, MA.
оFinn, J. T., Grunwald, M. E, and Yau, K-W. 1996. Cyclic nucleotide-gated ion channels: An ex-tended family with diverse functions. Annu. Rev. Physiol.58: 395-426.
оNakanishi, S., Nakajima, Y., Masu, M., Ueda, Y, Nakahara, K., Watanabe, D., Yamaguchi, S., Kawabata, S., and Okada, M. 1998. Glutamate receptors: Brain function and signal trans-duction
Masu, M., Ueda, Y, Nakahara, K., Watanabe, D., Yamaguchi, S., Kawabata, S., and Okada, M. 1998. Glutamate receptors: Brain function and signal trans-duction
оBrain Res. Rev. 26: 230-235.
оNathans, J. 1989. The genes for color vision. Sci. Am. 260(2): 42-49.
оSterling, P. 1997. Retina. In G.M. Shepherd (éd.), Synoptic Organization of the Brain. Oxford University Press, New York, Chapter 6.
Shepherd (éd.), Synoptic Organization of the Brain. Oxford University Press, New York, Chapter 6.
оStryer, L. 1991-1992. Molecular mechanism of visual excitation. Harvey Lect. 87: 129-143.
Статьи
оBaylor, D. Α., Lamb, T. D., and Yau, K. W. 1979. The membrane current of single rod outer segments. /. Physiol. 288: 589-611.
оBoycott, В. В., and Dowling, J. E. 1969. Organization of primate retina: Light microscopy. Philos. Trans. R.Soc. Land. В 255: 109-184.
оChen, J., Makino, C. L., Peachey, N. S., Baylor, D.A., and Simon, M.I. 1995. Mechanisms of rhodopsin inactivation in vivo as revealed by a COOH-terminal truncation mutant. Science 267: 374-377.
оCroner, L.J., and Kaplan, E. 1995. Receptive fields of Ρ and M ganglion cells across the primate retina. Vision Res. 35: 7-24.
оFinn, J.T., Xiong, W. H., Solessio, E. C., and Yau, K.W. 1998. A cGMP-gated cation channel and phototransduction in depolarizing photoreceptors of the lizard parietal eye. Vision Res. 38:1353-1357.
оKaneko, A. 1970. Physiological and morphological identification of horizontal, bipolar and amacnne cells in goldfish retina. /. Physiol. 207: 623-633.
оKaneko, A., Delavilla, P., Kurahashi, T., and Sasaki, T. 1994. Role of L-glutamate for formation of on-responses and off-responses in the retina. Biomed. Res. 15 (Suppl. I): 41-45.
оKuffler, S.W. 1953. Discharge patterns and functional organization of the mammalian retina. /. Neurophysiol. 16: 37-68.
оMeister, M., Lagnado, L., and Baylor, D.A. 1995. Concerted signaling by retinal ganglion cells. Science 270: 1207-1210.
оSchnapf, J. L., Kraft, T.W., Nunn, B.J., and Baylor, D.A. 1988. Spectral sensitivity of primate photoreceptors.
Vis. Neurosci. I: 255-261.
Цитированная литература
1.Boycott, В. В., and Dowling, J. Ε. 1969. Philos. Trans. R.Soc. Land. В 255: 109-184.
2.Sterling, P. 1997. Retina. In Synoptic Organization of the Brain. Oxford Universiiy Press, New York, Chapter
3.Hecht, S., Shlaer, S., and Pirenne, M. H. 1942. J.Cen. Physiol. 25: 819-840.
4.Helmholtz, H. von. 1962/1927. Helmholtz's Treatise on Physiological Optics. Dover, New York.
5.Fuortes, M. G. F., and Poggio, G. F. 1963. /. Gen. Physiol. 46: 435-452.
6.Baylor, D. A., Fuortes, M. G. F., and O'Bryan, P.M. 1971. /. Physiol. 214: 265-294.
7.Dowling, J. E. 1987. The Retina: An Approachable Part of the Brain. Harvard University Press, Cambridge, MA.
8 Brown, P. K., and Wald, G. 1963. Nature 200: 37-43. 9. Marks, W. В., Dobelle, W. H., and MacNichol, E.F. 1964. Science 143: 1181-1183.
10.Matthews, R.G., et al. 1963. J.Cen. Physiol. 47: 215-240.
11.Pepperberg, D.R., et al. 1993. Mol. Neurobiol. 7: 61-85.
12.Nathans, J., and Hogness, O.S. 1984. Proc. Nail. Acad. Sci. USA 81: 4851-4855.
13.Baylor, D.A. 1987. invest. Ophihalmol. Vis. Sci. 28: 34-49. 19Baylor, D.A., and Fuortes, M.G.F. 1970. J. Physiol. 207: 77-92.
14.Dartnall, H.J.A., Bowmaker, J. K., and Molino, J. D. 1983. Proc. R. Soc. Lend. В 220: 115-130.
15.Schnapf, J. L, et al. 1988. Vis. Neurosci. 1: 255-261.
16.Nathans, J. mi. Annu. Rev. Neurosci. 10:163-194.
Annu. Rev. Neurosci. 10:163-194.
17.Nathans, J. 1989. Sci. Am. 260(2): 42-49.
18.Nathans, J. 1999. Neuron 24: 299-312.
19.-Baylor, D. A., and Fuortes, M. G. F. 1970. /. Physiol. 207: 77-92.
442 |
Раздел III. Интегративные механизмы |
20.Baylor, D. Α., Lamb, T. D., and Yau, K.W. 1979. /. Physiol. 288:589-611.
21.Yau, K.W., and Chen, T. Y. 1995. In Handbook of Receptors and Channels: Ligandand Voltage-Gated Ion Channels. CRC P<ISS, Роса Raton, FL, p.
Y. 1995. In Handbook of Receptors and Channels: Ligandand Voltage-Gated Ion Channels. CRC P<ISS, Роса Raton, FL, p. 307-335.
307-335.
22.Fesenko, E. E., Kolesnikov, S. S., and Lyubarsky, A.L. 1985. Nature 313: 310-313.
23.Yau. K.W., and Nakatani, K. 1985. Nature 317: 252-255.
24.Sttyer, L., and Bourne, H. R. 1986. Annu. Rev. Cell ВЫ. 2: 391-419.
25.Torre, V., et al. 1995 /. Neunsci. 15: 7757-7768.
26.Kaupp, U. B. 1995. Curr. Opin. Neurobiol. 5: ·134-442.
27.Finn, J. T., Grunwald, M. E-. and Yau, K-W. 1996. Annu. Rev. Physiol. 58: 395-426.
28.Bucossi, G., Nizzari, M., and Tom, V. 1997. Bio-phys.J. 72: 1165-1181.
29.Stryer, L. 1987. Set. Am. 257(1): 42-50.
30.Stryer, L. 1991-1992. Harvey Led. 87: 129-143.
31.Finn, J.T., Solessio, E.G., and Yau, K.W. 1997. Nature 385: 815-819.
32.Finn, J.T., et al. 1998. Vision Res. 38: 1353-1357.
33.Fain, G. L., Mattiiews, H. R., and Cornwall, M. C. 1996. Trends Neurosci. 19: 502-507.
34.Baylor, D. 19%. Proc. Null. Acad. Sci. USA 93: 540-565.
35.Koutalos, Y.andYau.K.W. 1996. Trem/sNeurosci. 19: 73-81.
36.Morgans, C. W., et al. 1998. /. Neurosci. 18: 2467-2474.
37.Baylor, D.A., and Burns, M. E. 1998. Eye 12. 521-525.
38.Chen, J., et al. 1995. Science 267: 374-377.
39.Schnapf, J. L., and Baylor, D. A. 1987. Sci. Am. 256(4): 40-47.
40.Rieke, F, and Baylor, D.A. 1998. Biophys. J. 75: 1836-1857.
41.Baylor, D.A., and Hodgkin, A.L. 1973. J. Physiol. 234: 163-198.
42.Boycott, В., and Wassle, H. 1999. invest. Ophthal-mol. Vis. Sci. 40: 1313-1327.
43.Strettoi, E., and Masland, R. H. 1996. Proc. Natl. Acad. Sci. USA 93: 14906-14911.
44.Kolb, H. 1997. Eye 11: 904-923.
45.MacNeil, M.A., et al. 1999. J. Сотр. Neural. 413: 305-326.
46.Wassle, H., et al. 1998. Vision Res. 38: 1411-1430.
47.Brandstatter, J. H., Koulf n, P., and Wassle, H. 1988. Vision Res. 38: 1385-1397.
Koulf n, P., and Wassle, H. 1988. Vision Res. 38: 1385-1397.
48.Fourche, R. G. 1996. Cm Eye Res. 15: 797-803.
49. Qian, H., et al. 199,. /. Neurophysiol. 78: 2402-2412.
/. Neurophysiol. 78: 2402-2412.
50.Herbst, H., and Their, P. 1996. Exp. Brain Res. Ill: 345-355.·
51.Raviola, E., and Wiesel, T.N. 1990. Clba Found. Syttp. 155. 22-38.
52.Vardi, N.. et al. 1998. Vision Res. 38: 1359-1369.
53.von Gersdorff, H., et al. 1996. Neuron 16: 1221-1227.
54.Hartline, H. K. 1940. Am. J. Physiol. 130:690-699.
55.Kaneko, A., and Hashimoto, H. 1969. Vision Res. 9: 37-55.
56.Kikkawa, S., et al. 1993. Bnchem. Biophys. Res. Commun. 195: 374-379.
57.Kaneko, A.. et al. 1994. Biomed. Res. 15 (Suppl. 1): 41-<5.
58.Nakanishi, S., et al. 1998. Brain Res. Rev. 26: 230-235.
59.Kaneko, A. 1971. /. Physiol. 213: 95-105.
60.Kaneko, A., and Tachibana, M. 1986. /. Physiol. 373: 443-461.
61.Schwartz, E.A. 1987. Science 238: 350-355.
62.Yang, X. L., Gao, F., and Wu, S. M. 1999. Vis. Neunsci. 16: 967-979.
63.Savchenko, A., Barnes, S., and Kramer, R. H. 1997. Nature 390: 694-698.
64.Kuffler, S.W. 1953. /. Neurophysiol. 16: 37-68. 6-5. Hubel, D. H. 1988. Eye, Brain and Vision. Scientific American Library, New York.
66.Barlow, H.B. 1953. /. Physiol. 119: 69-88.
67.Maturana, H. R., et al. 1960. /. Gen. Physiol. 43: 129-175.
68.Barlow, H. В., Hill. R. M., and Levick, W. R. 1964. /. Physiol. 173: 377-407.
69.Kier, C.K., Buchsbaum, G., and Sterling, I1.1995. /. Neurosci. 15: 7673-7683.
I1.1995. /. Neurosci. 15: 7673-7683.
70.Croner, L.J., and Kaplan, E. 1995. Vision Res. 35: 7-24.
71.Kaplan, E., and Shapley, R. M. 198C. Proc. Natl. Acad. Sci. USA 83: 2755-2757.
72. Enroth-Cugell, C, and Robson, J. G. 1966. /. Physiol. 187: 517-552.
73.Benardete, Ε. Α., Kaplan, E., and Knight, B. W. 1992. Vb. Neurosci. 8: 483-486.
74.Daw,N.W.,Jensen,RJ.,andBrunken,W.J. 1990. Tren Is Neurosci. 13: 110-115.
75.Dacheux, R. F, and Raviola, E. 1986. /. Neurosci. 6. 331-345.
76.Soucy, E.. et al. 1998. Neuron 21: 481-493.
77.Baylor, D.A., and Fettiplace, R. 1977. /. Physiol. 271: 391-424.
78.Meister, M., Lagnado L., and Baylor, D.A. 1995. Science270: 1207-1210.
Lagnado L., and Baylor, D.A. 1995. Science270: 1207-1210.
79.Meister, M., and Berry, M. J., II 1999. Neuron 22: 435-450.
80.Maffei, L., and Galli-Resta, L. 1990. Proc. Natl. Acad. Sci. USA 87: 2861-2964.
81.Shomnglon, C. S. 1951. Man on His Nature. Cambridge University Press, Cambridge.
