
Nikolls_-_Ot_neyrona_k_mozgu
.pdf
Глава 13. Клеточная υ молекулярная биохимия синаптической передачи |
273 |
|||||
Рис. |
13.10. |
Пути |
|
|
||
синтеза, |
|
|
хранения, |
|
|
|
высвобождения |
|
и |
|
|
||
захвата |
глутамата |
в |
|
|
||
глутаматергических |
|
|
|
|||
нейронах. |
|
Глутамат |
|
|
||
синтезируется |
|
из |
|
|
||
глутамина |
|
|
в |
|
|
|
митохондриях |
|
с |
|
|
||
помощью |
|
|
фосфат- |
|
|
|
зависимой |
|
формы |
|
|
||
фермента |
глутаминазы. |
|
|
|||
Транспортер |
|
|
|
|
|
|
неорганического |
|
|
|
|||
фосфата |
|
|
(Р04) |
|
|
|
расположен |
|
|
в |
|
|
|
глутаматергических |
|
|
|
|||
терминалях. |
|
После |
|
|
||
высвобождения |
|
|
|
|
||
некоторое |
количество |
|
|
|||
глутамата |
|
|
|
|
|
|
захватывается |
|
|
|
|
||
пресинаптическим |
|
|
|
|||
окончанием; |
|
большая |
|
|
||
часть |
|
глутамата |
|
|
||
захватывается |
|
|
|
|
||
глиальными |
клетками |
и |
|
|
||
превращается |
|
в |
|
|
||
глутамин. Глутамин затем |
Fig. 13.10. Pathways for Glutamate Synthesis, Storage, Release, and Uptake in |
|||||
выбрасывается из глии и |
||||||
захватывается |
нервными |
glutamatergic neurons. Glutamate is synthesized from glutamine within mitochondria by |
||||
окончаниями |
|
для |
a phosphate-dependent form of the enzyme glutaminase. An inorganic phosphate (P04) |
|||
последующего |
|
|
transporter is localized to glutamatergic terminals. After release, some glutamate is taken |
|||
преобразования |
|
в |
up into presynaptic terminals; most is taken up by glial cells and converted to glutamine, |
|||
глутамат. |
|
ЕААТ |
= |
which is then released and taken up into nerve terminals for conversion to glutamate. |
||
транспортер |
|
|
|
ЕААТ = excitatory amino acid transporter. |
|
|
возбуждающих |
|
|
|
|
||
аминокислот. |
|
|
|
|
||
ких ганглиях человека, показали, что электрическая стимуляция преганглионарных волокон вызывает заметное повышение уровня мРНК тирозингидроксилазы и дофамин-- β-гидроксилазы в течение 20 мин. Это свидетельствует о том, что регуляция генов,
участвующих в синтезе норадреналина, является очень быстрой и зависит от внешних условий44).
Синтез нейропептидов
Регуляция запасов пептидных медиаторов затруднена в связи с разделением мест их синтеза и высвобождения. Пептиды синтезируются на рибосомах, которые расположены в телах нервных клеток, а не в аксонах или нервных терминалях. Такая организация имеет два последствия: во-первых, скорость синтеза пептидов регулируется в телах клеток, после чего пептиды должны быть перенесены в терминаль аксонным транспортом (о котором уже кратко говорилось). Это процесс медленный по сравнению с быстрым местным контро-
лем синтеза и хранения низкомолекулярных медиаторов внутри аксонных окончаний. Во- -вторых, количество пептида, доступное для высвобождения, ограничено его количеством, имеющимся в терминали. Однако связывание пептидов с рецепторами происходит при значительно более низких концентрациях (в пределах 10--10—10--8 М), чем связывание низкомолекулярных медиаторов, таких как ацетилхолин, с их рецепторами (10--7-10--4М). Механизмы, удаляющие пептидные медиаторы из синаптической щели, также в основном медленные. Более того, рецепторы нейропептидов, как и другие метаботропные рецепторы, действуют через внутриклеточные пути, обеспечивающие огромное усиление сигнала (глава 10). Вследствие этого для оказания воздействия на постсинаптическую мишень нужно небольшое число молекул пептида, так что потребность в необходимом для высвобождения количестве нейропептида может быть обеспечена транспортом молекул из тела клетки.

274 |
|
|
|
|
|
|
Раздел II. Передача информации в нервной системе |
|
Рис. 13.11. Синтез ней |
|
|
|
|||||
ропептидов. |
|
|
|
(А) |
|
|
|
|
Структура |
|
|
|
про- |
|
|
|
|
опиомеланокортина |
|
|
|
|
|
|||
быка. |
|
Положения |
|
|
|
|||
известных |
компонентов |
|
|
|
||||
пептида |
|
изображены |
|
|
|
|||
окрашенными |
|
|
|
|
|
|
||
прямоугольниками. |
|
|
|
|
|
|||
Обозначены |
|
|
пары |
|
|
|
||
основных |
|
|
|
|
|
|
|
|
аминокислотных |
|
|
|
|
|
|||
остатков, |
|
|
которые |
|
|
|
||
являются мишенями для |
|
|
|
|||||
ферментов. |
|
|
|
(В) |
|
|
|
|
Преобразование |
|
|
|
|
|
|||
нейропептидных |
|
|
|
|
|
|||
предшественников |
|
|
|
|
|
|||
обычно |
начинается |
с |
|
|
|
|||
отщепления |
|
|
|
|
|
|
|
|
карбокситерминальной |
|
|
|
|||||
части |
молекулы |
|
по |
|
|
|
||
положению, |
|
которое |
|
|
|
|||
распознается |
|
|
|
|
|
|
||
эндопротеазой. |
|
|
|
|
|
|
||
Основные |
положения |
|
|
|
||||
отделяются |
|
|
|
|
|
|
|
|
карбоксипептидазой |
Е. |
|
|
|
||||
Если |
|
|
пептид |
|
|
|
||
заканчивается |
глицином, |
|
|
|
||||
фермент |
|
|
пептидил- |
|
|
|
||
глицин--α-амидирующая |
|
|
|
|||||
монооксигеназа |
|
(РАМ) |
|
|
|
|||
преобразует |
|
конечную |
|
|
|
|||
карбоксигруплу |
|
|
в |
|
|
|
||
амидную. |
|
|
|
(С) |
|
|
|
|
Предшественники |
|
|
|
|
|
|||
нейропептидов |
|
|
|
|
|
|
||
направляются |
|
|
в |
|
|
|
||
полость |
|
|
|
|
|
|
|
|
эндоплазматического |
|
|
|
|
||||
ретикулума |
|
|
|
|
|
|
|
|
посредством |
сигнальной |
|
|
|
||||
последовательности. |
В |
|
|
|
||||
|
|
|||||||
эндоплазматическом |
|
|
по мере созревания везикул пролелтид расщепляется, образуя два пептида (А и |
|
||||
ретикулуме |
происходит |
|
В), упакованные в одной везикуле. Справа пролелтид расщепляется внутри |
|||||
образование |
|
|
|
|
|
аппарата Гольджи с последующей сортировкой пептидов в разные пузырьки. |
||
дисульфидных |
связей и |
|
Fig. 13.11. Synthesis of Neuropeptides. (A) Structure of bovine pro-opiomelanocortin. |
|||||
N-связанное |
|
|
|
|
|
|||
гликозилирование. Затем |
|
The locations of known peptide components are shown by colored boxes. Paired basic |
||||||
нейропептид |
|
|
|
|
|
amino acid residues — common targets for processing enzymes — are indicated. (B) |
||
транспортируется |
через |
|
Processing of neuropeptide precursors usually begins with cleavage on the carboxy- |
|||||
аппарат |
Гольджи, |
где |
|
terminal side of the recognition site by an endoprotease. The basic residues are trimmed |
||||
происходят |
|
|
|
его |
|
by carboxypeptidase E. If the peptide ends in glycine, the enzyme peptidyl glycine α- |
||
дальнейшие |
|
|
|
|
|
amidating monooxygenase (РАМ) converts the carboxy terminus to an amide. (C) |
||
модификации, |
такие |
как |
|
|||||
|
Neuropeptide precursors are directed into the lumen of the endoplasmic reticulum by a |
|||||||
сульфатирование |
|
и |
|
signal sequence. In the endoplasmic reticulum, disulfide bonds are formed and N-linked |
||||
фосфорилирование |
|
|
|
glycosylation occurs. The propeptide is then transported through the Golgi apparatus, |
||||
Показаны |
|
две |
схемы |
|
||||
|
|
where further modifications, such as sulfation and phosphorylation, take place. Two |
||||||
упаковки. |
|
|
|
Слева |
|
packaging schemes are illustrated. On the left a propeptide is packaged into vesicles |
||
пролептид упаковывается |
|
budding from the Golgi; as the vesicle matures, the propeptide is cleaved, resulting in |
||||||
в |
|
|
пузырьки, |
|
two peptides (A and B) packaged in the same vesicle. On the right a propeptide is |
|||
отпочковывающиеся |
от |
|
cleaved within the Golgi, followed by sorting of peptides into separate vesicles. (After |
|||||
аппарата Гольджи; |
|
|
|
Sossin, Fisher, and Scheller, 1989.) |
||||
|
|
|
|
|
|
|
||
Глава 13. Клеточная и молекулярная биохимия синаптической передачи |
275 |
Пептиды синтезируются в виде более крупных белков-предшественников, которые часто содержат последовательности нескольких биологически активных пептидов45· 46) (табл. 13.1, рис. 13.11). Первыми этапами синтеза предшественника нейропептида являются стадии, типичные для синтеза секретируемых белков: синтез в эндоплазматическом ретикулуме, отщепление сигнального пептида, процессинг в аппарате Гольджи и включение в крупные (100-200 нм) электронно--плотные пузырьки. Более поздние этапы одинаковы для нейронов и эндокринных клеток. Эти шаги катализируются специфическими эндопротеазами, которые расщепляют белок-предшественник на соответствующие пептидные молекулы, экзопептидазами, устраняющими С-терминальные основные группы, и амидирующим бифункциональным ферментом, который превращает глициновый остаток в соответствующую амидную группу пептида (рис. 13.11В). Протеолитический процесс начинается в аппарате Гольджи и продолжается внутри крупных плотных везикул, в то время когда они транспортируются вниз по аксону и находятся в терминали. Некоторые клетки синтезируют более одного медиаторного пептида; эти пептиды могут быть различным образом рассортированы в пузырьки и направлены в разные терминали47).
§ 3. Хранение медиаторов в синаптических пузырьках
Низкомолекулярные медиаторы, такие как АХ и НА синтезируются и упаковываются в пузырьки в аксонной терминали. На электронных микрофотографиях такие синаптические пузырьки выглядят мелкими (50 нм в диаметре) и могут быть прозрачными (т. е. АХ, аминокислотные медиаторы) или иметь электронноплотную сердцевину (т. е. биогенные амины). Концентрация низкомолекулярных медиаторов в пузырьках составляет 0,5 М, что значительно выше, чем в окружающей цитоплазме.
Накопление медиаторов в синаптических пузырьках осуществляется специфическими транспортными белками (рис. 13.12; см. также глава 4). Было установлено четыре везикулярных транспортера: транспортер всех биогенных моноаминов (названный VMAT), транспортер ГАМК и глицина, транспортер ацетилхолина (названный VAChT) и транспортер глутамата48)--50). Каждый из транспортеров является интегральным мембранным белком, имеющим 12 трансмембранных доменов. Мембраны синаптических везикул содержат также Независимую АТФазу, которая перекачивает протоны внутрь пузырьков, создавая там положительный заряд и более кислую среду по сравнению с цитоплазмой51). Для того чтобы перемещать молекулы медиатора внутрь пузырьков против градиента концентрации, везикулярные транспортеры медиаторов используют энергию электрохимического и рН градиентов. Из-за малого размера синаптические пузырьки, вероятно, содержат только одну копию протонной помпы, которая представляет собой большой комплекс, состоящий, по крайней мере, из 12 субъединиц.
Везикулярные транспортеры медиаторов не обладают такой же специфичностью, как постсинаптические рецепторы. Вследствие этого молекулы, которые не способны активировать постсинаптические рецепторы, иногда накапливаются в синаптических пузырьках и выбрасываются из аксонных терминалей в качестве псевдомедиаторов52· 53).
Первыми были выделены и проанализированы биохимически пузырьки из надпочечника. Эти крупные пузырьки (200—400 нм в диаметре) называются хромаффинными гранулами, так как они окрашиваются солями хрома. Хромаффинные гранулы помимо катехоламинов содержат высокие концентрации АТФ, фермента дофамин-β-гидроксилазы и растворимых белков, называемых хромогранинами. Образование мультимолекулярных комплексов между положительно заряженными катехоламинами, отрицательно заряженным АТФ и хромогранинами, по-видимому, способствует упаковке и хранению катехоламинов в таких концентрациях, которые в иных условиях могли бы быть гиперосмотическими54). Кроме того, высвобождение катехоламинов сопровождается выбросом АТФ, который оказывает свои собственные эффекты, и таким образом действует как котрансмитгер55· 56). Было показано также, что один из белков, хромогранин А, служит предшественником ряда пептидов, которые модулируют секрецию56).
Были выделены синаптические пузырьки из периферических холинергических и норадренергических терминалей и из центральной нервной системы. В норадренергических нервных окончаниях имеются крупные
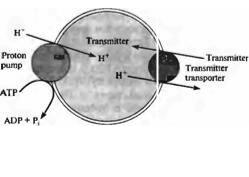
276 |
|
Раздел П. Передача информации в нервной системе |
|
||||
Рис. 13.12. |
Транспорт |
медиаторов в |
|
|
|
||
синаптические |
|
пузырьки |
|
управляется |
|
|
|
протонным электрохимическим |
градиентом. |
|
|
|
|||
АТФ-зависимая помпа транспортирует протоны |
|
|
|
||||
в синаптические пузырьки, создавая внутри |
|
|
|
||||
везикул кислую и положительно заряженную |
|
|
|
||||
относительно |
|
цитоплазмы |
среду. |
|
|
|
|
Нейромедиаторы |
переносятся |
в пузырьки |
|
|
|
||
специфическими |
|
транспортерами, |
|
|
|
||
энергетически |
сопряженными |
с |
протонным |
|
|
|
|
электрохимическим градиентом. |
|
|
|
|
|||
Fig. 13.12. Transport of Transmitters into Synaptic |
|
making the vesicle interior acidic and positive relative to the |
|
||||
Vesicles Is Driven by a Proton Electrochemical |
|
cytoplasm. Neurotransmitters are carried into the vesicles |
|
||||
Gradient. An ATP-powered pump transports |
|
by specific transporters, energetically coupled to the proton |
|
||||
protons into synaptic vesicles, |
|
|
|
electrochemical gradient. |
|
||
плотные пузырьки (70—200 нм в диаметре), которые похожи на хромаффинные гранулы. Эти пузырьки содержат хромогранины, растворимую форму дофамин-β-гидроксилазы и пептидные Нейромедиаторы. В катехоламин-содержащих нервных терминалях, так же как и в холинергических нервных окончаниях, находится большое число мелких синаптических пузырьков, в которых содержится незначительное количество растворимого белка. Синаптические пузырьки, содержащие ацетилхолин и большинство биогенных аминов, также содержат высокие концентрации АТФ57·58). В везикулах, содержащих серотонин, находится мало АТФ, но имеется большое количество белка, с высокой аффинностью связывающего 5-НТ59). Несмотря на то, что захват АТФ в катехоламин- и АХ-содержашие пузырьки был охарактеризован54· 60), транспортер АТФ еще не идентифицирован. Некоторые нейроны спинного мозга высвобождают и ГАМК, и глицин15). Тот факт, что эти два медиатора имеют один и тот же везикулярный транспортер61· 62), дают основания полагать, что ГАМК и глицин упаковываются вместе в одни и те же пузырьки.
§ 4. Аксонный транспорт
Белки, которые обнаруживают в аксонных окончаниях, должны доставляться туда из тела клетки, где они синтезируются. Первые доказательства передвижения вещества вдоль аксонов были получены в экспериментах Вейсса с коллегами. Они пережимали периферические нервы с помощью лигатуры и наблюдали разбухание аксонов выше места пережатия. После устранения лигатуры происходило перемещение накопившегося вещества вдоль аксона63). Эти эксперименты свидетельствуют, что в нормальных условиях существует постоянное объемное перемещение аксоплазмы вдоль аксона со скоростью 1-2 мм в день, которое получило название «аксоплазматического тока». Эта идея была подтверждена позднее в экспериментах с использованием радиоактивно меченых аминокислот, которые перемещались в составе белков от тел нервных клеток по периферическим и центральным аксонам64). Такое передвижение наблюдалось даже в одиночных аксонах в клеточной культуре (рис. 13.13)65).
Скорость и направленность аксонного транспорта
Характерные различия в скорости передвижения широкого спектра транспортируемых по аксону компонентов были показаны при измерении времени накопления веществ выше места пережатия аксона и в аксонных терминалях. Структурные белки, такие как тубулин и белки нейрофиламентов, перемещаются с самой медленной скоростью, 1—2 мм в день; клеточные органеллы, такие как митохондрии и пузырьки (включая синаптические пузырьки, содержащие медиаторы) движутся значительно быстрее (до 400 мм в день)66). Такое быстрое перемещение невозможно объяснить только объемным током цитоплазмы. В связи с этим был принят термин аксонный транспорт.
Некоторые белки и органеллы движутся по направлению к аксонным окончаниям (антероградный транспорт), а другие перемещаются от окончаний к телу клетки (ретроградный транспорт)66· 67). Ретроградный транспорт покрытых мембраной органелл способствует возврату веществ в тело клетки для переработки или распада и, как было показано, является

Глава 13. Клеточная υ молекулярная биохимия синаптической передачи |
277 |
|
|
Рис. 13.13. Медленный аксонный транспорт был продемонстрирован в результате накопления компонентов цитоскелета в месте пережатия аксона. Одиночный аксон в культуре нейронов ганглия корешка спинного мозга крысы был пережат путем сдавливания стеклянным волокном. (А) На фотографиях, полученных методом фазового контраста, показаны аксоны непосредственно перед пережатием и через 1, 30 и 120 мин. (В) Через два часа после пережатия клетку фиксировали и стеклянное волокно убирали. (С) Флуоресцентная микрофотография аксона, меченного антителами в белку нейрофиламентов. (D) Зависимость интенсивности флюоресценции от расстояния по аксону, который был пережат в течение 5 с, 30 мин или 2 ч. Время накопления белка нейрофиламентов в точке пережатия аксона (стрелка) показывает, что средняя скорость транспорта была примерно 3 мм в день.
Fig. 13.13. Stow Axonal Transport is demonstrated by the accumulation of cytoskeletal components at the site of axonal constriction. A single axon from a cultured rat dorsal root ganglion neuron was constricted by pressure from a glass fiber. (A) Phase-contrast images show the axon immediately before constriction and after 1, 30, and 120 min.
(B) Two h after constriction the cell was fixed, and the glass fiber removed. (C) Fluorescence micrograph of the axon labeled with antineurofilament protein antibodies. (D) Graphs of fluorescence intensity as a function of distance along axons constricted for 5 s, 30 min, or 2 h. The time course of accumulation of neurofilament protein at the site of the constriction (arrow) indicated that the average transport rate was approximately 3 mm/day. (After Koehnle and Brown,
1999; micrographs kindly provided by A. Brown.)
основным способом передвижения трофических молекул, таких как фактор роста нервов, от аксонных терминален к телам клеток (глава 23)68).
Нейроанатомы разработали методы исследования аксонного транспорта, основанные на использовании специальных маркеров (так называемых трейсеров), таких как пероксидаза хрена, флуоресцентно меченые гранулы и даже вирусы, которые переносятся по аксону в антероградном и ретроградном направлении. Использование таких маркеров дает возможность картирования синаптических контактов путем визуализации
индивидуальных аксонов, их терминального ветвления и тел клеток даже на больших расстояниях69· 70).
Микротрубочки и быстрый транспорт
В ранних экспериментах было показано, что аксонный транспорт требует затрат энергии и наличия интактных микротрубочек, но в те-

278 |
Раздел П. Передача информации в нервной системе |
Рис. 13.14. Идентификация органелл и путей, участвующих в быстром аксонном транспорте. Электронная микрофотография пузырька, прикрепленного к микротрубочке в аксоплазме кальмара. С помощью световой микросколии было установлено, что до фиксации эта органелла двигалась вдоль волоконного пути со скоростью, соответствующей скорости быстрого аксонного транспорта. Электронная микрофотография показывает, что эта органелла является синаптической везикулой, а ее путь — микротрубочкой. Гранулярный и волоконный материал расположен на стеклянном субстрате.
Fig. 13.14. Identifying the Organelles and Tracks Mediating Fast Axonal Transport. Electron micrograph of a vesicle attached to a rmcrotubule in extruded squid axoplasm Before fixation this organelle was observed by light microscopy moving along a filamentous track at a rate corresponding to fast axonal transport. The electron micrograph shows that the organelle is a synaptic vesicle, and the track is a microtubule. A layer of granular and finely filamentous material coats the glass substrate. (From Schnapp et al., 1985.)
чение 30 лет очень мало достигнуто в понимании механизмов этого процесса. Два технологических достижения дали возможность очень быстро продвинуться в исследовании этой проблемы: (1) развитие методов микроскопии, которые позволили напрямую визуализировать единичные пузырьки внутри клеток71· 72) и (2) открытие того, что движение везикул происходит и в бесклеточной среде, такой как аксоплазма кальмара73). Исследования Риза, Шитиа, Шнэппа, Вэйла, Блока и их коллег показали, что транспорт происходит путем прикрепления органелл, таких как митохондрии или пузырьки, к микротрубочкам. Механохимические ферменты, или моторы, расщепляют молекулу АТФ и используют полученную энергию для переноса органелл по «колее» микротрубочки (рис. 13.14)74· 75).
Микротрубочки обладают собственной полярностью; в аксонах «положительно заряженный» полюс расположен на дистальном конце аксонной терминали. Антероградный транспорт осуществляется белком кинезином (kinesin), который перемещает органеллы по направлению к положительно заряженному полюсу; ретроградный транспорт осуществляется цитоплазматическим белком линейном (dynein), который перемещает органеллы по направлению к отрицательному полюсу (рис. 13.15)76). Специфические рецепторы на поверхности органелл обусловливают присоединение к ним или кинезина, или цитоплазматического линейна и, таким образом, определяют направление движения органелл (рис. 13.16)77). Было показано, что один кинезиновый мотор перемещает органеллу вдоль микротрубочки со скоростью, эквивалентной скорости быстрого аксонного транспорта78); гидролиз одной молекулы АТФ обеспечивает энергией «шаг» длиной приблизительно 8 нм, что соответствует расстоянию от одного димера αβ-тубулина до следующего вдоль протофиламента микрогрубочки79· 80). Различия в скорости транспорта разных компонентов обусловлены долей времени, в течение которого они остаются «в колее», и тем сопротивлением, которое они встречают по мере прохождения через плотное переплетение элементов цитоскелета в аксоне.
Механизм медленного аксонного транспорта
Растворимые белки и элементы цитоскелета, такие как микротрубочки и нейрофиламенты, переносятся от тела клетки к аксонному окончанию медленным транспортом66). До сих пор обсуждается вопрос о том, транспортируются ли микротрубочки и нейрофиламенты в виде интактных полимеров81) или, если полимеризация филаментов является стационарным процессом, транспортируются ли мономеры или олигомеры нейрофиламентов82). Ясно лишь, что аксонный транспорт белков цитоскелета не может осуществляться путем диффузии, а является активным процессом.

Глава 13. Клеточная и молекулярная биохимия синаптической передачи |
279 |
Рис. 13.15. Молекулярные моторы динеин и кинезин двигают микротрубочки в противоположных направлениях. (А, В) Последовательные изображения движения фрагментов микротрубочек на очищенных «моторах» быстрого транспорта. Время показано в минутах. Очищенные цитоплазматический динеин (А) и кинезин (В) осаждали на покровных стеклах, добавляли фрагменты микротрубочек. После контакта фрагментов с поверхностью они двигались в направлении их раздвоенного (дистального или +) конца на динеине и в направлении компактного (проксимального или -) конца на кинезине, как показано на рисунке.
Fig. 13.15. The Molecular Motors Dynein and Kinesin Propel Microtubules in Opposite Directions. (A, B) Sequential images of the movement of microtubule fragments on purified fast-transport "motors." Time is indicated in minutes.
Purified cytoplasmic dynein (A) or kinesin (B) was adsorbed to a coverslip, and fragments of microtubules were added. When the fragments contacted the surface, they were propelled toward their frayed (distal or +) end on dynein and toward their compact (proximal or -) end on kinesin, as illustrated. (After Paschal and Vallée, 1987; micrographs kindly provided by R. Vallée.)
§5. Высвобождение медиаторов и метаболический круговорот везикул
Квантовое высвобождение медиаторов путем экзоцитоза везикул (глава 11) ставит ряд фундаментальных вопросов: как распределены синаптические пузырьки в нервных терминалях? Какие механизмы рекрутируют пузырьки в активную зону? Как вход кальция в клетку запускает экзоцитоз?
Сортировка везикул в нервном окончании
Не все пузырьки одинаковы. Исследования с использованием радиоактивных предшественников, которые включаются в медиаторы в процессе синтеза и затем поступают в пузырьки и высвобождаются из окончаний, предполагают, что существуют разные субпопуляции везикул в аксонных терминалях. Например, при стимуляции электрического органа морского ската Torpedo было установлено, что синтезированный вновь АХ не распределяется равномерно по синаптическим пузырькам, а локализован в тех везикулах, которые недавно образовались по завершении цикла круговорота83· 84). Изучение аксонных терминалей моторных и симпатических нейронов млекопитающих показало, что высвобождаются преимущественно вновь синтезированные молекулы медиатора20· 85). Такие результаты дают возможность предположить, что существует субпопуляция пузырьков, которые подвергаются быстрому круговороту, в то время как большинство везикул находится в резерве. Данные о том, что везами-

280 |
Раздел II. Передача информации в нервной системе |
Рис. 13.16. Быстрый аксонный транспорт управляется кинезином и динеином В аксоне микротрубочки стационарны и обладают полярностью: положительный конец направлен к аксонной терминали, а отрицательный — к телу клетки. Кинезин и цитоплазматическии динеин вместе с дополнительными факторами прикрепляют органеллы и двигают их по направлению к аксонной терминали и телу клетки соответственно.
Fig. 13.16. Fast Axonal Transport Powered by Kinesin and Dynein. In the axon, microtubules are stationary and have a polarity: The plus end points toward the axon terminât the minus end toward the cell body. Kinesin and cytoplasmic dynein, together with accessory factors, attach to organelles and propel them toward the axon terminal and celt body, respectively. (After Vallée, Shpetner, and Paschal, 1989.)
кол, специфически нарушающий транспорт АХ в синаптические пузырьки, избирательно блокирует высвобождение новообразованного АХ22), соответствуют приведенной схеме. Существование разных пулов везикул в аксонных окончаниях удалось подтвердить некоторым авторам в экспериментах86) с использованием флуоресцентного красителя, но не удалось другим87).
Деление пузырьков на разные субпопуляции требует, чтобы их движение было организовано определенным образом. Если бы синаптические пузырьки двигались свободно по законам броуновского движения, они должны бы были равномерно перемешиваться в нервных окончаниях. Кроме того, в экспериментах с использованием метода так называемого восстановления флюоресценции после фотообесцвечивания (FRAP) было установлено, что в окончаниях моторного нерва лягушки пузырьки не диффундируют свободно (рис. 13.17)88). В этих экспериментах пузырьки метили флуоресцентным красителем, и небольшой участок кластера меченых везикул обесцвечивали. Индикатором того, что пузырьки не могут свободно перемещаться в стороны, было то, что обесцвеченное пятно сохранялось даже в процессе высвобождения медиатора.
Грингард с коллегами открыли в аксонах и аксонных терминалях семейство белков, названных синапсинами (synapsin), которые прикрепляют пузырьки к цитоскелету, препятствуя их движению89· 90). Интересно, что связывание синапсинов с везикулами регулируется фосфорилированием; добавление фосфатных групп к синапсинам способствует их отсоединению от пузырьков. Эксперименты Ллинаса с коллегами91) иллюстрируют одну из функций, которую может выполнять такое ограничение движения пузырьков в высвобождении нейромедиатора. Эти авторы вводили дефосфорилированный синапсин I в пресинаптическую терминаль гигантского аксона кальмара, что вызывало снижение количества медиатора, высвобождаемого вследствие стимуляции нерва. Последующее введение протеинкиназы, специфично фосфорилирующей синапсин I, приводило к увеличению количества высвобождаемого медиатора. Таким образом, в нормальных условиях активность эндогенных киназ и фосфатаз может модулировать количество медиатора, высвобождаемого из аксонной терминали, регулируя фосфорилирование синапсинов.
Консервативные механизмы транспорта синаптических пузырьков
Как синаптические пузырьки переносятся к плазматической мембране и выбрасыва-

Глава 13. Клеточная и молекулярная биохимия синаптической передачи |
281 |
|
|
Рис. 13.17. Ограниченное движение синаптических везикул в нервной терминали Флуоресцентные микрофотографии нервных окончаний лягушки, в которых синаптические пузырьки были помечены флуоресцентным красителем. (А) Нервное окончание до (вверху), непосредственно после (в середине) и через 28 мин после (внизу) обесцвечивания окраски в небольшом пятне в группе везикул интенсивным освещением. Обесцвеченный участок (стрелка) остается почти неизменным через 28 мин после освещения, что указывает на незначительное спонтанное перемещение окрашенных везикул. (В) То же, что и на рисунке А, за исключением того, что после обесцвечивания терминаль стимулировали током с частотой 10 Hz в течение 5 мин. Хотя группы везикул бледнели, так как высвобождали окрашенное содержимое в ходе экзоцитоза, этот процесс не затрагивал обесцвеченный участок, что говорит об отсутствии передвижения окрашенных везикул в эту область.
Fig. 13.17. Restricted Movement of Synaptic Vesicles within Nerve Terminals. Fluorescence micrographs of frog nerve terminals in which synaptic vesicles have been labeled with a fluorescent dye. (A) Resting nerve terminal before (top), immediately after (middle), and 28 min after (bottom) bleaching the dye in a small spot among the vesicle clusters with intense illumination. The bleached region (arrowhead) is nearly unchanged after 28 min, indicating little spontaneous movement of dye-containing vesicles. (B) As in part A, except after bleaching the terminal was stimulated at 10 Hz for 5 min. Although all the vesicle clusters dim as vesicles undergo exocytosis and release their dye, no increase in fluorescence occurs in the bleached region, indicating no net movement of dye-containing vesicles into this area. (After Henkel et al. 1996; micrographs kindly provided by W. J. Betz.)
ют свое содержимое в синаптическую шель? Для того чтобы охарактеризовать компоненты нервных окончаний, участвующие в этих процессах, были проведены эксперименты92), которые привели к открытию нескольких белков, локализованных в синапсе, гомологичных белкам, необходимым для процессов секреции у дрожжей93) и для везикулярного транспорта в аппарате Голыши94). Понимание того, что в основе всех видов мембранного транспорта лежат одни и те же базовые механизмы, послужило основанием для быстрого прогресса в этой области исследований. Генетические, физиологические и биохимические подходы позволили выявить последовательность шагов, в результате которой происходит экзоцитоз медиаторов95· 96). Первым шагом является образование комплекса между белками мембраны синаптического пузырька и белками активной зоны на пресинаптической мембране. Этот комплекс удерживает везикулу в фиксированной позиции и способствует слиянию мембран в ответ на приток кальция. Белки, способствующие присоединению и слиянию мембран, называются SNARE, сокращенно от «рецептор SNAP», так как они были впервые идентифицированы в качестве рецепторов другого белка, необходимого для секреции у дрожжей, называемого растворимый прикрепляющий бе-

282 |
Раздел II. Передача информации в нервной системе |
Рис. 13.18. Места действия столбнячного и ботулинового токсинов. Эти токсины являются протеазами, которые разрушают компоненты SNARE комплекса. Ботулиновый токсин Cl действует на синтаксин, ботулиновые токсины А и Ε разрушают SNAP-Z5 и ботулиновые токсины В, D, F и G и столбнячный токсин воздействуют на синалтобревин.
Fig. 13.18. Site of Action of Tetanus and Botulinum Toxins. These toxins are proteases that degrade components of the SNARE complex. Botulinum toxin Cl acts on syntaxin, botutinum toxins A and Ε degrade SNAP-25, and botulinum toxins B, D, F, and G and tetanus toxin target synaptobrevin.
лок NSF (NSF attachment protein), или SNAP. В соответствии с этим представленная схема прикрепления и слияния мембран получила название SNARE-гипотеза.
Синаптотагмин и зависимость высвобождения медиаторов от кальция
Белок, известный как синаптотагмин (synaptotagmin), является кальциевым сенсором для высвобождения медиаторов95). Связываясь с кальцием в определенном интервале концентраций, синаптотагмин изменяет степень своего взаимодействия с белками синаптических пузырьков и плазматической мембраны. У мутантных животных, у которых отсутствует ген, кодирующий синаптотагмин, стимуляция аксона не оказывает эффекта или имеет незначительное воздействие на высвобождение медиаторов, хотя спонтанное высвобождение медиаторов повышено. Таким образом, синаптотагмин действует как прерыватель, предотвращающий слияние мембран в отсутствие кальция и усиливающий слияние мембран и экзоцитоз при поступлении кальция внутрь клетки.
Связывание кальциевых каналов и SNARE белков плазматической мембраны — синтаксина (syntaxin) и SNAP-25 — может играть роль в колокализации кальциевых каналов и мест высвобождения медиатора97). Кальциевый канал и синаптотагмин также связываются друг с другом, что может переводить синаптотагмин в положение, в котором он оказывается возле открытых каналов на участке повышенной концентрации кальция98).
Бактериальные нейротоксины нацелены на SNARE комплекс
Идентификация SNARE комплекса позволила понять механизм действия сильных нейротоксинов, вырабатываемых бактерией Clostridium: токсинов столбняка и ботулизма99). Одной молекулы этих токсинов достаточно для того, чтобы предотвратить высвобождение медиатора из нервного окончания. Каждый токсин состоит из легкой и тяжелой цепей, соединенных дисульфидной связью. Тяжелая цепь связывается с плазматической мембраной и переносит токсин внутрь нервного окончания. После этого дисульфидный мостик расщепляется и легкая цепь действует как эндопротеаза, которая специфически разрушает компоненты SNARE комплекса (рис. 13.18).
Восстановление компонентов мембран синаптических пузырьков путем зндоцитоза
Как описано в главе 11, после экзоцитоза компоненты мембраны синаптических пузырьков возвращаются обратно в клетку и используются повторно, совершая метаболический круговорот. Наиболее исследованным путем круговорота является путь классического эндоцитоза, при котором мембрана пузырька полностью сливается с пресинаптической мембраной в процессе экзоцитоза, и компоненты везикулярной мембраны возвращаются обратно путем эндоцитоза в виде фрагментов, покрытых клатрином (рис. 13.19)100). Помимо клатрина этот процесс требует участия
