
Nikolls_-_Ot_neyrona_k_mozgu
.pdf
Глава 13. Клеточная и молекулярная биохимия синоптической передачи |
263 |
Рис. 13.2. Низкомолекулярные нейромедиаторы.
Fig. 13.2. Low-Molecular-Weight
Neurotransmitters.
ны на детекции экспрессии белков, которые осуществляют различные аспекты химической синаптической передачи.
Нейромедиаторы как посредники
Один и тот же нейромедиатор может высвобождаться в разных отделах нервной системы. Точность послания, которое сообщается этим медиатором, определяется конкретными путями, связывающими разные нейроны между собой. Например, выделение ацетилхолина из терминали моторного нерва в мышце gastrocnemius (брюхоногого моллюска) вызывает удлинение ноги, тогда как ацетилхолин,
264 |
Раздел II. Передача информации в нервной системе |
высвобождаемый в определенных синапсах в ЦНС, дает вам возможность вспомнить картины вашего детства. С другой стороны, нейропептиды обнаружены только в очень малом числе клеток, которые служат для выполнения специфических функций. В таких случаях диффузная аппликация какого-либо нейропептида может вызвать характерное поведение, определяемое распределением и свойствами его рецепторов на центральных нейронах. Например, введение нейропептида Y в спинномозговую жидкость животных приводит к чрезмерному поеданию пищи и ожирению10).
Молекулы медиаторов
Медиаторы могут быть разделены на три группы. Одна группа содержит так называемые «классические» нейромедиаторы, вещества с низким молекулярным весом, которые хранятся в везикулах в нервных терминалях. Эта группа включает ацетилхолин, норадреналин, адреналин, дофамин, 5-гидрокситриптамин (5-НТ или серотонин), гистамин, аденозинтрифосфат (АТФ) и аминокислоты — γ-аминомасляную кислоту (ГАМК), глутамат и глицин (рис. 13.2). Вторая группа медиаторов, хранящихся в пузырьках, состоит из нейропептилов (табл. 13.1), более 40 из которых были обнаружены в ЦНС млекопитающих. Оксид азота (NO) и оксид углерода (СО) составляют третью группу трансмиттеров, которые являются газами, легко растворимыми в липидах и воде. Следовательно, они не могут храниться в клетках. Очень вероятно, что еще большее число медиаторных веществ остается неисследованным.
Многие вещества, которые были исходно охарактеризованы как нейромедиаторы в нервной системе беспозвоночных или в периферических синапсах нервной системы позвоночных, действуют и в ЦНС млекопитающих. Интересно, что одни и те же медиаторы широко распространены в царстве животных от пиявок и насекомых до миног и млекопитающих.
§ 2. Синтез нейромедиаторов
Где синтезируются молекулы медиатора и как происходит поддержание и пополнение его запасов? Транспортируются ли они в нервное окончание в готовом виде, или медиатор образуется непосредственно в терминали из предшественников, которые доставляются из тела клетки? Ответы на каждый из этих вопросов различны для разных медиаторов. Классические низкомолекулярные медиаторы продуцируются в аксонной терминали из общих клеточных метаболитов и включаются в маленькие синаптические пузырьки (50 нм в диаметре) для хранения и высвобождения. NO и СО также синтезируются в терминали. Поскольку они не могут быть упакованы в пузырьки, NO и СО сразу же диффундируют из нервного окончания и оказывают воздействие на мишени (глава 10). С другой стороны, пептидные нейромедиаторы синтезируются в теле клетки, упаковываются в большие везикулы с плотным центром (large dense-core vesicles, 100-200 нм в диаметре) и транспортируются в аксон.
Дополнительную сложность представляет то, что многие, а возможно и все, нейроны высвобождают более одного медиатора. Обычно это один низкомолекулярный трансмиттер и один или более нейропептид 11, 12). Рис. 13.3 показывает локализацию 5-НТ и нейропептидов FLRFамида и аллатостатина в отдельных нейронах ЦНС бабочки 13). Было установлено, что во многих синапсах такие котрансмиттеры действуют синергично (глава 16) 11, 14). Для выброса низкомолекулярных медиаторов достаточно одиночных импульсов, тогда как для высвобождения нейропептидных котрансмиттеров часто требуются пачки импульсов.
Имеются многочисленные доказательства того, что многие нейроны высвобождают более одного низкомолекулярного медиатора. Эту идею высмеивали всего лишь несколько лет назад. Например, некоторые спинальные интернейроны высвобождают аминокислоту глицин и ГАМК, каждая из которых оказывает тормозное влияние на одну и ту же постсинаптическую клетку через свои собственные рецепторы15). Другие спинальные нейроны выбрасывают одновременно АТФ как возбуждающий медиатор и ГАМК как тормозной медиатор16). Примечательно то, что многие так называемые моноаминергические нейроны в центральной нервной системе позвоночных (те, которые содержат дофамин, серотонин или норадреналин) содержат также глутаминазу — фермент, который обычно осуществляет синтез глутамата в аксонных терминалях, высвобождающих глутамат (см. обсуждение ниже в этой главе). Эти данные свидетельствуют о том, что такие нейроны высвобождают оба медиатора 17· 18). Например, нейроны

Глава 13. Клеточная и молекулярная биохимия синаптической передачи |
265 |
Таблица 13.1. Нейропептиды в нервной системе млекопитающих. Table 13.1. Neuropeptides in mammalian nervous systems

266 |
Раздел II. Передача информации в нервной системе |
Рис. 13.3. (См. цветную вклейку после с. 640.) 5 Гидрокситриптамин, FLRFaмид и аллатостатин в отдельных нервных клетках бабочки, Manduca. (А, С) Флуоресцентные конфокальные микрофотографии срезов оптической доли бабочки, окрашенных антисывороткой к 5-НТ (красный) и нейропептиду FLRFамиду (зеленый). (А) Продольный срез. Клетки кластера 0L2 (слева внизу) проецируются главным образом в слой ламина (La). (С) Фронтальный вид кластера клеток. Большинство клеток содержат и 5-НТ. и FLRFамид и выглядят желтыми. (В. D) Микрофотографии срезов, окрашенных антисывороткой к 5-НТ (красный) и нейропептиду аллатостатину (зеленый). (В) Продольный срез. Клетки, содержащие 5-НТ и/или аллатостатин, проецируются в ламину, медуллу (М), лобулу (L) и пластинку лобулы (LP). (D) Фронтальный вид кластера клеток
Fig. 13.3. Hydroxytryptamine, FLRFamide, and AUatostatin in Individual Nerve Cells of the moth, Manduca. (A, C) Fluorescence confocal micrographs of a section of the moth optic lobe labeled with antisera to 5-HT (red) and to the neuropeptide FLRFamide (green). (A) Longitudinal section. Cells in the OL2 cluster (lower left) project mostly to the lamina (La). (C) Frontal view of cell cluster. Most cells contain both 5-HT and FLRFamide, and so appear yellow. (B, D) Micrographs of a section labeled with antisera to 5-HT (red) and to the neuropeptide allatostatin (green). (B) Longitudinal section. Cells containing 5-HT and/or allatostatin project to the lamina, the medulla (M), the lobula (L), and the lobula plate (LP). (D) Frontal view of cell cluster. Colocalization of 5-HT and allatostatin occurs in a small subpopulation of cells. (Micrographs kindly provided by N.T. Davis and J. G. Hildebrand.)
ядер шва высвобождают и серотонин, и глутамат из одних и тех же синапсов, которые содержат два разных типа везикул в терминалях. Дофамин-содержащие нейроны среднего мозга имеют два разных типа терминален. Одни содержат и глутамат, который вызывает быстрый возбуждающий постсинаптический потенциал на клетке-мишени, и дофамин, который распространяется по большей площади, оказывая медленное модулирующее действие. Другие содержат только глутамат.
Синтез ацетилхолина (АХ)
Одно из первых полных исследований о том, как медиаторы аккумулируются в нервных терминалях и как запас медиаторов пополняется в периоды активности клетки, было выполнено Бирксом и МакИнтошем в работе, где они изучали ацетилхолин в терминалях преганглионарных аксонов переднего шейного ганглия кошки (рис. 13.4А и В; см. также главу 16)19). Они вставляли канюли в сонную артерию и яремную вену, перфузировали ганглий раствором, содержавшим антихолинэстеразу, и анализировали содержание ацетилхолина в перфузате. В условиях покоя небольшое количество ацетилхолина постоянно высвобождалось из ганглия, составляя примерно 0,1 % от общего содержания ацетилхолина каждую минуту (рис. 13.4С). Тот факт, что уровень ацетилхолина в ганглии оставался неизменным, означал, что ацетилхолин постоянно синтезировался в покое. (Впоследствии было показано, что скорость синтеза ацетилхолина в покое, измеренная по скорости включения радиоактивно меченого холина в ацетилхолин, настолько высока, что количество, равное полному запасу ацетилхолина, распадается и ресинтезируется в аксонной терминали каждые 20 мин20).)
Затем Бирке и МакИнтош стимулировали преганглионарный нерв длинными пачками импульсов и обнаружили, что количество ацетилхолина, которое высвобождалось из ганглия, увеличивалось в 100 раз. Этот прирост означал, что 10 % исходного содержания ацетилхолина выбрасывалось каждую минуту (см. рис. 13.4С). Интересно, что скорость выброса поддерживалась на одном уровне в течение одного часа без изменения содержания ацетилхолина в ганглии. Таким образом, в течение часовой стимуляции аксонная терминаль могла высвобождать количество ацетилхолина, многократно превышающее исходное содержание медиатора в ганглии без истощения его запаса.
Единственный экзогенный ингредиент, необходимый нервным окончаниям для поддержания запаса ацетилхолина в таких условиях, — это холин, который захватывается из окружающей жидкости по механизмам активного транспорта (рис. 13.5). Необходимость внеклеточного холина была продемонстрирована в экспериментах с перфузией препаратов растворами, не содержащими холин, и блокадой захвата холина аксонным окончанием с помощью гемихолина (НС—3). В обоих случаях уровень ацетилхолина в ганглии и количество ацетилхолина, высвобожденного в результате стимуляции, быстро снижались (рис. 13.4С).
Как же контролируется синтез ацетилхолина, чтобы он мог высвобождаться по первому требованию? Наше понимание механизмов, регулирующих синтез ацетилхолина и его хранение в холинергических нервных окончаниях, на удивление ограничено. Фер-

Глава 13. Клеточная и молекулярная биохимия синоптической передачи |
267 |
Рис. 13.4. Измерение высвобождений АХ из тер миналей преганглионарных аксонов переднего шейного ганглия кошки. (А) Преганглионарные аксоны приходят к переднему шейному ганглию от расположенного позади ганглия симпатического ствола. (В) Преганглионарные нейроны, тела которых лежат в спинном мозге, высвобождают ацетилхолин как медиатор в синапсах симпатических ганглиев. Клетки ганглиев высвобождают норадреналин (NE) из варикозных расширений, расположенных вдоль их отростков на периферии. (С) Высвобождение АХ из симпатического ганглия, перфузированного оксигенированной плазмой, содержащей 3 · 10--5 M эзерина для ингибирования ацетилхолинэстеразы.
Fig. 13.4. Measuring the Release of ACh from the terminals of preganglionic axons in the cat superior cervical ganglion. (A) Preganglionic axons reach the superior cervical ganglion from more posterior ganglia in the sympathetic chain.
(B) Preganglionic neurons, whose cell bodies lie in the spinal cord, release acetylcholine as a transmitter at synapses in sympathetic ganglia.
Ganglion cells release norepinephrine (NE) from varicosities along their processes in the periphery. (C) Release of ACh from a cat sympathetic ganglion perfused with oxygenated plasma containing 3 · 10--5 M eserine to inhibit acetylcholinesterase. In control medium, preganglionic stimulation at 20/s causes a sustained, 100-fold increase in the rate of ACh release, compared to release at rest. Release decreases rapidly during stimulation in the presence of 2 · 10~5 M hemicholinium (HC 3), which blocks choline uptake. (After Birks and
Macintosh, 1961.)
ментативные реакции этих процессов суммарно изображены на рис. 13.5 и детально показаны в приложении В. Ацетилхолин синтезируется из холина и ацетил СоА (ацетил-кофермента А) ферментом холинацетилтрансферазой и гидролизуется до холина и ацетата ацетилхолинэстеразой. Оба указанных фермента находятся в цитозоле. Поскольку реакция, катализируемая холинацетилтрансферазой, является обратимой, единственным фактором, контролирующим уровень ацетилхолина, служит закон действующих масс. Например, снижение концентрации ацетилхолина, вызванное его высвобождением, будет способствовать синтезу до тех пор, пока равновесие не будет восстановлено.
Однако регуляторные механизмы, работающие в холинергических нервных окончаниях, являются более сложными, чем этот. Так, в условиях покоя накопление ацетилхолина ограничено одновременным гидролизом, который осуществляется внутриклеточной ацетилхолинэстеразой; ингибирование ацетилхолинэстеразы в нервном окончании вызывает повышение содержания ацетилхолина19, 20). Таким образом, уровень, до которого накапливается ацетилхолин, представляет собой динамическое равновесие между текущим синтезом и распадом. Это является общей чертой метаболизма низкомолекулярных медиаторов. Хотя это и кажется расточительством, такой постоянный круговорот может быть неизбеж-

268 |
|
|
|
|
Раздел II. Передача информации в нервной системе |
||||||
Рис. 13.5. Механизмы |
синтеза, |
хранения, |
|
||||||||
высвобождения |
|
|
и |
|
|
распада |
|
||||
ацетилхолина. |
Ацетилхолин |
синтезируется |
|
||||||||
из холина и ацетил кофермента А (АсСоА) |
|
||||||||||
с |
|
помощью |
|
|
|
фермента |
|
||||
холинацетилтрансферазы |
|
(CAT) |
|
и |
|
||||||
разрушается |
|
|
|
|
ферментом |
|
|||||
ацетилхолинэстеразой |
(AChE). |
AcCoA |
|
||||||||
исходно образуется в митохондриях; холин |
|
||||||||||
доставляется |
в |
|
клетку |
|
системой |
|
|||||
высокоаффинного |
активного |
транспорта, |
|
||||||||
которая |
может |
ингибироваться |
|
||||||||
гемихолином (HC-3). Ach упаковывается в |
|
||||||||||
пузырьки вместе с АТФ (АТР) для |
|
||||||||||
последующего |
высвобождения |
путем |
|
||||||||
экзоцитоза. Транспорт Ach в пузырьки |
|
||||||||||
блокируется |
везамиколом. |
Везикулярный |
|
||||||||
Ach защищен от разрушения. После |
|
||||||||||
высвобождения |
|
Ach |
расщепляется |
|
|||||||
экстраклеточной AChE до холина и |
|
||||||||||
ацетата. |
Около |
|
половины |
холина, |
|
||||||
поступающего в холинергическую аксонную |
|
||||||||||
терминаль, имеет источником гидролиз |
|
||||||||||
ранее высвобожденного Ach. В некоторых |
|
||||||||||
синапсах |
АТФ |
|
соединяется |
|
с |
|
|||||
постсинаптическими |
рецепторами. |
АТФ |
|
||||||||
гидролизуется |
экстраклеточными |
АТФ- |
|
||||||||
азами до аденозина и фосфата (Р ); |
|
||||||||||
аденозин |
может |
соединяться |
|
с |
|
||||||
пресинаптическими |
|
|
рецепторами, |
a high-affinity active transport system that can be inhibited by |
|||||||
модулируя высвобождение. |
|
|
|
|
|
hemicholinium (HC-3). ACh is packaged into vesicles together with |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
Fig. |
13.5. |
Pathways of |
|
Acetylcholine |
ATP for release by exocytosis. Transport of ACh into vesicles is |
||||||
Synthesis, |
Storage, |
Release, |
and |
blocked by vesamicol. Vesicular ACh is protected from degradation. |
|||||||
Degradation. Acetylcholine is synthesized from |
After release, ACh is degraded by extracellular AChE to choline and |
||||||||||
choline |
and |
acetyl |
coenzyme |
A |
(AcCoA) |
by |
acetate. About half of the choline transported into cholinergic axon |
||||
choline |
acetyltransferase |
(CAT) and |
is |
terminals comes from the hydrolysis of ACh that has been released. |
|||||||
degraded by acetylcholinesterase (AChE). |
At some synapses, ATP combines with postsynaptic receptors. ATP |
||||||||||
AcCoA |
is |
|
synthesized |
primarily |
in |
is hydrolyzed by extracellular ATPases to adenosine and phosphate |
|||||
mitochondria; choline is supplied by |
|
|
|
(Pi ), adenosine can combine with presynaptic receptors to modulate |
|||||||
|
|
|
release. |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
ным последствием механизмов, которые гарантируют наличие всегда доступного необходимого количества медиатора.
Большая часть АХ в нервных окончаниях перераспределяется в синаптические пузырьки, тогда как синтез и деградация АХ происходят в иитозоле. Тогда для того, чтобы оказать влияние на уровень синтеза, высвобождение ацетилхолина должно снизить концентрацию АХ в цитоплазме. Этот процесс осуществляется путем перемещения цитоплазматического АХ в новообразованные пузырьки. Сходные взаимоотношения между цитоплазматическим синтезом и везикулярным хранением и высвобождением являются общей чертой метаболизма низкомолекулярных медиаторов.
В холинергических нервных окончаниях центральной нервной системы доступность холина, доступность субстрата ацетил СоА (производится в митохондриях) и активность
холинацетилтрансферазы, как было показано, регулируют скорость синтеза ацетилхолина 21·
22).
Синтез дофамина и норадреналина
Другой механизм, контролирующий синтез веществ в клетке, — это механизм отрицательной обратной связи, согласно которому скорость биосинтеза тормозится при увеличении конечного продукта реакции. Хороший пример этого приводится в работах фон Эйлера, Аксельрода, Уденфренда и их коллег по исследованию синтеза, хранения и высвобождения норадреналина в симпатических нейронах и секреторных клетках надпочечников 23). Клетки надпочечников сходны с симпатическими нейронами по многим параметрам: они имеют одинаковое эмбриональное происхождение, они иннервированы холинергическими волокнами, приходящими из центральной нервной системы, и они высвобождают катехоламины в ответ на стимуляцию. (Термин катехоламииы используется для обозначения
Глава 13. Клеточная и молекулярная биохимия синаптической передачи |
269 |
группы таких веществ, как ДОФА, дофамин, норадреналин и адреналин, которые содержат катехольное ядро — бензольное кольцо с двумя присоединенными гидроксильными группами
— и аминогруппу.) Симпатические нейроны млекопитающих высвобождают норадреналин (те же нейроны у лягушки высвобождают адреналин); клетки надпочечника выделяют и адреналин, и норадреналин.
Норадреналин синтезируется из общего клеточного метаболита тирозина в серии реакций, состоящей из трех шагов: тирозин превращается в ДОФА ферментом тирозингидроксилазой, из ДОФА образуется дофамин под действием фермента декарбоксилазы ароматических L- аминокислот, дофамин превращается в норадреналин под действием дофамин-β-гидроксилазы (рис. 13.6). Превращение тирозина в ДОФА и ДОФА в дофамин происходит в цитоплазме. Затем дофамин транспортируется в синаптические пузырьки, где он превращается в норадреналин дофамин-β-гидроксилазой, связанной с мембраной везикул. Большая часть норадреналина хранится внутри везикул; некоторое количество норадреналина проникает обратно в цитоплазму, где подвергается распаду под действием моноаминоксидазы.
Нейроны, которые выделяют дофамин как медиатор, содержат тирозингидроксилазу и декарбоксилазу ароматических L-аминокислот, но в этих нейронах отсутствует дофаминβгидроксилаза. Другие нейроны, так же как и клетки надпочечников, высвобождают адреналин, который образуется из норадреналина под действием фенилэтаноламин-N-метилтрансферазы.
Обычно первый фермент такого многоступенчатого процесса является фактором, лимитирующим скорость процесса, и ингибируется конечным продуктом реакции. В экстрактах надпочечника активность тирозингидроксилазы на два порядка ниже, чем декарбоксилазы ароматических L-аминокислот и дофаминβ-гидроксилазы, что дает основания предполагать, что гидроксилирование тирозина является этапом, лимитирующим скорость всего процесса. Более того, было установлено, что тирозингидроксилаза ингибируется норадреналином (а также дофамином и адреналином). Таким образом, по мере накопления дофамина, норадреналина или адреналина дальнейший их синтез будет тормозиться до тех пор, пока не будет достигнуто состояние равновесия, при котором скорость синтеза станет равной скорости распада и высвобождения (рис. 13.6).
Доказательства того, что ингибирование по принципу обратной связи регулирует синтез норадреналина в нейронах, были получены в экспериментах Вейнера с коллегами на терминалях симпатических аксонов, иннервирующих гладкие мышцы сосудистого русла (vas deferens)24). Эти авторы измерили скорость синтеза норадреналина в терминалях, инкубируя препараты с радиоактивно меченым предшественником и наблюдая за накоплением радиоактивного норадреналина. Они обнаружили, что скорость синтеза норадреналина была более чем в три раза выше, если в качестве предшественника для первой ферментативной реакции каскада использовали ДОФА вместо тирозина. Эти данные подтвердили, что превращение тирозина в ДОФА лимитирует скорость биосинтеза.
Для того чтобы доказать, что лимитирующий скорость этап контролируется по принципу отрицательной обратной связи, Вейнер с коллегами изменяли концентрацию норадреналина в цитоплазме двумя способами. Во-первых, воспользовавшись тем фактом, что терминали симпатических аксонов имеют специфический механизм транспорта для НА, они добавляли НА в инкубационную жидкость, что вызывало увеличение концентрации НА в терминалях. Это снижало скорость синтеза норадреналина из тирозина. Напротив, стимуляция нерва, которая уменьшала концентрацию НА в цитоплазме, повышала скорость превращения тирозина в НА почти в два раза. Такого увеличения скорости синтеза не наблюдалось, однако, если НА добавляли в инкубационную среду во время стимуляции нерва. По-видимому, захват НА из среды был достаточен для поддержания определенного уровня норадреналина в аксонных терминалях и, таким образом, лимитировал его биосинтез.
Дополнительные факторы оказывают влияние на синтез катехоламинов (рис. 13.7). При высвобождении норадреналина из аксонных терминалей, вызванном стимуляцией нерва, тирозингидроксилаза приобретает большее сродство к кофактору тетрагидробиоптерину и становится менее чувствительной к ингибированию НА25). Эти изменения связаны с обратимым фосфорилированием тирозингидроксилазы киназами, которые активируются входящими в клетку иона-

270 |
Раздел П. Передача информации в нервной системе |
|
|
|
|
Рис. 13.6. Механизмы синтеза, хранения, высвобождения и распада норадреналина. Тирозин превращается в ДОФА с помощью фермента тирозингидроксилазы (ТН). ДОФА преобразуется в дофамин декарбоксилазой ароматических L-аминокислот (AAAD). Дофамин транспортируется в пузырьки, где из него образуется
норадреналин при помощи фермента дофамин-β-гидроксилазы (DβH) Норадреналин ингибирует ТН, регулируя таким образом синтез по принципу отрицательной обратной связи. Транспорт дофамина и норадреналина в пузырьки блокируется резерпином. Пузырьки также содержат АТФ (крупные плотные
пузырьки также содержат растворимую DβH и хромогранины). Все растворимые компоненты везикул выбрасываются вместе. NE, АТФ, аденозин и пептиды, производные хромогранинов, могут связываться с преили постсинаптическими рецепторами. После высвобождения норадреналин возвращается обратно в варикозные расширения с помощью механизма захвата, который блокируется кокаином. Норадреналин в цитоплазме может быть вновь упакован в пузырьки для последующего высвобождения. В варикозных расширениях моноаминоксидаза (МАО) и альдегиддегидрогеназа (ADH) расщепляют норадреналин до 3,4- дигидроксиминдальной кислоты (DOMA) и дофамин до 3,4 дигидрофенилуксусной кислоты (DOPAC).
Fig. 13.6. Pathways of Norepinephrine Synthesis, Storage, Release, and Uptake. Tyrosine is converted to DOPA by tyrosine hydroxylase (TH). DOPA is converted to doparnine (DA) by aromatic L-arnino acid decarboxylase (AAAD).
Dopamine is transported into vesicles, where it is converted to norepinephrine (NE) by doparnine β-hydroxylase
(DβH). Norepinephrine inhibits TH, thus regulating synthesis by feedback inhibition. Transport of dopamine and norepinephrine into vesicles is blocked by reserpine. Vesicles also contain ATP (large dense-core vesicles contain
soluble DβH and chromogranins as well). All soluble components of vesicles are released together. NE ATP, adenosine, and peptides derived from chromogranins can bind to pre or postsynaptic receptors. After release, norepinephrine is transported back into the varicosity by an uptake mechanism that is blocked by cocaine.
Norepinephrine in the cytoplasm can be repackaged into vesicles for release. Within the varicosity, monoamine oxidase (MAO) and aldehyde dehydrogenase (ADH) degrade norepinephrine to 3,4-dihydroxymandelic acid (DOMA) and dopamine to 3,4-dihydroxyphenylacetic acid (DQPAC).
ми кальция26· 27). Еще одним фактором, регулирующим активность тирозингидроксилазы, является концентрация тетрагидробиоптерина, который синтезируется из гуанозинтрифосфата28). Итак, различные механизмы действуют в клетке для того, чтобы скорость синтеза норадреналина обеспечивала клетку необходимым количеством медиатора.
Синтез 5-НТ
Серотонин синтезируется из триптофана. Первая стадия этого процесса — превращение

Глава 13. Клеточная и молекулярная биохимия синоптической передачи |
271 |
|
|||||
Рис. 13.7. Регуляция тирозингидроксилазы |
|
|
|
||||
в симпатических нейронах. Активность |
|
|
|
||||
пресиналтического |
нейрона |
влияет на |
|
|
|
||
экспрессию тирозингидроксилазы (ТН) в |
|
|
|
||||
гостей налтической клетке. Этот процесс, |
|
|
|
||||
известный |
как |
транс еиналтическая |
|
|
|
||
регуляция, определяет количество ТН, |
|
|
|
||||
присутствующего в клетке и нервном |
|
|
|
||||
окончании. |
В |
нервной |
терминали |
|
|
|
|
существует |
локальный |
контроль |
|
|
|
||
активности тирозингидроксилазы. |
|
|
|
||||
Fig. 13.7. Regulation of Tyrosina· Hydroxylase |
|
|
|
||||
in sympathetic neurons. The expression of |
to as trans-synaptic regulation. This determines |
the amount of TH |
|
||||
tyrosine hydroxylase (TH) is influenced by the |
|
||||||
activity of the presynaptic neuron, a process |
present in the cell and nerve terminal. Within nerve terminals, there is |
|
|||||
referred |
|
|
|
|
local control of tyrosine hydroxylase activity. |
|
|
|
|
|
|
|
|
|
|
Рис. 13.8. |
Синтез |
|
|
|
|
|
|
5-HT. |
|
|
|
|
|
|
|
Fig. 13.8. Synthesis |
|
|
|
|
|
|
|
of 5-HT. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
триптофана в 5-гидрокситриптофан (5-НТР) с помощью фермента триптофангидроксилазы — является лимитирующей (рис. 13.8)29). 5-НТР декарбоксилируется с образованием серотонина (5-НТ) при участии декарбоксилазы ароматических L-аминокислот, т.е. того же самого фермента, который превращает ДОФА в дофамин. Высвобождение 5-НТ из нейронов во время стимуляции вызывает повышение скорости превращения триптофана в 5-гидрокситриптофан. Предполагается, что это происходит благодаря изменению свойств триптофангидроксилазы, вызванному кальцийзависимым фосфорилированием30), сходным с эффектами стимуляции тирозингидроксилазы. Как и в случае тирозингидроксилазы, для функционирования триптофангидроксилазы необходим кофактор тетрагидробиоптерин. Доступность этого кофактора будет регулировать синтез серотонина.
Нейроны не могут синтезировать триптофан. Поэтому первым шагом, ведущим к началу синтеза 5-НТ, является облегченный транспорт триптофана из крови в спинномозговую жидкость (глава 8). Другие нейтральные аминокислоты (фенилаланин, лейцин и метионин) транспортируются из крови в мозг теми же переносчиками, что и триптофан. Таким образом, важным фактором, определяющим уровень 5-НТ в серотонинергических нейронах, является относительное в сравнении с другими нейтральными аминокислота-
ми количество триптофана в пище. В результате поведение, связанное с функцией 5-НТ (глава 14), особенно чувствительно к составу диеты31). Например, добровольцы, которых кормили пищей с низким содержанием белка в течение одного дня, а затем давали смесь аминокислот, не содержавшую триптофана, демонстрировали агрессивное поведение32) и изменение цикла сна33).
Синтез ГАМК
ГАМК синтезируется из глутамата ферментом глутаматдекарбоксилазой (GAD). Эта реакция была впервые охарактеризована как часть так называемого ГАМК-шунта, т. е. серии реакций, в ходе которой α<кетоглутаратможет быть преобразован в сукцинат (рис. 13.9) ГАМК-шунт впервые был описан в качестве специфичного для мозга пути метаболизма глюкозы, который позволяет миновать часть реакций цикла Кребса (отсюда термин «шунт»). Данные о том, что ГАМК является основным тормозным медиатором в мозге34), вместе с данными о том, что глутаматдекарбоксилаза обнаружена только в нейронах, высвобождающих ГАМК, говорят о том, что главная функция ГАМК-шунта не связана с метаболизмом глюкозы.
Кравитц с коллегами показали, что в тормозных нейронах коры физиологические уровни ГАМК ингибируют глутаматдекарбокси-
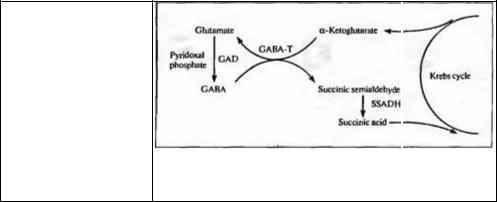
272 |
Раздел II. Передача информации в нервной системе |
Рис. 13.9. Синтез и метаболизм ГАМК. ГАМК синтезируется из глутамата с помощью фермента глутаматдекарбоксилазы (GAD), которой необходим пиридоксальфосфат в качестве кофактора. Глутамат образуется из
α-кетоглутарата при участии
фермента ГАМК-α- оксоглутараттрансаминазы (GABA Т). ГАМК расщепляется до янтарной кислоты GABA-T и сукцинатполуальдегиддегидрогеназой
(SSADH).
Fig. 13.9. GABA Synthesis and Metabolism. GABA is synthesized from glutamate by the enzyme glutamic
acid decarboxylase (GAD), which requires pyridoxal phosphate as a cofactor Glutamate
is synthesized from α-ketoglutarate by the enzyme GABA α-oxoglutarate transaminase (GABA-T) or from glutamine (see Figure 13.10). GABA is metabolized to succinic acid by GABA-T and succinic semialdehyde dehydrogenase (SSADH).
лазу, свидетельствуя о том, что отрицательная обратная связь регулирует накопление ГАМК35). В мозге млекопитающих были найдены несколько дополнительных регуляторов синтеза ГАМК, включая АТФ, неорганический фосфат и кофактор пиридоксальфосфат36). В мозге присутствуют две формы глутаматдекарбоксилазы37). GAD67 имеет высокое сродство к пиридоксальфосфату, и поэтому может быть активированной постоянно; GAD65 имеет низкое сродство к пиридоксальфосфату, и ее активность может быстро регулироваться доступностью этого кофактора. Мутантные мыши, у которых отсутствует GAD65, имеют нормальное поведение и нормальные уровни ГАМК, но они чуть более чувствительны к судорогам. Мыши, нокаутированные по гену GAD67, демонстрируют значительное снижение уровня ГАМК в мозге и умирают вскоре после рождения от сильного расщепления неба38).
Синтез глутамата
Глутамат является основным возбуждающим медиатором в мозге. В клетках существует несколько путей синтеза глутамата. В нейронах глутамат, который используется в качестве нейромедиатора, первоначально образуется из глутамина при помощи активируемой фосфатом формы фермента глутаминазы (рис. 13.10)39). Специфичный для мозга транспортер неорганического фосфата локализован избирательно на терминалях глутаматергических нейронов и, таким образом, может регулировать синтез глутамата40). Большая часть глутамата, высвобождаемого нейронами, захватывается глиальными клетками и превращается в этих клетках в глутамин. Глутамин, в свою очередь высвобождающийся из глиальных клеток, захватывается нейронами и снова превращается в глутамат.
Кратко- и долговременная регуляция синтеза медиаторов
Описанные выше регуляторные механизмы работают быстро, изменяя скорость синтеза в нервных окончаниях. Кроме таких кратковременных эффектов существуют механизмы долговременной регуляции. Прекрасным примером такой регуляции является ответ симпатической нервной системы у животных, подвергнутых продолжительному стрессу. При действии стресса на организм активируются симпатические нейроны. Продолжительная активация ведет к трех-, четырехкратному увеличению уровней тирозингидроксилазы и дофамин-β-гидроксилазы в телах и терминалях симпатических нейронов41· 42). Это увеличение происходит благодаря синтезу новых молекул ферментов и является специфичным. Другие ферменты синтеза и деградации норадреналина, такие как декарбоксилаза ароматических L- аминокислот и моноаминоксидаза, не подвержены такому воздействию.
Увеличение уровня ферментов запускается синаптической активацией симпатических нейронов (см. рис. 13.7). Такая транс-синаптическая регуляция представляет собой механизм, через который способности нейронов к синтезу медиаторов могут быть сопряжены со скоростью высвобождения медиаторов43). Эксперименты, проведенные на симпатичес-
