
Nikolls_-_Ot_neyrona_k_mozgu
.pdf
Глава 9. Основы прямой синоптической передачи |
183 |
Рис. 9.15. Глициновые тормозные ответы опосредованы ионами хлора. Внутриклеточная регистрация от нейрона ствола мозга миноги. (А) Потенциал покоя составляет —63 мВ. Кратковременные отклонения потенциала вызываются толчками тока величиной 10 нА из второго внутриклеточного электрода. Амплитуда этих ответов отражает сопротивление мембраны. При добавлении глицина клетка гиперполяризуется на 7 мВ и сопротивление мембраны резко снижается. (В) После удаления ионов хлора из наружного раствора ответы на глицин исчезают. (С) При перфузии раствором с нормальным содержанием ионов хлора ответы на глицин полностью восстанавливаются.
Fig. 9.15. Inhibitory Response to Glycine Depends |
|
||||
on Chloride. Intracellular microelectrode recordings |
|
||||
from a neuron in the brainstem of the lamprey. (A) |
|
||||
Resting membrane potential is -63 mV. Brief |
|
||||
downward voltage deflections are produced by 10 |
|
||||
nA current pulses from a second intracellular |
|
||||
microelectrode; |
their |
amplitude |
indicates |
|
|
membrane resistance. On application of glycine |
|
||||
(bar), the cell is hyperpolarized by about 7 mV and |
After 20 min in chloride-free bathing solution the response to glycine is |
||||
membrane resistance is reduced drastically. (B) |
|
||||
abolished. (C) Five minutes after return to normal chloride solution the |
|||||
|
|
|
|
||
|
|
|
|
response has recovered. (From Gold and Martin, 1983.) |
|
гиперполяризацию, сопровождаемую значительным уменьшением входного сопротивления (рис. 9.15А), что могло свидетельствовать об активации глицином большого количества хлорных каналов. Для проверки этой гипотезы ионы хлора были полностью удалены из наружного раствора и заменены на непроницаемый анион изотионат. Это привело также к вымыванию ионов хлора из клетки через хлорные каналы, которые открыты в состоянии покоя. Через 20 минут аппликация глицина не вызывала какого-либо заметного изменения мембранного потенциала или входного сопротивления (рис. 9.15В), что указывает на то, что помимо ионов хлора никакие другие ионы не проходят через тормозные каналы. Восстановление нормальной концентрации внеклеточных ионов хлора приводило к восстановлению ответов (рис. 9.15С).
Поскольку в основе тормозных ответов лежит увеличение хлорной проводимости, потенциал реверсии тормозного тока равен равновесному потенциалу ионов хлора, и амплитуда тока равна
При мембранных потенциалах, более положительных, чем ECl,, хлорный ток выходящий и
приводит к гиперполяризации мембраны. В этом случае выходящий ток обусловлен входом отрицательно заряженных ионов хлора. При мембранных потенциалах, отрицательных по отношению к ЕCl, тормозный нейромедиатор вызывает выход ионов хлора и деполяризацию. Соответствующая электрическая схема изображена ни рис. 9.14С.
На ранних этапах развития центральной нервной системы млекопитающих ГАМК и глицин вызывают парадоксальные деполяризующие и возбуждающие ответы в нейронах гиппокампа74). Этот эффект связан не с особенностями каналов, открываемых ГАМК и глицином, а с различиями в регуляции внутриклеточной концентрации ионов хлора, приводящими к изменению потенциала равновесия ионов хлора.
Пресинаптическое торможение
До сих пор мы разграничивали возбуждающие и тормозящие синапсы на основе эффекта медиатора на постсинаптическую мембрану — то есть на основании того, для каких ионов возрастает проводимость постсинаптической мембраны: для катионов или анионов. Однако, в ряде случаев торможение не может быть объяснено в рамках лишь постсинаптического изменения проводимости 75· 76). Этот парадокс был разрешен в результате открытия дополнительного механизма торможения —
184 |
Раздел II. Передача информации в нервной системе |
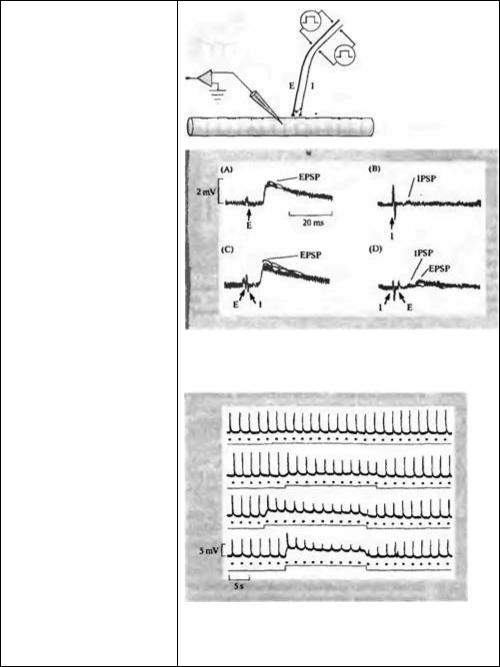
Рис. 9.16. Пресинаптическое торможение в мышечном волокне рака, который иннервируется одним возбуждающим и одним тормозным аксонами. (А) Стимуляция возбуждающего аксона [Е] вызывает ВПСП с амплитудой 2 мВ. (В) Стимуляция тормозного аксона [I] вызывает деполяризующий ТПСП с амплитудой около 0,2 мВ. (С) Если тормозный стимул следует за возбуждающим с маленькой задержкой, никакого эффекта на ВПСП не наблюдается. (D) Если тормозный стимул предшествует возбуждающему на несколько миллисекунд, то ВПСП практически полностью блокируется. Это указывает на то, что тормоэный нерв оказывает пресинаптическое действие, уменьшая количество медиатора, освобождаемого из возбуждающего нерва.
Fig. 9.16. Presynaptic |
Inhibition |
in a |
|
|
|||||
crustacean muscle fiber innervated by one |
|
|
|||||||
excitatory and one inhibitory axon. (A) |
|
|
|||||||
Stimulation of the excitatory axon (E) |
|
|
|||||||
produces a 2 mV EPSP. (B) Stimulation of |
|
|
|||||||
the inhibitory axon (I) produces a |
|
|
|||||||
depolarizing IPSP of about 0,2 mV. (С) If |
|
|
|||||||
the inhibitory stimulus follows the |
|
|
|||||||
|
|
||||||||
excitatory one by a short interval there is |
(D) If the inhibitory stimulus precedes the excitatory one by a few milliseconds, |
|
|||||||
no effect on the EPSP. |
|
|
|
|
|
|
the EPSP is almost abolished. The importance of precise timing indicates that the |
|
|
|
|
|
|
|
|
|
|
inhibitory nerve is having a presynaptic effect reducing the amount of excitatory |
|
|
|
|
|
|
|
|
|
neurotransmitter that is released. (After Dudel and Kuffter, 1961.) |
|
Рис. 9.17. Длительная аппликация АХ |
|
|
|||||||
вызывает |
|
|
десенситизацию |
|
|
||||
постсинаптических |
|
рецепторов |
в |
|
|
||||
нервно-мышечном |
|
|
соединении |
|
|
||||
лягушки. Внутриклеточная регистрация |
|
|
|||||||
изменений |
потенциала, |
вызываемых |
|
|
|||||
короткими |
|
|
|
тестовыми |
|
|
|||
ионофоретическими |
толчками |
АХ |
иэ |
|
|
||||
микропипетки (указаны точками). Из |
|
|
|||||||
другой |
пипетки |
|
производится |
|
|
||||
длительная аппликация АХ (отмечена |
|
|
|||||||
ступеньками |
внизу). |
Во |
|
время |
|
|
|||
длительной |
аппликации |
|
тестовые |
|
|
||||
ответы на АХ уменьшаются в |
|
|
|||||||
результате |
|
|
десенситизации |
|
|
||||
постсинаптических |
рецепторов. |
|
Чем |
|
|
||||
больше АХ выделяется по время |
|
|
|||||||
длительной аппликации/ тем больше |
|
|
|||||||
степень десенситизации. |
|
|
|
|
|
|
|||
Fig. 9.17. Prolonged Application of ACh |
doses of ACh were delivered from a second pipette (upward deflections of lower |
|
|||||||
Causes Receptor Desensitization |
at |
the |
|
||||||
frog neuromuscular junction. Intracellular |
traces). During the conditioning pulse the response to the test pulse decreases in |
|
|||||||
amplitude as the receptors desensitize. With increasing doses the rate and extent |
|
||||||||
recordings of |
potential |
changes |
produced |
|
|||||
of desensitization increase. (After Katz and Thesleff, 1957.) |
|
||||||||
by brief ionophoretic pulses of ACh from a |
|
||||||||
|
|
||||||||
micropipette (dots). Steady conditioning |
|
|
|||||||
пресинаптического торможения — которое было описано в спинном мозге млекопитающих в работах Экклса и его сотрудников 77), а также в нервно-мышечном соединении рака 68). Пресинаптическое торможение вызывает уменьшение количества медиатора, освобождаемого из возбуждающих нервных окончаний 68· 78· 79).
Глава 9. Основы прямой синоптической передачи |
185 |
Как показано на рис. 9.16, тормозным нерв в нервно-мышечном соединении рака не воздействует не только на мышечное волокно, но также и на возбуждающее окончание. Пресинаптический эффект длится короткое время, достигая максимума в течение нескольких миллисекунд и спадая практически до нуля в течение 6-7 мс. Максимальный тормозный эффект достигается в том случае, если нервный импульс приходит в тормозное пресинаптическое окончание за несколько миллисекунд до прихода потенциала действия в возбуждающее окончание. Влияние временной задержки между потенциалами действия в возбуждающем и тормозящем нервах на эффективность пресинаптического торможения показано на рис. 9.16. На частях А и В показаны возбуждающий и тормозный потенциалы, вызываемые стимуляцией соответствующих нервов по отдельности. На рис. 9.16С стимулируются оба нерва, но потенциал действия в тормозном нерве следует за потенциалом действия в возбуждающем нерве с задержкой в 1,5 мс — слишком поздно, чтобы оказать какой-либо тормозящий эффект. На рис. 9.16D, потенциал действия в тормозном нерве предшествует потенциалу действия в возбуждающем нерве и вызывает значительное уменьшение возбуждающего постсинаптического потенциала.
Пресинаптический и постсинаптический эффекты опосредованы одним и тем же нейромедиатором — гамма-аминомасляной кислотой (ГАМК), и связаны со значительным увеличением хлорной проводимости 80· 81). Было предположено, что при возрастании хлорной проводимости в мембране нервного окончания деполяризующий эффект входа ионов натрия во время восходящей фазы потенциала действия частично предотвращается одновременным входом ионов хлора. В результате происходит уменьшение амплитуды пресинаптического потенциала действия и количества освобождаемого медиатора. Было показано, что пресинаптическое торможение во многих синапсах млекопитающих происходит в результате ингибирования потенциалзависимых кальциевых каналов в окончаниях аксонов 82).
Функциональные значения пресинаптического и постсинаптического торможения в центральной нервной системе довольно сильно различаются. Постсинаптическое торможение уменьшает возбудимость клетки, делая ее менее чувствительной ко веем возбуждающим входам. Пресинаптическое торможение гораздо более специфично и направлено на определенный вход, давая клетке возможность интегрировать информацию из других входов 83). Пресинаптическое торможение предполагает, что тормозные аксоны устанавливают синаптический контакт с окончаниями возбуждающих аксонов. Наличие таких аксо-аксонных синапсов было показано с помощью электронной микроскопии в нервномышечном соединении рака 84) и в различных областях ЦНС млекопитающих 85). Более того, тормозные нервные окончания сами по себе могут подвергаться влиянию на пресинаптическом уровне 86); соответствующие ультраструктурные образования были обнаружены в тормозных синапсах рецептора растяжения рака87). Имеются также данные, свидетельствующие о существовании пресинаптического возбуждения, опосредованного синаптическими входами, которые увеличивают количество медиатора, освобождаемого из нервных окончаний 88).
Десенситизация
При многократной или длительной аппликации ответы, вызываемые нейромедиатором, уменьшаются; это явление получило название десенситизации Десенситизация в нервномышечном соединении была подробно охарактеризована в работах Катца и Теслева, которые показали, что при продолжительном воздействии АХ деполяризующий ответ в мышечном волокне постепенно уменьшается (рис. 9.17) 89). Десенситизация является молекулярным свойством самого АХ-рецептора 90). Однако, скорость десенситизации и восстановления рецептора модулируется фосфорилированием 91) - 93). В физиологических условиях Десенситизация не играет значительной роли в ответе мышечного волокна к АХ, освобождаемому из нервных окончаний 94). Однако, в мышце, которая обработана ингибиторами холинэстеразы (например, фосфороорганическими соединениями, используемыми в качестве инсектицидов и нервно-паралитических газов), продолжительное присутствие АХ в синаптической щели достаточно для того, чтобы вызвать десенситизацию и блокировать синаптическую передачу 95).
Глутаматные и ГАМК рецепторы также подвержены десенситизации 96). В синапсах центральной нервной системы, в которых глутамат и ГАМК участвуют в прямой химиче-
186 |
Раздел II. Передача информации в нервной системе |
ской передаче, десенситизация постсинаптических рецепторов развивается даже в нормальных физиологических условиях и является важным фактором, определяющим амплитуду и временной ход постсинаптических потенциалов 94· 97).
Рецепторы, которые опосредуют прямую и непрямую химическую передачу
Прямая химическая синаптическая передача опосредована ионными каналами в постсинаптической мембране, которые активируются при связывании нейромедиатора, освобождаемого пресинаптической клеткой. Такие лиганд-активируемые ионные каналы называются также ионотропными рецепторами. Основными медиаторами в прямых химических синапсах центральной нервной системы млекопитающих являются ГАМК, глицин и глутамат. ГАМК и глицин активируют рецепторы — анионные каналы, и, следовательно, являются тормозными медиаторами (глава 13). Глутамат — наиболее часто встречающийся медиатор возбуждения в ЦНС млекопитающих. Глутамат активирует несколько различных типов ионотропных рецепторов, селективных к катионам. Другими важными медиаторами в ЦНС млекопитающих, активирующих катион-селективные ионотропные рецепторы, являются ацетилхолин, серотонин и пурины.
Все перечисленные выше нейромедиаторы прямого действия, а также такие медиаторы, как дофамин, гистамин, норадреналин и нейропептиды, могут также воздействовать на постсинаптические клетки посредством весьма отличного механизма — непрямой химической передачи. Непрямая химическая синаптическая передача, как правило, опосредуется метаботропными рецепторами — постсинаптическими рецепторами, которые вызывают образование внутриклеточных вторичных посредников. Вторичные посредники, в свою очередь, оказывают влияние на активность ионных каналов, вызывая возбуждение или торможение, а также на другие внутриклеточные мишени. Следующая глава посвящена механизмам непрямой химической синаптической передачи.
Выводы
·Передача сигналов между нервными клетками и их мишенями происходит посредством химической и электрической синаптической передачи.
·Электрическая синаптическая передача опосредуется путем прямого протекания тока между клетками.
·В химических синапсах нейромедиатор, освобождающийся из пресинаптического нервного окончания, активирует рецепторы иа постсинаптической мембране; время, необходимое для освобождения медиатора, задает минимальную синаптическую задержку (около 1 мс).
·В случае прямой химической синаптической передачи постсинаптический рецептор, который активируется нейромедиатором, является в то же время ионным каналом. Такие лиганд-активируемые ионные каналы называются ионотропными рецепторами.
·В прямых возбуждающих синапсах, как, например, в нервно-мышечном соединении позвоночных, нейромедиатор (в этом случае АХ) открывает катион-селективные ионные каналы, которые позволяют передвижение ионов натрия, калия и кальция по их электрохимическим градиентам.
·Относительная проводимость через канал различных ионов определяет потенциал реверсии; в возбуждающих синапсах потенциал реверсии положителен по отношению к порогу потенциала действия.
·В случае прямого химического синаптического торможения нейромедиатор активирует анион-селективные каналы, которые позволяют ионам хлора перемещаться по их электрохимическому градиенту. Потенциал реверсии этих токов равен равновесному
хлорному потенциалу (ЕCl), который отрицателен по отношению к порогу потенциала действия.
·Многие рецепторы нейромедиаторов обладают способностью к десенситизации: их ответ уменьшается при часто повторяющемся или продолжительном воздействии медиатора.

Глава 9. Основы прямой синоптической передачи |
187 |
Рекомендуемая литература
Обзоры
оGalzi, J-L., Revah, F., Bessis, Α., and Changeux, J-P. 1991. Functional architecture of the nicotinic acetylcholine receptor: From electric organ to brain. Anna. Rev. Pharmacol. 31: 37-72.
оHille, B. 1992. Ionic Channels of Excitable Membranes, 2nd Ed. Smauer, Sunderland, MA.
оJones, M.V., and Westbrook, G. L. 1996. The impact of receptor desensitization on fast synaptic transmission.
Trends Neurosci. 19: 96-101.
оLester, H. A. 1992. The permeation pathway of neurotransmitter gated ion channels. Anna. Rev. Biophys. Biomol. Struct. 21: 267-292.
оLlinàs, R. 1985. Electrotonic transmission in the mammalian central nervous system. In M. V. L. Bennett and D. C. Spray (eds.), Gap Junctions. Cold Spring Harbor Laboratory, Cold Spring Harbor, NY, pp. 337-353.
оSalpeter, M. M. (éd.). 1987. The Vertebrate Neuro-muscular Junction. Alan R. Liss, New York.
Статьи
оCoombs, J.S., Eccles, J. C., and Fatt, P. 1955. The specific ionic conductances and the ionic movements across the motoneuronal membrane that produce ihe inhibitory post-synaptic potential. /. Physiol. 130: 326-373.
оdel Castillo, J., and Katz, B. 1955. On the localization of end-plate receptors. J. Physiol. 128: 157-181.
оDudel, J., and Kuffler, S. W. 1961. Presynaptic inhibition at the crayfish neuromuscular junction. /. Physiol. 155: 543-562.
оFatt, P., and Katz, B. 1951. An analysis of the end-plate potential recorded with an intra-cellular electrode. /. Physiol. 115: 320-370.
оFurshpan, E.J., and Potter, D. D. 1959. Transmission at the giant motor synapses of the crayfish. J. Physiol. 145: 289-325.
оKuffler, S.W., and Yoshikami, D. L975. The distribution of acetylcholine sensitivity at the post-synaptic membrane of vertebrate skeletal twitch muscles: lontophoretic mapping in the micron range. J. Physiol 244: 703730.
оMagleby, K. L., and Stevens, C. F. 1972. The effect of voltage on the time course of end-plate currents. / Physiol. 223:151-171.
оMartin, A. R., and Pilar, G. 1963. Dual mode of synaptic transmission in the avian ciliary ganglion. / Physiol. 168: 443-463.
оNeher, E., and Sakmann, B. 1976. Single channel currents recorded from membrane of denervated frog muscle fibres. Nature 260: 799-801.
оParadise, K., and Brehrn, P. 1998. Long-term desensitization of nicotinic acetylcholine receptors is regulated via protein kinase A mediated phosphory-lation. J. Neurosci. 18: 9227-9237.
оTakeuchi, A., and Takeuchi, N. 1960. On the permeability of the end-plate membrane during the action of transmitter. / Physiol. 154: 52-67.
оTakeuchi, A., and Takeuchi, N. 1966. On the permeability of the presynaptic terminal of the crayfish neuromuscular junction during synaptic inhibition and the action of y-aminobutyric acid. /. Physiol. 183: 433-449.
оTakeuchi, A., and Takeuchi, N. 1967. Anion permeability of the inhibitory post-synaptic membrane of the crayfish neuromuscular junction. /. Physiol. 191: 575-590.
Цитированная литература
1.Du Bois-Reymond, Ε. 1848. Untersuchungen uber thierische Electricitat. Reimer, Berlin.
2.Langley, J. N.. and Anderson, H. K. 1892. / Physiol. 13: 460-468.
3.Elliot, T.R. 1904. / Physiol. 31: (Proc.) xx-xxi.
4.Loewi, O. 1921. Pflugers Arch. 189: 239-242.
5.Feldberg, W. 1945. Physiol. Rev. 25: 596-642.
6.Dale, H. H. 1953. Adventures in Physiology. Perga-mon, London.
7.Dale, H. H., Feldberg, W., and Vogt, M. 1936. / Physiol. 86: 353-380.
8.Furshpan, E. J., and Potter, D. D. 1959. / Physiol. 145: 289-325.
9.Bennett, M.V. 1997. / Neurocytol. 26: 349-366. 10. Loewenstein, W. 1981. Physiol. Rev. 61: 829-913.
11.Llinàs, R. 1985. In Gap Junctions. Cold Spring Harbor Laboratory, Cold Spring Harbor, NY, pp. 337-353.
12.Grinnell, A.D. 1970. /. Physiol. 210: 17-43.
13.Baker, R., and Llinàs, R. 1971. / Physiol. 212: 45-63.
14.MacVicar, B.A., and Dudek, F. E. 1981. Science 213: 782-785.
15.McMahon, D. G. 1994. / Neurosci. 14: 1722-1734.
16.Baylor, D.A., and Nicholls, J.G. 1969. /. Physiol. 203: 591-609.
17.Acklin, S. E. 1988. / Exp. Biol. 137: 1-11.
18.Martin, A. R., and Pilar, G. 1963. / Physiol. 168: 443-463.

188 |
Раздел II. Передача информации в нервной системе |
19.Rovainen, С. М. 1967. / Neurophysiol. 30: 1024-1042.
20.Shapovalov, A. I., and Shiriaev, В. 1. 1980. / Physiol. 306: 1-15.
21.Nicholls, J. G., and Purves, D. 1972. J. Physiol. 225: 637-656.
22. Brodin, L., et al. 1994. / Neurophysiol. 72: 592-604.
23.Dityatev, A. E., and Clamann, H. P. 1996. / Neurophysiol. 76: 3451-3459.
24.Draguhn, A., et al. 1998. Nature 394: 189-192.
25.Brivanlou, I. H., Warland, D. K., and Meister, M. 1998. Neuron 20: 527-539.
26.Loewenstein, W. R. 1999. The Touchstone of Life. Oxford University Press, New York.
27.DeVries, S. H., and Schwartz, Ε. Α. 1989. / Physiol. 414: 351-375.
28.Hampson, E.C.G. M., Vaney, D. 1., and Weiler, R. 1992. /. Nearosci. 12: 4911-4922.
29.Silinsky, E. M., and Redman, R. S. 1996. / Pliysiol. 492: 815-822.
30.Heuser, J. E. 1989. Q. J. Exp. Physiol. 74: 1051-1069.
31.Eccles, J. C., and O'Connor, W. J. 1939. /. Physiol. 97: 44-102.
32.Eccles, J.C., Katz, В., and Kuffler, S.W. 1942. / Neurophysiol. 5: 211-230.
33.Lmg, G., and Gérard, R.W. 1949. J. Cell. Сотр. Physiol. 34: 383-396.
34.Fart, P., and Katz, B. 1951. J. Physiol. 115: 320-370.
35.Langley, J.N. 1907. / Physiol. 36: 347-384.
36.Nastuk, W.L. 1953. Fed. Froc. 12: 102.
37.del Castillo, J., and Katz, B. 1955. / Physiol. 128: 157-181.
38.Miledi, R. I960. / Physiol. 151: 24-30.
39.Dennis, M.J., Harris, A.J. and Kuffler, S.W 1971. Proc. R. Soc. Land. B 177: 509-539.
40.McMahan, U. J., Spitzer, N. C, and Peper, K. 1972. Proc. R. Soc. Lond. В 181: 421-430.
41.Betz, W. J., and Sakmann, B. 1973. J. Physiol. 230: 673-688.
42.Kuffler, S.W., and Yoshikami, D. 1975. J. Physiol. 244: 703-730.
43.Ravdin, P., and Axelrod, D. 1977. Anal. Biochem. 80: 585-592.
44.Burden, S.J., Sargent, PB., and McMahan, U.J. 1979. / Cell Biol. 82: 412-425.
45.Fertuck, H. C., and Salpeter, M. M. 1974. Proc. Natl. Acad. Sci. USA 71: 1376-1378.
46.Salpeter, M. M. 1987. In The Vertebrate Neuromus-cular Junction. Alan R. Liss, New York, pp. 1-54.
47.Heckmann, M., and Dudel, J. 1997. Biophys. J. 72: 2160-2169.
48.Jenkinson, D. H., and Nicholls, J. G. 1961. J. Physiol. 159: 111-127.
49.Takeuchi, A., and Takeuchi, N. 1959. J. Neuro-physiol. 22:395-411.
50.Magleby, K. L., and Stevens, С. F. 1972. / Physiol. 223: 151-171.
51.Takeuchi, Α., and Takeuchi, Ν. I960. J. Physiol. 154: 52-67.
52.Takeuchi, N. 1963. / Physiol. 167: 128-140.
53.Adams, D.J., Dwyer, T. M., and Hille, B. 1980 J Gen. Physiol. 75: 493-510.
M., and Hille, B. 1980 J Gen. Physiol. 75: 493-510.
54.Lassignal, N. L., and Martin, A. R. 1977. / Gen. Physiol. 70: 23-36.
55.Neher, E., and Sakmann, B. 1976. Nature 260: 799-802.
56.Dionne, V. E., and Leibowitz, M. D. 1982. Biophys. J. 39: 253-261.
57.Neher, E., and Steinbach, J. H. 1978. J. Physiol. 277: 153-176.
58.Galzi, J-L., et al. 1991. Annu. Rev. Pharmacol. 31: 37-72.
59.Lester, H. A. 1992. Annu. Rev. Biophys. Biomol. Struct. 21:267-292.
60.Niu, L., and Hess, G. P. 1993. Biochemistry 32: 3831-3835.
61.Niu, L., Abood, L.G., and Hess, G. P. 1995. Proc. Natl. Acad. Sci. USA 92: 12008-12012.
62.Dilger, J. P., et al. 1997. / Gen. Physiol. 109: 401-414.
63.Bouzat, C., and Barrantes, F. J. 1996. / Biol. Chem. 271: 25835-25841.
64.Dilger, J. P., Liu, Y, and Vidal, A. M. 1995. Eur. J. Anoesthesiol. 12:31-39.
65.Mishina, M-, et al. 1986. Nature 321: 406-411.
66.Grassi, F., et al. 1998. / Physiol. 508: 393-400.
67.Herlitze, S., et al. 1996. / Physiol. 492: 775-787.
68.Dudel, J., and Kuffler, S.W. 1961. / Physiol. 155: 543-562.
69.Takeuchi, A., and Takeuchi, N. 1967. J. Physiol. 191: 575-590.
70.Kuffler, S.W, and Eyzaguirre, C. 1955. J. Gen. Physiol. 39: 155-184.
71.Coombs, J. S., Eccles, J. C. and Fatt, P. 1955. J. Physiol. 130: 326-373.
72.Hille, B. 1992. Ionic Channels of Excitable Membranes, 2nd Ed. Sinauer, Sunderland, MA.
73.Gold, M.R., and Martin, A. R. 1983. / Physiol. 342:99-117.
74.Mladinic, M., et al. 1999. Proc. R. Soc. Land. B 266: 1207-1213.
75. Fatt, P., and Katz, B. 1953. / Physiol. 121: 374-389.
76.Frank, K., and Fuortes, M. G. F. 1957. Fed. Proc. 16: 39-40.
G. F. 1957. Fed. Proc. 16: 39-40.
77.Eccles, J.C., Eccles, R.M., and Magni, F. 1961. J. Pliysiol. 159: 147-166.
78.Kuno, M. 1964. / Physiol. 175: 100-112.
79.Rudomin, P. and Schmidt, R. F. 1999. Exp. Brain Res. 129: 1-37.

Глава 9. Основы прямой |
|
синоптической передачи |
189 |
80.Takeuchi, Α., and Takeuchi, Ν. 1966. /. Physiol. 183: 433-449.
81.Fuchs, P. Α., and Getting, P.
Α., and Getting, P. A. 1980. /. Neuro-physiol. 43: 1547-1557.
A. 1980. /. Neuro-physiol. 43: 1547-1557.
82.Wu, L.-G. and Saggau, P. 1997. Trends Neurosci. 20: 204-212.
83.Lomeli, J., et al. 1998. Nature 395: 600-604.
84.Atwood, H.L., and Morin, W.A. 1970. /. Ultra-struct. Res. 32: 351-369.
85.Schmidt, R. F. 1971. Ergeb. Physiol. 63: 20-101.
86.Nicholls, J. G., and Wallace, B. G. 1978. / Physiol. 281: 157-170.
87.Nakajima, Y, Tisdale, A. D'.', and Henkart, M. P. 1973. Proc. Natl. Acad. Sci. USA 70: 2462-2466.
88.Radclifle, K.A., et al. 1999. Ann. N. Y. Acad. Sci. 868: 591-610.
89.Katz, В., and TheslefC, S. 1957. J. Physiol. 138: 63-80.
90.Auerbach, A., and Akk, G. 1998. / Gen. Physiol. 112: 181-197.
91.Huganir, R. L., and Greengard, P. 1990. Neuron S: 555-567.
92.Hardwick, J.C., and Parsons, R. L. 1996. /. Neu-rophysiol. 76: 3609-3616.
93.Paradiso, K., and Brehm, P. 1998. /. Neurosci. 18: 9227-9237.
94.Jones, M.V., and Westbrook, G. L. 1996. Trends Neurosci. 19: 96-101.
95.Magleby, K. L., and Pallotta, B. S. 1981. /. Physiol. 316: 225-250.
96.Dudel, J., Adelsberger, H., and Heckmann, M. 1997. Invertebr. Neurosci. 3: 89-92.
97. Trussell, L. O. 1999. Annu. Rev. Physiol. 61: 477-496.
Глава 10 Механизмы непрямой синаптической передачи
Нейромедиаторы связываются с метаботропными рецепторами, которые посредством цитоплазматических или связанных с мембраной вторичных посредников влияют на активность ионных каналов и транспортеров. Во многих синапсах в центральной и вегетативной нервной системе синаптическая передача осуществляется исключительно за счет таких непрямых механизмов. В ряде других синапсов непрямые механизмы модулируют прямую синаптическую передачу.
Непрямая синаптическая передача часто опосредуется рецепторами, связанными с G-белками. G-белки, названные так потому, что они связываются с гуаниновыми нуклеотидами, состоят из трех субъединиц: α/0, β и γ. Активация рецептора вызывает диссоциацию α1-и βγ-1субъединиц. В свободном состоянии субъединицы связываются с внутриклеточными мишенями и модулируют их активность. Некоторые субъединицы G-белка связываются с ионными каналами, вызывая сравнительно кратковременные эффекты. Например, G-белок активируется при связывании АХ с мускариновыми рецепторами на клетках синатриального узла сердца. Освобождающаяся при этом βγ-субъединица связывается с калиевым каналом и вызывает его открывание, что приводит к урежению сердцебиений.
Вторым механизмом действия G-белков является активация ферментов, которые вызывают образование внутриклеточных посредников. Примером такого механизма является активация G-белков в кардиомиоцитах при связывании норадреналина с β-адренорецепторами. Активированные α- и βγ-субъединицы стимулируют фермент аденилатциклазу. Образующийся в результате циклический АМФ активирует другой фермент — цАМФзависимую протеинкиназу, которая модулирует активность ионных каналов и ферментов путем их фосфорилирования. Эти ответы могут длиться от нескольких секунд до нескольких часов и часто могут продолжаться длительное время после того, как взаимодействие медиатора с рецептором заканчивается. Такие механизмы обеспечивают значительное усиление сигнала.
Главными мишенями непрямого действия медиаторов являются калиевые и кальциевые каналы. Непрямое действие медиаторов может вызывать открывание или закрывание каналов, а также изменение их потенциалзависимости. Так, путем непрямого действия медиаторы открывают калиевые каналы в клетках синатриального узла сердца, ингибируют кальциевые каналы N-типа в симпатических нейронах и увеличивают вероятность открывания кальциевых каналов в кардиомиоцитах при деполяризации. Модуляция ионных каналов в пресинаптических нервных окончаниях приводит к изменениям в процессе освобождения медиаторов, а в постсинаптических клетках — к изменению спонтанной активности нейронов и ответов, вызываемых синаптическими входами.
Помимо прямых механизмов синаптической передачи, которые были рассмотрены в главе 9, медиаторы также действуют непрямым образом, связываясь с рецепторами, которые сами по себе не являются ионными каналами. Такие рецепторы в свою очередь модифицируют активность ионных каналов, ионных транспортеров и рецепторных белков (рис. 10.1). Непрямые механизмы называют также «медленными» или «связанными с внутриклеточными посредниками». Многие рецепторы непрямого действия вызывают свои эффекты посредством взаимодействия с ГТФ--связываюшими белками (G-белкамн) 1) и называются также метаботропиыми рецепторами. В некоторых синапсах, как, например, в синапсах между симпатическими нейронами и мышечными волокнами в сердце 2) или между фоторецепторами и определенными биполярными клетками в сетчатке 3), синаптическая передача происходит исключительно через непрямые механизмы. В других синапсах непрямые механизмы могут модулировать эффективность прямой синаптической
Глава 10. Механизмы непрямой синаптической передачи |
191 |
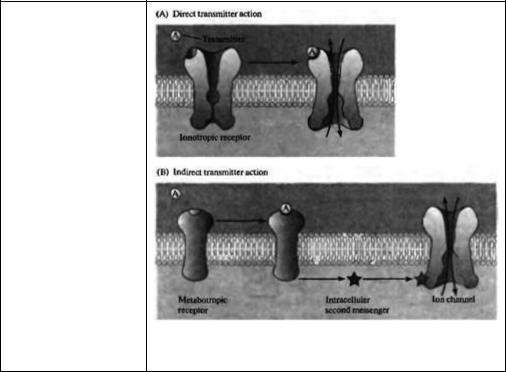
Рис. 10.1. Прямое и непрямое действие медиаторов. (А) В прямом химическом синапсе медиатор связывается с ионотропным рецептором. Ионотропные рецепторы — это лиганд-активируемые ионные каналы. (В) Медиаторы непрямого действия связываются с метаботропными рецепторами. Метаботропные рецепторы сами по себе не являются ионными каналами. Они активируют внутриклеточные пути сигнализации с вовлечением вторичных посредников, которые влияют на открывание и закрывание ионных каналов.
Fig. 10.1. Direct and Indirect Transmitter Action. (A) At direct chemical synapses the transmitter binds to an lonotropic receptor, lonotropic receptors are ligandactwated ion channels. (B) Indirectly acting transmitters bind to metabotropic receptors. Metabotropic receptors are not themselves ion channels, but rather activate intracellular second messenger signaling pathways that influence the opening and closing of ion channels.
передачи (глава 16), что называется процессом нейромодуляции. В этой главе мы сначала рассмотрим структуру и функции метаботропных рецепторов и G-белков. Затем мы рассмотрим примеры синаптических взаимодействий, которые они могут опосредовать. Мы увидим, что метаботропные рецепторы, действуя через G-белки, влияют на огромное количество механизмов внутриклеточной сигнализации, значительно модифицируя нейрональную активность на несколько секунд, минут, часов и даже на еще более длительное время.
§ 1. Метаботропные рецепторы и G-белки
Структура метаботропных рецепторов
Связанные с G-белками метаботропные рецепторы составляют суперсемейство мембранных белков, характеризующихся семью трансмембранными доменами с внеклеточным аминным концом и карбоксильным внутриклеточным концом (рис. 10.2) 4). В настоящее время идентифицировано более тысячи различных метаботропных рецепторов. Некоторые из них активируются ацетилхолином (мускариновые холинэргические рецепторы), другие связываются с норадреналином (α- и β- адренорецепторы), ГАМК, 5-НТ, дофамином, пуринами; есть метаботропные рецепторы, которые активируются светом (родопсин) (глава 19), запахами — одорантами (глава 17), а также протеазами.
Биохимические, структурные и генетические эксперименты выявили несколько различных способов связывания лиганда, каждый из которых приводит к одинаковому изменению структуры α-геликальной области, которая формирует трансмембранную часть рецептора (рис. 10.2). Участки второй и третьей цитоплазматических петель, а также примембранный участок карбоксильного окон-
192 |
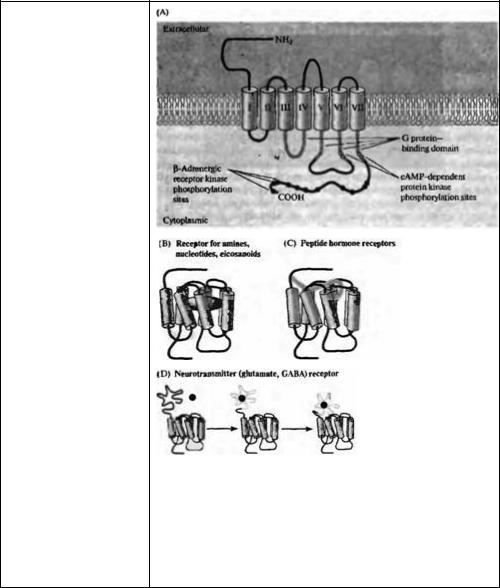
Раздел II. Передача информации в нервной системе |
Рис. 10.2. Метаботропные рецепторы. (А) Метаботропные рецепторы имеют сень трансмембранных доменов, внеклеточный аминный конец и
внутриклеточный |
|
|
карбоксильный |
|
конец. |
Вторая |
и |
третья |
цитоплазматические |
петли, а |
|
также примембранныи участок
внутриклеточного |
конца |
||
образуют место |
связывания |
с |
|
соответствующим |
G-белком. |
||
Фосфорилирование |
нескольких |
||
оснований |
на |
третьей |
|
цитоплазматической |
петле |
и |
|
карбоксильном |
|
конце |
|
(например, цАМФ зависи мой протеинкиназои) вызывает десенситизацию рецептора. Фосфорилирование карбоксильного конца G- белокзависимыми рецептор киназами (GRKs), например, β- адренорецептор-киназой (βARK), также вызывает десенситизацию рецептора, связывание белка аррестина и прекращает ответ. (В) Места связывания аминов, нуклеотидов и эйкозаноидов образуются участками трансмембранных доменов. (С) В рецепторах пептидных гормонов участок связывания лиганда находится на наружной части трансмембранных доменов. (D) В метаботропных рецепторах глутамата и ГАМК место связывания лиганда находится на наружном N-конце.
Fig. 10.2. Metabotropic or G Protein-Coupled Transmitter Receptors. (A) Indirectly coupled transmitter receptors have seven transmembrane domains, an extracellular ammo terminus, and an intracellular carboxy terminus. The second and third cytoplasmic loops, together with the ammo terminal region of the intracellular tail mediate binding to the appropriate G protein.
1
Phosphorylation of sites on the third cytoplasm loop and the carboxy terminus by second messenger-related kinases, such as cAMP-dependent protein kinase, causes receptor desensitization. Phosphorylation of sites on the carboxy terminus by G protein coupled receptor kinases (GRKs), such as β-adrenergic receptor kinase (βARK), causes receptor desensitization, binding of the protein arrestin, and termination of the response. (B) Portions of the transmembrane domains form the ligand-bindmg sites of metabotropic receptors that bind amines, nucleotides, and eicosanoids. (C) Ligands bind to the outer portions of the transmembrane domains of peptide hormone receptors. (D) The ammoterminal tail forms the ligand-bindmg domain of metabotropic receptors for glutamate and GABA (After Ji, Grossmann, and Ji, 1998.)
чания участвуют в связывании и активации соответствующих G-белков 5, 6).
Структура и функция G-белков
G-белки, названные так по их способности связываться с гуаниновыми нуклеотидами, являются тримерами, состоящими из трех субъединиц: α, β и γ (рис. 10.3) 7). Существует большое количество разновидностей каждой из субъединиц (20 α, 6 β, 12 γ). что создает основу для огромного количества их комбинаций. G-белки разделяются на четыре основных группы по структуре и мишеням их α-субъединиц: Gs стимулирует аденилатциклазу; Gi интибирует аденилатциклазу; Gq связывается с фосфолипазой С; мишени С12 пока не известны. Семейство Gi включает Gt
