
Nikolls_-_Ot_neyrona_k_mozgu
.pdf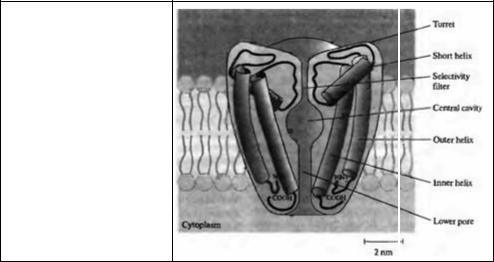
Глава 3. Структура ионных каналов |
63 |
Рис. 3.7. Структура калиевого кана ла. Поперечный срез калиевого канала К А типа, показывающий две из четырех субъединиц. Каждая субъединица имеет две трансмембранных спирали и короткую спираль, обращенную в пору. Петли, идущие от короткой спирали, образуют селективный фильтр канала.
Fig. 3.7. Potassium Channel Structure. Sectional view of a KSCA potassium channel showing two of four subumts, one on either side of the central pore. Each subunit has two membrane-spanning helices and a short helix pointing into the pore. The connections between the outer helices and the short helices of the four subunits form four turrets that surround the pore entrance and contain binding sites for blocking molecules. The four connections between the short helices and the inner helices combine to form the selectivity filter, which allows the permeation of potassium, cesium, and rubidium but excludes smaller cations such as sodium and lithium. (After Doyle et al., 1998.)
ду наружной и короткой спиралями образуют четыре возвышения, окружающие наружное отверстие поры и содержащие связывающие сайты для TEA и других блокирующих канал токсинов 53). В каждой субъединице петля между центральным концом короткой спирали и внутренней спиралью формирует структуру ионной поры. Четыре такие петли, объединяясь, образуют узкий проход, ответственный за ионную избирательность канала — селективный фильтр. Относительно большая центральная полость и нижняя внутренняя пора соединяют селективный фильтр с цитоплазмой.
Избирательность для калия достигается как размером, так и молекулярным строением селективного фильтра. Диаметр фильтра составляет около 0,3 нм и аминокислоты в его стенке ориентированы таким образом, что последовательные кольца, образованные четырьмя карбоксильными группами (по одной от каждой субъединицы), обращены внутрь поры. Диаметр поры достаточен для прохождения дегидратированного иона калия (диаметром около 0,27 нм). Следует заметить, что дегидратация проникающего иона могла бы потребовать значительной энергии (глава 2). Однако этот фактор минимизируется за счет кислорода стенки канала, который заменяет атомы кислорода воды в гидратированной молекуле. Ионы меньшего размера, такие как натрий (диаметр 0,19 нм) или литий (диаметр 0,12 нм), не способны проникнуть через калиевый канал, поскольку они не могут сформировать достаточно плотный контакт одновременно со всеми четырьмя кислородами, поэтому они остаются гидратированными. Ионы большего размера, такие как цезий (диаметр 0,33 нм), не могут проникнуть через пору из--за своих размеров. Эти структурные основы ионной избирательности вполне согласуются с традиционными воззрениями на ионную проницаемость каналов56).
Исследователи надеются, что метод рентгеновской дифракции сможет обеспечить новыми данными о пока еще малоизученных структурных изменениях, происходящих при открытии ворот калиевого канала. Например, загадкой является локализация ворот, поскольку в калиевых каналах Shaker приложенные с цитоплазматической стороны вещества имеют при открытом канале свободный доступ вглубь поры, хотя тогда, когда каналы закрыты, они могут проникать внутрь канала только на очень короткую дистанцию. Следовательно, ворота должны находиться совсем рядом со входом, с цитоплазматической стороны ионной поры57).
64 |
Раздел II. Передача информации в нервной системе |
§ 4. Другие каналы
Помимо перечисленных ранее, в нейронах имеется еще довольно много иных ионных каналов, принципиально важных для функционирования нервной системы. Для многих из этих каналов были определены детали их молекулярного устройства. Среди них представлено семейство глутамат-активируемых каналов, семейство АТФ-активируемых каналов и многие другие. Клонированы представители большого семейства потенциал-активируемых хлорных каналов, а также определены аминокислотные последовательности субъединиц, формирующих потенциал-чувствительные калиевые каналы внутреннего выпрямления. Кроме того, установлены структуры ионных каналов, активируемых внутриклеточными лигандами.
Главной закономерностью, установленной к настоящему времени, является то, что для формирования ионного канала необходим, как правило, ансамбль четырех или более белковых субъединиц (или в случае потенциал-активируемых натриевых и кальциевых каналов — наличие четырех повторяющихся доменов одного белка). Во многих случаях реальное число субъединиц, образующих канал, зачастую остается неизвестным, хотя для потенциалчувствительных каналов и катионных каналов, активируемых внутриклеточными лигандами, предполагается тетрамерная структура. В отличие от этого, для каналов, активируемых внеклеточными лигандами, общепринятым считается наличие пяти субъединиц. Далее приведены некоторые примеры таких каналов.
Потенциал-активируемые хлорные каналы
Впервые потенциал-акта внруемые хлорные каналы были клонированы из электрического органа Torpedo58). Известные как CLC-0 каналы, они с высокой плотностью экспрессированы в неиннервированной части клеток этого органа, предоставляя собой низкоомный путь распространения токов, генерируемых в иннервированной области клетки. Ген, кодирующий CLC-0, обнаружен также в мозге млекопитающих и относится к большому семейству, которое включает, по меньшей мере, восемь других гомологичных генов59). CLC-1 хлорные каналы, найденные в скелетной мышце млекопитающих, вносят ведущую роль в проводимость мембраны мышечных
волокон. В частности, они стабилизируют заряд мембраны на уровне потенциала покоя. CLC-2 каналы ассоциированы с регуляцией объема клетки и обладают чувствительностью к растяжению мембраны. Две другие изоформы хлорных каналов, CLC-K1 и CLC-K2, отвечают за реабсорбцию хлорида в почках.
До сих пор остаются некоторые неясности в трансмембранной топологии хлорных каналов CLC, что в значительной мере зависит от различной трактовки гидропатического анализа аминокислотной последовательности белка канала 60). CLC каналы состоят из 13 гидрофобных доменов, 11 из которых с высокой вероятностью расположены внутри мембраны (рис. 3.8). Особенностью этих хлорных каналов является наличие протяженного гидрофобного участка D9-D10, конфигурация которого в мембране пока неизвестна. Экспериментальные данные позволяют предположить, что CLC-0 функционирует в мембране как димер, необычным свойством которого является то, что каждая субъединица формирует в мембране свой собственный независимый канал 61).
Калиевые каналы внутреннего выпрямления
Калиевые каналы внутреннего выпрямления (Kir каналы) обеспечивают движение ионов калия в клетку тогда, когда мембранный потенциал отрицателен по отношению к равновесному потенциалу калия, хотя они практически не поддерживают движения калия наружу клетки. Имеется по крайней мере пять подсемейств канала Kirl—КiГ5, обнаруженных в мозге, сердце и почках 62· 63). Одно семейство, Кir3, формирует каналы, активируемые внутриклеточными G- белками (глава 10). Эти каналы могут быть заблокированы внутриклеточным магнием и/или внутриклеточными полиаминами. Предполагаемая структура субъединиц Kir (рис. 3.8В) подобна таковой у канала KCSA с двумя трансмембранными доменами. Магний-связывающий сайт, блокирующий активность Kir каналов, располагается предположительно на М2 домене в области цитоплазматического конца канала.
АТФ-активируемые каналы
Аденозин-5'-трифосфат (АТФ) выполняет функцию нейротрансмиттера в гладкомышечных клетках, в клетках автономных ганглиев и в нейронах центральной нервной

Глава 3. Структура ионных каналов |
65 |
Рис. 3.8. Примеры отдельных типов каналов. (А) Белок потенциал активируемого хлорного канала предположительно имеет 11 трансмембранных участка. Димеры этого канала в мембране образуют два независимых канала. (В) Вторичная структура калиевого канала входного выпрямления с двумя трансмембранными доменами петлей, образующей пору. Полный канал, по-видимому, тетрамер (С) Структура АТФ рецептора сходная со структурой канала входного выпрямления. (D) Субъединица глутаматного рецептора с тремя трансмембранными спиралями и образующая пору петля, исходящая с цитоплазматической стороны. Полный канал, по-видимому, пентамер. (Е) Строение субъединицы канала, активируемого цАМФ или цГМФ, подобно строению потенциал активируемого калиевого канала (рис. 3.6) Полный канал, по-видимому, тетрамер.
Fig. 3.8. Examples of Distinctive Types of Channels. (A) The voltage-activated chloride channel protein is thought to have 11 membrane-spanning regions; the arrangement of segment D9-D10 is not known. The protein is believed to assemble in the membrane as a dimer to form a "double-barreled" channel structure. (B) Proposed secondary structure of a subunit of the inward-rectifying potassium channel, with two membrane-spanning regions and a porelining loop. The complete channel is assumed to be a tetramer. (C) The subunit structure of receptors for ATP appears similar to that of the inward rectifier. (D) Glutamate receptor subunits are believed to have three transmembrane helices and a pore-forming loop entering the channel from the cytoplasmic side. The complete receptor is thought to be a pentamer. (E) The subunit structure of channels activated by cyclic AMP or cyclic GMP is similar to that of voltage-activated potassium channels (see Figure 3.6C). Complete channels are assumed to be tetramers.
системы 64, 65). Так как АТФ является пурином, его рецепторные молекулы известны как пуринергические рецепторы. Один из них Р2Х рецептор, лиганд-активируемый катионный канал. Клонировано семь субъединиц Р2Х рецептора (Р2Х1-Р2Х7) 66). Их предполагаемая третичная структура (рис. 3.8С) с двумя трансмембранными участками подобна таковой у субъединиц канала KCSA.
Глутаматные рецепторы
Глутамат является наиболее важным и наиболее распространенным возбуждающим нейротрансмиттером центральной нервной систе-
66 |
Раздел II. Передача информации в нервной системе |
мы, активирующим, по меньшей мере, три типа катионных каналов. Все три типа рецепторноканальных комплексов обладают различными функциональными свойствами и отличаются друг от друга по чувствительности к разным аналогам глутамата 67). Один из рецепторов, называемый NMDA-рецептор, избирательно отвечает на N-methyl-D-aspartate (NMDA). Два других рецептора активируются соответственно АМРА (α-amino3-hydroxy-5-methyl-4-isoxazole propionic acid) или каинатом. Благодаря избирательности, три этих агониста (NMDA, АМРА, каинат) являются важными экспериментальными инструментами для селективной активации соответствующего типа глутаматного рецептора. При этом следует помнить, что естественным трансмиттером для всех трех типов рецепторов является только глутамат, но не его аналоги.
Молекулярное клонирование позволило идентифицировать кДНК для 16 субъединиц глутаматного рецептора. Пять из этих субъединиц, названные NR1 и NR2, могут принимать участие в формировании NMDA-рецептора. АМРА-рецепторы сформированы другими типами субъединиц, обозначаемых как GluRA-GluRD (или GluRl-GluR4). Каинатные рецепторы собраны из субъединиц КА1 и/или КА2 в комбинации с GIuR5, 6 или 7. Для двух гомологичных субъединиц глутаматного рецептора, δt и δ2, принадлежность к какому-либо отдельному рецептору остается пока не установленной. По аналогии с никотиновым АХР считается, что глутаматные каналы являются также пентамерами, хотя на этом подобие между ними заканчивается Аминокислотная последовательность субъединиц глутаматного рецептора 68) - 70) примерно вдвое длиннее таковой суперсемейства, включающего АХР, 5-НТ3, ГАМК и глициновые рецепторы. Кроме того, между двумя этими суперсемействами практически нет гомологии.
Поскольку субъединицы глутаматного рецептора имеют четыре трансмембранных сегмента, поначалу считали, что они располагаются в мембране так же, как у АХР (см. рис. 3.3). Однако последние данные позволяют представить строение глутаматных каналов так, как это изображено на рис. 3.8D. Согласно этому представлению, второй сегмент вступает в мембрану с цитоплазматической стороны, образуя петлю-шпильку, выстилающую пору. Эта уникальная для глутаматного рецептора конфигурация подтверждается и данными мутагенеза данной петли ионного канала 72).
Каналы, активируемые циклическими нуклеотидами
Рецепторы сетчатки и обонятельного эпителия активируются внутриклеточным циклическим АМФ или циклическим ГМФ 73, 74). Рецепторы формируют ионные каналы, с различной избирательностью для калия, натрия или кальция. Аминокислотная последовательность субъединиц нуклетид-активируемых ионных каналов имеет некоторую гомологию с субъединицами потенциал-чувствительных каналов. Предполагаемая структура каналов (рис. 3.8Е) включает шесть трансмембранных участков, что хорошо согласуется с гидропатическими индексами этих белков. Участок S4 представлен регулярно повторяющимися заряженными остатками, хотя число их ниже, чем у потенциалчувствительных каналов. В соответствии с активацией внутриклеточными лигандами, большая часть массы белка канала находится на цитоплазматической стороне мембраны. Наиболее вероятной формой объединения субъединиц является тетрамер.
§ 5. Разнообразие субъединиц
Характерной особенностью ионных каналов является широкое разнообразие изоформ субъединиц. Существует больше дюжины вариантов субъединиц никотинового АХР и еше большее число субъединиц калиевого канала и глутаматного рецептора. Как возникает такое разнообразие? В основе этого лежит прежде всего то, что каждый канал или субъединица канала кодированы отдельным геном. Кроме того, установлены два других механизма, приводящих к появлению субъединиц с различающими свойствами.
Во-первых, это альтернативный сплайсинг. Большинство белков кодированы в различных сегментах ДНК, так называемых экзонах. В некоторых случаях экзоны вместо комбинации в единственный вариант мРНК, контролирующий синтез специфической субъединицы, образуют различные альтернативные комбинации, что приводит к созданию мРНК для множественных изоформ субъединиц. Во время транскрипции неизвестный регулирующий механизм определяет, какая из альтернативных мРНК будет использована для синтеза
Глава 3. Структура ионных каналов |
67 |
белка. Остаток исключается из транскрипта и оставшиеся сегменты РНК соединяются, формируя конечную мРНК. Например, именно таким путем образуются изоформы калиевого канала типа Shaker.
Второй способ достижения разнообразия субъединиц — редактирование РНК. Примером являются субъединицы глутаматных рецепторов GluRB, GluR5 и GluR6. Эти субъединицы в середине второго трансмембранного сегмента содержат либо глютаминовый, либо аргининовый остаток (рис. 3.8D). Присутствие аргинина устраняет кальциевую проницаемость ионного канала и уменьшает его проводимость. Таким образом, хотя ДНК всех трех субъединиц для этого сайта содержит глютаминовый кодон (CAG), на уровне мРНК, в соответствующем участке может появиться кодон для аргинина (CGG)75). Это изменение в базовой последовательности нуклеиновых кислот достигается редактированием РНК в ядре клетки. Таким образом, например, редактируется процесс синтеза GluRB и отчасти синтез GluR5 и GluR6. В GluR6 дополнительное редактирование A/G найдено в первом трансмембранном сегменте 76).
Заключение
Современными методами биохимии, молекулярной и клеточной биологии, электронной микроскопии, электронной и рентгеновской дифракции получена детальная информация о молекулярной организации и структуре каналов и рецепторов. Мы знаем, например, что каналы образованы четырьмя или более субъединицами или доменами, собранными в определенном порядке вокруг центральной поры. Каждая субъединица или домен включает, в свою очередь, от двух до шести трансмембранных участков, объединенных вне- и внутриклеточными петлями. Ансамбль, состоящий из субъединиц, составляет структуру, достаточную, чтобы на адекватный сигнал образовать пору, пропускающую ионы. Каналы, являющиеся относительно избирательными, такие как потенциал-зависимые каналы, обычно представляют собой тетрамеры; более крупные и менее избирательные лиганд-активируемые каналы являются пентамерами. Как продолжение этого принципа наиболее крупные каналы — щелевые контакты — имеют гексамерную структуру (глава 7). Для некоторых каналов до сих пор остается неясной функциональное предназначение
ряда трансмембранных участков субъединиц. Однако имеется несколько примеров, в которых функция отдельных участков достаточно твердо установлена. Например, четко доказано, что М2 участок субъединиц суперсемейства АХР формирует стенку ионной поры и воротный механизм. Рентгеновская дифракция выявила структурную основу ионной избирательности калиевых каналов. Этот результат может быть экстраполирован на другие каналы, имеющие подобные первичные последовательности, такие как потенциал-зависимые каналы, каналы внутреннего выпрямления, каналы, активируемые циклическими нуклеотидами, и каналы, активируемые АТФ. Большинство исследователей считает, что трансмембранные участки каналов представляют собой α-спирали. Структурные исследования подтвердили это предположение для KCSA канала, но не для никотинового АХР, у которого М2 сегмент представлен более крупной β-спиралью.
Внемембранные петли, соединяющие трансмембранные участки, обеспечивают ряд специфических функций, наиболее важной из которых является формирование центров связывания внутриклеточных и внеклеточных лигандов, регулирующих функции канала. Кроме того, накопление ионов во внемембранных устьях канала помогает регулировать ионную избирательность и повышает проводимость канала. Многие детали молекулярного устройства каналов остаются невыясненными, но, вооруженные современными техническими возможностями, мы можем надеяться на быстрый прогресс наших знаний о молекулярной основе функционирования нервной системы.
Выводы
·Никотиновые ацетилхолиновые рецепторы электрического органа Torpedo состоят из пяти субъединиц (две α и три другие, обозначаемые βγ *и δ), группирующихся вокруг центральной поры, α-субъединицы содержат связывающие сайты для АХ.
·В каждой субъединице АХ рецептора имеется четыре трансмембранных участка (ΜΙ— Μ4), объединенных внутри- и внеклеточными петлями. Показано, что М2 участок белка формирует пору ионного канала.

68 |
Раздел II. Передача информации в нервной системе |
·Из нервной системы выделены одиннадцать отдельных субъединиц никотинового АХ
рецептора, восемь из которых имеют сайты, связывающие АХ (и обозначаемые как α2—α9), и
три других обозначаются β2-β4· Большинство комбинаций α-β-субъединиц могут формировать функциональные каналы, способные отвечать на АХ.
·Субъединицы рецепторов γ-аминомасляной кислоты (ГАМК), глицина и серотонина (5-НТ) аналогичны по структуре субъединицам АХ рецептора. Вместе четыре этих семейства рецепторов образуют суперсемейство, имеющее общее генетическое происхождения.
·Потенциал-активируемый натриевый канал электрического органа угря является одиночной молекулой, состоящей из 1 800 аминокислот. Этот канал имеет четыре крупных повторяющихся домена (I-1V). Домены являются архитектурными эквивалентами субъединиц других каналов; внутри каждого имеется шесть трансмембранных участков (S1S6), соединенных внутри- и внеклеточными петлями. Натриевый ионный канал угря является прототипом разнообразных изоформ этого канала, представленных в мышцах и мозге.
·Семейство потенциал-активируемых кальциевых каналов аналогично по структуре натриевому каналу. Потенциал-активируемые калиевые каналы структурно подобны натриевым и кальциевым каналам, но с важным отличием: у них четыре повторяющихся домена экспрессированы как отдельные субъединицы, а не как повторяющиеся домены одной молекулы. Существует по меньшей мере 20 генов, контролирующих экспрессию субъединиц калиевого канала. Калиевые каналы группируются в четыре отдельных подсемейства. Потенциал-активируемые натриевый, кальциевый и калиевый каналы составляют вместе единое суперсемейство.
·Субъединицы других лиганд- и потенциал-активируемых ионных каналов значительно различаются как размерами, так и аминокислотным составом. Некоторые имеют сходство с субъединицами потенциал-активируемых каналов, но большинство заметно отличаются от представителей как потенциал-, так и АХ-активируемых каналов. Некоторые имеют только два или три трансмембранных домена, а другие могут иметь больше 10 таких доменов.
Рекомендуемая литература
оAkabas, M. H., Kauflhian, C., Archdeacon, P., and Karlin, A. 1994. Identification of acetylcholme receptor channel-linning residues in the entire M2 segment of the α subunit. Neuron 13: 919-927.
оDoyle, D. A., Cabrai, J. M., Pfeutzner, A. K.,Gulbis, J. M., Cohen, S. L., Chait, B.T., and McKinnon, R. 1998. The structure of the potassium channel: Molecular basis of K+ conduction and selectivity. Science 280: 69-77.
оHille, B. 1992. Ionic Channels in Excitable Membranes, 2nd Ed. Sinauer Associates, Sunderland, MA, pp. 236258, 423-444.
оLevinson, S. R. 1998. Structure and mechanism of voltage-gated ion channels. In N.Sperelakis (éd.),
Cell Physiology Source Book, 2nd Ed. Academic Press, San Diego, CA, pp. 406-428.
оMcGehee, O.S., and Role, L.W. 1995. Physiological diversity of nicotinic acetylchnline receptors expressed by vertebrate neurons. Annu. Rev. Physiol. 57: 521-546.
оMiller, C. 1992. Hunting for the pore of voltage-gated channels. Curr. Biol. 2: 573-575.
оUnwin, N. 1993. Nicotinic acetylcholine receptor at 9À resolution. J. Mol. Biol. 229: 1101-1124.
оUnwin, N. 1995. Acetylcholine receptor imaged in the open state. Nature 373: 37-43.
Цитированная литература
1.Tank, D. W., et al. 1983. Proc. Nail. Acad. Sci. USA 80:5129-5133.
2.Wise, D. S., Schoenborn, B. P., and Karlin, A. 1981. J. Biol. Chem. 256: 4124-4126.
3.Unwin, N.. Toyoshima, C., and Kubalek, E. 1988. J. Cell Biol. 107: 1123-1138.
Cell Biol. 107: 1123-1138.
4.Toyoshima, C., and Unwin, N. 1988. Nature 336: 247-250.

Глава 3. Структура ионных каналов |
69 |
5.Maeno, T., Edwards, С, and Anraku, M. 1977. У. Neurobiol. 8: 173-184.
6.Dwyer, T. M., Adams, D.J., and Hille, В. 1980. У. Сет). Physiol. 75: 469-492.
7.Raftery, M. Α., et al. 1980. Science 208: 1454-1457.
8.Noda, M., et al. 1982. Nature 299: 793-797.
9.Noda, M., et al. 1983. Nature 301: 251-255.
10.Noda, M., et al. 1983. Nature 302: 528-532.
11.McCrea, P. D., Popot, J-L., and Engleman, D. M. 1987. EMBO У. 6:3619-3626.
12.DiPaola, M., Czajkowski, C., and Karlin, A. 1989. У. ВЫ. Chem. 264: 15457-15463.
13.Miledi, R, Parker, I., and Sumikawa, K. 1983. Proc. R. Soc. Lond. В 218: 481-484.
14.Takai, T., et al. 1985. Nature 315: 761-764.
15.Mishina, M., et al. 1986. Nature 321: 406-411.
16.Leonard, R. J., et al. 1988. Science 242: 1578-1581.
17.Akabas, M. H., et al. 1994. Neuron 13: 919-927.
18.Unwin, N. 1993. У. Mol. ВЫ. 229: 1101-1124.
19.Unwin, N. 1995. Nature 373: 37-43.
20.Wilson, G. G., and Karlin, A. 1998. Neuron 20: 1269-1281.
21.Orteils, M. O., and Lunt, G. G. 1995. Trends Neu-rosci. 18: 121-127.
22.Colquhoun, L. M., and Patrick, J.W. 1997. Adv. Pharmacol. 39: 191-220.
23.McGehee, D. S., and Rôle, L. W. 1995. Annu. Rev. Physiol. 57: 521-546.
24.Cooper, Ε., Couturier, S., and Ballivet, M. 1991. Nature 350: 235-238.
25.Sieghart, W. 1995. Pharmacol. Rev. 47: 181-234.
26.McKernan, R. M., and Whiting, P.J. 1996. Trends Neurosci. 19: 139-143.
27.Bormann, J., and Feigenspan, A. 1995. Trends Neurosci. 18: 515-519.
28.Kuhse, J., Betz, H., and Kirsch, J. 1995. Cuir. Opin. Neurobiol. 5: 318-323.
29.Yakel, J. L, and Jackson, M. B. 1988. Neuron 1: 615-621.
30.Maricq, A.V., et al. 1991. Science 254: 432-437.
31.Orteils, M. O., and Lunt, G. G. 1995. Trends Neurosci. 18: 121-127.
32.Unwin, N. 1989. Neuron 3: 665-676.
33.Miller, J., Agnew, W. S., and Levinson, S. R. 1983. Biochemistry 22: 462-470.
34.Hartshorn, W. Α., and Catterall, W. A. 1984. У. Biol. Chem. 259: 1667-1675.
35.Barchi, R. L. 1983. У. Neurochem. 40: 1377-1385.
36.Noda, M., et al. 1984. Nature 312: 121-127.
37.Cormick, Κ. Α., et al. 1998. У. Biol. Chem. 273: 3954-3962.
38.Trimmer J. S., et al. 1989. Neuron 3: 33-49.
S., et al. 1989. Neuron 3: 33-49.
39.Kallen, R.G., et al. 1990. Neuron 4: 233-342.
40.Rogart, R. В., et al. 1989. Proc. Natl. Acad. Sci. USA 86: 8170-8174.
41.Hofmann, F., Biel, M., and Flockerzi, V. 1994. Annu. Rev. Neurosci. 17: 399-418.
42.Randall, A., and Tsien, R. W. 1995. У. Neurosci. 15: 2995-3012.
43.Tanabe, T., et al. 1987. Nature 328: 313-318.
44.Walker, D., and De Waard, M. 1998. Trends Neurosci. 21: 148-154.
45.Papazian, D. M., et al. 1987. Science 237: 749-753.
46.Timpe, L. C., et al. 1988. Nature 331: 143-145.
47.SalkofT, L., et al. 1992. Trends Neurosci. 15: 161-166.
48.Jan, L. Y., and Jan, Y. N. 1997. Annu. Rev. Neurosci. 20: 91-123.
49.MacKinnon, R. 1991. Nature 350: 232-238.
50.Yool, A. J., and Schwarz, T. L. 1991. Nature 349: 700-704.
51.Yellen, G., et al. 1991. Science 251: 939-942.
52.Miller, C. 1992. Cuir. Biol. 2: 573-575.
53. Heinemann, S. H., et al. 1992. Nature 356: 441-443.
54.Doyle, D.A., et al. 1998. Science 280: 69-77.
55.MacKinnon, R., et al. 1998. Science 280: 106-109.
56.Mullins, L.J. 1975. Biophys. J. 15: 921-931.
57.Liu, Y, et al. 1997. Neuron 19: 175-184.
58.Jentsch, T. J., Steinmeyer, K., and Schwarz, G. 1990. Nature 348: 510-514.
59.Jentsch, T.J., et al. 1995. У. Physiol. 482P: 19S-25S.
60.Schmidt-Rose, Y., and Jentsch, T. J. 1997. Proc. Natl. Acad. Sci. USA 94: 7633-7638.
61.Middleton, R.E., Pheasant, D.J., and Miller, C.
1996. Nature 383: 337-340.
62.Doupnik, C.A., Davidson, N., and Lester, H. A. 1995. Cuir. Opin. Neurobiol. 5: 268-277.
A. 1995. Cuir. Opin. Neurobiol. 5: 268-277.
63.Nicholls, C. G., and Lopatin, A. N. 1997. Annu. Rev. Physiol. 59: 171-191.
64.Burnstock, G. 1996. Drug Dev. Res. 39: 204-242.
65.Burnstock, G. 1996. P2-Purinoceptors: Localization, Function and Transduction Mechanisms. Wiley, London.
66.Soto, F., Garcie-Guzman, M., and Sturuner, W.
1997. У. Membr. Biol. 160: 91-100.
67.Seeburg, P.H. 1993. Trends Neurosci. 16: 359-365.
68.Moriyoshi, K., et al. 1991. Nature 354: 31-37.
69.Keinân, K., et al. 1990. Science 249: 556-560.
70.Egebjerg, J., et al. 1991. Nature 351: 745-748.
71.Dani, J.A., and Mayer, M. I. 1995. Cuir. Opin. Neurobiol. 5: 310-317.
72.Hollmann, M., Maron, C., and Heinemann, S. 1994. Neuron 13: 1331-1343.
73.Finn, J.T., Grunwald, M. E., and Yau, K-W. 1996. Annu. Rev. Physiol. 58: 395-426.
74.Zagotta, W.N., and Siegelbaum, S.A. \996.Annu. Rev. Neurosci. 19: 235-263.
75.Kôhler, M., et al. 1993. Neuron 10: 491-500.
76.Kyte, J., and Doolittle, R. F. 1982. У. Mol. Biol. 157: 105-132.
Глава 4 Транспорт через мембрану клетки
Вход и выход ионов через каналы в мембране нейрона имеет пассивный характер и происходит благодаря наличию электрических и химических градиентов. Для компенсации результатов передвижения ионов клетка использует активные транспортные механизмы, которые затрачивают энергию на перемещение ионов в направлении, противоположном их электрохимическим потенциалам. Таким образом, концентрации ионов в цитоплазме поддерживаются на постоянном уровне, что позволяет сохранить неизменным потенциал покоя, а также генерировать электрические сигналы.
Первичный активный транспорт осуществляется за счет энергии гидролиза АТФ. Наиболее распространенный пример такого транспорта — натрий-калиевый обменник, или насос. Специальная молекула, называемая натрий-калиевой АТФазой, осуществляет за счет энергии расщепления одной молекулы АТФ перенос трех ионов натрия наружу и двух ионов калия внутрь клетки. Поскольку в результате каждого транспортного цикла происходит изменение суммарного трансмембранного заряда на единицу, натрий-калиевый насос является электрогенным, то есть производит электричество. Другой пример активного ионного транспорта — АТФазы, выводящие кальций из цитоплазмы: кальциевые АТФазы плазматической мембраны выкачивают кальций за пределы клетки, а АТФазы эндоплазматического и саркоплазматического ретикулумов закачивают кальций из цитоплазмы во внутриклеточные структуры.
Вторичный активный транспорт основан на энергии передвижения ионов натрия в направлении их электрохимического градиента. При этом другие ионы переносятся за счет движения ионов натрия либо в том же (ко-транспорт), либо в обратном направлении (ионообмен). Примером такого механизма является натрий-кальциевый обменник, выводящий один ион кальция за счет входа в клетку трех ионов натрия. Как и все системы активного транспорта, этот обменник обратим и может работать как в прямом, так и в обратном направлении, в зависимости от соотношения электрических и химических градиентов для обоих ионов. Вторая система натрий-кальциевого обмена встречается в клетках сетчатки и осуществляет перенос одного иона кальция и одного иона калия наружу, в обмен на четыре входящих иона натрия. Энергия входа натрия в клетку используется также для переноса ионов хлора и бикарбоната через клеточную мембрану. Все вышеперечисленные механизмы основаны на передвижении натрия в направлении его электрохимического градиента и, следовательно, зависят от эффективности работы натрий-калиевого насоса, обеспечивающего поддержание этого градиента.
Транспорт медиаторов необходим для функционирования нейронов. Накопление молекул медиатора в синаптических пузырьках (везикулах) в цитоплазме пресинаптического окончания невозможно без такого транспорта, основанного на перемещении ионов (ионно-сопряженный транспорт). Подобный же механизм используется для обратной закачки медиатора после его выброса в синаптическую щель.
На сегодняшний день выделен и клонирован целый ряд транспортных АТФаз и высказаны предположения об их конфигурации в клеточной мембране. Все АТФазы состоят из 10-12 трансмембранных сегментов, которые, по всей вероятности, образуют канало-подобные структуры. Передвижение веществ по этим каналам происходит в результате выдвижения участков, соответствующих местам связывания ионов, поочередно то во внеклеточную, то во внутриклеточную среды.
Глава 4. Транспорт через мембрану клетки |
71 |
В главе 2 обсуждался механизм генерации электрических сигналов при перемещении ионов через каналы в плазматической мембране. Так, например, движение положительных ионов натрия внутрь клетки приводит к снижению суммарного негативного заряда на внутренней стороне мембраны, то есть приводит к ее деполяризации. Напротив, вход в клетку отрицательно заряженных ионов хлора влечет за собой гиперполяризацию. Движение ионов через каналы носит пассивный характер и обусловлено наличием электрических и концентрационных градиентов на мембране. При отсутствии компенсирующих процессов такое передвижение ионов очень скоро привело бы к полному исчезновению электрохимических градиентов.
Существует, однако, целый ряд механизмов активного транспорта, которые перемещают ионы в направлении, противоположном электрохимическому градиенту. Эти механизмы компенсируют утечку ионов, происходящую как в покое, так и в результате электрической активности. Активный транспорт подразделяется на первичный и вторичный. Первичный транспорт происходит за счет прямого использования метаболической энергии, а именно, энергии расщепления АТФ. Вторичный активный транспорт использует энергию потока ионов (чаще всего ионов натрия) в направлении их электрохимического градиента для перемещения других ионов через мембрану либо в том же (ко-транспорт), либо в противоположном направлении (ионообмен).
§1. Натрий-калиевый обменный насос
Большинство возбудимых клеток имеют потенциал покоя от -90 до -60 мВ. Равновесный потенциал для ионов натрия (ENa) — обычно порядка +50 мВ. Таким образом, существует большой электрохимический потенциал, стремящийся перенести ионы натрия внутрь клетки. Такой перенос осуществляется при помощи многочисленных механизмов. Кроме того, равновесный потенциал для калия более отрицателен, чем потенциал покоя, вследствие чего ионы калия постоянно выводятся из клетки. Для поддержания жизнеспособности клетки необходимо, чтобы ионы натрия непрерывно переносились наружу, а ионы калия внутрь клетки, т, е. против их электрохимических градиентов. Для этой цели в мембране клетки существует натрий-калиевый обменный насос, который при каждом своем цикле переносит три иона натрия наружу и два иона калия внутрь клетки.
Уже ранние эксперименты Ходжкина и Кейнеса 1, 2) на гигантском аксоне кальмара убедительно показали, что источником энергии для этого процесса является расщепление АТФ. В то же время Скау3) продемонстрировал, что АТФаза, изолированная из нерва краба, обладает многими из биохимических характеристик, которые должен иметь натрий--калиевый насос. Действительно, как для работы насоса, так и для активации АТФазы необходимо присутствие ионов натрия и калия. Кроме того, уабаин (ouabain) одинаково блокирует активность насоса и АТФазы.
На основе этих наблюдений был сделан вывод о том, что натрий-калиевая АТФаза и есть натрий-калиевый насос. Она принадлежит к семейству АТФаз Р-типа (P-type), получившему свое название потому, что в процессе работы эти АТФазы образуют фосфорилированную форму. Перенос ионов осуществляется за счет энергии расщепления АТФ. К этому же семейству относятся кальциевые АТФазы, выводящие ионы кальция из цитоплазмы клетки, и протон-калиевые АТФазы, наиболее примечательная функция которых заключается в секреции большого количества кислоты в полость желудка.
Биохимические свойства натрий-калиевой АТФазы
Биохимические свойства натрий-калиевой АТФазы хорошо известны уже на протяжении многих лет4). Стехиометрическое соотношение связываемых катионов совпадает со свойствами транспортного процесса: в среднем, на каждую расщепляемую молекулу АТФ переносится три иона натрия и два иона калия. Избирательность к ионам калия весьма высока: это единственный субстрат, переносимый насосом наружу клетки, и единственный моновалентный катион, не принимаемый насосом для переноса внутрь. Например, литий, аммоний, рубидий, цезий и таллий могут заменить калий во внеклеточном растворе, но не натрий во внутриклеточном. В отсутствии калия насос переносит натрий гораздо менее эффективно (около 10% мощности).
Специфическим блокатором натрий-калиевой транспортной системы являются вещества, используемые при лечении сердечной
72 |
Раздел II. Передача информации в нервной системе |
недостаточности (digitalis glycosides), в особенности уабаин и строфантидин. Блокируя активный транспорт натрия и калия, эти вещества не оказывают воздействия на пассивное перемещение ионов через ионные каналы в мембране.
Экспериментальные доказательства электрогенности насоса
В результате того, что насос переносит за один цикл неодинаковое количество ионов натрия и калия, происходит суммарный перенос через мембрану одного положительного заряда. Поэтому насос называется электрогенным. Это свойство насоса было протестировано экспериментально на аксоне кальмара 1· 2· 5), а также Томасом на нейронах улитки 6, 7). Нейроны улитки достаточно велики для того, чтобы можно было ввести несколько микроэлектродов в цитоплазму, не повреждая клетки. Для исследования взаимосвязи между внутриклеточной концентрацией натрия, током через насос и мембранным потенциалом Томас использовал две микропипетки для введения ионов в клетку, одна из которых была заполнена ацетатом натрия, а другая ацетатом лития (рис. 4.1 А). Третья пипетка использовалась в качестве электрода для регистрации мембранного потенциала. Четвертая пипетка служила токовым электродом, обеспечивающим режим фиксации потенциала (voltage--clamp; глава 6). Еще один электрод, сделанный из натрий-чувствительного стекла, позволял измерять внутриклеточную концентрацию натрия. Для инъекции натрия, на электрод, заполненный ионами натрия, подавалось положительное напряжение по отношению к электроду, содержащему ионы лития. Таким образом, весь ток в инъекционной системе протекал между двумя пипетками внутри клетки, а не через клеточную мембрану.
Результат опыта показан на рис. 4.1 В. После кратковременной инъекции работа насоса активизировалась и мембрана клетки гиперполяризовалась приблизительно на 20 мВ. По мере того, как избыточное количество натрия выводилось из клетки, мембранный потенциал постепенно восстанавливался, что занимало несколько минут. Инъекция лития, произведенная посредством приложения положительного потенциала к литиевой пипетке, не привела к гиперполяризации клетки.
Можно выделить несколько фактов, подтверждающих участие насоса в изменении мембранного потенциала. Так, в присутствии блокатора транспорта (уабаина) гиперполяризация мембраны была значительно менее выраженной или полностью устранялась (рис. 4.1C). Кроме того, устранение калия из внеклеточного раствора приводило к исчезновению влияния инъекции натрия на мембранный потенциал; восстановление уровня внеклеточного калия после инъекции натрия вызывало немедленную гиперполяризацию (рис. 4.1 D).
Количественные оценки скорости работы насоса и соотношения обмениваемых ионов были получены в опытах с фиксацией потенциала. Этот метод (описанный в главе 6) позволяет измерять ток, протекающий через мембрану, в то время как мембранный потенциал поддерживается на неизменном уровне. Концентрация натрия также измерялась в ходе этого опыта. Инъекция натрия вызвала кратковременное повышение его внутриклеточной концентрации, которое сопровождалось выходящим током. Длительность и амплитуда этого выходящего тока зависели от изменения концентрации натрия внутри клетки (рис.4.1E). Величина суммарного заряда, перенесенного наружу клетки, была подсчитана на основании измерения интеграла мембранного тока (то есть площади под кривой тока). Суммарный заряд составил приблизительно одну треть заряда ионов натрия, инъецированных в клетку. Эти данные подтверждают представление о том, что на каждые три иона натрия, выводимого насосом из клетки, приходится два иона калия, переносимые внутрь.
Механизм переноса ионов
Рис. 4.2 иллюстрирует последовательность событий, лежащих в основе переноса ионов натрий-калиевым насосом. Внутри канало-подобной структуры насоса расположены места связывания калия и натрия, которые поочередно вступают в контакт с внутриклеточной и внеклеточной средами. Циклическое изменение конформации насоса происходит за счет фосфорилирования и дефосфорилирования его белковой молекулы. Этот процесс сопровождается изменением сродства мест связывания к соответствующим ионам. Места связывания, направленные внутрь клетки, имеют низкое сродство к калию и высокое к натрию (рис. 4.2А). Связывание трех ионов натрия ведет к изменению конформации белка, последующему связыванию АТФ и фосфорилированию фермента
(рис. 4.2В).
