
Nikolls_-_Ot_neyrona_k_mozgu
.pdf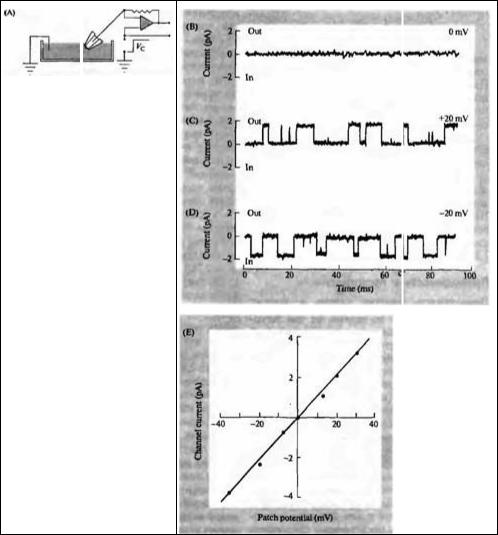
Глава 2. Ионные каналы и нейранальная сигнализация |
43 |
Рис. 2.6. Влияние потенциала на ток через одиночный калиевый канал в симметричном растворе ионов калия по обе стороны мембраны. (А) Схема установки. (B-D) Примеры токов через одиночные ионные каналы при разных уровнях мембранного потенциала. (Е) Ток через калиевый канал как функция мембранного потенциала.
Fig. 2.6. Effect of Potential on Currents through a single, spontaneously active potassium channel in an outside-out patch, with 150 mM potassium in both the electrode and the bathing solution.
(A) The recording system. The output from the patch clamp amplifier is proportional to the current across the patch. The potential across the patch is equal to the potential (VC) applied to the input of the amplifier as shown. Positive charge flowing out of the electrode is defined as positive current. (B) When no potential is applied to the patch, no channel currents are seen because there is no net flux of potassium through the channels. (C) Application of +20 mV to the electrode results in an outward current (upward deflections) of about 2 pA through the channels. (D) A -20 mV potential results in inward channel currents (downward deflections) of the same amplitude as in С. (Е) Channel currents as a function of applied voltage. The slope of the line is the channel conductance (7). In this case, 7 = 110 pS
(picosiemens).
из направлений. Поэтому на данном рис. 2.6В показано отсутствие мембранного тока.
Пэтч-кламп метод имеет достоинство, которое еще не было упомянуто: мы можем менять потенциал на регистрирующей пипетке и варьировать, таким образом, трансмембранную разность потенциалов. Например, при мембранном потенциале +20 Мв каждое открытие калиевого ионного канала сопровождается током, направленным наружу (рис. 2.6С). Это связано с тем, что положительно заряженные ионы калия двигаются через канал по электрическому градиенту между раствором в пипетке и в ванночке. С другой стороны, когда внутри пипетки создан отрицательный потенциал величиной в -20 мВ
44 |
Раздел II. Передача информации в нервной системе |
(рис. 2.6D), ток направлен в обратном направлении (через открытый канал в пипетку). Зависимость тока от величины потенциала на мембране представлена на рис. 2.6Е. Эта зависимость является линейной: ток (I), проходящий через канал, пропорционален
потенциалу (V):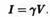
Это формула представляет собой преобразованный закон Ома (приложение А). Константа 7 называется проводимостью канала. При одном и том же потенциале на мембране канал с высокой проводимостью переносит много тока, канал с низкой проводимостью проводит малый ток.
Проводимость измеряется в сименсах (См). В нейронах трансмембранный потенциал
обычно выражается в милливольтах (1 мВ = 10–3 В), токи одиночных ионных каналов в пикоамперах ( 1 пА = 10–12 А), проводимость в пикосименсах (1 пСм = 10–12 См). На рис.
2.6 потенциал +20 мВ продуцировал ток около 2,2 пА, соответственно проводимость канала (γ = I/V) составила 2,2 пА/20 мВ = 110 пСм.
Проводимость и проницаемость
Проводимость ионного канала γ зависит от двух факторов: во-первых, от той легкости, с которой ионы проходят через открытый канал. Это внутреннее свойство канала известно как проницаемость канала. Во-вторых, проводимость зависит от концентрации ионов около устьев канала. Ясно, что если ионы калия отсутствуют как внутри, так и снаружи клетки, то не может быть и тока. При этом становится не важно, какова проницаемость канала или насколько велик мембранный потенциал. Если присутствует всего несколько ионов калия, то, при одной и той же величине проницаемости и стандартном трансмембранном потенциале, ток через ионный канал будет гораздо меньше, чем при избыточной концентрации ионов калия. Эти взаимоотношения могут быть представлены следующим образом:
Открытый канал —> проницаемость Проницаемость + ионы —> проводимость.
Равновесный потенциал
В уже рассмотренных примерах ионного тока концентрации ионов калия были одинаковыми по обе стороны мембраны. Что произойдет, если мы сделаем концентрации этого иона в пипетке и в ванночке различными? Представим, что после получения конфигурации outside-out, как это показано на рис. 2.7 А, концентрация калия в ванночке составляет 3 ммоль (подобно нормальной внеклеточной концентрации этого иона), а внутри электрода эта концентрация равняется 90 ммоль (подобно цитоплазматической концентрации). Если калиевый канал в мембране будет открыт, то ионы калия начнут двигаться из пипетки в ванночку. Такой ток будет происходить даже при отсутствии потенциала на пипетке (рис. 2.7В), так как движущей силой для ионов калия является градиент концентраций. Если же мы зарядим пипетку положительно, градиент потенциала на мембране будет еще более увеличивать движение положительно заряженных ионов калия наружу (к минусу). В результате ток ионов через калиевые каналы будет возрастать (рис. 2.7 С). И наоборот, если придать пипетке отрицательный заряд, движение ионов калия из электрода наружу через мембрану замедлится и канальный ток уменьшится (рис. 2.7 D). Важно отметить, что при достаточно большом отрицательном заряде ионы калия начнут движение внутрь, то есть против градиента концентрации (рис. 2.7Е). Зависимость ионного тока от напряжения на мембране для этой экспериментальной модели показана на рис. 2.7 F.
Рис. 2.7 F иллюстрирует, что ток ионов калия через канал зависит от электрического потенциала мембраны и градиента концентрации калия. Сочетание этих двух факторов формирует электрохимический градиент для калия. В отличие от начального результата, полученного при одинаковых концентрациях ионов калия по обе стороны мембраны (рис. 2.6), в данном примере ионный ток равен нулю при потенциале на пипетке -85 мВ. При этом потенциале стремление ионов калия выйти через канал наружу по градиенту концентраций полностью уравновешено трансмембранной разницей электрического потенциала, которая направляет движение ионов в противоположном направлении. Этот трансмембранный потенциал называется калиевым равновесным потенциалом (ЕK) Равновесный потенциал зависит только от концентрации ионов по обе стороны мембраны, но не от свойств ионного канала или механизма проникновения ионов через канал.

Глава 2. Ионные каналы и нейрональная сигнализация |
45 |
Рис. 2.7. Потенциал реверсии для калиевого тока в асимметричном растворе калия. Остальные обозначения такие же, как на рис. 2.6.
Fig. 2.7. Reversal Potential For Potassium Currents in a hypothetical experiment using an outside-out patch with the concentration of potassium in the recording pipette ("intracellular" concentration) 90 mM and in the bathing solution ("extracellular" concentration) 3 mW. (A) Recording arrangement as in Figure 2.6. (B) With no potential applied to the pipette, the flux of potassium from the electrode to the bath along its concentration gradient produces outward channel currents.
(C) When a potential of +20 mV is applied to the pipette, outward currents increase in amplitude. (D) Application of -50 mV to the pipette reduces outward currents. (E) At -100 mV, currents are reversed. (F) The currentvoltage relation indicates zero current at —85 mV, which is the potassium equilibrium potential (EK).
Уравнение Нернста
Какой именно потенциал необходим для того, чтобы уравновесить эффект реальной разницы концентраций ионов калия? Предположение о том, что Ек просто пропорционален разнице между внутриклеточной [К]i и внешней [К]0 концентрацией ионов калия, не совсем верно. Точнее, равновесный потенциал зависит от разницы между логарифмами концентраций:
Константа k определяется из формулы RT/(zF), где R — газовая постоянная, Т — абсолютная температура, z — валентность иона (в данном случае +1 ) и F — число Фарадея
(число кулонов электричества в 1 молярном растворе иона). Таким образом,
что можно представить как:
Это уравнение называется уравнением Нернста для ионов калия. Аналогично, можно построить уравнение Нернста и для других основных ионов. Отношение RT/(zF) измеряется в вольтах и равно примерно 25 мВ при температуре 20° С. Иногда более удобно пользоваться десятичным (log), а не натуральным логарифмом (ln). Тогда значение

46 |
Раздел II. Передача информации в нервной системе |
RT/(zF) должно быть умножено на In 10, или 2,31, что даст в результате 58 мВ. То есть:
При температуре тела млекопитающих (37° С) вместо 58 мВ следует использовать 61 мВ. Для клетки, показанной на рис. 2.7, значение £?к = —85 мВ соответствует отношению концентраций 1/30.
Необходимо отметить, что диффузия иона по градиенту концентрации не строго зависит от его концентрации. Во всех растворах, кроме очень слабых, ионы взаимодействуют друг с другом, что проявляется в электростатическом притяжении или отталкивании заряженных частиц. Результатом таких взаимодействий является снижение эффективной концентрации ионов. Эффективная концентрация иона называется активностью. Поэтому более точным теоретическим параметром для уравнения Нернста является соотношение активностей, а не соотношение концентраций. Однако поскольку суммарные концентрации ионов внутри и вне клетки близки (глава 5), соотношение активности ионов не будет существенно отличаться от соотношения концентраций.
Движущая сила
Рис. 2.7F иллюстрирует важный момент для прохождения тока через ионные каналы: без приложения потенциала ток составляет около 4 рА, тогда как с потенциалом на пипетке - 85 мВ ионный ток равен нулю. Следовательно, ионный ток определяется не абсолютным значением мембранного потенциала (Vm), a разницей между мембранным потенциалом и равновесным потенциалом для данного иона, в данном случае для иона калия (Ек). Эта разница Vm — Ек является движущей силой для прохождения ионов через канал. Вновь обратимся к рис. 2.7F: при мембранном потенциале, равном нулю, движущая сила составляет +85 мВ.
Нелинейные отношения «ток—напряжение»
Вторым характерным свойством зависимости «ток—напряжение» на рис. 2.7F, в отличие от рис. 2.6Е, является ее нелинейность. При сдвиге от равновесного потенциала -85 м В
в сторону деполяризации (то есть к нулю) ток меняется более быстро, чем при переходе в сторону гиперполяризации. Это происходит из-за того, что проводимость канала является функцией концентрации иона. В нашем примере концентрация ионов калия внутри пипетки гораздо выше концентрации этого иона во внешнем растворе. Это приводит к тому, что током, идущим наружу, переносится больше ионов, чем током, направленным внутрь. По мере сдвига от равновесного потенциала в сторону деполяризации, этот эффект становится все более заметным. Поэтому зависимость «ток—напряжение» имеет направленный вверх изгиб, несмотря на то, что проницаемость этого типа канала практически не зависит от потенциала.
Нелинейные отношения «ток—напряжение» наблюдаются также в ионных каналах, обладающих выпрямляющими свойствами. В таких каналах проницаемость зависит от потенциала, поэтому при определенном потенциале ионы двигаются в одном направлении гораздо легче, чем в обратном. Одним из таких примеров является потенциалзависимый калиевый канал, называемый каналом внутреннего выпрямления (inward rectifier). Такой тип канала позволяет ионам калия двигаться внутрь клетки при потенциале, более негативном, чем равновесный калиевый потенциал. Однако при потенциалах, менее негативных по отношению к равновесному калиевому потенциалу, выходящий ток или очень мал, или полностью отсутствует.
Проницаемость ионных каналов
Каким же образом ионы проходят через каналы? Одним из возможных механизмов является диффузия через водную среду, заполняющую пору. Представление о диффузии лежало в основе ранних гипотез о процессе ионной проницаемости. Однако для большинства каналов простая диффузия описывает ионную проницаемость недостаточно адекватно. Главная причина в том, что проникающие ионы вступают во взаимодействие с белками ионного канала. Так, в растворе, благодаря наличию заряда, ионы всегда покрыты гидратной оболочкой (рис. 2.1). В случае катионов молекулы воды ориентированы таким образом, что отрицательно заряженный кислород
Глава 2. Ионные каналы и нейрональная сигнализация |
47 |
обращен в сторону иона. Если пора ионного канала достаточно узкая, необходимо некоторое количество энергии, чтобы освободить ион от ассоциированных молекул воды и позволить ему проникнуть через этот участок (глава 3). В канале ион может быть объектом притяжения или отталкивания электростатическими зарядами стенки канала. Взаимодействие иона с комплементарными центрами ионного канала может приводить к тому, что процесс проникновения будет представлять собой своеобразный «перескок» иона с одного центра связывания на другой. Такие взаимодействия иона со стенкой канала могут влиять как на ионную избирательность, так и на скорость потока ионов. Модели, описывающие ионную проницаемость по этому механизму, называются моделями Эйринга 9). В целом, такие модели описывают ионную избирательность и проводимость гораздо более адекватно, чем модели простой диффузии.
Значение ионных каналов
Функционирование ионных каналов, описанных в этой главе, дает возможность нейронам реагировать на сигналы из внешней среды или от других нейронов, передавать импульсы на большие расстояния к исполнительным органам или к другим нейронам. Таким образом, вся сложная система восприятия и анализа сигналов, так же как генерация двигательной команды, определяется, в конечном счете, активностью ионных каналов.
Важно понимать, что все ионные токи, лежащие в основе нейрональной сигнализации, обусловлены пассивным движением ионов через открытые ионные каналы по градиенту концентрации и в зависимости от заряда клеточной мембраны. Другими словами, нейроны используют электрохимические градиенты для генерации потока ионов и, как следствие, для формирования электрических сигналов. Потенциально ионные токи могли бы нарушать эти градиенты, однако в действительности этого не происходит, так как клетки используют энергию, образуемую в ходе метаболизма, для поддержания ионного состава цитоплазмы. Специализированные механизмы, лежащие в основе активного транспорта ионов, описаны в главе 4.
Выводы
·Электрические сигналы в нервной системе генерируются движением ионов через мембрану нервной клетки. Эти ионные токи протекают через водные поры трансмембранных белков, известных как ионные каналы.
·Каналы различаются по своей избирательности: некоторые катионные каналы пропускают только натрий, калий или кальций, другие являются менее избирательными. Анионные каналы сравнительно не избирательны для малых анионов, но они пропускают в основном ионы хлора, так как хлор является самым распространенным анионом внеклеточной и внутриклеточной жидкостей.
·Каналы совершают переходы между открытым и закрытым состояниями. Каждый канал имеет присущее ему время открытого состояния. Когда каналы активированы, вероятность их открытия возрастает. Деактивация снижает частоту открытия. Каналы также могут быть инактивированы или блокированы.
·Каналы могут быть классифицированы по типу их активации: механочувствительные, потенциал-активируемые, лиганд-активируемые.
·Ионы движутся через каналы пассивно в соответствии с градиентом концентрации или электрическим градиентом на мембране.
·Результирующий поток ионов через канал по градиенту концентрации может быть снижен противоположно направленным электрическим градиентом. Электрический потенциал, снижающий результирующий поток какого-либо иона до нуля, называется равновесным потенциалом данного иона. Отношение между равновесным потенциалом и градиентом концентрации описывается уравнением Нернста.
·Движущая сила для движения ионов через мембрану есть разница между равновесным и мембранным потенциалами. Ионный ток, протекающий через одиночный канал, зависит от движущей силы для данного иона и проводимости канала для этого иона. В свою очередь, проводимость зависит от проницаемости данного канала и внешней и внутренней концентраций ионов.

48 |
Раздел II. Передача |
|
информации в нервной системе |
Рекомендуемая литература
оHille, В. 1992. Ion Channels in Excitable Membranes, 2nd Ed. Sinauer, Sunderland, MA, pp. 291-314.
оPun, R. Y. K., and Lecar, H. 1998. Patch clamp techniques and analysus. In N. Sperelakis (éd.), Cell Physiology Source Book, 2nd Ed. Academic Press, San Diego, CA, pp. 391-405.
391-405.
Цитированная литература
1.Karplus, M., and Petsko, G. A. 1990. Nature 347: 631-639.
A. 1990. Nature 347: 631-639.
2.Katz, В., and Miledi, R. 1972. J. Pliysiol. 224: 665-699.
3.Anderson, C. R., and Stevens, C. F. 1973. /. Pliysiol. 235: 665-691.
4.Neher, E., Sakmann, В., and Sieinbach, J. H. 1978. Pflugers Arch. 375: 219-228.
5.Hamill, O. P., et al. 1981. Pflugers Arch. 391:85-100.
Arch. 391:85-100.
6.Horn, R., and Marty, A. 1988. J. Gen. Pliysiot. 92: 145-149.
7.Ling, G., and Gerard, R.W. 1949. J. Cell Сотр. Physiol. 34: 383-396.
8.Gold, M. R., and Martin, A. R. 1983. /. Physiol. 342:99-117.
9.Johnson, F. H., Eyring, H., and Polissar, M. J. 1954. Tlie Kinetic Basis of Molecular Biology. Wiley, New York.
Глава 3. Структура ионных каналов
Молекулярная структура ионных каналов может быть расшифрована и соотнесена с их функцией с помощью различных экспериментальных методов. Эти методы включают: биохимическое выделение белков, клонирование, определение последовательности аминокислот, точечные мутации для изменения аминокислотной последовательности в отдельных участках молекулы белка, экспрессию ионных каналов в чужеродных клетках, таких, например, как ооциты лягушек ксенопус (Xenopus). Кроме того, физическое устройство каналов может быть изучено посредством электронной микроскопии, электронной и рентгеновской дифракции.
Наиболее широко комбинация этих экспериментальных подходов была использована для изучения лиганд-активируемых каналов ацетилхолинового рецептора. Этот рецептор состоит из пяти отдельных субъединиц, собранных кольцом вокруг центра. Две из них — α-субъединицы — содержат рецепторы для медиатора ацетилхолина. Каждая субъединица имеет четыре трансмембранных домена (обозначаемых как M1, М2, МЗ и М4), соединенных с помощью внутри-и внеклеточных фрагментов белковой молекулы. М2 домены всех пяти субъединиц формируют проницаемую для ионов пору ионного канала. Ацетилхолиновый рецептор является представителем суперсемейства лигандактивируемых рецепторов, включающего также рецепторы для глицина, γ-аминомасляной кислоты (ГАМК) и серотонина.
Потенциал-активируемые каналы образуют другое суперсемейство ионных каналов. Установлено, что потенциал-активируемый натриевый канал является единой большой молекулой с четырьмя повторяющимися доменами, расположенными кольцом вокруг центра. Каждый домен содержит шесть трансмембранных сегментов (обозначаемых как S1-S6). В каждом из четырех доменов фрагмент белка между сегментами S5 и S6 обращен к центру и формирует проницаемую для ионов пору. Потенциалактивируемые кальциевые каналы имеют сходную структуру. Потенциал-активируемые калиевые каналы также подобны по конфигурации натриевым или кальциевым каналам, но с одним важным отличием: они состоят не из одной молекулы, а из 4 отдельных субъединиц.
Аминокислотные последовательности и детальная информация о структуре получены и для других семейств рецепторов и ионных каналов. За редким исключением все они представляют собой совокупность нескольких субъединиц, каждая из которых состоит как минимум из двух трансмембранных доменов и участка, формирующего водную пору ионного канала.
Для успешного функционирования нервной системы нейроны должны обладать весьма разнообразным репертуаром электрической активности. Например, импульс, генерируемый одним из нейронов, может подавить электрическую активность соседних нервных клеток, активировать ряд отдаленных нейронов, и, наконец, плавно модулировать активность третьей группы нейронов. Все эти варианты поведения зависят, в конечном счете, от активации или деактивации ионных каналов, регулирующих ионные токи через мембраны нервных клеток.
Поэтому столь важно понимать, как функционируют ионные каналы. Это понимание базируется на знании молекулярной структуры белков каналов. Для большого числа ионных каналов определены последовательности аминокислот в белковой молекуле, а также предположительная конфигурация белка в плазматической мембране. В этой главе мы рассмотрим в деталях два типа ионных каналов. Первая группа — это лиганд-активируемые каналы, представленная никотиновым ацетилхоли новым рецептором. Вторая группа — потенциал-активируемые катионные каналы, которые обеспечивают движение
50 |
Раздел II. Передача информации в нервной системе |
ионов натрия, калия и кальция через клеточную мембрану. Эти два типа каналов служат моделями, на которых базируются постулаты о структуре прочих каналов.
Как же выглядит молекула ионного канала и как она функционирует? В последние годы осуществлен значительный прогресс в понимании структуры ионных каналов. В получении этой информации были использованы два экспериментальных достижения. Во-первых, были изолированы клоны ДНК, кодирующие структуру ионных каналов, что позволило получить информацию об аминокислотной последовательности этих белков. Техника, используемая при этом, давала также возможность менять основания в молекуле ДНК (сайт-направленный мутагенез) и заменять, таким образом, в выбранном участке белка одну аминокислоту другой.
Вторым достижением была разработка техники, посредством которой клоны ДНК были использованы для экспрессии ионных каналов в чужеродных клетках, таких как ооциты Xenopus. Этот прием позволил оценить функциональные свойства клонированных ионных каналов электрофизиологическими методами. Комбинация двух методов позволяла манипулировать специфическими участками молекулы ионного канала, чтобы определить значение этих участков для его функционирования. Применение этих методов позволило выяснить, что в ряде случаев замена даже одной аминокислоты меняет ионную избирательность канала.
§ 1. Никотиновый ацетилхолиновый рецептор
Одним из первых изученных в деталях ионных каналов был никотиновый ацетилхолиновый рецептор (АХР). Заметим, что для лиганд-активируемых каналов предпочтительнее термин «рецептор», чем часто используемый термин «канал», так как характеристика таких белковых молекул в первую очередь зависит от связывания молекул агонистов, антагонистов, токсинов и антител, чем от специфических характеристик ионного канала. Никотиновые АХР представлены в постсинаптических мембранах скелетных мышечных волокон позвоночных, в нейронах нервной системы беспозвоночных и позвоночных, в синапсах электрического органа электрического ската.
Эти рецепторы активируются АХ, освобождающимся из пресинаптических нервных окончаний. При активации АХР открываются ионные каналы, через которые катионы могут проходить клеточную мембрану постсинаптической клетки. Рецепторы обозначаются как «никотиновые», поскольку действие АХ воспроизводится никотином, и для того, чтобы отличать их от других АХР, которые активируются мускарином. Мускариновые АХР сами не являются ионными каналами; их активация запускает систему внутриклеточных посредников, которые являются непосредственными регуляторами активности ионных каналов.
Биохимической изоляции никотинового АХР способствовало наличие концентрированного источника рецепторов в синаптических мембранах электрического органа ската Torpedo. Электрический орган этой и других подобных электрических рыб представляет собой редуцированные мышечные клетки (электроциты). Ряды электроцитов анатомически выстроены таким образом, что при одновременной их деполяризации общий разряд достигает 100 V — величину достаточную, чтобы оглушить добычу. После экстракции из мембран электроцитов молекулы АХР были отделены от других мембранных белков благодаря их высокому аффинитету (сродству) к α-бунгаротоксину. Этот нейротоксин обладает высокой специфичностью по отношению к АХР в электроцитах и в скелетной мышце позвоночных. Было обнаружено, что АХР из Torpedo состоит из 4 белковых субъединиц (α, β, γ и δ) с молекулярной массой около 40, 50, 60 и 65 кДа (килодальтон), соответственно. Изолированный АХР, после включения в искусственные липидные мембраны, сохраняет большинство функциональных характеристик, присущих нативному ионному каналу1).
Физические свойства АХР рецептора
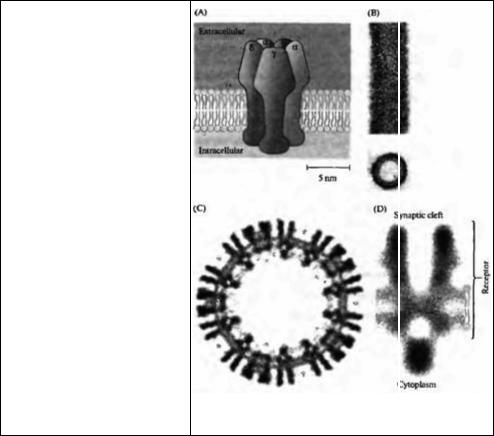
Размер и ориентация ионного канала АХР по отношению к мембране были определены с помощью электронной микроскопии высокого разрешения, а также другими физическими методами 2) - 4). Физическая структура АХР показана на рис. 3.1. Пять субъединиц — две α, одна β, одна γ и одна δ — образуют кольцо вокруг центральной поры. Диаметр молекулы в ее самой широкой, внеклеточной части, составляет около 8,5 нм, а длина АХР —
Глава 3. Структура ионных каналов |
51 |
Рис. 3.1. АХ рецептор. (А) АХ рецептор состоит из пяти субъединиц — две α, ,
одна β, одна γ и одна δ-субъединицы расположенных радиально с углом около 72° вокруг центра, α-субъединицы содержат центры связывания АХ. Позиция β- и γ-субъединиц может быть обратной. (В) Продольное и поперечное сечение электронно-микроскопического изображения цилиндрических везикул постсинаптической мембраны Torpedo, на котором показаны плотно расположенные АХ рецепторы. (С) Поперечный разрез такого цилиндра с большим увеличением. (D) Тот же объект под еще большим увеличением, на котором показан одиночный АХ рецептор.
Fig. 3.1. The ACh Receptor. (A) The complete AChR consists of five subunits— two a, one β, one 7, and one 6 — spaced radially in increments of about 72° around a central core. The a subunits contain receptor sites for acetylcholine. The position of the β and 7 subunits may be reversed.
(B) Longitudinal and transverse electron microscope images of cylindrical vesicles from postsynaptic membranes of Torpedo, showing closely packed ACh receptors. (C) Transverse section of the tube at higher magnification. (D) Further enlarged image of a single ACh receptor, showing its position and size relative to the membrane bilayer. Dense blob under the receptor is intracellular receptor-associated protein. (A based on Stroud and Finer-Moore, 1985, and Toyoshima and Unwin 1988; B, C, and
D kindly provided by N. Unwin.)
11 нм. Внеклеточная часть АХР выдается над поверхностью мембраны на 5 нм. Измерение избирательности ионного канала АХР по отношению к большим катионам предполагает, что диаметр центральной поры составляет примерно 0,7 нм 5, 6).
Аминокислотная последовательность субъединиц АХР
После предварительных биохимических исследований 7) были клонированы кДНК для всех субъединиц АХР и определены последовательности аминокислот в каждой из них. Рис. 3.2 показывает аминокислотную последовательность α-субъединицы АХР из электрического органа Torpedo (соответствующие субъединицы АХР человека и ко-
ровы несколько отличаются от представленной на рисунке). Аминокислотные последовательности других трех субъединиц весьма сходны (гомологичны) со структурой α-субъединицы, с незначительными вариациями нескольких аминокислот. Поэтому принципы структурной конфигурации, обсуждаемые для α-субъединицы, в основном применимы и других субъединиц.
Вторичная и третичная структура АХР
Хотя первичная структура субъединиц не дает информации о том, каким образом белковая молекула АХР организована в мембране, можно приблизиться к пониманию этого вопроса путем построения молекулярных

52 |
Раздел II. Передача информации в нервной системе |
|
|
|
|
Рис. 3.2. Аминокислотная последовательность субъединицы АХР. Затемненные области показывают гидрофобные участки (M1, М2, М3 и М4), способные формировать трансмембранные α-спирали.
Fig. 3.2. Amino Acid Sequence of the AChR Subunit. Sequences in color indicate hydrophobic regions (Ml, M2, M3, and M4) that are capable of forming membrane-spanning a helices. In the Ml region, 16 of the 22 amino acids are hydrophobic. The other membrane-spanning regions are of similar composition. The initial underscored segment is the signal sequence. (After Numa et al. 1983.)
моделей, основываясь на данных об аминокислотной последовательности белка. Логично предположить, что, как у любых крупных белков, сегменты молекулы свернуты в упорядоченные мелкие α- или крупные β-спирали. Эти вторичные структуры, в свою очередь, сворачиваются, образуя третичные структуры. Наконец, пять субъединиц (две α, одна β, одна γ и одна δ) соединяются вместе, формируя конечную четвертичную структуру — полноценный ионный канал.
Для построения модели вторичной и третичной структуры АХР существенную роль
