
Nikolls_-_Ot_neyrona_k_mozgu
.pdf
Глава 10. Механизмы непрямой синоптической передачи |
203 |
|
|
Рис. 10.15. Паракринное действие N0. Ацетилхолин связывается с мускариновыми рецепторами (mAChR) на эндотелиалыных клетках кровеносных сосудов и активирует фосфатидилинозитид-специфическую фосфолипазу С (PIPLC) PI-PLC вызывает образование IP3 , который вызывает освобождение кальция из внутриклеточных депо. Кальций, связавшись с кальмодулином, активирует NO-синтазу (NOS), которая вызывает образование N0. N0 диффундирует в близлежащие гладкомышечные клетки и стимулирует гуанилатциклазу (GC), которая катализирует образование цГМФ. цГМФ активирует цГМФ-зависимую протеинкиназу (PKG), и последующее фосфорилирование белков приводит к уменьшению внутриклеточной концентрации кальция и мышечному расслаблению. N0 имеет короткое время жизни и поэтому его действию подвергаются лишь близлежащие клетки — поэтому его действие называется паракринным.
Fig. 10.15. Рагасппе Signaling by Release of Nitric Oxide. ACh binds to muscarinic receptors (mAChR) on vascular endothelial cells, activating phosphotidylinositide-specific phospholipase С (PI-PLC). PI-PLC forms inositol trisphosphate (IP3), which releases calcium from intracellular stores. Calcium, together with calmodulin, activates nitric oxide synthase (NOS), producing nitric oxide (NO). NO diffuses into neighboring smooth muscle cells and stimulates guanylyl cyclase (GC), increasing cGMP. Cyclic GMP activates cGMP-dependent protein kinase (PKG). The resulting increases in protein phosphorylation lead to a decrease in intracellular calcium concentration, causing relaxation. NO is rapidly degraded, so that it affects only nearby cells — hence the term "paracrine".
и HPETES, и циклооксигеназному, с образованием простагландинов и тромбоксанов 42).
Арахидоновая кислота модулирует нейрональную активность, действуя напрямую на ионные каналы 43, 44), через активацию протеинкиназы С45) и через свои метаболиты46). Например, в сенсорных нейронах аплизии арахидоновая кислота образуется в ответ на пептид FMRFamide и метаболизируется по липоксигеназному пути до 12-НРЕТЕ. 12-НРЕТЕ связывается с калиевыми каналами S-типа и увеличивает вероятность их открывания (рис. 10.14) 47, 48). Этот эффект приводит к гиперполяризации постсинаптических мышечных клеток и торможению синаптической передачи между сенсорным нейроном и мышечным волокном 49, 50).
Сигнализация через N0 и СО
Окись азота (nitric oxide, NO) является водо--и жирорастворимым газом, образующимся из аргинина под действием фермента NO--синтазы. NO — это медиатор, который диффундирует из цитоплазмы клетки, в которой он образуется, в соседние клетки, где он активирует фермент гуанилатциклазу51, 52). NO был впервые описан как регулятор кровяного давления, опосредующий расширение сосудов при воздействии ацетилхолина 53). Взаимодействие АХ с мускариновыми рецепторами на эндотельиальных клетках сосудов приводит к активации фосфолипазы С, образованию IР3 и освобождению ионов кальция из внутриклеточных депо (рис. 10.15). Кальций связывается с кальмодулином и активирует NO-синтазу, приводя к образованию NO. NO диффундирует в соседние гладкомышечные клетки и стимулирует растворимую гуанилатциклазу, что приводит к увеличению концентрации внутриклеточного цГМФ. цГМФ, в свою очередь, активирует цГМФ-зависимую протеинкиназу. Фосфорилирование белков модулирует активность калиевых и кальциевых каналов, а также кальциевых насосов, приводя к уменьшению внутриклеточной концентрации кальция, что в конечном счете вызывает мышечное расслабление. NO инактивируется в течение нескольких секунд, взаимодействуя с супероксидами и образуя комплексы с белками крови, например, с гемоглобином.
Выяснение сигнального пути, вовлекающего NO, привело к пониманию механизма действия нитроглицерина, который уже
204 |
Раздел II. Передача информации в нервной системе |
давно используется при лечении ишемической болезни сердца. Нитроглицерин является донором NO и особенно эффективен для расширения коронарных артерий. Его действие приводит к увеличению кровоснабжения сердца и устранению боли, возникающей при ишемической болезни сердца.
В мозге NO-синтаза связана с ионотропным NMDA рецептором глутамата (глава 3) 54, 55). Кальциевые ионы, входящие через активированный NMDA рецептор, связываются с кальмодулином, и кальций-кальмодулиновый комплекс активирует NO-синтазу 56). Основным эффектом NO в мозге, так же как и в гладких мышцах, является стимуляция гуанилатциклазы 52). NO вовлечен в разнообразные синаптические взаимодействия как у беспозвоночных, так и позвоночных животных 57) - 60).
Свойства монооксида углерода (СО) во многом схожи со свойствами NO 56· 61). CO продуцируется оксигеназой тема, находящейся в эндотелиальных клетках кровеносных сосудов и активирующейся при фосфорилировании протеинкиназой С. Легко растворимый в липидах и воде, СО диффундирует в близлежащие гладкомышечные клетки и стимулирует образование цГМФ, вызывая вазодилятацию. Помимо этого, NO-синтаза и оксигеназа тема были обнаружены в нейронах, располагающихся в стенках кишечника, и было показано, что NO и СО принимают участие в расслаблении гладкомышечных клеток кишечника. Специфическая форма оксигеназы тема (НО2) сконцентрирована в мозге и имеет такое же распределение, как и растворимая гуанилатциклаза, что предполагает участие СО в сигнализации в ЦНС.
Важной особенностью сигналов, опосредованных NO и СО, является то, что эти вещества не могут накапливаться в синаптических везикулах и освобождаться аксонными окончаниями в специфических местах, расположенных возле постсинаптической мембраны с соответствующими рецепторами. Вместо этого, NO и СО равномерно диффундируют от места их синтеза в близлежащие клетки, и их распространение лимитируется только их коротким временем жизни. Этот тип сигнализации, промежуточный между прямой синаптической передачей и освобождением гормонов эндокринными органами в кровеносное русло, называется паракриниым Очевидно, что специфичность эффектов такого рода паракринных сигналов зависит от распределения и свойств ферментов, активируемых или ингибируемых NO или СО.
Модуляция калиевых и кальциевых каналов метаботропными рецепторами
Важным обобщением из всего вышеизложенного является то, что калиевые и кальциевые каналы служат первичной мишенью для модуляции нейромедиаторами, действующими через метаботропные рецепторы. Изменения в активности этих каналов могут влиять на мембранный потенциал покоя, спонтанную активность, на ответы, вызываемые другими возбуждающими и тормозными входами, и на количество кальция, входящего во время потенциала действия. Эти эффекты оказывают очень сильное влияние на сигнализацию в нервной системе. Весьма сложно предсказать, каким образом непрямые механизмы будут модулировать активность каналов в данной клетке. Например, норадреналин и ГАМК уменьшают кальциевые токи в сенсорных нейронах цыпленка через активацию протеинкиназы С37), в то время как ГАМК — но не норадреналин, — действуя через цАМФ-зависимый механизм, продляет кальциевые потенциалы действия в чувствительных нейронах миноги, ингибируя кальций-активируемые калиевые каналы 62). Сложность этих взаимодействий наблюдается и на уровне одной клетки: активность нейронов верхнего ресничного ганглия крысы модулируется по крайней мере девятью медиаторами, действующими через пять связанных с G-белками путей, каждый из которых влияет на активность двух кальциевых каналов и одного калиевого канала 63).
§ 4. Кальций в роли внутриклеточного вторичного посредника
Концентрация кальция в клетках определяется его входом через лигандили потенциалактивируемые каналы (глава 3) и активностью кальциевых насосов и ионных обменников (глава 4). Помимо этого, кальций может освобождаться из внутриклеточных депо при входе в клетку кальция, натрия или под действием IP,64·65). Истощение внутриклеточных депо вызывает открывание расположенных на клеточной мембране кальциевых каналов особого типа, называемых icrac66·67).
Глава 10. Механизмы непрямой синоптической передачи |
205 |
С развитием оптических методов измерения внутриклеточной концентрации кальция было сделано два значительных наблюдения. Во-первых, были обнаружены кальциевые микродомены — особые участки клетки, в которых происходит ограниченное повышение концентрации кальция 68) - 71). Соответственно, эффекты, опосредованные кальцием, зависят от его внутриклеточного распределения, распределения белков, активируемых кальцием, и их мишеней — ферментов и ионных каналов. Во-вторых, было обнаружено, что физиологические сигналы часто вызывают высокодинамичные изменения в концентрации кальция в виде осцилляции, спайков, спарков (искорок) и волн 41· 65· 72· 73). Было также обнаружено, что различные пространственно-временные паттерны изменения внутриклеточной концентрации кальция запускают различные каскады внутриклеточных биохимических реакций 74).
Быстрое ингибирование синаптической передачи, опосредованное кальцием
Синаптическое торможение между эфферентными слуховыми волокнами и волосковыми клетками цыпленка является примером того, как кальций, входя в волосковые клетки через ионотропные рецепторы, действует в качестве вторичного посредника, активируя другие ионные каналы 75). В этом синапсе ацетилхолин, освобождаемый из эфферентных нервных окончаний, активирует на постсинаптической мембране волосковых клеток ионотропные нейрональные ацетилхолиновые рецепторы, которые пропускают в клетку кальций и другие катионы. Можно ожидать, что результатом будет обычное возбуждение, как и в нервномышечном соединении. Однако в волосковых клетках входящий кальций вызывает открывание кальций-активируемых калиевых каналов, тем самым вызывая торможение постсинаптической клетки (рис. 10.16А).
На рис. 10.16В показана схема эксперимента, в котором волосковые клетки регистрировались с помощью методики пэтч--кламп в конфигурации whole-cell (от целой клетки). Короткий пульс АХ вызывал в клетке большой выходящий (тормозной) калиевый ток, которому предшествовал маленький входящий ток. При добавлении в регистрирующий электрод (и соответственно в цитоплазму клетки) кальциевого хелатора ВАРТА выходящий ток исчезал, выявляя замаскированный им значительный входящий катионный ток. Объяснение этому явлению простое: при входе в клетку кальций сразу же связывается с хелатором ВАРТА, что предотвращает его действие на кальций-активируемые кальциевые каналы. Было показано, что похожий механизм торможения существует и в ЦНС 76).
Многообразие путей кальциевой сигнализации
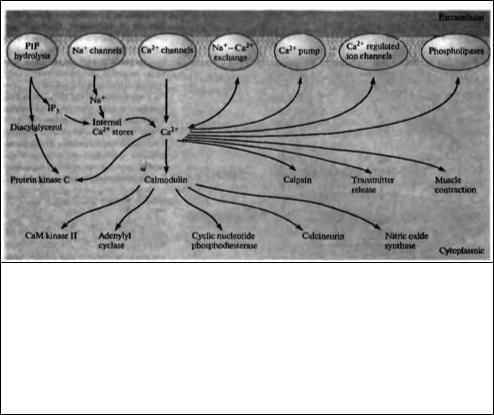
Внутриклеточный кальций регулирует калиевые, катион-селективные и хлорные каналы, расположенные на клеточной мембране, а также активность связанных с мембраной фосфолипаз С и А2 (рис. 10.17) 77). Эти ферменты, вовлеченные в образование внутриклеточных вторичных посредников IР3, диацилглицерола и арахидоновой кислоты, также регулируются G-белками (см. выше). В цитоплазме кальций активирует три основных мишени: протеинкиназу С, кальмодулин и кальций-зависимую протеазу (кальпаин).
Кальпаины являются группой протеаз, которые вовлечены в регуляцию цитоскелета и мембранных белков 78· 79). Кальмодулин является белком с четырьмя местами связывания кальция 80· 81). Когда все эти места связаны с кальцием, кальмодулин становится способным активировать кальций/кальмодулин--зависимую протеинкиназу, аденилатциклазу, фосфодиэстеразу циклических нуклеотидов, протеин фосфатазу (кальцинейрин), а также NOсинтазу.
§ 5. Длительное действие медиаторов непрямого действия
Синаптические взаимодействия, опосредованные непрямыми механизмами, развиваются, как правило, более медленно и длятся намного дольше, чем взаимодействия, опосредованные прямыми механизмами. В нервно--мышечном соединении на скелетной мышце требуется всего одна-две миллисекунды для того, чтобы АХ освободился, прошел через синаптическую щель, связался и открыл ионотропные ацетилхолиновые рецепторы. В случае ответов, опосредованных, например, аденилатциклазой или фосфолипазой

206 |
Раздел II. Передача информации в нервной системе |
Рис. 10.16. Торможение, опосредованное АХактивируемыми катионными каналами, в волосковых клетках цыпленка. (А) АХ связывается с ионотропными рецепторами, через которые катионы, в том числе кальций, входят внутрь клетки. Входящий кальций активирует кальций-зависимые калиевые каналы, вызывая выходящий калиевый ток и гиперполяризацию. (В) В условиях whole--cell регистрации аппликация АХ на основание волосковой клетки вызывает кратковременный ток небольшой амплитуды (отмечен стрелкой), за которым следует выходящий ток большой амплитуды. В интактной клетке такой ток будет приводить к торможению. При добавлении хелатора кальция ВАРТА в регистрирующий электрод (откуда он проникает в цитоплазму) выходящий ток полностью блокируется, поскольку входящий через АХ-рецепторы кальций связывается с хелатором, что предотвращает активацию кальций-- зависимых калиевых каналов.
Fig. 10.16. Inhibition by ACh Activated Cation Channels in hair cells from the chick cochlea. (A) In chick hair cells ACh binds to ionotropic receptors that allow cations, including calcium, to flow into the cell. Intracellular calcium causes calcium-activated potassium channels to open, leading to outward potassium current and hyper-polarization. (B) In a wholecell recording (inset), application of ACh near the base of a hair cell produces a small, transient inward current (arrow) followed by a large outward current. In the intact celt the outward current would be inhibitory. If the calcium chelator BAPTA is added to the recording electrode, and hence to the cell cytoplasm, ACh application produces only inward current. No outward current is seen because incoming calcium ions are chelated and so prevented from activating potassium channels. (Records kindly provided by P. A. Fuchs.)
С, синтез только одной молекулы цАМФ или гидролиз одного мембранного липида занимает несколько миллисекунд. Даже процесс активации мембранного канала при связывании субъединицы G-белка к самому ионному каналу имеет временной ход в секундном диапазоне, что отражает время жизни активной α-субъединицы 82). Ответы, опосредованные ферментативными реакциями с образованием внутриклеточных вторичных посредников типа цАМФ или IР3, имеют еще более длительный временной ход и длятся от нескольких секунд до нескольких минут, что отражает медленные изменения в концентрации вторичных посредников.
В то же время опыт нам подсказывает, что некоторые изменения в передаче сигналов в нервной системе могут сохраняться на всю жизнь. Каким образом могут происходить столь долговременные изменения в эффективности синаптической передачи? Одним из объяснений этому может быть особое свойство протеинкиназ, о которых говорилось в этой главе. Эти ферменты сами по себе являются мишенью для фосфорилирования. Например, изначально активированная кальцием, СаМ-киназа II фосфорилирует сама себя 83). Если фосфорилируются несколько субъединиц, то свойства этого энзима кардинально меняются: он становится постоянно активным, и кальций-кальмодулиновый комплекс больше не требуется для поддержания его активности. Такого рода механизм может обеспечить долговременные изменения в активности киназы, что в свою очередь может привести к столь же длительному изменению в активности белков, являющихся мишенью этого фермента.
Глава 10. Механизмы непрямой синоптической передачи |
207 |
|
|
Рис 10.17. Кальций в роли внутриклеточного вторичного посредника. Концентрация кальция в цитоплазме регулируется его входом через ионные каналы, активностью кальциевых насосов и обменников, секвестрацией во внутриклеточных депо (в том числе в эндоплазматическом ретикулуме), а также освобождением из внутриклеточных депо, которое может вызываться IP, и входом натрия и кальция. В свою очередь, кальций регулирует активность мембранных и цитоплаэматических белков, включая ионные каналы, обменники, насосы, фосфолипазы, протеинкиназу С, кальмодулин и кальпаин.
Fig. 10.17. Calcium as an Intracellular Second Messenger. The concentration of calcium in the cytoplasm is regulated by influx through membrane channels, by the activity of calcium pumps and exchangers in the plasma membrane, by sequestration in internal stores such as the endoplasmic reticulum, and by release from internal storage sites by sodium influx, calcium influx, and IP3. Calcium, in turn, regulates membrane and cytosolic proteins, including ion channels, exchangers, pumps, phospholipases, protein kinase C, calmodulin, and calpain. (After Kennedy, 1989.)
Для того, чтобы изменения сохранялись в течение нескольких дней и больше, обычно требуется изменения на уровне синтеза белков. Было показано, что многие из систем вторичных посредников, описанные в этой главе, вызывают изменения в синтезе белков (рис. 10.18) 84) -- 86). Эти изменения обычно происходят в результате активации одного или более сигнальных каскадов фосфорилирования белков, что приводит к фосфорилированию факторов транскрипции и изменению в экспрессии генов. Самые быстрые эффекты наблюдаются в случае экспрессии немедленных ранних генов c-fos, с-- jun и zif/2681, которые кодируют индуцируемые факторы транскрипции из семейств Fos, Jun и Krox87). По окончании трансляции эти белки входят в ядро, где регулируют последующую экспрессию генов, приводя к метаболическим и структурным изменениям, навсегда изменяющим клеточные свойства.
Выводы
·Нейромедиаторы активируют метаботропные рецепторы в клетках-мишенях. Метаботропные рецепторы сами по себе не являются ионными каналами; они модифицируют работу ионных каналов, ионных насосов и других белков посредством непрямых механизмов.
·Действие метаботропных рецепторов опосредовано G-белками. Примерами метаботропных рецепторов являются мускариновый ацетилхолиновый рецептор; α))и β- адренорецепторы; определенные рецепторы ГАМК, серотонина, дофамина и глугамата; рецепторы нейропептидов, света и одорантов.
·G-белки являются αβγ-гетеротримерами. В состоянии покоя α-субъединица связана с ГДФ, и все три субъединицы связаны в тримерный комплекс. При активации
метаботропного рецептора ГДФ замещается на ГТФ, тример распадается на α-

208 |
Раздел II. Передача информации в нервной системе |
|
|
|
|
|
Рис. |
10.18. |
Сигнальные |
пути, |
|
|
участвующие |
в |
регуляции |
||
|
транскрипции G-белками |
Активация G |
|||
|
белков |
метаботропными |
рецепторами |
||
|
запускает внутриклеточные сигнальные |
||||
|
каскады, |
включая фосфатидилиноэитид |
|||
|
специфическую фосфолипаэу С (PI-- |
||||
|
PLC), аденилатциклазу (АС), Ras и Rac, |
||||
|
которые, в свою очередь, активируют |
||||
|
протеинкинаэы. |
Протеинкиназы |
фос |
||
|
форилируют |
большое |
количество |
||
|
различных белков-мишеней. Фосфорили |
||||
|
рование |
факторов |
транскрипции |
||
|
изменяет экспрессию генов и вызывает |
||||
|
долговременные изменения в клетке. |
||||
Fig. 10.18. G Protein Signaling Pathways Alter Transcription. Activation of G proteins by metabotropic neurotransmitter receptors triggers intracellular signaling cascades involving phosphatidylinositidespecific phospholipase С (PI-PLCV adenylyl cyclase (AC), Ras, and Rac, which activate, in turn, protein kinases. The protein kinases phosphorylate a wide variety of target proteins. Phosphorylation of transcription factors alters gene expression and produces Long-lasting changes in the cell.
и βγ-субъединицы, и свободные субъединицы активируют одну или несколько внутриклеточных мишеней. Активность субъединиц G-белка заканчивается с гидролизом ГТФ до ГДП в результате эндогенной ГТФ-азной активности α-субъединицы и рекомбинацией α- и βγ-субъединиц в тримерный комплекс.
· βγ-субъединицы некоторых С-белков связываются напрямую с ионными каналами, увеличивая или уменьшая их активность; α- или βγ-субъединицы других G-белков активируют аденилатциклазу, фосфолипазу С или фосфолипазу А2, что приводит к образованию внутриклеточных вторичных посредников с широким спектром эффектов.
·Действуя непрямым образом, медиаторы оказывают влияние на работу калиевых и кальциевых каналов. Изменения в работе этих каналов в свою очередь приводят к изменениям потенциала покоя, спонтанной активности, ответов в других синаптических входах, а также в количестве кальция, входящего во время потенциала действия, и, следовательно, в количестве освобождаемого медиатора.
·Изменения в концентрации внутриклеточного кальция или кальций-кальмодулина
регулируют работу ионных каналов и активность фосфолипаз С и А2, протеинкиназы С, кальпаина, аденилатциклазы, фосфодиэстеразы циклических нуклеотидов, NO-синтазы. Важными факторами, определяющими действие кальция, являются распределение изменений концентрации кальция внутри клетки, которое может быть очень локальным, а также динамика этих изменений (кальциевые волны и осцилляции).
·Действие медиаторов, опосредованное непрямыми механизмами, может длится от нескольких миллисекунд до нескольких лет. В основе быстрых эффектов лежат изменения в активности ионных каналов; эффекты с промежуточной длительностью опосредованы активацией и фосфорилированием ферментов и других белков; длительные эффекты связаны с регуляцией синтеза белков.

Глава 10. Механизмы непрямой |
|
синаптической передачи |
209 |
Рекомендуемая литература
Обзоры
оBerridge, M.J. 1998. Neuronal calcium signaling. Neuron 21: 13-26.
оClapham, D.E., and Neer, E.J. 1997. G protein βγ subumts Anna. Rev. Pharmacol. Toxicol. 37: 167-203.
оHamm, H. E. 1998. The many faces of G protein signaling. J.Biol. Chem. 273: 669-672.
оMille, В. 1994. Modulation of ion-channel function by G-protein-coupled receptors. Trends Neurosci. 17: 531535.
оKaczmarek, L. K., and Levitan, I.B. (eds.). 1987. Neuromodulation·. The Biochemical Control of Neuronal Excitability. Oxford University Press, New York.
оLevitan, I. В., and Kaczmarek, L. K. 1997. The Neuron: Cell and Molecular Biology, 2nd Ed. Oxford University Press, New York.
оPiomelli, D. 1994. Eicosanotds in synaptic transmission. Crit. Rev. Neurobiol. 8: 65-83.
оSchmidt, H. H., and Walter, U. 1994. NO at work. Cell 78: 919-925.
оSchulman, H., and Hyman, S. E. 1999. Intra-cellular signaling. In M. J. Zigmond, F. E. Bloom, S. C. Landis, J. L. Roberts, and L. R. Squire (eds.), Fundamental Neuroscienct. Academic Press, New York, pp. 269-316.
оWess, J. 1998. Molecular basis of receptor/G-protetn coupling selectivity. Pharmacol. Ther. 80: 231-264.
Статьи
оDunlap, К., and Fischbach, G. D. 1981. Neu-rotransmitters decrease the calcium conductance activated by depolarization of embryonic chick sensory neurones. J. Physiol. 317: 519-535.
оFlockerzi, V., Oeken, H-J., Hofmann, F., Pelz-er, D, Cavalié, A., and Trautwein, W. 1986. Purified dihydropyridine-bindtng site from skeletal muscle t-tubules is a functional calcium channel. Nature 323: 66-68.
оLambright, D. G., Sondek, J., Bohm, A., Ski-ba, N. P. Hamm, H. E., and Sigler, P. B. 1996. The 2,0 A crystal structure of a heterotnmetnc G protein. Nature 379: 311-319.
A crystal structure of a heterotnmetnc G protein. Nature 379: 311-319.
оSakmann, В., Noma, A., and Trautwein, W. 1983. Acetylcholine activation of single muscarinic K+ channels in isolated pacemaker cells of the mammalian heart. Nature 303: 250-253.
оSunahara, R. K., Tesmer, J.J. G., Gilman, A. G., and Sprang, S. R. 1996. Crystal structure of the adenylyl cyclase activator GS0. Science 278: 1943-1947.
оTesmer, J.J.G., Sunahara, R. K., Gilman, A.G., and Sprang, S. R. 1997. Crystal structure of the catalytic domains of adenylyl cyclase in a complex with G^ · GTP7S. Science 278: 1907-1916.
оWickmann, K. D., Iniguez-Lluhi, J. A., Davenport, P.
Iniguez-Lluhi, J. A., Davenport, P. A., Taussing, R., Krapivinsky, G.B., Under, M. E.,
A., Taussing, R., Krapivinsky, G.B., Under, M. E.,
Gilman, A. G., and Clapham, D. E. 1994. Recombinant G-protein βγ-subuntts activate the muscarinic-gated atrial potassium channel. Nature 368: 255-257.
Цитированная литература
1.Dunlap, К., Holz, G. G., and Rane, S. G. 1987. Trends Neurosci. 10: 244-247.
2.McDonald, T. F, et al. 1994. Physiol. Rev. 74: 365-507.
3.de la Villa, P., Kurahashi, T., and Kaneko, A. 1995. /. Neurosci. 15: 3571-3582.
4.Ji, T. H., Grossmann, M., and Ji, I. 1998. J. Biol. Chem. 273: 17299-17302.
5.Wess, J. 1997. FASEB J. 11: 346-354.
6.Wess, J. 1998. Pharmacol. Ther. 80: 231-264.
7.Hamm, H.E. 1998. J. Biol. Chem. 273: 669-672.
8.Ross, E.M. 1989. Neuron 3: 141-152.
9.Clapham, D. E., and Neer, E.J. 1997. Annu. Rev. Pharmacol. Toxicol. 37: 167-203.
10.Gautam, N., et al. 1998. Cell. Signalling 10: 447-455.
11.Herman, D. M., and Gilman, A. G. 1998. J. Biol. Chem. 273: 1269-Î272.
12.Lambright,D.G.,etal. 1996. Nature 379:311-319.
Nature 379:311-319.
13. Tesmer, J. J. G., et al. 1997. Science 278: 1907-1916.
14.Sunahara, R. K., et al. 1997. Science 278: 1943-1947.
15.Lefkowitz, R.J. 1998. J. Biol. Chem. 273: 18677-18680.
16.Birnbaumer, L., Abramowitz, J., and Brown, A. M. 1990. Biochim. Biophys. Acta 1031: 163-224.
17.Sakmann, В., Noma, A., and Trautwein, W. 1983. Nature 303: 250-253.
18.Brown, A. M., and Birnbaumer, L. 1990. Annu. Rev. Physiol. 52: 197-213.
19.Szabo, G., and Otero, A. S. 1990. Annu. Rev. Physiol. 52: 293-305.
20.Pfafflnger, P. J., et al. 1985. Nature 317: 536-538.
21.Breitwieser, G. E., and Szabo, G. 1985. Nature 317: 538-540.
22.Wickman, K. D., et al. 1994. Nature 368: 255-257.
23.Reuveny, E., et al. 1994. Nature 370: 143-146.

210 |
Раздел II. Передача |
|
информации |
|
в нервной системе |
24.Huang, C.-L.,etaI. 199S. Neuron 15: 1133-1143.
25.Soejima, M., and Noma, A. 1984. Pflugers Arch. 400: 424-431.
26.Lipscombe, D., Kongsamut, S., and Tsien, R.W. 1989. Nature 340: 639-642.
27.Hirning, L. D., et al. 1988. Science 239: 57-61.
28.Ikeda, S.R. 1996. Nature 380: 255-258.
29.Herlitze, S., et al. 1996. Nature 380: 258-262.
30.Tsien, R.W. 1987. In Neuromodulation·. The Biochemical Control of Neuronal Excitability. Oxford University Press, New York, pp. 206-242.
31.Reuter, H., et al. 1983. Cold Spring Harb. Symp. Quant. ВЫ. 48: 193-200.
32.Tsien, R.W., et al. 1981 Cold Spring Harb. Symp. Quant. Biol. 48: 201-212.
33.Taussig, R., and Oilman, A. G. 1995. /. Biol. Chem. 270: 1-4.
34.Tang, W.-J., and Oilman, A. G. 199I. Science 254: 1500-1503.
35 Curtis, B. M., and Catterall, W. A. 1986. Biochemistry 25: 3077-3083.
36.Flockerzi, V., et al. I986. Nature 323: 66-68.
37.Dolphin, A. C. 1990. Annu. Rev. Physiol. 52: 243-255.
38.Dunlap, K., and Fischbach, G. D. I98I. /. Physiol. 317: 519-535.
39.Mudge, A. W., Leeman, S. E., and Fischbach, C. D. 1979. Proc. Natl. Acad. Sci. USA 76:526-530.
40.Berridge, M. J. 1998. Neuron 21: 13-26.
41.Miyazaki, S. 1995. Cuir. Opin. Ceil Biol. 7:190-196.
42.Bazan, N. C. 1999. In Basic Neurochemistry: Molecular, Cellular and Medical Aspects, 6th Ed Lippincott-Raven, Philadelphia, pp. 731-741.
43.Fraser, D. D., et al. I993. Neuron II: 633-644.
44.Fink, M., et al. 1998. EMBOJ. 17: 3297-3308.
45.Majewski, H., and lannazzo, L. 1998. Prog. Neu-robiol. 55: 463-475.
46.Piomelli, D. 1994. Cri/. Леи Neurobiol. 8: 65-83.
47.Piomelli, D., et al. 1987. Nature 328: 38-43.
48.Butiner, Ν., Siegelbaum, S. Α., and Volterra, A. 1989. Nature 342: 553-555.
49.Pieroni, J. P., and Byrne, J. H. 1992. /. Neurosci. 12: 2633-2647.
50.Belkin, K.J., and Abrams, T.W. 1993. /. Neurosci. 13: 5139-5152.
51.Ignarro, L.I. 1990. Pharmacol. Toxicol. 67: 1-7.
52.Schmidt, H. H., and Walter, U 1994. Cell 78: 919-925.
1994. Cell 78: 919-925.
53.Furchgott, R.F., and Zawadzki, J.V. 1980. Nature 288: 373-376.
54.Bredt, D. S., and Snyder, S. H. 1989. Proc. Nail. Acad. Sci. USA 86: 9030-9033.
55.Carthwaite, J., et al. 1989. Eur. J. Pharmacol. 172: 413-416.
56.Snyder, S. H., Jeffrey, S. R., and Zakhary, R. 1998. Brain Res. Brain Res. Rev. 26: 167-175.
57.Daniel, H., Levenes, C., and Crepel, F. 1998. Trends Neurosci. 21: 401-407.
58.Savchenko, A., Barnes, S., and Kramer, R. H. 1997. Nature 390: 694-698.
59.Hawkins, R. D., Zhuo, M., and Arancio, O. 1994. /. Neurobiol. 25: 652-665.
60.Park, J. H., Straub, V. A., and O'Shea, M. 1998. /. Neurosci. 18: 5463-5476.
61.Wang, R. 1998. Can. J. Physiol. Pharmacol. 76: 1-15.
62.Leonard, J. P., and Wickelgren, W.O. 1986. /. Physiol. 375: 481-497.
63.Hille, B. 1994. Trends Neurosci. 17: 531-536.
64.Lipscombe, D., et al. 1988. Neuron 1: 355-365.
65.Tsien, R.W., and Tsien, R.Y. 1990. Annu. Rev. Cell Biol. 6: 715-760.
Annu. Rev. Cell Biol. 6: 715-760.
66.Lewis, R.S. 1999. Adv. Second Messenger Phospho-protein Res. 33: 279-307.
67.Putney, J.W., Jr., and McKay, R, R. 1999. BioEs-says 21: 38-46.
68.Ross, W. N., Arechiga, H., and Nicholls, J. C. 1988. Proc. Natl. Acad. Sci. USA 85: 4075-4078.
69.Bacskai, B.J., et al. 1995. Neuron 14: 19-28.
70.Tucker, T., and Fettiplace, R. 1995. Neuron 15: 1323-1335.
71.Llinôs, R., Sugimori, M., and Silver, R.B. 1995. /. Physioi. (Paris) 89: 77-81.
72.Meyer, T., and Stryer, L. 1991. Annu. Rev. Biophys. Biophys. Chem. 20: 153-174.
73.Cheng, H., et al. 1996. Am. J. Physiol. 270: C148-159.
74.DeKoninck, P., and Schulman, H. I998. Science 279: 227-230.
75.Fuchs, P. A., and Murrow, B. W. 1992. /. Neurosci. 12: 800-809.
A., and Murrow, B. W. 1992. /. Neurosci. 12: 800-809.
76.Wong, L.A., and Gallagher, J.P. 1991. /. Physiol. 436: 325-346.
77.Marty, A. 1989. Trends Neurosci. 12: 420-424.
78.Sorimachi, H., Ishiura S., and Suzuki, Κ. Ι997. Bioc,hem. J. 328: 721-732.
79.Johnson, C.V., and Guttmann, R.P. 1997. BioEs-saysl9: I01I-IOI8.
80.Vogel, H.J. 1994. Biochem. Cell Biol. 72: 357-376.
81.Ghosh, A., and Greenberg, Μ. Ε. Ι995. Science 268: 239-247.
82.Casey, P.J., et al. I988. Cold Spring Harb. Symp. Quant. Biol. 53: 203-208.
83.Miller, S.G., and Kennedy, M.B. 1986. Cell 44: 861-870.
84.Gutkind, J.S. 1998./. Biol. Chem. 273:1839-1842.
85.Schulman, H., and Hyman, S.E. 1999. In Fundamental Neuroscience. Academic Press, New York, pp. 269-
86.Heist, E. K., and Schulman, H. 1998. Cell Calcium 23: 103-114.
87.Tischmeyer, W., and Grimm, R. 1999. Cell. Mol. Lye Sci. 55: 564-574.
Глава 11 Высвобождение медиатора
Стимулом для высвобождения медиатора из терминали является деполяризация нервного окончания. Высвобождение происходит в результате входа ионов кальция в нервное окончание через потенциалзависимые кальциевые каналы. Медиатор высвобождается примерно через 0,5 мс после пресинаптической деполяризации. Эта задержка обусловлена временем, необходимым для открывания кальциевых каналов и кальций-зависимого высвобождения медиатора.
Медиатор высвобождается мультимолекулярными пакетами (квантами), каждый из которых содержит несколько тысяч молекул медиатора. От 1 до 300 квантов (в зависимости от типа синапса) выделяется практически одновременно из нервного окончания в ответ на потенциал действия. В состоянии покоя нервные окончания также высвобождают кванты спонтанно, хотя и с низкой частотой, вызывая в постсинаптической клетке миниатюрные синаптические потенциалы. Помимо этого, в состоянии покоя небольшое количество медиатора высвобождается из нервного окончания неквантовым образом, в виде постоянной утечки.
Один квант нейромедиатора соответствует содержимому одной синаптической везикулы — нескольким тысячам молекул медиатора с низким молекулярным весом. Высвобождение осуществляется посредством экзоцитоза, в результате которого происходит слияние мембраны синаптической везикулы с пресинаптической мембраной и содержимое везикулы высвобождается в синаптическую щель. Компоненты везикулярной мембраны впоследствии эндоцитируются, сортируются в эндосомах и используются для образования новых синаптических везикул.
При рассмотрении процесса высвобождения медиатора пресинаптическими нейронами возникает большое количество вопросов. Для того чтобы ответить на эти вопросы, требуются экспериментальные подходы для определения количества высвобождаемого медиатора с временным разрешением в миллисекундном диапазоне. Во многих экспериментах, представленных в этой главе, эти измерения производились путем измерения мембранного потенциала постсинаптической клетки. Удобным препаратом для исследования процесса высвобождения медиатора является нервномышечное соединение позвоночных, в котором медиатором является АХ. Однако для получения более полной информации о процессе высвобождения необходимо также иметь возможность регистрировать непосредственно от пресинаптических окончаний; это необходимо, например, для того, чтобы определить, каким образом кальций и мембранный потенциал влияют на процесс высвобождения. Пресинаптические окончания в нервно--мышечном соединении позвоночных слишком малы для электрофизиологической регистрации (Морита и Баррет, 19901)). Однако эта регистрация может быть осуществлена в других синапсах, например, гигантском синапсе звездчатого ганглия кальмара 2), гигантских окончаниях биполярных клеток сетчатки золотой рыбки 3), а также в калициформных синапсах цилиарного ганглия птиц 4) и стволе мозга грызунов 5). Более того, некоторые новые методики позволяют исследовать высвобождение медиатора без регистрации от постсинаптической клетки. В этой главе будут рассмотрены электрофизиологические и морфологические эксперименты, которые характеризуют процесс высвобождения. Белки, которые участвуют в высвобождении медиатора, будут описаны в главе 13.

212 |
Раздел II. Передача информации в нервной системе |
§ 1. Основные свойства процесса высвобождения медиатора
Деполяризация нервных окончаний и высвобождение медиатора
Звездчатый ганглий кальмара был использован в экспериментах Катца и Миледи для исследования зависимости между мембранным потенциалом на нервном окончании и количеством высвобождаемого медиатора 6). Препарат и экспериментальный дизайн для одновременной регистрации от нервного окончания и постсинаптического волокна изображены на рис. 11.1 А. После добавления тетродотоксина (ТТХ) в наружный раствор пресинаптический потенциал действия постепенно уменьшается в течение 15 минут (рис. 11.1В).
Рис. 11.1. Пресинаптический импульс и постсиналтический ответ в гигантском синапсе кальмара. (А) Схема звездчатого ганглия кальмара, изображающая два больших аксона, которые образуют химический синапс. В оба аксона введены микроэлектроды. (В) Одновременная регистрация пресинаптических аксонов (серая линия) и постсинаптических аксонов (черная линия) в процессе развития блока проведения тетродотоксином. По мере уменьшения амплитуды пресинаптических потенциалов действия уменьшается также и лостсинаптический потенциал. (Обратите внимание, что два первых ответа вызывают постсинаптический потенциал действия.) (С) Зависимость амплитуды постсинаптического потенциала от амплитуды пресиналтического потенциала. Черными кружками представлены результаты, показанные на части В; серыми кружками представлены результаты, полученные при нанесении деполяризующих пульсов тока на пресинаптическое окончание после полного блокирования потенциала действия тетродотоксином.
Fig. 11.1. Presynaptic Impulse and Postsynaptic Response at a squid giant synapse. (A) Sketch of the stellate ganglion of the squid, illustrating the two Large axons that form a chemical synapse. Both axons can be impaled with microelectrodes as shown. (B) Simultaneous recordings from the presynaptic axons (black records) and postsynaptic axons (grey records) during the development of conduction block by TTX. As the amplitude of the presynaptic action potential decreases, so does the size of the postsynaptic potential. (Note that the two largest presynaptic action potentials evoke postsynaptic action potentials.) (C) The relation between the amplitude of the presynaptic action potential and the postsynaptic potential Grey circles represent results in B; black circles represent results obtained by applying depolarizing current pulses to the presynaptic terminals after complete TTX block. (A after Bullock and Hagiwara, 1957; В and С after Katz and Miledi, 1977c.)
