
Nikolls_-_Ot_neyrona_k_mozgu
.pdf
Глава 4. Транспорт через мембрану клетки |
83 |
·
Рис. 4.8. Предполагаемая молекулярная структура транспортных молекул. Многие транспортные молекулы были успешно клонированы, а их расположение в мембране известно из результатов гидропатического анализа. (А) Натрий-калиевая АТФаза состоит из α-субъединицы, имеющей от 8 до 12 трансмембранных
участков, и меньшей по размеру β-субъединицы, пронизывающей мембрану лишь один раз. Кальциевые АТФазы имеют сходное строение. (В) Натрий-кальциевые обменники насчитывают 11 трансмембранных участков. (С) Калий-хлорные ко--транспортеры, молекулы анионных семенников, а также натрий-калий--хлорные транспортеры имеют 12 трансмембранных участков и похожую конфигурацию в мембране. (D) Суперсемейство транспортных молекул, обеспечивающих закачку моноаминов, ГАМК и глицина, характеризуется наличием 12 трансмембранных участков. (Е) Глутаматные транспортеры меньше по размеру (10 трансмембранных участков).
Fig. 4.8. Proposed Molecular Configurations of Transport Molecules. Various transport molecules have been cloned and their structure in the membrane deduced from hydropathy analyses. (A) Sodium-potassium ATPase consists of an a subunit with 8 to 10 transmembrane segments, and a smaller β subunit that spans the membrane only once. Calcium ATPases have a similar structure. (B) Sodium-calcium exchangers have 11 transmembrane segments. (C) Potassium-chloride cotransporters, anion exchange molecules, and sodium-potassium-chloride transporters all share the same membrane configuration, characterized by 12 transmembrane segments. (D) The superfamily of transporters for the uptake of monoammes, GABA, and glycine has a motif of 12 transmembrane segments. (E) Glutamate transport molecules are smaller, with 10 transmembrane segments.
изводящих закачку в нервное окончание норэпинефрина (NET), серотонина (SERT), дофамина (DAT), ГАМК (GAT) и глицина (GLYT), позволяет заключить, что все они происходят от одного суперсемейства генов 66). Переносчики моноаминов представляют особый интерес, поскольку именно они являются мишенью для многих наркотических веществ, включая кокаин и амфетамин, а также некоторых антидепрессантов (глава 13). Каждый член суперсемейства представлен несколькими изотипами. Белки имеют молекулярную массу от 80 до 100 кД и, как следует из гидропати-
84 _Раздел II. Передача информации в нервной системе_____________________
ческого анализа, состоят из 12 трансмембранных сегментов (рис. 4.8D). По первичной последовательности молекулу переносчика холина также можно отнести к этому суперсемейству 67).
В настоящее время изолировано пять белков, осуществляющих закачку глутамата 68). Они структурно отличаются от суперсемейства переносчиков моноаминов, ГАМК и глицина. Размер этих белков сравнительно невелик, от 500 до 600 аминокислот, при массе около 65 кД. Гидропатические данные свидетельствуют о наличии 10 трансмембранных сегментов (см. рис. 4.8Е).
Семейства белков, осуществляющих закачку моноаминов, глицина, ГАМК, глутамата и ацетилхолина в синаптические пузырьки, функционально отличаются тем, что зависят не от натриевых, а от протонных градиентов. Везикулярные переносчики моноаминов (VMAT1 и VMAT2) были клонированы раньше других, за ними последовал везикулярный переносчик ацетилхолина (VAChT) 38). Каждая из этих молекул включает в себя от 520 до 530 аминокислот и, судя по гидропатическим данным, состоит из 12 трансмембранных сегментов. Структура VMAT1 и VMAT2 совпадает на 65 %, a VAChT идентичен им на 40 %. Молекулы переносчиков ГАМК и глицина также были успешно клонированы 69, 70). Они структурно отличаются от переносчиков моноаминов и ACh и состоят всего из 10 трансмембранных сегментов.
§ 7. Роль механизмов транспорта
Как первичные, так и вторичные механизмы активного транспорта вносят постоянный вклад в поддержание клеточного гомеостаза, а также поставляют необходимые элементы для синаптической передачи. Тем не менее, этими простыми на первый взгляд процессами их роль в жизнедеятельности нервной системы не ограничивается. Переносчики вносят существенный вклад в работу сигнальных систем клетки. Так, например, в небольших ответвлениях нервных окончаний во время распространения потенциала действия, активация натрий-калиевых АТФаз вследствие накопления внутриклеточного натрия может вызвать блок проводимости (глава 15). Другой пример связан с активацией рецепторов ГАМКА, которые образуют хлорные каналы в мебране клетки (глава 3). В тех клетках, из которых переносчики выводят хлор наружу, внутриклеточные концентрации этого иона низки, и при открывании хлорных каналов ГАМКА-рецепторов хлор входит в клетку, вызывая гиперполяризацню мембранного потенциала. Напротив, в тех клетках, где преобладают переносчики ионов хлора из внеклеточного пространства в цитоплазму, внутриклеточный уровень хлора сравнительно высок, и открывание ГАМКА-каналов приводит к деполяризации за счет выхода хлора из клетки 37). Таким образом, характер действия медиатора непосредственно определяется наличием тех или иных переносчиков в клетке.
Еще более важную роль играют переносчики нейромедиаторов. Быстрое удаление молекул медиатора из синаптической шели может предотвратить избыточную активацию, а также инактивацию рецепторов. Своевременная закачка медиатора в синаптические пузырьки поддерживает нервное окончание в состоянии постоянной готовности. Следовательно, переносчики выполняют важнейшую функцию регуляции динамических свойств синапсов и нервной системы в целом.
Вообще говоря, следует рассматривать ионные каналы как системы, проводящие электрические сигналы, а переносчики — как системы обеспечения базовых условий, при которых такое проведение становится возможным. Следует отметить, что между этими двумя системами зачастую происходят и более сложные взаимодействия, влияющие на работу нервной системы.
Выводы
·Перенос различных веществ через мембрану в клетку или из клетки производится целым рядом мембранных белков. Один из примеров — натрий-калиевый обменник, переносящий три иона натрия наружу и два иона калия внутрь клетки за счет энергии гидролиза одной молекулы АТФ. Обменник поддерживает внутриклеточную концентрацию натрия и калия на постоянном уровне, несмотря на утечку обоих ионов.
·Низкий уровень внутриклеточного кальция поддерживается двумя типами кальциевых АТФаз. АТФаза первого типа, расположенная в плазматической мембране, осуществляет вывод кальция из клетки. Второй тип находится в мембранах

Глава 4. Транспорт через мембрану клетки |
85 |
эндоили саркоплазматического ретикулума и обеспечивает откачку кальция из цитоплазмы во внутриклеточные органеллы.
·Еще один механизм кальциевого транспорта — натрий-кальциевый обменник. Энергия, получаемая от перемещения натрия внутрь клетки, т. е. в направлении его электрохимического градиента, затрачивается на вывод ионов кальция наружу. Это пример вторичного переносчика, работа которого · зависит от поддержания натриевого градиента натрий-- калиевой АТФазой. В большинстве нейронов перенос одного иона кальция происходит за счет входа в клетку трех ионов натрия. При некоторых физиологических условиях натрийкальциевый обменник может работать в противоположном направлении. В палочках сетчатки транспортная молекула переносит один нон кальция и один ион калия в обмен на четыре иона натрия, входящих в клетку.
·Существует два основных типа молекул, осуществляющих вывод хлора из клетки. Первый
— хлор-бикарбонатный обменник, играющий также важную роль в регуляции внутриклеточного рН и зависящий от электрохимического градиента натрия. Второй — калийхлорный ко-переносчик, работа которого основана на перемещении калия из клетки наружу, т. е. в направлении его электрохимического градиента.
В некоторых типах клеток хлор не выводится наружу, а наоборот, аккумулируется в клетке. Этот процесс зависит от натриевого градиента и сопровождается входом в клетку ионов калия.
·В пресинаптических нервных окончаниях перемещение молекул медиатора в синаптические пузырьки происходит в обмен на выход из них протонов. Протонный градиент на везикулярной мембране поддерживается водородными АТФазами.
·После выброса в синаптическую щель молекулы медиатора закачиваются обратно при помощи систем вторичного транспорта, которые зависят от электрохимического градиента натрия. Существует два типа систем закачки медиатора: система, в которой перенос глутамата связан с входом натрия и выходом калия, и системы закачки других медиаторов, связанной с входом в клетку ионов натрия и хлора.
·Для большинства переносчиков последовательность образующих их аминокислот известна, а гидропатический анализ позволяет сделать предположения об их конформации в мембране клетки. Как правило, молекулы переносчиков состоят из 10-12 трансмембранных участков и, по-видимому, образуют канало-подобные структуры, перенос веществ через которые осуществляется путем попеременного выдвижения посадочных мест во внутриклеточную и внеклеточную среды.
Рекомендуемая литература
оAltamirano, Α. Α., and Russell, J. M. 1987. Coupled Na/K/Cl efflux. "Reverse" unidirectional fluxes in
squid giant axons. /. Gen. Physlol. 89: 669-686. о Baker, P. F, Hodgkin, A. L., and Ridgeway, Ε. Β. 1971. Depolarization and calcium entry in squid
giant axons. /. Physiol. 218: 709-755. о Kanner, B.I. 1994. Sodium-coupled neurotransmitter transport: Structure, function and regulation. J.
Exp. Biol. [96: 237-249. о Schatzmann, H. J. 1989. The calcium pump of the surface membrane of the sarcoplasmic reticulum.
Ann. Rev. Physiol. 51: 473-485. о Schnetkamp, P. P. 1995. Calcium homeostasis in vertebrate retinal rod outer segments. Cell Calcium
18: 322-330.
оSchuldiner, S., Shirvan, A., and Linial, M. 1995. Vesicular neurotransmitter transporters: From bacteria to humans. Physiol. Rev. 75: 369-392.
оSimpson, P. В., Challiss, R. A. J., and Nahorski, S. R. 1995. Neuronal Ca2+ stores: Activation and function.
Trends Neurosci. 18: 299-306.
оSkou, J. C. 1988. Overview: The Na.K pump. Methods Enzymol. 156: 1-25.
оThomas, R. C. 1969. Membrane currents and in-tracellular sodium changes in a snail neurone during extrusion of injected sodium. /. Physiol. 201: 495-514.

86 |
Раздел II. Передача информации в нервной |
|
системе |
Цитированная литература
1.Hodgkin, A. L., and Keynes, R. D. 1955. J. Physiol. 128: 28-60.
2.Caldwell, P. C, et al. 1960. J. Physiol. 152: 561-590.
3.Skou, J. C. 1957. Biochim. Biophys. Acta 23: 394-401.
4.Skou, J.C. 1988. Methods Enzymol. 156: 1-25.
5.Baker, P.P., et al. 1969. J. Physiol. 200: 459-496.
6.Thomas, R.C. 1969. J. Physiol. 201: 495-514.
7.Thomas, R.C. 1972. J. Physiol. 220: 55-71.
8.Simpson, P. В., Challjss, R. A. J., and Nahorski, S. R. 1995. Trends Neurosci. 18: 299-306.
9.Babcock, D. F., et al. 1997. J. Cell ВЫ. 136: 833-844.
10.Baker, P.P., Hodgkin, A. L, and Ridgeway, E.B. 1971. J. Physiol. 218: 709-755.
11.Tsien, R.Y. 1988. Trends Neurosci. 11:419-424.
12.Miyawaki, A., et al. 1997. Nature 388: 882-887.
13.Persechini, A., Lynch, J. A., and Romoser, V. A. 1997. Cell Calcium 22: 209-216.
14.Golovina, V. A., and Blaustein, M. P. 1997. Science 275: 1643-1648.
15.Edes, I., and Kranias, E.G. 1995. In Cell Physiology Source Book. Academic Press, New York, pp. 156-165.
16.Schatzmann, H.J. 1989. Annu. Rev. Physiol. 51: 473-485.
17.Carafoli, E. 1994. FASEBJ. 8: 993-1002.
18.DiPolo, R., and Beaugé, L. 1979. Nature 278: 271-273.
19.Reuter, H., and Seitz, N. 1968. J. Physiol. 195: 451-470.
20.Baker, P. P., and Blaustein, M. P. 1968. Biochim. Biophys. Acta 150: 167-179.
21.Baker, P. P., et al. 1969. J. Physiol. 200: 431-458.
22.Caputo, C., Bezamlla, P., and DiPolo, R. 1989. Biochim. Biophys. Acta 986: 250-256.
23.Rasgado-Flores, H., Santiago, E. M., and Blaustein, M.P. 1989. J.Gen. Physiol. 93: 1219-1241.
24.Philipson, K. D., et al. 1996. Ann. N. Y. Acad Sci. 779: 20-28.
25.LeBlanc, N., and Hume, J. R. 1990. Science 248: 372-376.
26.Lipp, P., and Niggli, E. 1994. J. Physiol. 474: 439-446.
27.Bridge, J. H. В., Smolley, J. R., and Spitzer, K. W. 1990. Science 248: 376-378.
28.Schnetkamp, P. P., Basu, D. K., and Szerencsei, R.T. 1989. Am. J. Physiol. 257: C153-C157.
29.Cervetto, L., et al. 1989. Nature 337: 740-743.
30.Schnetkamp, P.P. 1995. Cell Calcium 18: 322-330.
31.Inagaki, С, Нага, M., and Zeng, H.T. 1996. /. Exp. Zoo/. 275: 262-268.
32.Thomas, R.C. 1977. J. Physiol. 273: 317-338.
33.Payne, J.A. 1997. Am. J. Physiol. 273: C1516-C1525.
34.Kaplan, M. R., et al. 1996. Annu. Rev. Physiol. 58: 649-668.
35.Russell, J. M. 1983. J. Gen. Physiol. 81: 909-925.
36.Altamirano, A. A., and Russell, J. M. 1987. /. Gen. Physiol. 89: 669-686.
37.Rohrbough, J., and Spitzer, N. C. 1996. J. Neurosci. 16: 82-91.
38.Schuldiner, S., Shirvan, A., and Linial, M. 1995. Physiol. Rev. 75: 369-392.
39.Varoqui, H., and Erickson, J. D. 1997. Mol. Neu-robiol. 15: 165-191.
40.Schuldiner, S., Steiner-Mordoch, S., and Yelin, R. 1998. Adv. Pharmacol. 42: 223-227.
41.Hartinger, J., and Jahn, R. 1993. J. Biol. Chem. 268: 23122-23127.
42.Barbour, В., et al. 1994. Neuron 12: 1331-1343.
43.Tong, G., and Jahr, С. Е. 1994. Neuron 13: 1195-1203.
44.Kanner, B. I. 1994. J. Exp. Biol. 196: 237-249.
45.Kanai, Y. 1997. Curr. Opin. Cell Biol. 4: 565-572.
46.Bouvier, M., et al. 1992. Nature 360: 471-474.
47.Hediger, M.A., et al. 1995. J. Physiol. 482P: 7S-17S.
48.Mager, S., et al. 1996. /. Neurosci. 16: 5405-5414.
49.Attwell, D., Barbour, В., and Szatkowski, M. 1993. Neuron 11:401-407.
50.Cammack, J. N., and Schwartz, E. A. 1993. J. Physiol. 472: 81-102.
51.Takahashi, M., et al. 1997. J. Exp. Biol. 200: 401-409.
52.Cooper, J. R., Bloom, F. E., and Roth, R. H. (eds.). 1996. The Biochemical Basis of Neuropharmacology. Oxford University Press, New York, pp. 194-225.
53.Pressley, T. A. 1996. Miner. Electrolyte Metab. 22: 264-271.
A. 1996. Miner. Electrolyte Metab. 22: 264-271.
54.Chow, D. C., and Forte, J. G. 1995. J. Exp. Biol. 198: 1-17.
55.Kawakami, K., et al. 1985. Nature 316: 733-736.
56.Noguchi, S., et al. 1986. FEBS Lett. 196: 315-320.
57.Anderson, J. P., and Vilsen, B. 1995. FEBS Lett. 359: 101-106.
58.Filoteo, A. G., et al. 1997. J. Biol. Chem. 272: 23741-23747.
59.Nicoll, D.A., Longoni, S., and Philipson, K. D. 1990. Science 250: 562-565.
60.Philipson, K. D., et al. 1996. Ann. N. Y. Acad. Sci. 779: 20-28.
61.Cook, О., Low, W., and Rahamimoff, H. 1998. Biochim. Biophys. Acta 1371: 40-52.
62.Reilënder, H., et al. 1992. EMBOJ. 11:1689-1695.
63.Payne, J. A., Stevenson, T. J., and Donaldson, L. F. 1996. J.Biol. Chem. 271: 16245-16252.

Глава 4. Транспорт через мембрану клетки |
87 |
64.Gillen, С., et al. 1996. J. Вiоl. Chem. 271: 16237-16244.
65.Alper, S. L. 1991. Annu. Rev. Physiol. 53: 549-564.
66.Nelson, N.. and Lill, H. 1994. J. Exp. ВЫ. 196: 213-228.
67.Mayser, W., Schloss, P., and Betz, H. 1992. FEBS Lett. 305: 31-36.
68.Palacin, M., Estuvez, R., Bertran, J., and Zorzano, A. 1998. Physiol Rev. 78: 969-1054.
69.Mclntire, S. L., et al. 1997. Nature 389: 870-876.
70.Sagne, G, et al. 1997. FEBS Lett. 417: 177-183.
Глава 5 Ионные механизмы потенциала покоя
В состоянии покоя на мембране нейронов поддерживается постоянный электрический потенциал, при этом внутриклеточная среда заряжена отрицательно по отношению к внеклеточной. Поскольку внутри клетки больше ионов калия и меньше ионов натрия и хлора, чем снаружи, то каждый из этих ионов стремится проникнуть сквозь мембрану в направлении своего электрохимического градиента, то есть ионы калия стремятся наружу, а ионы натрия и хлора — внутрь клетки. Этому перемещению препятствует мембранный потенциал. Если представить себе упрощенную модель клетки, мембрана которой проницаема лишь для калия и хлора, то в ней возможен такой баланс между концентрационными градиентами и мембранным потенциалом, при котором суммарный ток каждого из этих ионов равен нулю. Тогда мембранный потенциал будет в точности равен равновесному потенциалу для этих двух ионов.
Если в такой модели изменить внеклеточную концентрацию калия, то изменится равновесный потенциал для калия, а следовательно и мембранный потенциал. Изменение внеклеточной концентрации хлора, напротив, приведет к соответствующему изменению его внутриклеточного уровня. При этом ни равновесный потенциал для хлора, ни мембранный потенциал не изменятся.
Мембрана реальной клетки проницаема также для натрия. В состоянии покоя ионы натрия непрерывно перемещаются внутрь клетки, снижая таким образом отрицательный заряд на мембране. Поскольку при этом калий уже не находится в равновесии, он начинает вытекать из клетки. Если бы не механизмы компенсации, то такое перемещение натрия и калия привело бы к изменению их внутриклеточных концентраций. Этого не происходит благодаря работе натрий--калиевого насоса-обменника, переносящего ионы натрия наружу и ионы калия внутрь клетки в пропорции 3:2. Мембранный потенциал покоя зависит от калиевого и натриевого равновесного потенциала, относительной проницаемости клеточной мембраны для этих ионов, а также от стехиометрии натрий-калиевого насоса. В состоянии покоя скорость переноса натрия и калия насосом в точности компенсирует пассивную утечку этих ионов. Натрий-калиевый обменник вносит также непосредственный вклад в мембранный потенциал (в размере нескольких милливольт), поокольку он перемещает больше положительных зарядов наружу, чем внутрь клетки.
В зависимости от механизмов транспорта, равновесный потенциал для хлора может быть как более, так и менее отрицательным по отношению к потенциалу покоя. Наличие значительной хлорной проницаемости играет важную роль в обеспечении электрической стабильности многих клеток, несмотря на то, что распределение ионов хлора не столь важно для формирования потенциала покоя.
Возникновение электрических сигналов в нервной клетке происходит в основном за счет изменения проницаемости мембраны для таких ионов, как натрий и калий. Увеличение проницаемости мембраны позволяет ионам перемещаться внутрь или наружу клетки в направлении своих электрохимических градиентов. Как показано в главе 2, изменения проницаемости зависят от активации ионных каналов. Перемещение ионов через каналы в мембране приводит к изменению заряда на ней и, следовательно, мембранного потенциала. Чтобы понять принцип возникновения электрического сигнала, необходимо уяснить сущность ионных градиентов на мембране, а также то, как они влияют на потенциал покоя.
§ 1. Идеальная клетка
Начнем с рассмотрения модели идеальной клетки, показанной на рис. 5.1. В этой клетке содержатся ионы калия, натрия и хлора, а так-
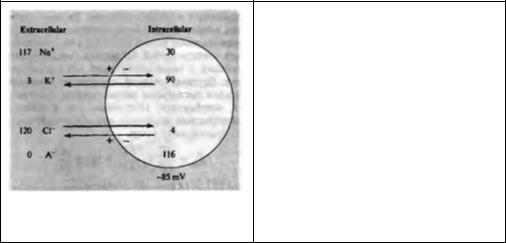
Глава 5. Ионные механизмы потенциала покоя |
89 |
Рис. 5.1. Распределение ионов в идеальной клетке. Мембрана проницаема для К и Cl , но непроницаема для Na и внутриклеточных анионов (А ). Концентрационный градиент ионов калия способствует выходу этих ионов из клетки (черная стрелка); градиент потенциала стремится перенести ионы калия внутрь клетки (серая стрелка). В состоянии покоя эти две силы уравновешивают друг друга. Концентрационный и электрический градиенты для хлора имеют противоположные направления. Ионные концентрации выражены в мил лимолях (ммоль).
Fig. 5.1. Ion Distributions in a Model Cell. The cell membrane is impermeable to Na– and to the internal anion (A–), and permeable to K+ and Cl–. The concentration gradient for K+ tends to drive it out of the cell (black arrow); the potential gradient tends to attract K+ into the cell (grey arrow). In a cell at rest the two forces are exactly in balance. Concentration and electrical gradients for Cl – are in the reverse directions. Ion concentrations are expressed in millimolar (mM)
же крупные анионы. Клетка помещена в раствор, содержащий ионы натрия и калия. Другие ионы, присутствующие в реальных клетках, не играют важной роли в формировании потенциала покоя и потому не рассматриваются в данной модели. Концентрации ионов внутри и снаружи клетки приблизительно соответствуют средним величинам, полученным на клетках лягушки. В клетках птиц и млекопитающих эти значения несколько выше, а у таких морских беспозвоночных, как кальмар — значительно выше, чем у лягушки (см. табл. 5.1). В настоящей модели рассматривается клеточная мембрана, проницаемая для калия и хлора, но не для натрия и внутриклеточных анионов. Для того чтобы клетка пребывала в стабильном состоянии, необходимо выполнение трех условий:
1.Как внутриклеточная, так и внеклеточная среды должны быть электрически нейтральными. Так, например, раствор не может состоять из одних лишь ионов хлора. Отрицательный заряд этих ионов должен компенсироваться такими положительными ионами, как натрий или калий (иначе взаимное отталкивание одинаково заряженных частиц приведет к разрушению раствора).
2.Клетка должна находиться в осмотическом равновесии. В противном случае вода будет проникать в клетку (или вытекать из нее) до тех пор, пока равновесие не будет достигнуто. Осмотическое равновесие наступает при условии равенства суммарной концентрации растворенных частиц внутри и вне клетки.
3.Суммарный заряд каждого отдельно взятого иона, переносимый через мембраны клетки, должен равняться нулю.
Ионное равновесие
Как создаются и поддерживаются ионные градиенты и соответствующий электрический потенциал? На рис. 5.1 показано, что ионы находятся в положении обратной пропорциональности: ионы калия более концентрированы внутри клетки, а ионы хлора снаружи. Представим себе, что мембрана клетки проницаема только для ионов калия. Возникает вопрос, почему эти ионы не диффундируют из клетки наружу до тех пор, пока концентрации внутри и снаружи клетки не сравняются. Причина этого заключается в том, что если ионы калия покидают клетку, то снаружи накапливается положительный заряд, а внутри клетки образуется избыток заряда отрицательного. Возникший таком образом электрический потенциал снижает скорость перемещения ионов калия, а при достижении определенного уровня приводит к полному его прекращению. Это равновесный потенциал для калия (Ек). При потенциале Ек электрический градиент полностью уравновешивает градиент химический, в результате чего движение ионов прекращается. Отдельные ионы калия по прежнему втекают в клетку и вытекают из нее, но суммарный ток равен нулю. Ионы калия находятся в равновесии.
Условия нахождения ионов калия в равновесии те же самые, что описаны в главе 2 при рассмотрении нулевого суммарного тока через одиночный канал в небольшом участке (patch) мембраны. В этом случае концентрационный градиент уравновешивался потенциалом, при-

90 |
Раздел II. Передача информации в нервной системе |
ложенным к patch-электроду. Важное отличие описываемой здесь ситуации в том, что перемещение ионов само по себе производит электрический потенциал, уравновешивающий и останавливающий это перемещение. Другими словами, равновесие в данной модели достигается автоматически и является неизбежным. Напомним, что в главе 2 равновесный потенциал для калия получался из уравнения Нернста:
где [К]1 и [К]0 — внутриклеточная и внеклеточная концентрации калия, соответственно. Для
клетки, изображенной на рис. 5.1, получим ЕK = -85 мВ.
Допустим теперь, что в мембране, кроме калиевых, присутствуют еще и хлорные каналы. Поскольку для анионов z = — 1, получим равновесный потенциал для хлора:
или, пользуясь свойствами логарифма,
Для модели идеальной клетки получим соотношение концентраций хлора, которое тоже равно 1 : 30, и хлорный равновесный потенциал, равный -85 мВ. Как и в случае с калием, мембранный потенциал величиной в -85 мВ в точности уравновешивает стремление ионов хлора двигаться в направлении их концентрационного градиента, т. е. внутрь клетки.
Обобщая вышесказанное, можно заключить, что мембранный потенциал препятствует перемещению как хлора внутрь клетки, так и калия из клетки наружу. Равновесные потенциалы для двух ионов равны благодаря тому, что соотношения их внеклеточных и внутриклеточных концентраций одинаковы ( 1 : 30). Поскольку калий и хлор единственные ионы в нашей модели, способные проникать через мембрану клетки, и при -85 мВ оба иона находятся в равновесии, то клетка может находиться сколь угодно долго в состоянии покоя, при котором суммарное перемещение ионов в клетку и из клетки будет равно нулю.
Электрическая нейтральность
Перемещение иоиов калия наружу и ионов хлора внутрь клетки приводит к накоплению отрицательного заряда в клетке и положительного — во внеклеточном пространстве. На первый взгляд, такая ситуация противоречит принципу электрической нейтральности, однако это не так. Ионы калия, покидая клетку, накапливаются в непосредственной близости от ее мембраны, в то время как их отрицательно заряженные спутники остаются внутри клетки вблизи от внутренней поверхности той же мембраны. И те и другие фактически оказываются вне основной части раствора, как вне-, так и внутриклеточного. Также и ионы хлора, входя в цитоплазму, остаются вблизи от мембраны, а их спутники, оставленные перед проходом через мембрану, скапливаются поблизости от нее. Образуются два слоя ионов — катионов снаружи и анионов внутри клетки, которые удерживаются у мембраны благодаря взаимному притяжению. Таким образом, мембрана играет роль электрической емкости, разделяющей и запасающей заряд.
Вышесказанное не означает, что ионы калия и хлора прикованы к поверхностям мембраны. Отдельные ионы свободно обмениваются с ионами внутриили внеклеточного раствора. Тем не менее, заряд, накопленный на мембране, остается неизменным, а растворы — нейтральными.
Интересным представляется вопрос, какую долю от общего количества ионов в клетке составляют ионы, накапливающиеся на мембране. Доля их весьма незначительна. Если предположить, что диаметр клетки составляет 25 мкм, то при концентрации 120 ммоль общее количество катионов (а следовательно, и анионов) получится 4 1012. При мембранном потенциале -85 мВ величина заряда, разделенного мембраной, составляет приблизительно 5 1011 одновалентных ионов на см2 (глава 7). При площади поверхности клетки 8 10–5 см2 получается, что иа внутренней поверхности мембраны накапливается около 4 107 отрицательных ионов, или одна стотысячная часть общего числа ионов во внутриклеточном растворе. Следовательно, перемещение ионов калия и хлора, достаточное для создания мембранного потенциала, никак не влияет на концентрации ионов в клетке.
Влияние внеклеточного калия и хлора на мембранный потенциал
На мембранный потенциал нейронов, а также многих других клеток, влияют изменения вне-

Глава 5. Ионные механизмы потенциала покоя |
91 |
Рис. 5.2. Влияние изменений внеклеточных концентраций ионов на внутриклеточные концентрации и на мембранный потенциал. (А) Внеклеточный уровень калия удвоен, а концентрация натрия снижена с целью сохранения осмолярности на прежнем уровне. (В) Половина ионов внеклеточного хлора заменена на анионы, не проникающие через мембрану (А ). Ионные концентрации выражены в миллимолях (ммоль), объем внеклеточного пространства рассматривается как бесконечно большой в сравнении с объемом клетки, поэтому вход и выход ионов через мембрану не изменяет их внеклеточных концентраций.
Fig. 5.2. Effects of Changing Extracellular Ion Composition on intracellular ion concentrations and on membrane potential. (A) Extracellular K+ concentration is doubled and, to keep osmolarity constant Na+ concentration is reduced.
(B) Half the extracellular Cl– is replaced by an impermeant anion. A–. Ion concentrations are in millimolar (mM), and extracellular volumes are assumed to be very large with respect to cell volumes, so fluxes into and out of the cell do not change extracellular concentrations.
клеточной концентрации калия, но не хлора. Обратимся к модели идеальной клетки. Сделаем допущение (для рассмотрения данной ситуации), что объем внеклеточной жидкости бесконечно велик, и что перемещение ионов не влечет за собой значительного изменения концентрации ионов вне клетки. На рис. 5.2А показаны изменения внутриклеточного ионного состава и мембранного потенциала, вызванные повышением внеклеточного уровня калия с 3 до 6 ммоль. Для сохранения первоначальной осмолярности, одновременно с добавлением 3 ммоль калия из раствора удалили 3 ммоль натрия, в результате чего общая
концентрация растворенных ионов осталась на уровне 240 ммоль. Увеличение внеклеточной концентрации калия приводит к снижению его трансмембранного градиента, движущего ионы из клетки наружу. При этом на начальном этапе мембранный потенциал не меняется. В результате происходит перенос суммарного положительного заряда внутрь клетки. Вследствие накопления положительного заряда на внутренней поверхности мембраны она деполяризуется. Ионы натрия благодаря деполяризации выходят из состояния равновесия и начинают двигаться внутрь клетки. Перемещение ионов калия и хлора продол-
92 |
Раздел II. Передача информации в нервной системе |
жается до тех пор, пока не будет достигнуто новое равновесное состояние, основанное на новом соотношении концентраций и новом уровне мембранного потенциала, в данном примере —68 мВ.
Вход калия и хлора сопровождается втоком в клетку некоторого количества воды, приводящим к небольшому увеличению объема клетки. В процессе достижения нового состояния равновесия концентрация калия возрастает с 90 до 91 ммоль, хлора — с 4 до 7,9 ммоль, а объем клетки увеличивается на 3,5 %. На первый взгляд кажется, что количество вошедшего в клетку хлора превышает количество калия, но представим себе, каковы были бы эти концентрации, если бы объем клетки не увеличился: концентрации обоих ионов были бы выше на 3,5%. Следовательно, вместо 7,9 ммоль концентрация хлора была бы 8,2 ммоль, а концентрация калия была бы на уровне 94,2 ммоль, то есть увеличение обеих концентраций составило бы 4,2 %. Таким образом, сначала калий и хлор входят в клетку в приблизительно равных количествах (за исключением незначительного количества, необходимого для изменения заряда на мембране), а уже затем вода втекает в клетку, снижая концентрации обоих ионов до окончательного уровня.
Сходные рассуждения применимы и в случае увеличения внеклеточной концентрации хлора, с той лишь разницей, что при этом мембранный потенциал не меняется. На рис. 5.2В показан результат 50-процентного снижения концентрации хлора во внеклеточном растворе путем замены 60 ммоль хлора на другой анион, не проникающий через мембрану. Ионы хлора вытекают из клетки, тем самым деполяризуя мембрану до нового хлорного равновесного уровня (-68 мВ). Калий, выведенный из равновесия, также начинает вытекать из клетки. Как и в предыдущем примере, оба иона покидают клетку в равных количествах, увлекая за собой воду. Снижение внутриклеточного уровня калия невелико в процентном отношении, поскольку начальная его концентрация в клетке высока. Напротив, снижение внутриклеточного уровня хлора весьма существенно, и оно влечет за собой значительное изменение равновесного потенциала для хлора. По мере выхода хлора из клетки значение равновесного хлорного потенциала вновь приближается к первоначальному. Процесс продолжается до тех пор, пока равновесные потенциалы для хлора и калия не сравняются и мембранный потенциал не восстановит свое прежнее значение.
§ 2. Мембранный потенциал в аксоне кальмара
Гипотеза о том, что в основе мембранного потенциала лежит различие между внеклеточной и внутриклеточной концентрациями калия, была впервые высказана Бернштейном 1) в 1902 г. Ему не удалось проверить свое предположение экспериментально, поскольку в то время не существовало способа измерения мембранного потенциала. В наши дни можно с высокой точностью измерить мембранный потенциал, а также убедиться в том, что изменения концентрации калия внутри и снаружи клетки приводят к изменениям мембранного потенциала в соответствии с предсказаниями уравнения Нернста.
Впервые такие измерения были проведены на гигантском аксоне кальмара. Аксон этот достигает 1 ммоль в диаметре 2), что позволяет вводить в него электроды с целью прямого измерения мембранного потенциала (рис. 5.3А). Более того, аксон кальмара удивительно живуч и продолжает функционировать, даже если из него выдавить цитоплазму с помощью резинового валика и заменить ее на перфузионный раствор (рис. 5.3В и С). У исследователя есть возможность контролировать ионный состав как внеклеточного, так и внутриклеточного растворов. А. Л. Ходжкин, вместе с А. Ф. Хаксли впервые поставивший многие эксперименты
на аксоне кальмара (за которые они позже были удостоены Нобелевской премии), однажды сказал 3):
Можно утверждать, что введение Юнгом в 1936 году препарата аксона кальмара имело для науки об аксоне большее значение, чем какое-либо другое открытие, сделанное за последние 40 лет. Один выдающийся нейрофизиолог заметил недавно во время ужина на одном из конгрессов (не самым тактичным образом, должен признать): «Если честно. Нобелевскую премию нужно было присвоить кальмару».
Концентрации основных ионов в крови кальмара, а также в цитоплазме его аксона, приведены в табл. 5.1 (такие ионы, как магний и внутриклеточные анионы, опущены). Эксперименты на изолированном аксоне обычно проводятся в морской воде, соотношение концентраций калия во внутриклеточной и внеклеточной средах составляет при этом 40 : 1.
