
Nikolls_-_Ot_neyrona_k_mozgu
.pdf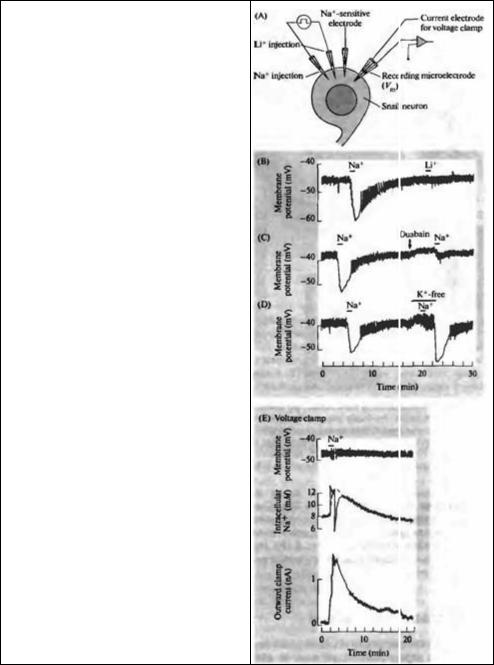
Глава 4. Транспорт через мембрану клетки |
73 |
Рис. 4.1. Влияние инъекции натрия в нейрон улитки на внутриклеточную концентрацию натрия, мембранный потенциал и ток через мембрану. (А) Два микрозлектрода используются для инъекции натрия или лития. Натрий-чувствительный электрод измеряет концентрацию натрия внутри клетки. Еще один электрод используется либо для измерения мембранного потенциала, либо, в паре с токовым электродом, для фиксации потенциала на определенном уровне с целью измерения тока через мембрану (показан на рис. 4.1Е) (В) Гиперполяризация мембраны вследствие инъекции натрия. (Небольшие кратковременные выбросы на кривой представляют собой спонтанные потенциалы действия, размер которых преуменьшен за счет инертности самописца.) Инъекция лития не влечет за собой гиперполяризации. (С) После подачи блокатора натриевых насосов уабаина (20 г/мл) инъекция натрил вызывает значительно менее выраженную гиперполяризацию. (D) Удаление калия из внеклеточной среды блокирует насос, поэтому инъекция натрия не вызывает гиперполяризации до тех пор, пока уровень калия не восстанавливается. (Е) Измерение мембранного тока при потенциале, фиксированном на —47 мВ В результате инъекции натрия его внутриклеточная концентрация повышается, и через мембрану протекает выходящий ток. Выбросы на кривой натриевой концентрации представляют собой артефакты инъекционной системы; временной ход изменений этой концентрации показан пунктиром.
Fig. 4.1. Effects of Sodium Injection into a snail neuron on intracellular sodium concentration, membrane potential, and membrane current. (A) Two micropipettes are used to inject either sodium or lithium. A sodium-sensitive electrode measures the intracellular sodium concentration. Another electrode measures membrane potential or, alternatively, is used in combination with a current-passing electrode to hold the membrane potential steady while measuring membrane current (shown in E). (B) Hyperpolar-ization of the membrane following intracellular injection of sodium. (The small rapid deflections are spontaneously occurring action potentials, reduced in size because of the poor frequency response of the pen recorder.) Injection of lithium does not produce hyperpolarization. (C) After application of ouabain (20 g/ml), which blocks the sodium pump, hyperpolarization by sodium injection is greatly reduced. (D) Removal of potassium from the extracellular solution blocks the pump, so sodium injection produces no hyperpolarization until potassium is restored. (E) Measurements of membrane current with the membrane potential clamped at -47 mV. Sodium injection results in an increase in intracellular sodium concentration, and an outward current across the cell membrane. Sharp deflections on the sodium concentration record are artifacts from the injection system; the time course of the concentration change is indicated by the dashed line. (After Thomas, 1969.)
Фосфорилирование приводит к дальнейшему изменению конформации, в результате которого места связывания ионов оказываются
в контакте с внеклеточной средой (рис.4.2С). В этом положении места связывания обладают низким сродством к натрию и вы-

74 |
Раздел II. Передача информации в нервной системе |
Рис. 4.2. Перенос ионов Na-K АТФазой. (А) Посадочные места, направленные внутрь клетки, обладают высоким сродством к натрию и низким — к калию. Ионы калия, до этого момента связанные с молекулой АТФазы, высвобождаются, в то время как ионы натрия связываются с ней. (В) Вслед за связыванием натрия происходит связывание молекулы АТФ и фосфорилирование фермента. (С) В результате фосфорилирования в структуре фермента происходят изменения, приводящие к выдвижению посадочных мест во внеклеточную среду. (D) В таком положении посадочные места обладают низким сродством к натрию и высоким — к калию, поэтому они связывают два иона калия. (Е) При связывании калия АТФаза дефосфори-лируется. (Е) Возврат в первоначальное состояние.
Fig. 4.2. Ion Translocation by Na-K ATPase. (A) Inward-facing binding sites have a high affinity for sodium and a low affinity for potassium. Previously bound potassium ions are released and three sodium ions are bound. (B) Sodium binding is followed by ATP binding and phosphorylation of the enzyme. (C) The phosphorylated enzyme undergoes a conformational change such that its binding sites face the extracellular solution. (0) Outward-facing sites have a low affinity for sodium and high affinity for potassium, and they bind two potassium ions. (E) Potassium binding leads to dephosphorylation. (F) Dephosphorylation is followed by a return to the starting conformation.
соким к калию, поэтому ионы калия замещают два иона натрия (рис. 4.2D). Связывание калия вызывает дефосфорилирование фермента (рис. 4.2Е) и возвращает насос в первоначальное положение (рис. 4.2F). Ионы калия высвобождаются во внутриклеточное пространство.
§ 2. Кальциевые насосы
Изменение концентрации ионов кальция внутри клетки играет важнейшую роль во многих процессах жизнедеятельности нейронов, таких как высвобождение медиатора в синаптическую щель, активация ионных каналов в клеточной мембране, а также регуляция целого ряда цитоплазматических ферментов.
В мышечных клетках кальций играет ключевую роль в запуске процесса сокращения мышечного волокна. Все эти функции связаны с кратковременным повышением концентрации кальция в цитоплазме, поэтому важной задачей для клетки является поддержание неизменного уровня кальция в покое. В противном случае различные кальций--зависимые механизмы будут активироваться не в ответ на специфическое раздражение, а постоянно.
Изменение концентрации кальция в цитоплазме может происходить по двум причинам: кальций может входить или выходить через клеточную мембрану, либо переходить из цитоплазмы во внутриклеточные органеллы и обратно (рис. 4.3) 8), в первую очередь в эндоплазматический ретикулум

Глава 4. Транспорт через мембрану клетки |
75 |
Рис. 4.3. Внутриклеточные органеллы. В цитоплазме клетки находится множество внутриклеточных огранелл. Некоторый из них — в первую очередь эндо- и саркоплаэматиче ский ретикулумы — способны запасать кальций.
Fig. 4.3. Intracellular Compartments. Within the cytoplasm of animal cells are numerous intracellular compartments. Some of these compartments — principally the endoplasmic reticulum and mitochondria — sequester calcium.
(в мышце — саркоплазматический ретикулум) и митохондрии 9). Для измерения внутриклеточной концентрации кальция в клетку вводятся специальные вещества, такие как экворин 10) (aequorin) или фура-2 11) (fura2), которые излучают или поглощают свет при связывании ионизированного кальция. Другой способ отслеживания изменений уровня кальция — трансфекция особых белковых комплексов 12, 13), созданных при помощи генной инженерии таким образом, что их флуоресцентные свойства изменяются в зависимости от концентрации ионизированного кальция. В обоих случаях изменения в поглощении или излучении, пропорциональные изменениям уровня кальция, измеряются с помощью высокочувствительных оптических методов. Средняя концентрация кальция в покое для большинства нейронов составляет от 10 до 100 нМ. Уровень кальция в межклеточном пространстве позвоночных составляет от 2 до 5 ммоль.
Для поддержания низкой внутриклеточной концентрации кальция необходим механизм, осуществляющий непрерывный вывод кальция из клетки вопреки наличию значительного концентрационного градиента. Кроме того, системы кальциевого транспорта через внутриклеточные мембраны поддерживают высокую концентрацию кальция в органеллах. Так, уровень кальция в эндоплазматическом ретикулуме может достигать 400 мкмоль12, 14), а в саркоплазматическом ретикулуме мышцы поднимается до 10 ммоль 15). Молекула, ответственная за транспорт кальция через плазматическую и цитоплазматическую мембраны, называется кальциевая АТФаза. Еще один механизм транспорта кальция будет обсуждаться ниже в этой главе.
АТФазы зндоплазматического и саркоплазматического ретикулумов
Одно из семейств АТФаз расположено в мембране эндоплазматического ретикулума нейронов, а также в саркоплазматической мембране скелетной мышцы. Эти АТФазы переносят ионы кальция из цитоплазмы во внутриклеточные органеллы. Сокращение мышечного волокна происходит при освобождении кальция из саркоплазматического ретикулума в миоплазму. Быстрое устранение ионов кальция из миоплазмы, необходимое для релаксации мышцы, обеспечивается за счет высокой концентрации АТФаз в мембране саркоплазматического ретикулума.
Кальциевый транспортный цикл в принципе аналогичен циклу работы натрий-калиевого насоса, показанному на рис. 4.2. Он начинается с присоединения двух ионов кальция к
местам связывания, расположенным в цитоплазме и обладающим высоким сродством к кальцию (Km(Ca) ~ 100 нМ) 16).
76 |
Раздел II. Передача информации в нервной системе |
Затем происходит фосфорилирование фермента и изменение его конформации, в результате чего ионы кальция переносятся внутрь ретикулума. После освобождения кальция молекула АТФазы дефосфорилируется и возвращается в свое первоначальное состояние.
АТФазы плазматической мембраны
Кальциевые АТФазы встречаются также в плазматической мембране любой клетки. За исключением некоторых деталей 17), строение и функция этих АТФаз не отличается от кальциевых АТФаз эндоплазматического и саркоплазматического ретикулумов. Внутриклеточное место связывания обладает высоким сродством к кальцию 18), однако во время транспортного цикла происходит связывание всего одного иона кальция. Концентрация АТФаз в плазматической мембране нейронов и мышечных клеток довольно низка, поэтому эффективность этой транспортной системы не слишком высока. Тем не менее, с задачей устранения входящего в клетку кальция она справляется.
§3. Натрий-кальциевый обменник
Во многих механизмах ионного транспорта используется совершенно иной принцип переноса ионов через мембрану против электрохимического градиента. Вместо энергии расщепленной молекулы АТФ эти механизмы используют энергию уже существующего перемещения ионов натрия в направлении их концентрационного градиента, то есть внутрь клетки. Один из примеров — натрий-протоновый обменник, переносящий ионы в соотношении 1 : 1 и участвующий в поддержании внутриклеточного рН. Протоны переносятся из клетки наружу вопреки электрохимическому градиенту в обмен на ионы натрия, перемещаемые внутрь клетки. Подобным же образом переносятся кальций, калий, бикарбонат и хлор. В результате работы этих вторичных транспортных механизмов, в состоянии покоя внутрь клетки попадает значительное количество натрия. Тем более важна роль натрий-калиевых обменников, выводящих натрий обратно во внеклеточную среду. В некоторых случаях механизмами вторичного активного транспорта используется энергия перемещения ионов калия в направлении их электрохимического градиента.
Транспортные системы натрий-кальциевого обмена
Существуют по-крайней мере два механизма натрий-кальциевого обмена. Наиболее часто встречаются обменники типа NCX (Na—Са exchange), которые были впервые описаны в сердечной мышце 19), нерве краба 20) и аксоне кальмара 21). При переносе транспортной молекулой одного иона кальция наружу происходит перенос трех ионов натрия внутрь клетки 22). Несмотря на то, что сродство NCX к кальцию ниже, чем у кальциевой АТФазы, общая мощность этого транспортного механизма выше приблизительно в 50 раз, поскольку плотность таких молекул в мембране значительно выше 23, 24). NCX играют важную роль в условиях повышенного входа кальция в клетку, вызванного электрической активностью и превышающего возможности АТФаз по устранению избыточного кальция из клетки.
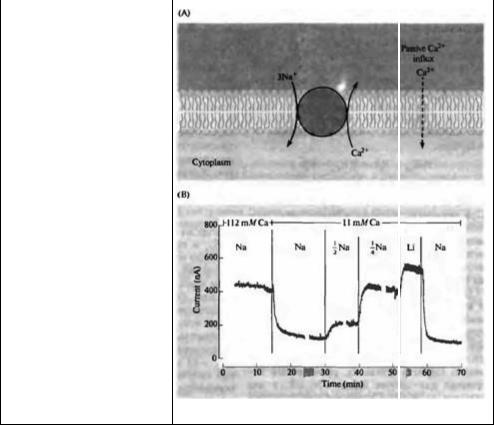
На рис. 4.4 показан принцип действия механизма натрий-кальциевого обмена в аксоне кальмара. Для измерения внутриклеточной концентрации кальция использовали флуоресцентную молекулу экворин (aequorin). В состоянии покоя вход кальция в направлении электрохимического градиента уравновешивается за счет переноса ионов из клетки ионным обменником (рис. 4.4А). В начале опыта внутриклеточная концентрация кальция высока потому, что уровень кальция снаружи аксона повышен (112 ммоль). При снижении внеклеточной концентрации снижается и пассивный вход кальция в аксон. В результате снижается внутриклеточная концентрация кальция, и движущая сила для этого иона возрастает до тех пор, пока скорость пассивного втока вновь не сравняется со скоростью выброса кальция. С другой стороны, снижение внеклеточной концентрации натрия приводит к увеличению внутриклеточной концентрации кальция, поскольку обменник медленнее выводит кальций в условиях сниженной движущей силы для натрия. Поэтому происходит повышение внутриклеточного уровня кальция, снижающее скорость входа кальция в клетку. Замена ионов кальция ионами лития, не способными участвовать в работе обменника, приводит к дальнейшему повышению внутриклеточной концентрации кальция.
Глава 4. Транспорт через мембрану клетки |
77 |
||||||
Рис. 4.4. Транспорт |
ионов |
кальция |
|
||||
из аксона кальмара наружу. (А) |
|
||||||
Схема |
|
|
натрий-кальциевого |
|
|||
обменника. Выброс одного иона |
|
||||||
кальция |
из |
клетки |
энергетически |
|
|||
сопряжен с входом трех ионов натрия |
|
||||||
в |
направлении |
|
их |
|
|||
электрохимического |
градиента. |
|
|||||
Равновесная |
концентрация |
кальция |
|
||||
устанавливается в тот момент, когда |
|
||||||
вывод кальция обменником из клетки |
|
||||||
уравновешивает |
пассивный |
вход |
|
||||
кальция в клетку. (В) Влияние |
|
||||||
изменений |
|
|
внеклеточных |
|
|||
концентраций |
кальция и натрия на |
|
|||||
внутриклеточный |
уровень |
кальция. |
|
||||
Концентрация кальция внутри клетки |
|
||||||
измеряется |
фотодетектором |
по |
|
||||
уровню свечения зкварина (aequorin), |
|
||||||
инъецированного в клетку. Снижение |
|
||||||
внеклеточной |
концентрации |
кальция |
|
||||
с 112 до 11 ммоль влечет за собой |
|
||||||
снижение |
его |
внутриклеточного |
|
||||
уровня. Ионы лития не способны |
|
||||||
заменить натрий в зтой транспортной |
|
||||||
системе. |
|
|
|
|
|
|
|
Fig. 4.4. Transport of Calcium Ions out of a squid axon. (A) Scheme for sodiumcalcium exchange. The influx of three sodium ions down their electrochemical gradient is coupled to the extrusion of one calcium ion. The calcium concentration reaches a steady state when outward transport through the exchanger is equal to the inward
Ca2+ leak. (B) Effect of changes in extracellular calcium and sodium on intracellular cal-
cium concentration. Changes in intracellular calcium concentration are measured by changes in the luminescence of injected aequorin, indicated by nanoamperes of current from the photodetector. Increased readings mean increased concentrations of intracellular free calcium. Reducing the extracellular calcium concentration from 112 mM) to 11 mM) reduces the intracellular concentration. Reducing extracellular sodium reduces outward calcium transport and hence increases intracellular concentration. Lithium ions do not substitute for sodium in the transport system. (From Baker, Hodgkin, and Ridgetvay, 1971.)
Реверсия направления работы NCX
Изменение градиентов для одного или нескольких ионов, участвующих в работе обменника, может привести к перемене направления его работы. Интересно, что в случае NCX такая смена направления может произойти в физиологических условиях. При этом кальций будет переноситься внутрь клетки, а натрий — выводиться из нее. Направление работы NCX определяется разницей между энергией, выделяемой при перемещении трех ионов натрия внутрь клетки, и энергией, необходимой для переноса одного иона кальция наружу. Одним из факторов, определяющих этот энергетический баланс, является мембранный потенциал. Влияние потенциала мембраны обусловлено тем, что процесс ионообмена не является электрически нейтральным. Вследствие каждого прямого цикла работы обменника, через мембрану внутрь клетки переносится один положительный заряд. Следовательно, гиперполяризация мембраны облегчает прямой цикл обменника, в то время как деполяризация его затрудняет и может привести к изменению направления, то есть к работе обменника в режиме обратного цикла. Следует подчеркнуть, что, несмотря на отсутствие электрической нейтральности, обменники не являются электрогенными. В отличие от насосов, они работают за счет электрохимических градиентов, а не производят их.
Энергия, выделяемая за счет входа ионов натрия в клетку (или энергия, необходимая для переноса этих ионов наружу), равна про-

78 |
Раздел II. Передача информации в нервной системе |
изведению заряда на разность между равновесным потенциалом для натрия (ENa) и мембранным потенциалом (Vm). Для трех ионов натрия эта энергия будет равна 3(.ENa — Vm). Соответственно, для одного двухвалентного иона кальция энергия переноса будет равна 2(ЕСа—Vm). При определенном значении мембранного потенциала уровни энергии сравняются и перенос прекратится. Обозначив это значение через потенциал реверсии Vr, получим
или
При значениях потенциала более отрицательных, чем потенциал реверсии, натрий перемещается внутрь клетки, а кальций — наружу. При более положительных значениях направление движения ионов сменяется на обратное.
Предположим, что концентрации натрия и кальция в клетке принимают значения 15 ммоль и 100 нМ соответственно, а во внеклеточной среде находится 150 ммоль натрия и 2 ммоль кальция. Такие значения вполне вероятны для клеток млекопитающих. По уравнению Нернста (глава 2), равновесный потенциал для натрия будет +58 мВ, а для кальция +124 мВ. Потенциал реверсии, при котором движение ионов через обменник прекратится, будет —74 мВ. Это значение близко к потенциалу покоя многих клеток млекопитающих. Следовательно, в отдельно взятой клетке направление ионообмена может быть как прямым, так и обратным, в зависимости от текущего значения мембранного потенциала и от того, происходило ли накопление ионов натрия или кальция в этой клетке. В клетках сердечной мышцы вход кальция через NCX в ходе потенциала действия способен вызвать сокращение мышцы 25, 26), а его последующий вывод из клетки посредством того же NCX способствует релаксации 27).
Натрий-кальциевый обменник в палочках сетчатки
Для клеток с низкими значениями потенциала покоя NCX не представляется надежной системой вывода кальция из цитоплазмы. В таких клетках кальций сначала будет накапливаться до некоторого, достаточно высокого, уровня. Примером такой клетки может служить палочка сетчатки млекопитающих, мембранный потенциал покоя которой обычно находится на уровне -40 мВ (глава 19). В мембране таких клеток встречается другой тип натрий-кальциевого обменника, RetX 28) - 30). По сравнению с NCX дополнительная энергия для переноса кальция получается за счет двух отличий в стехиометрии RetX. Во-первых, вместо трех ионов натрия через RetX проходят четыре. Во-вторых, в работе обменника участвует ион калия, также перемещающийся в направлении своего электрохимического градиента и, следовательно, выделяющий при этом дополнительную энергию. Уравнение потенциала реверсии натрий--калий-кальциевого обменника имеет следующий вид:
Исходя из подсчитанных выше значений ЕNa и ECa и принимая значение ЕK за —90 мВ, получим из уравнения Нернста Vr. = +74 мВ. Очевидно, что вероятность реверсии ионообмена через RetX весьма мала.
Для лучшего понимания работы RetX представляется целесообразным задать следующий вопрос: какое значение должен принять равновесный потенциал ЕCa для того, чтобы Vr сравнялся с потенциалом покоя клетки, т. е. -40 мВ. С помощью того же уравнения получим 181 мВ, что при внеклеточной концентрации кальция 2 ммоль дает значение внутриклеточной концентрации 1 нМ. Другими словами, при мембранном потенциале -40 мВ обменник RetX обладает достаточной энергией для того, чтобы снизить уровень кальция внутри клетки до 1 нМ. Интересно отметить, что при тех же условиях NCX способен понизить внутриклеточную концентрацию кальция только до 383 нМ.
§ 4. Хлорный транспорт
Концентрация хлора внутри клетки поддерживается в строго определенных границах. В нейронах постоянство уровня хлора особенно важно, поскольку от этого фактора зависит синаптическая депрессия (ингибирование) (глава 9). Хлор-чувствительные АТФазы были описаны в клетках мозга, выращенных в культуре 31), что указывает на возможность существования первичных механизмов транспорта хлора. Тем не менее, большая часть хлора переносится через мембрану посредством трех механизмов вторичного транспорта. Это — хлор-бикарбонатный обменник, выводящий ионы хлора из клетки через плазматическую мембрану; ко-транспорт калия

Глава 4. Транспорт через мембрану клетки |
79 |
Рис. 4.5. Механизмы хлорного транспорта. (А) Хлор бикарбонатныи обменных, совместно с натрийводородным обменником, определяет уровень рМ внутри клетки. (В) Калий-хлорный ко-транспорт осуществляет вывод ионов хлора из клетки за счет энергии выходящего тока калия в направлении его электрохимического градиента. (С) В некоторых нейронах транспорт хлора внутрь клетки производится сразу двумя независимыми механизмами, использующими натриевый электрохимический градиент. Первый — натрий-хлорный ко-транспортер, второй — натрий-калий-хлорный ко-транспортер, обладающий стехиометрией 1:1:2. Заметим, что все системы транспорта хлора электрически нейтральны.
Fig. 4.5. Mechanisms of Chloride Transport. (A) Chloridebicarbonate exchange operates in parallel with sodium-- hydrogen exchange to regulate intracellular pH. (B) Potassium-chloride cotransport uses the outward electrochemical gradient for potassium to transport chloride out of the cell. (C) In some neurons, inward chloride transport is mediated by two independent mechanisms, both using the electrochemical gradient for sodium. One is sodium--chloride cotransport the other sodium-potassium-chloride cotransport with a stoichiometry of 1 : 1 : 2. Note that all the chloride transport systems are electrically neutral.
и хлора наружу клетки; ко-транспорт натрия, калия и хлора. Эти механизмы представлены на рис. 4.5.
Хлор-бикарбонатный обменник
Хлор-бикарбонатный обменник (рис. 4.5А) встречается в большинстве клеток. Поскольку бикарбонат играет важную роль буфера ионов водорода в цитоплазме, этот механизм, наряду с натрий-водородным обменником, участвует в поддержании внутриклеточного рН. Томас 32) проводил эксперименты по измерению рН в нейронах улитки с помощью рН--чувствителъных электродов. Внутриклеточная среда закислялась посредством инъекции НС1 или аппликации СО2, после чего измерялась скорость восстановления уровня до первоначального. Восстановление замедлялось, если внеклеточный уровень бикарбоната был понижен, а также если внутриклеточная концентрация хлора была снижена. Более того, восстановления рН не происходило вовсе, если из внеклеточной среды полностью удалялся натрий. Следовательно, в процессе восстановления рН происходит перемещение ионов натрия и бикарбоната внутрь клетки в обмен на вывод ионов хлора наружу. Механизм блокируется веществами SITS и DIDS. Хлор и бикарбонат перемещаются против своих электрохимических градиентов за счет энергии, выделяемой при пассивном движении ионов натрия в направлении его градиента.
Калий-хлорный ко-транспорт
Еще одним механизмом переноса хлора является калий-хлорный ко-транспорт (рис. 4.5В) 33). Система не чувствительна к SITS и DIDS, но блокируется фуросемидом и буметанидом (furosemide, bumetanide). Это вещества блокируют хлорный транспорт в таких клетках, как трубчатые клетки почек. Энергия для переноса хлора поступает исключительно от движения ионов калия в направлении его электрохимического градиента, поскольку система эта нечувствительна к изменениям внеклеточной концентрации натрия.
Транспорт хлора внутрь клетки
В клетках многих типов, например, в волокнах скелетной мышцы, трубчатых клетках почки, аксоне кальмара, происходит активное накопление ионов хлора. Транспорт хлора внутрь клетки зависит от внеклеточных уровней калия и натрия, не чувствителен к DIDS и блокируется фуросемидом и буметанидом (furosemide, bumetanide). В клетках почки имеется два подтипа этого механизма: первый имеет стехиометрию Na : К : Cl

80 |
Раздел II. Передача информации в нервной системе |
Рис. 4.6. Транспорт медиаторов (трансмиттеров) в синаптические пузырьки. Водородные АТФазы переносят протоны из цитоплазмы внутрь везикул, создавая тем самым электрохимический градиент для выхода протонов. Через
молекулу вторичного посредника выходящий поток протонов предоставляет энергию для аккумуляции трансмиттера (Т) в пузырьках. Предполагается, что стехиометрия системы в случае транспорта моноаминов и ацетилхолина составляет 2 : 1 (А), глицина, ГАМК и глутамата — 1: 1 (В и С). Вместе с глутаматом в везикулу входит хлор.
Fig. 4.6. Transport of Neurotransmitters into Synaptic Vesicles. Hydrogen ATPase transports protons into the vesicle from the cytoplasm, creating an electrochemical gradient for proton efflux. Proton efflux through the secondary transport molecule provides the energy for accumulation of the neurotransmitter (T) in the vesicle. The proposed stoichiometry is 2 : 1 for monoamine and ACh transport (A), 1 : 1 for glycine, GABA, and glutamate transport (B and C). Glutamate transport is accompanied by chloride entry into the vesicle.
в соотношении 1 : 1 : 2, а второй Na : Cl в соотношении 1 : 1 (рис. 4.5С) 34). В экспериментах на аксоне кальмара Рассел 35, 36) показал существование натрий- и калийзависимого транспорта хлора внутрь клетки, обладающего стехиометрией Na : К : Cl в соотношении 1:2:3. Пока неясно, объясняется ли это наличием третьего механизма хлорного транспорта или лишь одновременной работой двух вышеописанных механизмов. Транспорт хлора внутрь клетки был также описан в клетках спинного мозга головастиков 37).
§ 5. Транспорт нейромедиаторов
Помимо транспорта неорганических ионов, в нервных клетках имеются также механизмы накопления веществ, участвующих в синаптической передаче. Нейромедиаторы транспортируются в органеллы, находящиеся в цитоплазме пресинаптического нервного окончания, где и запасаются к моменту высвобождения в синаптическую щель. После высвобождения, такие медиаторы, как норэпинефрин, серотонин, ГАМК, глицин или глутамат, откачиваются из синаптической щели специальными переносчиками, расположенными в клеточной мембране самих нейронов или соседних глиальных клеток (главы 8 и 13). Все эти механизмы являются вторичными транспортными системами и черпают энергию из перемещения ионов калия, натрия или водорода в направлении их электрохимических градиентов.
Транспорт в синаптические пузырьки
Нейромедиаторы синтезируются в цитоплазме нервного окончания, после чего накапливаются в синаптических пузырьках (везикулах) при помощи механизма вторичного активного транспорта, сопряженного с выходом протонов. Этот механизм аналогичен вторичному транспорту через плазматическую мембрану, основанному на движении ионов натрия, однако вместо натриевого градиента здесь используется градиент протонов, создаваемый протонной АТФазой, переносящей протоны из цитоплазмы в синаптические пузырьки 38) - 40). Количество систем транспорта, основанных на энергии движения протонов, ограничено. Так, механизм везикулярного транспорта моноаминов обеспечивает накопление норэпинефрина, дофамина, гистамина и серотонина (5-НТ). Существует также обшая транспортная система для ГАМК и глицина. Ацетилхолин и глутамат обладают собственными системами закачки в пузырьки. Предполагаемая стехиометрия систем закачки показана на рис. 4.6. Все эти системы, не будучи электрически нейтральными, зависят от потенциала везикулярной мембраны и от градиента рН. Отличительная особенность механизма транспорта глутамата состо-

Глава 4. Транспорт через мембрану клетки |
81 |
Рис. 4.7. Закачка нейромедиаторов из внеклеточного пространства. (А) Закачка глутамата сопряжена с входом двух ионов хлора и выходом одного иона калия, кроме того, она сопровождается выбросом из клетки одного иона ОН (или НС03). (В) В системах закачки ГАМК, глицина и моноаминов (норэпинефрин, дофамин и серотонин) закачка трансмиттера (Т) сопряжена с входом двух ионов натрия и сопровождается входом одного иона хлора. Продукт гидролиза ацетилхолина, холин, закачивается в нервное окончание с той же стехиометрией, что и ГАМК, глицин и моноамины.
Fig. 4.7. Uptake of Neurotransmitters. (A) Glutamate uptake is coupled to the influx of two sodium ions and efflux of one potassium ion, and it is accompanied by the extrusion of one OH– (or one HCO–3 ) ion. (B) In the GABA, glycine, and monoamine (norepinephrine, dopamine, and serotonin) uptake systems, recovery of the transmitter (T) is coupled to the influx of two sodium ions and accompanied by the uptake of a single chloride ion. Choline from the hydrolysis of acetylcholine is recovered into the nerve terminal with the same stoichiometry as the GABA, glycine, and monoamine systems.
ит в том, что одновременно с медиатором внутрь пузырьков переносятся ионы хлора 41).
Механизм закачки медиатора в клетку
Медиаторы могут также закачиваться из внеклеточного пространства внутрь нейронов или глиальных клеток (главы 8 и 13). В целом этот процесс выполняет две задачи: 1) устранение медиатора из внеклеточного пространства, окружающего синапс, с целью прекращения его действия на постсинаптическую клетку 42, 43); и 2) закачку медиатора обратно в пресинаптическое окончание для повторного использования в синаптической передаче. Все подобные механизмы используют электрохимический градиент натрия для перемещения медиатора в цитоплазму.
На рис. 4.7 показаны два основных типа систем закачки медиатора 44). Механизмы первого типа сопряжены с перемещением ионов натрия внутрь и ионов калия наружу клетки. Такие системы используются для закачки нейтральных и кислых аминокислот, таких как глутамат45). Перемещение одной молекулы глутамата внутрь клетки сопряжено с перемещением двух или трех ионов натрия внутрь и одного иона калия наружу. Кроме того, происходит перемещение либо протона внутрь, либо гидроксильной группы наружу, что приводит к окислению внутриклеточной среды 46, 47).
Механизмы второго типа используют вход натрия для введения в клетку молекул медиатора и ионов хлора. Эти системы обеспечивают транспорт ГАМК, норэпинефрина, дофамина, глицина и серотонина в клетку. За один цикл в клетку входит один или два иона натрия, одна молекула медиатора и один ион хлора48).
Интересным свойством таких механизмов закачки медиаторов в клетку является отсутствие электрической нейтральности. Следовательно, вариации мембранного потенциала, даже в физиологическом диапазоне, могут вызвать реверсию направления работы этих систем49). Действительно, в клетках клетчатки сома был показан обратный транспорт ГАМК наружу50). Таким образом, транспортные системы могут осуществлять не только закачку медиатора, но и его высвобождение. Реверсия механизма закачки медиатора может также иметь вредные последствия. Так, в результате травмы головного мозга или инсульта может произойти выброс глутамата из деполяризованных глиальных клеток, приводящий к накоплению токсичных
концентраций этого медиатора во внеклеточной среде и дальнейшему повреждению соседних клеток 51).
Круговорот еще одного медиатора, ацетилхолина (ACh), происходит по несколько иной схеме. ACh синтезируется из холина и ацетил-кофермента А (глава 13). После высвобождения ACh в синаптическую щель его действие на постсинаптическую клетку ограничивается особым ферментом (ацетилхолинэстеразой; глава 9), которая гидролизует ACh на ацетат и холин. Приблизительно половина молекул холина закачивается в нервное окончание с помощью высокоаффинного (Кm = 2 мкмоль) механизма и используется для синтеза ACh. Подобно механизмам закачки моноаминов, ГAMK и глицина, этот механизм также зависит от внеклеточного натрия и хлора52).
82Раздел II. Передача информации в нервной системе
§6. Молекулярная структура переносчиков
До сих пор речь шла лишь о функциональных характеристиках переносчиков, без упоминания их молекулярного строения. Как и в случае ионных каналов (глава 2), каждая функциональная группа связана с определенной белковой молекулой или, в более общем виде, с семейством молекул. Многие из них удалось изолировать и клонировать, а также сделать предположение о конфигурации этих молекул в мембране. Ниже приведены обшие сведения о структуре молекул переносчиков, показанной на рис. 4.8. Большинство из них имеет от 10 до 12 трансмембранных сегментов и, как полагают, образует каналоподобные структуры. Перенос веществ через мембрану осуществляется путем попеременного выдвижения посадочных мест во внутриклеточную и внеклеточную среды.
АТФазы
Молекулярное строение натрий-калиевой АТФазы изучено достаточно детально 53, 54). Она состоит из двух субъединиц, α и β. α-субъединица, молекулярная масса которой составляет приблизительно 100 кД, отвечает за ферментативную активность насоса и содержит все места связывания субстрата. Меньшая по размеру (35 кД) β-субъединица содержит несколько внеклеточных мест гликозилирования и также необходима для функционирования насоса, однако в чем именно состоит ее роль, неизвестно. Обе субъединицы были успешно клонированы 55, 56). Предполагаемая структура показана на рис. 4.8А. Места связывания нуклеотидов и фосфорилирования расположены в большом цитоплазматическом участке α-субъединицы, между четвертым и пятым трансмембранными сегментами. Большая часть β-субъединицы расположена во внеклеточном пространстве, и лишь один сегмент предположительно пронизывает мембрану. Известны три изоформы α<субъединицы- (α?, α2 и α3), все они экспрессируются в нервной системе. Две из трех известных изоформ β-субъединицы (β? и β2) найдены в нервных тканях.
Семейство кальциевых АТФаз эндо- и саркоплазматического ретикулумов (SERCA) проистекает, как минимум, из трех генов с альтернативным сплайсингом15·57). Семейство кальциевых насосов плазматической мембраны (РМСА) является продуктом экспрессии четырех различных генов, каждый из которых имеет, как минимум, два варианта сплайсинга. Все эти белковые молекулы представляют собой одиночную полипептидную цепочку с молекулярной массой порядка 100 кД, структура которой напоминает α- субъединицу натрий-калиевой АТФазы с увеличенным цитоплазматическим сегментом со стороны карбоксильного окончания. В отличие от натрий-калиевой АТФазы, эти АТФазы не нуждаются в β-субъединице для осуществления своей ферментативной активности.
Натрий-кальциевые обменники
Натрий-кальциевый обменник сердечной мышцы (NCX1) представляет собой белок с молекулярной массой около 120 кД, состоящий из 970 аминокислот 59). Второй тип, NCX2, был первоначально клонирован из мозга крысы. Оба клона обладают рядом изоформ сплайсинга 60). С помощью гидропатического анализа и исследований с использованием антител было показано, что обменники состоят из 11 трансмембранных сегментов и большой внутриклеточной петли, расположенной между 5-м и 6-м
сегментами (см. рис. 4.8В) 61). Размер и масса RetX несколько больше: 1 199 аминокислот, 130 кД 62). Несмотря на то, что между RetX и NCX нет большого сходства
аминокислотных последовательностей, их мембранная топология должна быть сходной, как показывает гидропатический анализ.
Переносчики других ионов
В мозге крысы были найдены калий-хлорные ко-переносчики (КСС1 и КСС2) 63· 64). Каждый из них состоит из 1100 аминокислот и имеет молекулярную массу 120 кД. На основании первичной структуры этих молекул можно заключить, что в них входят 12 трансмембранных сегментов, и что оба окончания (аминотерминаль и карбокситерминаль) расположены в цитоплазме (см. рис. 4.8С). Сходной структурой обладают молекулы обменников анионов (АЕ)65), а также семейство натрий-калий- хлорных ко-переносчикрв (NKCC)34).
Молекулы переносчиков нейромедиаторов
Сходство первичных аминокислотных последовательностей транспортных белков, про-
