
Nikolls_-_Ot_neyrona_k_mozgu
.pdf
Глава 11. Высвобождение медиатора |
|
|
|
|
233 |
|
|
||||
Рис. 11.18. Наблюдение за зкзоцитозом в живых |
|
|
|
|
|||||||
клетках. (А) Хромаффинные клетки были |
|
|
|
|
|||||||
выращены на |
покровных стеклах |
и |
окрашены |
|
|
|
|
||||
флуоресцентной меткой, которая концентрируется |
|
|
|
|
|||||||
в хромаффинных везикулах. Одиночные везикулы, |
|
|
|
|
|||||||
расположенные возле плазматической мембраны, |
|
|
|
|
|||||||
визуализируются |
с помощью |
флуоресцентного |
|
|
|
|
|||||
микроскопа. |
Высвобождение |
катехоламинов |
|
|
|
|
|||||
одновременно |
детектируется |
с |
|
помощью |
|
|
|
|
|||
амперометрии. |
|
(В) |
Изображения |
одной |
|
|
|
|
|||
хромаффинной |
|
везикулы, |
полученные |
с |
|
|
|
|
|||
интервалом в 2 с после того, как клетка была |
|
|
|
|
|||||||
простимулирована |
раствором |
с |
повышенной |
|
|
|
|
||||
концентрацией |
калия |
Светящееся пятно в центре |
|
|
|
|
|||||
исчезает быстро и необратимо, как только везикула |
|
|
|
|
|||||||
подвергается экзоцитозу и высвобождает свое |
|
|
|
|
|||||||
флуоресцентное содержимое. (С) Временной ход |
|
|
|
|
|||||||
зкзоцитоза в ответ на увеличение внеклеточной |
|
|
|
|
|||||||
концентрации калия, зарегистрированного с |
|
|
|
|
|||||||
помощью |
амперометрической |
|
детекции |
|
|
|
|
||||
высвобождения катехоламинов, а также по |
|
|
|
|
|||||||
исчезновению флуоресцентных пятен. Обратите |
|
|
|
|
|||||||
внимание на то, что высвобождение и |
|
|
|
|
|||||||
исчезновение пятен совпадают (стрелкой отмечен |
|
|
|
|
|||||||
один из примеров). Большее количество событий |
|
|
|
|
|||||||
регистрируется с помощью амперометрии, |
|
|
|
|
|||||||
поскольку |
амперометрический |
|
электрод |
|
|
|
|
||||
детектирует зкзоцитоз с большой поверхности |
|
|
|
|
|||||||
клетки, в то время как измерение флюоресценции |
|
|
|
|
|||||||
проводится лишь от небольшого участка |
|
|
|
|
|||||||
клеточной поверхности. |
|
|
|
|
|
|
|
|
|
||
Fig. 11.18. Exocytosis Observed in Living Cells. (A) |
|
|
|
|
|||||||
Chromaffin cells growing on a glass coverslip in cell· |
|
|
|
|
|||||||
culture were labeled with a fluorescent dye, which |
|
|
|
|
|||||||
becomes concentrated in chromaffin vesicles. |
|
|
|
|
|||||||
Individual vesicles docked at the plasma membrane |
|
|
|
|
|||||||
were visualized by evanescentwave microscopy. At |
|
|
|
|
|||||||
the same time, release of catecholamines was detected |
|
|
|
|
|||||||
by amperometry (B) High-power images of a single |
|
|
|
|
|||||||
chromaffm vesicle at 2 s intervals after the cell was |
|
|
|
|
|||||||
stimulated with high potassium. The spot disappears |
|
|
|
|
|||||||
abruptly and permanently as the vesicle undergoes |
|
|
|
|
|||||||
exocytosis and releases its fluorescent contents. (C) |
|
|
|
|
|||||||
The time course of exocytosis in response to an |
|
recorded by amperometry than by fluorescence |
because the amperometric |
|
|||||||
increase in extracellular potassium concentration, as |
|
|
|||||||||
recorded by amperometric detection of catecholamine |
|
electrode detects exocytosis over a large part of the cell, while only a |
|||||||||
release and the |
disappearance of |
fluorescent |
spots. |
|
small portion of the cell surface is imaged by evanescent-wave |
||||||
Note the coincidence of release and spot disappearance |
|
microscopy. (After Steyer, Horstmann, and Aimers, 1997; micrographs |
|||||||||
(the arrows mark one example). More events are |
|
|
kindly provided by W. Aimers.) |
||||||||
квантовые ворота в пресинаптической мембране, не получили достаточной экспериментальной поддержки. Как было замечено выше, в некоторых специализированных синапсах сетчатки деполяризация может высвобождать медиатор посредством транспортных белков в пресинаптической мембране, т. е. посредством механизма, который не является квантовым, не опосредован экзоцитозом везикул и не зависит от входа кальция75· 76).
Круговорот синаптических везикул
Что происходит с опустошенной синаптической везикулой после того, как она освободила свой запас медиатора? Сливается ли она с пресинаптической мембраной или остается целой и возвращается обратно в цитоплазму, как только ее содержимое было высвобождено? В нервно-мышечном соединении и в синапсах ЦНС интенсивная стимуляция

234 |
Раздел П. Передача информации в нервной системе |
|
|
(B) Synapse fixed after stimulation of the spinal cord for 15 min
at 20 Hz.Note the depletion of Synaptic vesicles, the presence of Fig. 11.19. Stimulation Causes a Reversible coated vesicles (C) and pleomorphic vesicles (P), and the Depletion of Synaptic Vesicles in lamprey giant expanded presynaptic membrane. (C) Synapse fixed 60 min after axons. (A) Control synapse fixed after 15 min in cessation of stimulation. Note similarities to the control synapse in saline. Synaptic vesicles are clustered at the A. (Micrographs kindly provided by W.O.Wickelgren.) presynaptic membrane.
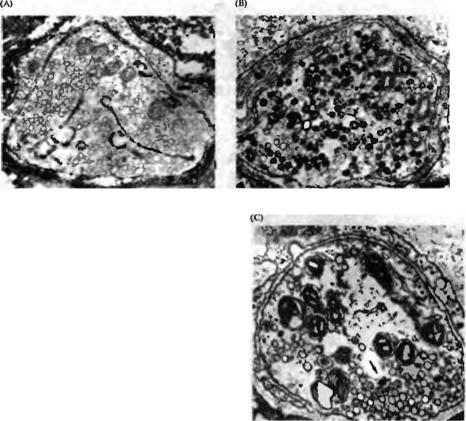
вызывает уменьшение количества синаптических везикул и увеличение площади поверхности аксонного окончания, указывая на то, что после высвобождения своего содержимого пустая везикула уплощается и становится частью мембраны окончания (рис. 11.19)77) -- 79). Хеузер и Рииз80) обнаружили, что компоненты везикулярной мембраны вновь используются (рециклируются) в новые синаптические везикулы. Они исследовали рециклирование везикул в двигательных нервных окончаниях лягушки, стимулируя нервно-мышечный препарат в присутствии пероксидазы хрена (ПХ) — фермента, катализирующего образование электронно-плотного продукта реакции. На электронных микрофотографиях окончаний, зафиксированных после короткого периода электрической стимуляции, ПХ обнаруживалась главным образом в везикулах, располагающихся возле наружных краев синоптической области, что предполагает образование этих везикул из мембраны окончания посредством эндоцитоза и захват при этом ПХ из внеклеточного пространства (рис. 11.20). После небольшой задержки ПХ появлялась также в синаптических везикулах. Количество синаптических везикул, заполненных ПХ, уменьшалось при стимуляции в среде, не содержащей ПХ, что свидетельствует о том, что захваченная в результате эндоцитоза мембрана и ПХ рециклируется в популяцию везикул, которые впоследствии участвуют в высвобождении медиатора.
Состав мембраны синаптических везикул несколько отличается от плазматической мембраны нервных окончаний; тем не менее, определенные компоненты везикулярной мембраны захватываются обратно в цитоплазму вскоре после того, как везикулярная мембрана сливается с плазматической мембраной окончаний (рис. 11.21)81). Полный цикл восстановления специфических мембранных белков и липидов проиллюстрирован на рис. 11.2282). Компоненты везикулярной мембраны захватываются из пресинаптической мембраны посредством формирования покрытых везикул
Глава 11. Высвобождение медиатора |
235 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 11.20. Вторичное использование мембраны |
|
|
|
|
|
|
|
|
|
|
|
синаптических везикул. Электронные микрографии |
|
|
|
|
|
|
|
|
|
|
|
поперечных срезов нервно-мышечного соединения |
|
|
|
|
|
|
|
|
|
|
|
лягушки, окрашенных перок сидазой хрена (ПХ) (А) Нерв |
|
|
|
|
|
|
|
|
|
|
|
стимулировался в растворе, содержащем ПХ, на |
|
|
|
|
|
|
|
|
|
|
|
протяжении 1 минуты; электронно-плотный продукт |
|
|
|
|
|
|
|
|
|
|
|
реакции наблюдается во внеклеточном пространстве, а |
|
|
|
|
|
|
|
|
|
|
|
также в цистернах и покрытых везикулах. (В) Нерв |
|
|
|
|
|
|
|
|
|
|
|
стимулировался в течение 15 минут в присутствии ПХ, а |
|
|
|
|
|
|
|
|
|
|
|
затем восстанавливался в течение 1 часа в растворе, не |
|
|
|
|
|
|
|
|
|
|
|
содержащем ПХ. Многие синаптические везикулы |
|
|
|
|
|
|
|
|
|
|
|
содержат продукт реакции ПХ, указывая на то, что они |
|
|
|
|
|
|
|
|
|
|
|
образовались при эндоцитозе клеточной мембраны. (С) |
|
|
|
|
|
|
|
|
|
|
|
Аксонные окончания были загружены ПХ и затем |
|
|
|
|
|
|
|
|
|
|
|
восстановлены так же, как и на части В, после чего |
|
|
|
|
|
|
|
|
|
|
|
простимулированы второй раз и восстановлены еще через |
|
|
|
|
|
|
|
|
|
|
|
1 час. Лишь небольшое количество везикул содержит |
|
|
|
|
|
|
|
|
|
|
|
продукт реакции ПХ (отмечено стрелкой), указывая на то, |
|
|
|
|
|
|
|
|
|
|
|
что захваченные при зндоцитозе мембрана и ПХ были |
|
|
|
|
|
|
|
|
|
|
|
рециклированы в популяцию везикул, которая участвует в |
|
|
|
|
|
|
|
|
|
|
|
процессе высвобождения. |
Many |
synaptic |
vesicles |
contain |
HRP |
reaction |
product, |
|
||
|
Fig. 11.20. Recycling of Synaptic Vesicle Membrane. Electron |
indicating |
that |
they have |
been |
formed |
from |
membrane |
|
||
|
retrieved by endocytosis. (C) The axon terminal was loaded |
|
|||||||||
|
micrographs of cross sections of frog neuromuscular junctions |
|
|||||||||
|
with HRP and rested as in B, then stimulated a second time and |
|
|||||||||
|
stained with horseradish peroxidase (HRP). (A) The nerve was |
|
|||||||||
|
allowed to recover an additional hour. Few vesicles are labeled |
|
|||||||||
|
stimulated for 1 min in saline containing HRP; electron-dense |
|
|||||||||
|
(arrow), indicating that the recaptured membrane and enclosed |
|
|||||||||
|
reaction product can be seen in the extracellular space and in |
|
|||||||||
|
HRP |
were |
recycled into the vesicle population from which |
|
|||||||
|
cisternae and coated vesicles. (B) The nerve was stimulated for |
|
|||||||||
|
release occurs. (From Heuser and Reese, 1973; micrographs |
|
|||||||||
|
15 min in HRP, then allowed to recover for 1 h while the HRP |
|
|||||||||
|
kindly provided by J. E. Heuser.) |
|
|
|
|
|
|||||
|
was washed out of the muscle. |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
и рециклируются в новые синаптические везикулы либо напрямую, либо через эидосомы (см. также главу 13).
В результате особенно интенсивной стимуляции в присутствии ПХ наблюдается образование больших непокрытых углублений и цистерн, содержащих ПХ (см. рис. 11.20А). Непокрытые углубления и цистерны представляют собой неселективные инвагинации излишков синаптической мембраны81). По всей видимости, покрытые везикулы затем удаляют специфические компоненты из таких цистерн для последующего рециклирования напрямую или через эндосомы (см. рис. 11.22).
Наблюдения за экзоцитозом и эндоцитозом в живых клетках
Аналогичные эксперименты были проведены с использование высоко флуоресцентных меток для маркировки рециклированных везикул83). Внедренная Бетцом и коллегами, эта методика дает то важное преимущество, что кругооборот везикул можно наблюдать в живом препарате по вызываемым стиму-

236 |
Раздел П. Передача информации в нервной системе |
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
Рис. 11.21. Вторичное |
использование |
||||||||||
|
|
|
|
специфических |
белков |
мембраны |
|||||||||
|
|
|
|
синаптических |
везикул. |
(А-С) |
|||||||||
|
|
|
|
Флуоресцентные |
|
|
микрографии |
||||||||
|
|
|
|
нервно-мышечных |
|
|
соединений |
||||||||
|
|
|
|
лягушки, окрашенных антителами к |
|||||||||||
|
|
|
|
синаптофизину |
|
|
|
|
(белок |
||||||
|
|
|
|
везикулярной |
мембраны) |
и |
|||||||||
|
|
|
|
вторичными |
|
|
|
|
антителами, |
||||||
|
|
|
|
конъюгированными |
|
|
|
|
|
с |
|||||
|
|
|
|
флюоресцеином. |
|
|
(О, |
|
Е) |
||||||
|
|
|
|
Электронные |
|
микрофотографии |
|||||||||
|
|
|
|
поперечных |
|
срезов |
|
нервно- |
|||||||
|
|
|
|
мышечных |
|
соединений. |
(А) |
||||||||
|
|
|
|
Нервно-мышечное соединение в |
|||||||||||
|
|
|
|
контроле. |
Мембрана |
|
аксонного |
||||||||
|
|
|
|
окончания |
должна быть обработана |
||||||||||
|
|
|
|
детергентом, |
|
|
чтобы |
|
стать |
||||||
|
|
|
|
проницаемой |
|
для |
|
антител, |
|||||||
|
|
|
|
связывающихся |
с |
синаптофизином. |
|||||||||
|
|
|
|
(В, D) Мышца была обработана α- |
|||||||||||
|
|
|
|
латротоксином, |
который |
способен |
|||||||||
|
|
|
|
вызвать высвобождение медиатора |
в |
||||||||||
|
|
|
|
отсутствии |
|
кальция. |
Последующий |
||||||||
|
|
|
|
зндоцитоз |
был |
предотвращен |
путем |
||||||||
|
|
|
|
убирания |
кальция |
|
из |
наружного |
|||||||
|
|
|
|
раствора. В этих условиях запас |
|||||||||||
|
|
|
|
синаптических |
везикул |
в |
аксонных |
||||||||
|
|
|
|
окончаниях |
истощается, |
окончания |
|||||||||
|
|
|
|
раздуваются и их можно окрасить |
|||||||||||
|
|
|
|
даже |
без предварительной обработки |
||||||||||
|
|
|
|
детергентом. Это указывает на то, что |
|||||||||||
|
|
|
|
синаптические везикулы сливаются с |
|||||||||||
|
|
|
|
мембраной в процессе экзоцитоза, |
|||||||||||
|
|
|
|
что |
в |
условиях |
заблокированного |
||||||||
|
|
|
|
обратного |
|
захвата |
|
везикулярной |
|||||||
|
|
|
|
мембраны |
приводит |
к |
длительному |
||||||||
|
|
|
|
нахождению |
|
синаптофизина |
|
на |
|||||||
|
Fig. 11.21. Recycling of Specific Synaptic Vesicle Membrane Proteins. (A-C) |
|
поверхности клетки. (С, Е) Мышца |
||||||||||||
|
|
была обработана α-латротоксином в |
|||||||||||||
|
Fluorescence micrographs of frog neuromuscular junctions labeled with antibodies to |
||||||||||||||
|
нормальном |
растворе. |
|
Окончания |
|||||||||||
|
synaptophysin (a vesicle membrane protein) and fluorescein-conjugated second |
выглядят нормально и могут быть |
|||||||||||||
|
antibodies. (D, E) Electron micrographs of cross sections of neuromuscular junctions. |
окрашены |
только |
после |
обработки |
||||||||||
|
(A) Normal junction. The axon terminal membrane must be made permeable with |
детергентом. |
|
В |
этих |
условиях |
|||||||||
|
detergent in order for antibodies to reach synaptophysin. (B, D) Muscle was treated with |
популяция |
везикул поддерживается |
||||||||||||
|
α-latrotoxin, which causes quanta! transmitter release in the absence of calcium. This |
активным |
рециклированием, |
в |
то |
||||||||||
|
was done in calcium-free medium, which blocks endocytosis. Under these conditions, |
время |
|
как |
|
из |
|
|
окончания |
||||||
|
axon terminals are depleted of synaptic vesicles, appear distended, and stain without |
высвобождается |
в |
два |
раза больше |
||||||||||
|
being made permeable. This indicates that synaptic vesicles have fused with the |
квантов, чем их было в самом начале. |
|||||||||||||
|
terminal membrane during exocytosis while retrieval of vesicle membrane was blocked, |
В результате, несмотря |
на активное |
||||||||||||
|
leaving synaptophysin exposed on the surface. (C, E) Muscle was treated with o- |
использование |
|
|
синаптических |
||||||||||
|
latrotoxin in normal saline. Terminals have a normal appearance and can be stained only |
везикул, |
на |
поверхности |
окончания |
||||||||||
|
after being made permeable. Under these conditions the vesicle population is |
не |
|
обнаруживается |
следов |
||||||||||
|
maintained by active recycling while more than two times the initial store of quanta is |
синаптофизина, |
что |
демонстрирует |
|||||||||||
|
released. Thus, despite the active turnover of synaptic vesicles, no detectable |
специфичность |
и |
|
эффективность |
||||||||||
|
synaptophysin remains on the terminal surface, demonstrating the specificity and |
механизма |
|
обратного |
захвата |
||||||||||
|
efficiency of synaptic vesicle membrane retrieval. (From Valtorta et al., 1988; |
везикулярной мембраны. |
|
|
|
||||||||||
|
micrographs kindly provided by F. Valtorta.) |
|
|
|
|
|
|
|
|
|
|
|
|
||
ляцией накоплению и высвобождению метки (рис. 11.23). Эти исследования позволили обнаружить, что в нормальных физиологических условиях полный цикл экзоцитоза обратного захвата и формирования новых синаптических везикул занимает менее 1 минуты 84) -- 86) ; восстановление же после более интенсивной стимуляции происходит медленнее 79). Более
Глава 11. Высвобождение медиатора |
|
|
237 |
|
|
|||||||||
Рис. |
11.22. |
Предполагаемые |
|
|
|
|
|
|
||||||
пути |
мембранного |
захвата |
в |
|
|
|
|
|
|
|||||
процессе |
|
|
|
вторичного |
|
|
|
|
|
|
||||
использования |
везикул. |
После |
|
|
|
|
|
|
||||||
экзоцитоза везикулы, покрытые |
|
|
|
|
|
|
||||||||
клатрином, |
|
|
селективно |
|
|
|
|
|
|
|||||
захватывают |
|
компоненты |
|
|
|
|
|
|
||||||
везикулярной мембраны. |
Новые |
|
|
|
|
|
|
|||||||
синаптические |
|
|
везикулы |
|
|
|
|
|
|
|||||
образуются |
из |
покрытых |
|
|
|
|
|
|
||||||
везикул либо напрямую, либо |
|
|
|
|
|
|
||||||||
через |
|
эндосомы. |
После |
|
|
|
|
|
|
|||||
интенсивной |
|
|
стимуляции |
|
|
|
|
|
|
|||||
наблюдается |
|
захват |
|
из |
|
|
|
|
|
|
||||
непокрытых |
углублений |
в |
|
|
|
|
|
|
||||||
мембране, а также из цистерн. |
|
|
|
|
|
|
||||||||
Новые синаптические везикулы, |
|
|
|
|
|
|
||||||||
образовавшиеся |
|
|
|
из |
Fig. 11.22. Proposed Pathways for Membrane Retrieval during vesicle recycling. After |
|||||||||
рециклированием |
|
мембраны, |
||||||||||||
|
exocytosis, clathrin-coated |
vesicles |
selectively |
recapture synaptic |
vesicle |
membrane |
||||||||
заполняются |
нейромедиатором |
components. New synaptic |
vesicles |
are formed |
from coated vesicles, |
either |
directly or |
|||||||
и могут |
быть |
высвобождены |
||||||||||||
through endosomes. After intense stimulation, retrieval occurs from uncoated pits and |
||||||||||||||
при стимуляции. |
|
|
|
|
||||||||||
|
|
|
|
cisternae. The new synaptic vesicles formed from recycled membrane are filled with |
||||||||||
|
|
|
|
|
|
|
|
transmitter and can be released by stimulation. |
|
|
|
|||
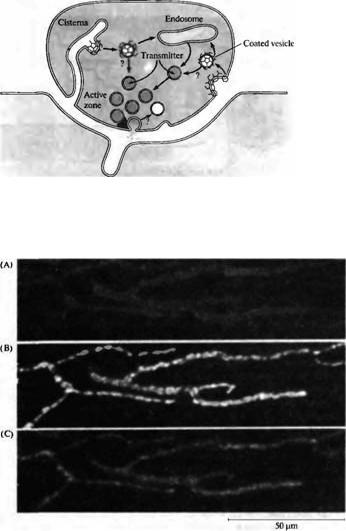
Рис. |
11.23. |
Вызываемые |
|
|
|
|
|
|
||||||
активностью |
|
захват |
|
и |
|
|
|
|
|
|
||||
высвобождение |
|
|
|
|
|
|
|
|
|
|
||||
флуоресцентной |
метки |
|
в |
|
|
|
|
|
|
|||||
аксонных |
окончаниях нервно- |
|
|
|
|
|
|
|||||||
мышечного |
|
соединения |
|
|
|
|
|
|
||||||
лягушки. |
|
Флуоресцентные |
|
|
|
|
|
|
||||||
микрографии |
|
|
аксонных |
|
|
|
|
|
|
|||||
окончаний |
в |
|
кожно |
грудин |
|
|
|
|
|
|
||||
ной мышце. (А) Мышца была |
|
|
|
|
|
|
||||||||
обработана |
флуоресцентной |
|
|
|
|
|
|
|||||||
меткой |
(FM |
|
1-43, |
с |
|
|
|
|
|
|
||||
концентрацией 2 мкмоль) в |
|
|
|
|
|
|
||||||||
течение 5 минут и затем |
|
|
|
|
|
|
||||||||
отмывалась на протяжении |
30 |
|
|
|
|
|
|
|||||||
минут. |
|
Лишь |
|
небольшое |
|
|
|
|
|
|
||||
количество |
метки |
остается |
|
|
|
|
|
|
||||||
связанной |
|
с |
|
мембраной |
|
|
|
|
|
|
||||
окончания. (В) Та же мышца |
|
|
|
|
|
|
||||||||
была далее обработана меткой в |
|
|
|
|
|
|
||||||||
течение 5 минут, в то время как |
|
|
|
|
|
|
||||||||
нерв стимулировался с частотой |
|
|
|
|
|
|
||||||||
10 гЦ, и затем отмывалась на |
|
|
|
|
|
|
||||||||
протяжении |
|
30 |
|
минут. |
|
|
|
|
|
|
||||
Флуоресцентные |
|
|
пятна |
|
|
|
|
|
|
|||||
являются |
|
|
|
кластерами |
|
|
|
|
|
|
||||
синаптических везикул, которые |
axon terminals at the frog neuromuscular junction. Fluorescence micrographs of axon |
|||||||||||||
были |
заполнены |
меткой |
в |
terminals in a cutaneous pectoris muscle. (A) Muscle was bathed for 5 min in fluorescent |
||||||||||
процессе рециклирования. (С) |
dye (2 µΜ FM1-43) and washed for 30 min. Only small amounts of dye remain associated |
|||||||||||||
Та |
же |
|
мышца |
затем |
with the terminal membrane. (B) The same muscle was then bathed in dye for 5 min while |
|||||||||
стимулировалась |
5 |
минут |
с |
the nerve was stimulated (10 Hz) and washed for 30 min. The fluorescent patches are |
||||||||||
частотой |
10 |
Гц |
и |
затем |
clusters of synaptic vesicles that were filled with dye during recycling. (C) The same muscle |
|||||||||
отмывалась в течение 30 минут. |
was then stimulated at 10 Hz for 5 min and washed for 30 min. Stimulation released most of |
|||||||||||||
Fig. 11.23. Activity-Dependent |
the dye. (Micrographs kindly provided by W. J. Betz.) |
|
|
|||||||||||
|
|
|
|
|
|
|||||||||
Uptake and Release of fluorescent |
|
|
|
|
|
|
||||||||
dye by |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
того, было показано, что захват флуоресцентных меток в пресинаптические бутоны культивируемых гиппокампалъных нейронов происходит квантовым образом, причем размер каждого кванта соответствует захвату одной синаптической везикулы87). Такого рода квантовый захват происходит в течение секунд после начала стимуляции, предполагая.

238 |
|
|
|
|
|
Раздел II. Передача информации в нервной системе |
|||
Рис. |
11.24. |
|
Высвобождение |
|
|
|
|||
медиатора |
|
и |
|
захват |
|
|
|
||
везикулярной |
|
мембраны, |
|
|
|
||||
регистрируемый |
|
по |
|
|
|
||||
изменению |
|
|
мембранной |
|
|
|
|||
емкости. |
Увеличение емкости |
|
|
|
|||||
клетки при регистрации пэтч- |
|
|
|
||||||
электродом |
в |
конфигурации |
|
|
|
||||
от |
целой |
|
клетки |
имеет |
|
|
|
||
ступенчатый |
|
характер, |
|
|
|
||||
отражая |
слияние |
отдельных |
|
|
|
||||
везикул |
с |
|
плазматической |
|
|
|
|||
мембраной. |
|
Уменьшение |
|
|
|
||||
емкости |
|
происходит |
при |
|
|
|
|||
|
|
|
|||||||
обратном захвате везикул. |
|
Increases in celt capacitance measured with the whole-cell patch pipette recording technique |
|
||||||
|
|
|
|
|
|
|
|
|
|
Fig. |
11.24. |
Release |
and |
|
occur in a stepwise fashion reflecting the fusion of individual vesicles with the plasma |
||||
Retrieval |
of |
Vesicle Membrane |
|
membrane. Corresponding decreases in capacitance are seen during vesicle retrieval. The |
|||||
monitored |
|
by |
changes in |
|
recordings are from a rat mast cell, which has particularly large secretory vesicles (800 nm in |
||||
membrane capacitance. |
|
|
diameter). (After Fernandez, Neher, and Gomperts, 1984.) |
||||||
что одиночные события экзоцитоза и эндоцитоза очень близко связаны. Эта методика позволяет анализировать квантовое высвобождение из отдельных пресинаптических бутонов без регистрации постсинаптических ответов. Поскольку регистрирующие электроды не нужны, эти оптические методы оказываются весьма удобными при исследовании пресинаптической функции и долговременной пластичности.
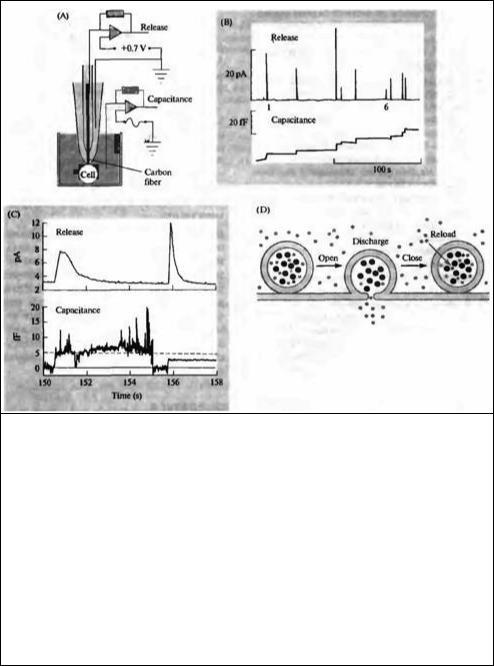
Многообещающим подходом для исследований экзоцитоза везикул является использование не нейрональных секреторных клеток, например, клеток молочной железы и хромаффинных клеток, в которых экзоцитоз больших и плотных секреторных гранул может быть исследован одновременно с помощью световой микроскопии, электрофизиологической регистрации и амперометрии, которая позволяет детектировать амины, выделяемые этими клетками88·89'. Слияние одиночных гранул с плазматической мембраной может быть зарегистрировано пэтчэлектродом в виде увеличения электрической емкости клетки, которое возникает при добавлении мембранных гранул к клеточной поверхности; обратный же захват мембраны при эндоцитозе приводит к уменьшению емкости (рис. 11.24)90). Алмерс с соавторами в экспериментах на хромаффинных клетках добавили электрод из угольного волокна внутрь пэтч-электрода, чтобы измерить высвобождение катехоламинов, содержащихся в гранулах91'. Высвобождение обычно детектировалось одновременно с увеличением емкости, как это можно было бы предположить в случае экзоцитоза и включения гранулярной мембраны в плазматическую (рис. 11.25). Однако примерно 15 % событий высвобождения сопровождались кратковременным и неполным увеличением емкости. В этих случаях экзоцитоз, по всей видимости, происходил через маленькое, открываемое на короткое время отверстие (fusion роге), которое затем быстро закрывалось, позволяя грануле отойти обратно в цитоплазму без включения ее в наружную мембрану (рис. 11.25D). Такие события типа «поцеловал и убежал» (kiss and run) могут позволить освобождаться маленьким молекулам, например, катехоламинам, чей запас может быть быстро восстановлен, но задерживать при этом большие белки, потеря которых может быть восполнена только путем синтеза абсолютно новых гранул в аппарате Гольджи.
Изменения емкости, связанные с высвобождением множественных квантов, были измерены в одиночных нервных окончаниях, выделенных из ЦНС позвоночных92· 93). Пока еще технически невозможно регистрировать изменение емкости, связанные со слиянием одиночных синаптических везикул. Хотя полное слияние синаптических везикул с пресинаптической мембраной явно происходит во время интенсивной стимуляции, остается неясным, может ли происходить в нормальных физиологических условиях высвобождение по механизму «поцеловать и убежать»94, 95).
Глава 11. Высвобождение медиатора |
239 |
|
|
Рис. 11.25. Увеличение емкости мембраны и высвобождение катехоламинов из хромаффинных клеток. (А) Электрод, изготовленный из угольного волокна и расположенный внутри пэтч-электрода, измеряет высвобождение катехоламина амперометрическим способом, в то время как сам электрод используется для измерения емкости в пределах регистрируемого участка мембраны. (В) Одновременная регистрация высвобождения катехоламинов (вверху) и емкости (внизу). Все события экзоцитоза, зарегистрированные по высвобождению катехоламина, совпадают с увеличением емкости. (С) Шестое и седьмое события экзоцитоза (из части В рисунка) показаны на увеличенной временной шкале. Шестое событие экзоцитоэа совпадает с кратковременным и довольно шумящим увеличением емкости, которая длится около 5 с. Седьмое событие совпадает с быстрым и длительным увеличением емкости. (D) Кратковременное увеличение емкости может соответствовать зкзоцитозу через отверстие, образующееся при частичном слиянии везикул с мембраной, который длится короткое время, заканчиваясь отсоединением везикулы от мембраны и уходом обратно в цитоплазму без включения в плазматическую мембрану. В зтих условиях могут высвобождаться маленькие молекулы, в то время как большие белки остаются внутри везикулы.
Fig. 11.25. Coincident Increases in Membrane Capacitance and Release of Catecholamines from chromaffin cells. (A) A carbon fiber electrode inside the patch pipette measures catecholamine release by amperometry, while at the same time the electrode is used to measure capacitance within the patch. (B) Simultaneous recording of catecholamine release (top trace) and capacitance (bottom trace). All exocytic events detected by catecholamtne release coincide with increases in capacitance. (C) The sixth and seventh exocytic events in part B, displayed on an expanded scale. The sixth exocytic event coincides with a transient flickering increase in capacitance that lasts about 5 s. The seventh exocytic event coincides with an abrupt and long-lasting increase in capacitance. (D) Transient increases in capacitance may correspond to exocytosis through a temporary fusion pore that rapidly closes, allowing the vesicle to pinch back off into the cytoplasm without ever becoming incorporated into the plasma membrane. Under such circumstances small molecules may be released while larger proteins are retained in the vesicle. (After Albillos et aL, 1997.)

240 |
Раздел II. Передача информации в нервной системе |
Выводы
·Деполяризация окончания аксона приводит к открыванию потенциал-активируемых кальциевых каналов, увеличению внутриклеточной концентрации кальция и высвобождению медиатора.
·Медиатор высвобождается в виде мультимолекулярных квантов, что происходит при слиянии синаптических везикул, заполненных медиатором, с плазматической мембраной и высвобождении их содержимого путем экзоцитоза. Помимо этого существует также постоянная неквантовая утечка медиатора из окончаний аксонов в состоянии покоя.
·Синаптическая задержка между началом пресинаптической деполяризации и началом постсинаптического потенциала обусловлена временем, необходимым для деполяризации нервного окончания, открывания кальциевых каналов и увеличения внутриклеточной концентрации кальция, который запускает процесс экзоцитоза.
·В покое экзоцитоз происходит с низкой частотой, вызывая спонтанный миниатюрный синаптический потенциал. В ответ на потенциал действия от 1 до 300 квантов (в зависимости от типа синапса) высвобождается практически одновременно.
·Синаптические везикулы содержат несколько тысяч молекул медиатора. Количество постсинаптических рецепторов, активируемых одним квантом медиатора, варьирует значительно, в пределах от 15 до 1 500, в зависимости от типа синапсов.
·Распределение амплитуд спонтанных миниатюрных и вызванных постсинаптических потенциалов может быть проанализировано статистическими методами для определения размера кванта и квантового состава. Эффективность синаптической передачи может модулироваться на пресинаптическом уровне за счет изменения квантового состава, а также на постсинаптическом уровне за счет изменения размера кванта.
·В результате экзоцитоза мембраны синаптических везикул могут сливаться с плазматической мембраной. Компоненты везикулярной мембраны затем специфично захватываются обратно путем эндоцитоза покрытых везикул и рециклируются при формировании новых синаптических везикул. В определенных условиях высвобожденные везикулы могут возвращаться обратно в цитоплазму без включения в клеточную мембрану.
Рекомендуемая литература
Обзоры
оCochilla, A. J., Angleson, J. К., and Betz, W. J. 1999. Monitoring secretory membrane with FM1-43 fluorescence. Annu Rev. Neurosd. 22: 1-10.
оLlinàs, R. 1982. Calcium in synoptic transmission. Sci. Am. 247(4): 56-65.
оOlivera, B. M., Miljanich, G. P., Ramachandran, J., and Adams, M. E. 1994. Calcium channel diversity and neurotransmitier release: The omega-conotoxins and omega-agatoxins. Annu. Rev. Biochem. 63: 823-867.
оParnas, H., Segel, L., Dudel, J., and Parnas, I. 2000. Autoreceptors, membrane potenlial and the regulation of transmitter release. Trends Neurosd. 23: 60-68.
оRedman, S. 1990. Quanta! analysis of synaptic potentials in neurons of the central nervous system. Physio/. Rev. 70: 165-198.
оWalmsley, В., Alvarez, F.J., and Fyffe, R. E.W. 1998. Diversity of structure and function at mammalian central synapses. Trends Neurosd. 21: 81-88.
оZucker, R. S. 1993. Calcium and transmitter release. /. Physio/. (Paris) 87: 25-36.
Статьи
оAdler, Ε. Μ., Augustine, G. J., Duffy, S. N., and Charlton, M. P. 1991. Alien intracellular calcium chelators attenuate neurotransmitter release at the squid giant synapse. /. Neurosd. 11: 1496-1507.
оBetz, W. J., and Bewick, O.S. 1993. Optical monitoring of transmitter release and synaptic vesicle recycling at the frog neuromuscular junction. /. Physiol. 460: 287-309.
оBoyd, I. A., and Martin, A. R. 1956. The end-plate potential in mammalian muscle. /. Physiol. 132: 74-91.
оdel Castillo, J., and Katz, B. 1954. Quanta! components of the end-plate potential. /. Physiol. 124: 560-573.
оEdwards, F. A., Konnerth, A., and Sakmann, B. 1990. Quanta! analysis of inhibitory synaptic transmission in the dentate gyrus of rat hippocam-pal slices: A patch-clamp study. /. Physiol. 430: 213-249.

Глава 11. Высвобождение |
|
медиатора |
241 |
оFatt, P., and Katz, В. 1952. Spontaneous sub-threshold potentials at motor nerve endings. /. Physiol. 117: 109-128.
оFernandez, J. M., Neher, E., and Gomperts, B. D. 1984. Capacitance measurements reveal stepwise fusion events in degranulating mast cells. Nature 312: 453-455.
оHeuser, J. E., and Reese, T. S. 1973. Evidence for recycling of synaptic vesicle membrane during transmitter release at the frog neuromuscular junction. /. CellBiol. 57: 315-344.
оHeuser, J. E., Reese, T. S., Dennis, M. L, Jan, Y., Jan, L., and Evans, L. 197,9. Synaptic vesicle exocytosis captured by quick freezing and correlated with quanta! transmitter release. /. Cell Biol 81: 275-300.
оKatz, В., and Miledi, R. 1967. A study of synaptic transmission in the absence of nerve impulses. /. Physiol. 192: 407-436.
оKatz, В., and Miledi, R. 1967. The timing of calcium action during neuromuscular transmission. /. Physiol. 189: 535-544.
оKuffler, S. W., and Yoshikami, D. 1975. The number of transmitter molecules in a quantum: An estimate from iontophoretic application of acetyl-choline at the neuromuscular synapse. /. Physiol. 251:465-482.
оLlinàs, R., Sugimori, M., and Silver, R.B. 1992. Microdomains of high calcium concentration in a presynaptic terminal. Science 256: 677-679.
оMiller, T.M., and Heuser, J.E. 1984. Endocytosis of synaptic vesicle membrane at the frog neuromuscular junction. /. Cell Biol. 98: 685-698.
оRyan, T.A., Reuter, R, and Smith, S. J. 1997. Optical detection of a quantal presynaptic membrane turnover. Nature 388: 478-482.
оSteyer, J. A., Horstmann, H., and Aimers, W. 1997. Transport, docking and exocytosis of single secretory granules in live chromaffin cells. Nature 388: 474-478.
Цитированная литература
1.Morita, К., and Barrett, E. F. 1990. / Neurosci. 10: 2614-2625.
2.Bullock, T. H., and Hagiwara, S. 1957. /. Gen. Physiol. 40: 565-577.
3.Heidelberger, R., and Matthews, G. 1992. /. Physiol. 447: 235-256.
4.Martin, A. R., and Pilar, G. 1963. / Physiol. 168: 443-463.
5.Borst, J. G. G., and Sakmann, B. 1996. Nature 383: 431-434.
6.Katz, В., and Miledi, R. 1967. J. Physiol. 192: 407-436.
7.Katz, В., and Miledi, R. 1965. J. Physiol. 181: 656-670.
8.Parnas, H., Segel, L., Dudel, J., and Parnas, I. 2000. Trends Neurosci. 23: 60-68.
9.del Castillo, J., and Stark, L. 1952. / Physiol. 116: 507-515.
10.Dodge, F. A., Jr., and Rahamimoff, R. 1967. /. Physiol. 193: 419-432.
11.Schwartz, E.A. 1987. Science 238: 350-355.
12.Penner, R., and Neher, E. 1988. /. Exp. Biol. 139: 329-345.
13.Kasai, H. 1999. Trends Neurosci. 22: 88-93.
14.Katz, В., and Miledi, R. 1967. /. Physiol. 189: 535-544.
15.Llinàs, R. 1982. Sci. Am. 247(4): 56-65.
16.Llinàs, R., Sugimori, M., and Silver, R. B. 1992. Science 256: 677-679.
17. Adler, E. M., et al. 1991. /. Neurosci. 11: 1496-1507.
18.Hochner, В., Parnas, H., and Parnas, I. 1989. Nature 342: 433-435.
19.Delany, K. R., and Zucker, R.S. 1990. J. Physiol. 426: 473-498.
20.Zucker, R.S. 1993. /. Physiol. (Paris) 87: 25-36.
21.Heidelberger, R., et al. 1994. Nature 371: 513-515.
al. 1994. Nature 371: 513-515.
22.Linial, M., Ilouz, N.. and Parnas, H. 1997. /. Physiol. 504: 251-258.
Ilouz, N.. and Parnas, H. 1997. /. Physiol. 504: 251-258.
23.Fatt, P., and Katz, B. 1952. /. Physiol. 117: 109-128.
24.Kuffler, S. W., and Yoshikami, D. 1975. /. Physiol. 251: 465-482.
25.del Castillo, J., and Katz, B. 1954. /. Physiol. 124: 586-604.
26.Brooks, V. B. 1956. /. Physiol. 134: 264-277.
27.Birks, R., Katz, В., and Miledi, R. 1960. /. Physiol. 150: 145-168.
28.Reiser, G., and Miledi, R. 1989. Brain Res. 479: 83-97.
29. .Katz, В., and Miledi, R. 1977. Proc. R.Soc. Land. В 196: 59-72.
30.Vyskocil, F., Nikolsky, E., and Edwards, C. 1983. Neuroscience 9: 429-435.
31.del Castillo, J., and Katz, B. 1954. /. Physiol. 124: 560-573.
32.Johnson, E.W., and Wernig, A. 1971. /. Physiol. 218: 757-767.
33.Rahamimoff, R., and Fernandez, J. M. 1997. Pre-and postfusion regulation of transmitter release. Neuron 18: 17-27.
34.Stjurne, L., et al. 1994. Molecular and Cellular Mechanisms of Neurotransmitter Release. Raven, New York.

242 |
Раздел II. Передача информации в нервной системе |
35.Blackmail, J. G., and Purves, R. D. 1969. /. Physio/. 203: 173-198.
36.Martin, A.R., and Pilar, G. 1964. /. Physiol. 175: 1-16.
37.Redman, S. 1990. Physiol. Rev. 70: 165-198.
38.Edwards, F. A., Konnerth, A., and Sakmann, B. 1990. /. Physiol. 430: 213-249.
39.Kuno, M. 1964. /. Physiol. 175: 81-99.
40.Walmsley, В., Alvarez, F.J., and Fyffe, R.E.W. 1998. Trends Neurosci. 21: 81-88.
41.Bekkers, J. M. 1994. Си/г. Opin. Neurobiol. 4: 360-365.
42.Magleby, K. L., and Weinstock, M. M. 1980. /. Physiol. 299: 203-218.
43.Katz, В., and Miledi, R. 1972. / Physiol. 244: 665-699.
44.Gold, M. R., and Martin, A. R. 1983. /. Physiol. 342: 85-98.
45.Jonas, P., Major, G., and Sakmann, B. 1993. /. Physiol. 472: 615-663.
46.Villanueva, S., Fiedler, J., and Orrego, F. 1990. Neuroscience 37: 23-30.
47.Hartzell, H.C., Kuffler, S.W., and Yoshikami, D, 1975. /. Physiol. 251: 427-463.
48.Salpeter, M. M. 1987. In The Vertebrate Neuromus-cular Junction. Alan R. Liss, New York, pp. 1-54.
49.Harris, K. M., and Landis, D. M. M. 1986. Neuro-science 19: 857-872.
50.Schikorski, T., and Stevens, C. F. 1997. /. Neurosci 17: 5858-5867.
51.Denis, M, J., and MHedi, R. 1974. /. Physiol. 239: 571-594.
52.Erxleben, C. and Kriebel, M. E. 1988. /. Physiol. 400: 659-676.
53.Vautrin, J., and Kriebel, M. E. 1991. Neuroscience 41: 71-88.
54.Drachman, D. B. 1994. New England J. Med. 330: 1797-1810.
55.Reger, J.F. WSS.Anat. Rec. 130: 7-23.
56.Birks, R., Huxley, H. E., and Katz, B. 1960. /. Physiol. 150: 134-144.
57.Robitaille, R., Adler, E. M., and Charlton, M. R
1990. Neuron 5: 773-779.
58.Cohen, M.W., Jones, O.T., and Angelides, K. J. 1991. /. Neurosci. 11: 1032-1039.
59.Sugiura, Y, et al. 1995. J. Neurocytol. 24: 15-27.
60.Olivera, B. M., et al. 1994. Annu. Rev. Biochem. 63: 823-867.
61.Heuser, J. E., Reese, T.S., and Landis, D. M. D. 1974. /. Neurocytol. 3: 109-131.
62.Peper, K., et al. 1974. Cell Tissue Res. 149:437-455.
Tissue Res. 149:437-455.
63.Porter, C.W., and Barnard, E.A. 1975. /. Membr. Biol. 20: 31-49.
64.Kirshner, N. 1969. Adv. Biochem. Psychopharmacol. 1:71-89.
65.Smith, A. D., et al. 1970. Tissue Cell 2: 547-568.
66.Silinsky, E. M., and Redman, R. S. 1996. /. Physiol. 492: 815-822.
67.Wagner, J. A., Carlson, S. S., and Kelly, R. B. 1978. Biochemistry 17: 1199-1206.
68.Heuser, J. E., et al. 1979. /. Cell Biol. 81: 275-300.
69.Heuser, J. E., and Reese, T. S. 1981. /. Cell Biol. 88: 564-580.
70.Lang, T., et al. 1997. Neuron 18: 857-863.
71.Steyer, J.A.,
J.A., Horstmann,
Horstmann, H., and Aimers, W. 1997. Nature 388: 474-478.
H., and Aimers, W. 1997. Nature 388: 474-478.
72.Steyer, J.A., and Aimers, W. 1999. Biophys. J. 76: 2262-2271.
73.Oheim, M., et al. 1999. Philos. Trans. R. Soc. Land. £354:307-318.
74.Dunant, Y, and Israel, M. 1998. Neurochem. Res. 23: 709-718.
75.Cammack, J.N., and Schwartz, E.A. 1993. / Physiol. 472: 81-102.
76.Cammack, J. N., Rakhilin, S.V., and Schwartz, E.A. 1994. Neuron 13: 949-960.
77.Ceccarelli, В., and Hurlbut, W. P. 1980. Physiol. Rev. 60: 396-441.
78.Dickinson-Nelson, A., and Reese, T. S. 1983. /. Neurosci. 3: 42-52.
79.Wickelgren, W. O., et al. 1985. J. Neurosci. 5: 1188-1201.
80.Heuser, J. E., and Reese, T.S. 1973. /. Cell Biol. 57: 315-344.
81. Valtorta, F., et al. 1988. J. Cell Biol. 107: 2717-2727.
82.Miller, T.M., and Heuser, J.E. 1984. /. Cell Biol. 98: 685-698.
83.Cochilla, A. J., Angleson, J. K., and Betz, W. J. 1999. Annu. Rev. Neurosci. 22: 1-10.
84.Betz, W. J., and Bewick, G. S. 1993. /. Physiol. 460: 287-309.
85.Ryan, T.A., et al. 1993. Neuron 11: 713-724.
86.Teng, H., et al. 1999. J. Neurosci. 19: 4855-4866.
87.Ryan, T.A., Reuter, H., and Smith, S.J. 1997. Nature 388: 478-482.
88.Penner, R., and Neher, E. 1989. Trends Neurosci. 12: 159-163.
89.Angleson, J. K., and Betz, W. J. 1997. Trends Neurosci. 20: 281-287.
90.Fernandez, J. M., Neher, E., and Gomperts, B. D. 1984. Nature 312: 453-455.
91.Albillos, A., et al. 1997. Nature 389: 509-512.
92.Lim, N. F., Nowycky, M.C., and Bookman, R.J. 1990. Nature 344: 449-451.
93.von Gersdorff, H., and Matthews, G. 1997. /. Neurosci. 17: 1919-1927.
94.Fesce, R., et al. 1994. Trends Cell ВЫ. 4: 1-4.
95.KJingauf, J., Kavalali, E. T., and Tsien, R. W. 1998. Nature 394: 581-585.
