
Nikolls_-_Ot_neyrona_k_mozgu
.pdf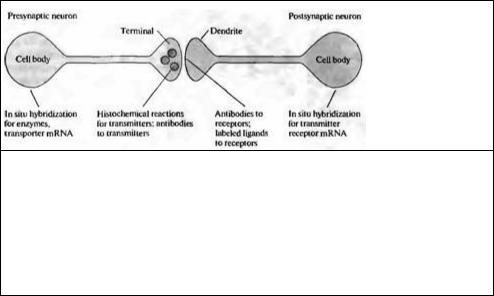
Глава 14. Нейромедиаторы в центральной нервной системе |
293 |
Рис. 14.1. Методы идентификации нейромедиаторов в ЦНС Для выявления экспрессии ферментов, участвующих в синтезе или распаде медиаторов в пресинаптическом нейроне, могут быть использованы меченые антитела или нуклеотидные зонды. Сам нейромедиатор может быть обнаружен с помощью гистохимической реакции или с помощью антител к конъюгированной форме медиатора. Специфичный захват радиоактивно меченого медиатора помогает обнаруживать некоторые нейроны. Лиганды или антитела к постсинаптическим рецепторам или нуклеотидные зонды к мРНК рецепторам позволяют установить восприимчивость нейронов к конкретным медиаторам.
Fig. 14.1. Methods for Identifying Neurotransmitters in the CNS. Labeled antibodies or nucleotide probes can be used to detect the expression of enzymes involved in synthetic and degradative pathways in the presynaptic neuron. The neurotransmitter itself can be detected by chemical reaction or by antibodies to a conjugated form of the transmitter. Specific uptake of radiolabeled transmitter can identify some neurons. Ligands or antibodies to postsynaptic receptors, or nucleotide probes for receptor mRNA, provide means to identify cells sensitive to a particular transmitter.
представляют собой потенциальную мишень для фармакологических воздействий, позволяющих корректировать нарушения медиаторного баланса, возникающие при различных заболеваниях. Более широкие возможности для фундаментальных и клинических исследований появляются в связи с наличием большого разнообразия мембранных рецепторов для каждого типа медиаторов, идентифицированных с помощью методов молекулярного клонирования. Однако новые знания, полученные с помощью методов молекулярной генетики, не могут быть использованы без установления принадлежности к определенному классу нейромедиаторов, механизма действия и распределения медиаторов в центральной нервной системе.
Материал этой главы в некоторой степени повторяет информацию, представленную в главах 3 и 13. Здесь, однако, мы хотим обратить ваше внимание на типы нейронов, которые содержат различные медиаторы, и их распределение в центральной нервной системе. Начнем с методов выявления медиаторов, которые используются для картирования распределения нейронов, высвобождающих отдельные медиаторы. Эти методы суммарно представлены на рис. 14.1. Они включают визуализацию медиатора как такового, мечение одного из белков, участвующих в синтезе, действии или деградации медиатора, и выявлении мРНК для этих белков. Идентификация предполагаемых генов позволяет создавать трансгенных животных или использовать антисенс--нуклеотиды (antisense nucleotides) для блокады специфичной мРНК. Безусловно, такая информация дает возможность предлагать новые методы терапевтических воздействий для лечения дефектов центральной нервной системы с помошью методов генной инженерии и переноса генов.
§ 1. Картирование распределения медиаторов
Одним из подходов, используемых для визуализации нейронов, которые высвобождают какиелибо медиаторы в ЦНС, является картирование распределения нейронов с помощью методов гистологии или иммуногистохимии. Флуоресцентный метод Фалька и Хиллярпа1) позволяет метить нейроны, содержащие биогенные амины, такие как дофамин, норадреналин и 5- гидрокситриптамин (5-НТ, известный также как серотонин). После конденсации с формальдегидом каждое из этих веществ при облучении ультрафиолетом начинает испускать свет с характерной длиной волны2) (рис. 14.2). Для небольших молекул нейромедиаторов, таких как ГАМК (γ-аминомасляная кислота), 5-НТ, дофамин3) и нейропептиды, были созданы специфичные антитела. Антитела напрямую или через

294 |
Раздел П. Передача информации в нервной системе |
Рис. 14.2. Визуализация клеток, содержащих биогенные амины, и их терминален с помощью вызванной формальдегидом флюоресценции. (А) Клетки, содержащие норадреналин, в голубом пятне (locus coeruleus) (В) Распределение окончаний клеток голубого пятна в гиппокампе.
Fig. 14.2. Visualization of Biogenic AmineСопtaining Cells and their terminal arborizations by formaldehydeinduced fluorescence. (A) Norepinephrine-containing cells in the locus coeruleus. (B) The terminal arborizations of locus coeruleus cells in the hippocampus. (From Harik, 1984.)
промежуточные звенья соединяют с маркерами, которые могут быть обнаружены с использованием световой, флуоресцентной или электронной микроскопии. Методы клонирования кДНК нейропептидов и гибридизации in situ дали дополнительные возможности для идентификации нейронов, которые синтезируют нейропептиды, и для изучения регуляции экспрессии пептидов4).
Альтернативой методам мечения самих медиаторов является создание специфических зондов для обнаружения ферментов, осуществляющих синтез и деградацию медиаторов. Нейроны содержат большое число ферментов, катализирующих синтез тех медиаторов, которые высвобождаются данными нейронами. Например, нейроны, использующие в качестве медиатора ГАМК, имеют высокий уровень фермента декарбоксилазы глутаминовой кислоты. Антитела к этому ферменту были использованы для обнаружения ГАМК-содержащих нейронов5· 6). Антитела к ферменту холинацетилтрансферазе метят холинергические нейроны7), в то время как антитела к тирозингидроксилазе и дофамин-β- гидроксилазе выявляют клетки, высвобождающие дофамин и норадреналин8). Для многих ферментов, участвующих в синтезе нейромедиаторов, была клонирована комплементарная ДНК. Регуляция и локализация мРНК этих ферментов были изучены с использованием метода гибридизации in situ9). Ферменты, участвующие в распаде медиатора, в меньшей степени подходят для его идентификации. В то же время при определенных условиях ферменты, разрушающие ацетилхолин и ГАМК, могут быть использованы в качестве подходящих маркеров этих медиаторов10)--12).
Химическая природа синапсов может быть также установлена с помощью зондов, распознающих рецепторы на постсинаптических клетках. Например, моноклональные антитела к рецепторам ГАМК были использованы для локализации синапсов, в которых ГАМК, возможно, является медиатором13). С другой стороны, сам медиатор или специфичный агонист или антагонист рецепторов, содержащий радиоактивную метку, может быть использован для обнаружения рецепторов14)--16). Другие методы основаны на механизмах инактивации медиаторов. Например, клетки, которые высвобождают биогенные амины или ГАМК, имеют специфичные системы обратного захвата этих медиаторов. Поэтому при инкубации ткани с радиоактивным норадреналином, дофамином, 5-НТ или ГАМК можно избирательно выделить те нервные терминали, которые высвобождают эти медиаторы.
Быстрое нарастание сведений о генах, кодирующих рецепторы нейромедиаторов, сделало возможным разработку и внедрение экспериментальных стратегий, использующих молекулярно-генетические методы. In situ гибридизация позволяет установить местонахождение мРНК. Полимеразные цепные реакции, осуществляемые обратной транскриптазой (reverse-transcriptase polimerase chain reaction) (RT-PCR) дают возможность амплификации продуктов идентифицированных генов. Эта реакция может быть проведена на небольших фрагментах нервной ткани или даже на единичных изолированных клетках17). Можно также вывести трансгенных животных, у которых необходимый ген, предположительно кодирующий рецептор, удаляют с помощью технологии нокаута (gene "knock
Глава 14. Нейромедиаторы в центральной нервной системе |
295 |
out") или изменяют каким-либо другим способом. Последующее изучение поведения и физиологии таких животных дает информацию о вкладе гена-кандидата в работу синапсов. Эксперименты сходного типа могут быть выполнены и на клетках при введении в них антисенс-олигонуклеотидов в условиях in vitro18). Наконец, мутации генов, связанных с функциями нейромедиаторов, и имеющие место в естественных условиях у людей или животных, приводят к изменениям поведения, которые позволяют сделать выводы о функциях продуктов, кодируемых этими генами. В случае рецептора для нейромедиатора это могут быть анатомические или функциональные изменения в отделах мозга или даже в отдельных нейронах, чувствительных к этому нейромедиатору.
ГАМК и глицин: тормозные медиаторы в ЦНС
ГАМК высвобождается в тормозных синапсах различных областей ЦНС. В серии изящных экспериментов Отсука, Ито, Обата и их коллеги установили, что клетки Пуркинье мозжечка выделяют ГАМК в качестве тормозного медиатора в синапсах, которые они образуют на клетках ствола мозга19)--21). В зрительной системе также получены морфологические и физиологические доказательства высвобождения ГАМК как медиатора (главы 19 и 20). Так, в сетчатке ГАМК обнаружена в определенных типах горизонтальных и амакриновых клеток22)-- 25). В ядрах латерального коленчатого тела некоторые клетки содержат фермент декарбоксилазу глутаминовой кислоты, синтезирующий ГАМК, а в зрительной коре определенные типы локальных тормозных нейронов содержат декарбоксилазу глутаминовой кислоты и имеют систему захвата ГАМК26).
Местная аппликация агентов, блокирующих действие ГАМК, оказывает влияние на нейрональную сигнализацию в зрительной системе. Так, бикукуллин и пикротоксин изменяют организацию рецептивных полей ганглионарных клеток сетчатки и комплексных клеток коры (главы 19 и 20)27· 28). Бесспорно установлено наличие большой доли ГАМК--содержащих нейронов в центральной нервной системе. Например, в ряде областей коры больших полушарий каждый пятый нейрон высвобождает ГАМК в качестве медиатора29). Важность тормозных взаимодействий, опосредуемых ГАМК, для нейронной сигнализации в ЦНС в целом может быть проиллюстрирована тем фактом, что применение веществ, которые блокируют рецепторы ГАМК, таких как пикротоксин и пенициллин, приводит к возникновению судорог30).
Вторым, медиатором, осуществляющим торможение в синапсах ЦНС, особенно в тех, которые расположены в стволе головного мозга и спинном мозге, является глицин. В спинном мозге кошки и речной миноги глицин играет роль основного тормозного медиатора31· 32). Увеличение проводимости мембран нейронов для хлора вследствие стимуляции тормозных путей точно воспроизводится внеклеточной аппликацией глицина из пипетки. Оба тормозных медиатора — и ГАМК, и глицин — открывают хлорные каналы на мембране. Для того чтобы разделить влияние этих медиаторов на проводимость и кинетику открытых каналов, необходимо осуществить запись активности одиночных ионных каналов, активируемых этими медиаторами, или провести анализ шумов. Таким образом можно продемонстрировать, что характеристики каналов, открываемых эндогенными медиаторами в процессе синаптической активности, соответствуют характеристикам каналов, которые активируются во время аппликации экзогенного ГАМК или глицина. Простым и часто используемым методом, позволяющим разделить эффекты этих двух медиаторов, является применение веществ, блокирующих торможение, таких как стрихнин для глициновых рецепторов и пикротоксин и бикукулин для ГАМК рецепторов33).
Ионотропный глициновый рецептор является членом суперсемейства лиганд-зависимых ионных каналов, которое включает никотиновые АХ рецепторы, рецепторы ГАМК и 5-НТ34) (глава 3). Мутация α-субъединицы глицинового рецептора у мышей и человека приводит к возникновению нарушения двигательной функции и поведения35· 36), что подчеркивает важное значение глииинергической синаптической сигнализации.
Рецепторы ГАМК
В ЦНС обнаружены три класса рецепторов ГАМК. Два из них, ГАМКA и ГАМКС, являются ионотропными, а ГАМКВ рецепторы — метаботропными. Идентифицированы четыре типа субъединиц ГАМКД рецепторов (глава 3): α, β, γ и δ37· 38)). Субъединицы α и β, каждая по отдельности или в комбинации,
296 |
Раздел П. Передача информации в нервной системе |
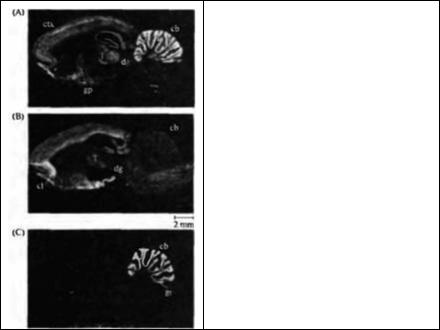
Рис. 14.3. Распределение мРНК субъединиц ГАМКА рецептора в мозге крысы. Представлены авторадиограммы серийных срезов мозга крысы, полученные с помощью in situ гибридизации с мечеными 35S антисенс олигонуклеотидными
зондами к α1 (А), α3 (В) и α6 (С) субъединицы ГАМКA рецептора, cb = мозжечок; cl = claustrum; ctx = кора больших полушарий; dg = зубчатая фасция; др = бледный шар; gr = гранулярные клетки мозжечка; Т = таламус.
Fig. 14.3. The Distribution of GABAA Receptor Subunit mRNAS in the rat brain. Light-microscopic autoradiographs of serial sections of rat brain following in situ hybridization with 35S-labeled
antisense oligonucleotide probes for the αE, (A),
α3 (B), and α6 (C) GABAA receptor subunits. cb = cerebellum, cl = claustrum, ctx = cortex, dg = dentate gyrus, gp = globus pallidus, gr = cerebellar granule cells, Т = thalamus. (After Luddens and Wisden, 1991; autoradiographs kindly provided by W. Wisden.)
могут образовывать каналы в экспериментальных условиях. Каждый тип субъединиц объединяет множество различающихся между собой изоформ, поэтому разные комбинации субъединиц образуют рецепторы с разными свойствами. Распределение мРНК, кодирующей разные изоформы субьединиц рецепторов ГАМ К, различается в разных отделах мозга, что предполагает наличие специфичности распределения подтипов рецепторов ГАМК в мозге29).
Как видно на рис. 14.3, высокий уровень экспрессии подтипов субъединиц α и α , но не α ,
?> 6 3
наблюдается в мозжечке. Определенная комбинация субъединиц ГАМК рецептора, включающая α?, β2, γ2-субъединицы, более широко распространена в нервной системе, чем другие варианты39). Установлено, что различный субъединичный состав рецепторов ГАМК вносит определенный вклад в фармакологическую гетерогенность нативных рецепторов40).
Вначале 1980-х годов в нейронах ЦНС были обнаружены медленные ответы на аппликацию ГАМК, нечувствительные к действию бикукуллина41). Такие медленные ответы вызывал
баклофен, который не оказывает влияния на ГАМКД рецепторы. Этот эффект связан с
активацией метаботропных ГАМКВ рецепторов. Позднее был клонирован ген ГАМКB, рецепторов42· 43). Он кодирует G--белок-сопряженный рецептор, имеющий семь трансмембранных доменов и сходный с метаботропным глутаматным рецептором (глава 10).
Постсинаптические ГАМКВ рецепторы активируют калиевые каналы внутреннего выпрямления (GIRK или Kir3.0)44)--45), тогда как пресинаптические ГАМКВ рецепторы подавляют активность потенциалзависимых кальциевых каналов47).
Вбиполярных клетках сетчатки наблюдаются быстрые ГАМК-зависимые изменения тока
хлора, подобные тем, что имеют место при активации ГАМКА рецепторов, но не чувствительные к бикукуллину (или баклофену). Рецепторы, осуществляющие этот процесс,
были названы ГАМКС рецепторами48). Эти рецепторы фармакологически, генетически и функционально отличаются от ГАМКА рецепторов49). ГАМКС рецепторы особо чувствительны к аналогу ГАМК — цис-4-аминокротоновой кислоте. Два родственных гена (rho1 и rho2) кодируют ГАМКс-подобный рецептор, экспрессирующийся в ооцитах Xenopus50), и субъединица rho2 была обнаружена в мозге повсеместно. Объединяясь вместе, субъединицы
ГАМКА и ГАМКС рецепторов могут образовывать совершенно иной, функционально отличный класс рецепторов51).
Модуляция функции ГАМКд рецепторов бензодиазепинами и барбитуратами
Отличительной чертой ГАМКА рецепторов является их регуляция посредством аллостерической модуляции52). ГАМКА рецепторы имеют места связывания как минимум для

Глава 14. Нейромедиаторы в центральной нервной системе |
297 |
Рис. 14.4. Гипотетическая модель ГАМКА рецептора. (А) Изображен рецептор в виде
α2β2γ комплекса по аналогии с никотиновым ацетилхолиновым рецептором; действительное число и состав субъединиц натив ного рецептора
неизвестны. ГАМК и барбитураты связываются сα и
β-субъединицами, каждая из которых может образовывать функционирущий гомомультимерныи
рецептор; бензодиазепины связываются с γ субъединицей. (В) Вид рецептора в поперечном разрезе.
Fig. 14.4. Hypothetical Model for the GABAA Receptor.
(A) The receptor is drawn as an α2β2γ complex, by analogy with the nicotinic acetylcholine receptor; the actual number and arrangement of subunits in the native receptor is not known. GABA and barbiturates bind to the
α and β subunits, each of which can form a functional
homomultimeric receptor; benzodiazepines bind to the γ subunit. (B) Cross-sectional view of the receptor.
двух классов модуляторов: бензодиазепинов и барбитуратов (рис. 14.4). Бензодиазепины, к которым относят диазепам (Валиум) и хлордиазепоксид (Либриум), являются транквилизаторами и мышечными релаксантами. Барбитураты, такие как фенобарбитал и секобарбитал, являются противосудорожными препаратами. И те, и другие вещества усиливают вызванные ГАМК хлорные токи. Причем бензодиазепины увеличивают частоту открывания ионных каналов, а барбитураты продлевают время пребывания каналов в открытом состоянии44). Субъединицы α к β имеют места связывания и для ГАМК, и для барбитуратов (см. рис. 14.4); кроме того, экспрессия каждой из этих субъединиц в отдельности может приводить к образованию функционирующего рецептора53). Бензодиазепины связываются с γ2 субъединицей. Субъединица γ должна экспрессироваться одновременно с α и β-субъединицами, для того чтобы образовался ГАМКА рецептор, чувствительный к бензодиазепинам54). Аффинность и специфичность каждого из мест связывания по отношению к их лигандам определяется не только внутренними свойствами субъединицы, но также ее взаимодействиями с другими субъединицами.
Предполагаемый нативный ГАМКА рецептор представляет собой пентамер, состоящий из двух α, двух β и одной γ или δ субъединиц. Следовательно, существующее разнообразие субъединиц является достаточным, чтобы образовать сотни различных рецепторов. Изучение распределения и свойств различных подтипов рецепторов и идентификация эндогенных лигандов, если таковые существуют, для мест связывания барбитуратов и бензодиазепинов являются областями активных исследований55). Рецепторы ГАМК (и глутамата) в ЦНС и сетчатке также модулируются цинком56· 57). Цинк в высоких концентрациях присутствует в некоторых синаптических пузырьках и высвобождается в период активности нейрона.
Глутаматные рецепторы в ЦНС
Множество физиологических тестов подтверждает идею о том, что глутамат, впервые открытый как возбуждающий медиатор в нервно-мышечном контакте саранчи58) и гигантском синапсе кальмара59), высвобождается в качестве медиатора в возбуждающих синапсах центральной нервной системы60). Как было описано в главе 3, ионотропные глутаматные рецепторы могут быть сгруппированы в два крупных класса: NMDA (на основании связывания с N-метил-D-аспартатом) и не-NMDA, включающий AMРА (по связыванию с а-амино-3- гидрокси-5-изоксазолпропионовой кислотой) и каинатные рецепторы61). NMDA рецепторы формируют каналы, проницаемые для кальция, которые могут быть мишенью для действия ряда важных модулирующих факторов. Ионы магния блокируют ток через канал, сопряженный с NMDA рецептором. Магниевый блок может быть снят действием сильной деполяризации (глава 12)62)--64). Активность NMDA рецепторов также чрезвычайно сильно зависит от наличия внеклеточного глицина, который, действуя аллостерически, способствует открыванию каналов глутаматом65).
О роли кальция, входящего в клетку через NMDA рецепторы, в длительных изменениях сигнализации в центральных синапсах было рассказано в главе 12. Избыточный при-

298 |
Раздел II. Передача информации в нервной системе |
|
|
|
|
Рис. 14.5. Распределение глутаматных рецепторов в ЦНС (A) NMDA рецепторы на авторадиограмме парасагит тального среза мозга крысы, выявленные с помощью меченного тритием глутамата (выбраны условия, при которых АМРА рецепторы не обнаруживаются). (В) Места связывания меченного тритием АМРА. АМРА и NMDA рецепторы широко распространены, и,р6ласти их распределения, главным образом, перекрываются, как, например, в коре больших полушарий. Однако можно наблюдать и определенные различия: например, относительно меньшее число NMDA рецепторов наблюдается в молекулярном слое клеток мозжечка. С — кора больших полушарий; G = слой гранулярных клеток мозжечка; M = молекулярный слой мозжечка.
Fig. 14.5. The Distribution of Glutamate Receptors in the CNS. (A) NMDA receptors in a parasagittal autoradiograph of rat brain labeled by tritiated glutamate (conditions chosen so that AMPA receptors were not labeled). (B) Tritiated AMPA binding sites. AMPA and NMDA receptors are widespread and generally overlap, as in cerebral cortex.
However, differences also can be seen: for example, there are relatively few NMDA receptors in the molecular layer of cerebellum. С = cerebral cortex; G = granule cell layer of cerebellum; M = molecular layer of cerebellum. (After Young et al. 1995.)
ток ионов кальция через NMDA рецепторы также является причиной нейротоксичлости, наблюдающейся при различных патологиях нервной системы, включая аноксию, гипогликемию и судороги. В этих условиях уровень глутамата сохраняется на высоком уровне в течение продолжительного периода, постоянно активируя NMDA рецепторы и позволяя внутриклеточной концентрации кальция достигать цитотоксического уровня. Антагонисты NMDA рецепторов могут предотвращать такую гибель нейронов66).
В ЦНС глутамат используется в качестве медиатора практически повсеместно, что подтверждается данными авторадиографического исследования распределения NMDA и АМРА рецепторов (рис. 14.5). Оба типа рецепторов широко представлены в коре больших полушарий и многих подкорковых отделах мозга. В то же время имеются значительные различия в относительной доле того или иного типа рецепторов в разных отделах мозга. Например, в мозжечке клетки Пуркинье экспрессирует относительно большее число АМРА, чем NMDA рецепторов67). Исследование распределения отдельных субъединиц рецепторов с помощью in situ гибридизации выявило еще более четкие паттерны распределения. В самом деле, селективная экспрессия подтипов АМРА рецепторов в ядрах слухового нерва в стволе мозга приводит к формированию быстрых каналов, что согласуется с той ролью, которую эти клетки играют в определении точного временного разрешения, необходимого для локализации источника звука (глава 18)68).
Оксид азота как медиатор в ЦНС
Биологическая активность оксида азота (NO) была впервые открыта благодаря его способности оказывать расслабляющее действие на гладкие мышцы эндотелия68) (глава 10). Нейрональная форма фермента, синтезируюшего NO, NO-синтазы (NOC), экспрессируется в ЦНС70)--72). Избыточная продукция NO является нейротоксичной и вносит определенный вклад в патогенез неврологических заболеваний73). Трансгенные мыши, у которых отсутствует NOC, устойчивы к ишемии мозга74), а химическое повреждение дофаминергических нейронов предотвращается ингибированием NOC75). Активность NOC может иметь особенно важное значение для холинергических нервных сетей в ЦНС. Содержащие NOC нейроны коры больших полушарий специфично иннервируются холинергическими нейронами базальных ядер переднего мозга76), которые сами содержат высокий уровень NOC.
Ацетилхолин: базальные ядра переднего мозга
Первым веществом, которое было открыто в качестве медиатора в ЦНС, был ацетилхо-
Глава 14. Нейромедиаторы в центральной нервной системе |
299 |
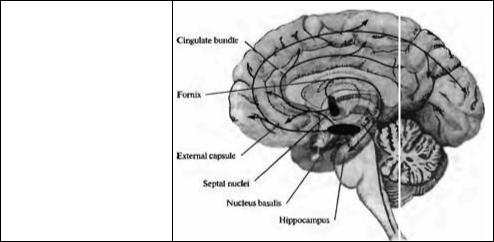
Рис. 14.6. Холинергическая иннервация коры больших полушарий и гилпо кампа нейронами ядер септума и ба зального ядра.
Fig. 14.6. Cholinergic Innervation of the cortex and hippocampus by neurons in the septal nuclei and nucleus basalis.
лин, высвобождающийся в синапсах, образованных коллатералями спинальных нейронов на клетках Реншоу77). Эти синапсы, обеспечивающие быструю синаптическую передачу с участием никотиновых ацетилхолиновых рецепторов, являются, однако, нетипичными. В последующих работах в различных областях мозга было продемонстрировано большое разнообразие ответов на ацетилхолин, которые осуществляются мускариновыми рецепторами. Эти ответы включают увеличение катионной проводимости мембраны, усиление или снижение проводимости для ионов калия и снижение кальциевой проводимости. Несмотря на то, что никотиновые ацетилхолиновые рецепторы несомненно экспрессируются в ЦНС (одним из примеров их существования является привыкание к курению сигарет), их синаптическую функцию определить пока довольно трудно.
Холинергические нейроны обнаружены в ядрах, разбросанных по всему мозгу, и холинергические аксоны иннервируют большинство регионов ЦНС. Наиболее известными источниками холинергического входа в кору больших полушарий и гиппокамп являются базальные ядра переднего мозга, особенно ядра септума и базальное ядро (рис. 14.6). Холинергические нейроны этих ядер имеют широко разветвленные и диффузные проекции, иннервирующие кору, гиппокамп, миндалину, таламус и ствол мозга. Повреждение базального ядра приводит к снижению уровня холинацетилтрансферазы в коре более, чем на 50%78).
Холинергические нейроны, когнитивные функции и болезнь Альцгеймера
В исследованиях на животных и человеке было установлено, что Холинергическая система имеет большое значение для когнитивных процессов, обучения и памяти79). Вещества, блокирующие мускариновые рецепторы, такие как атропин и скополамин, как и повреждение базального ядра, нарушают приобретение новых навыков и выполнение приобретенных форм поведения. Ингибиторы ацетихолинэстеразы, такие как физостигмин, могут улучшать выполнение задач на обучение и память и восстанавливать некоторые дефекты, возникшие вследствие повреждения базальных ядер переднего мозга. Однако такие повреждения неизбежно затрагивают клетки, высвобождающие другие медиаторы, поэтому воздействия, имеющие целью усилить функцию холинергических нейронов, лишь частично восстанавливают последствия этих повреждений. Таким образом, функция памяти осуществляется не только холинергическими нейронами, но более вероятно, что они вместе с нейронами, высвобождающими другие медиаторы, образуют один из модуляторных входов в кору и гиппокамп80).
Интерес к роли холинергических нейронов базальных ядер в процессах обучения и памяти возрос после того, как было установлено, что снижение когнитивных способностей при старении происходит параллельно со снижением уровня фермента холинацетилтрансферазы, синтезирующего ацетил-
300 |
Раздел II. Передача информации в нервной системе |
|||||
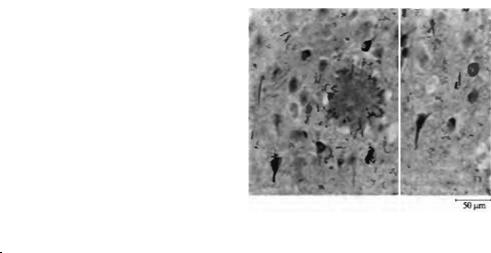
Рис. 14.7. Нейрофибриллярные сплетения и |
|
|
|
|||
сенильные бляшки, характерные для болезни |
|
|
|
|||
Альцгеймера. На срезе миндалины пациента с |
|
|
|
|||
болезнью |
Альцгеймера |
среди |
цитологически |
|
|
|
нормальных |
нейронов наблюдаются |
поврежденные |
|
|
|
|
пирамидные |
клетки, |
|
заполненные |
|
|
|
темноокрашенными |
неирофибриллярными |
|
|
|
||
сплетениями, образованными связками парных |
|
|
|
|||
спиральных филаментов. Сенильная бляшка (в |
|
|
|
|||
центре) образована крупным компактным отложением |
|
|
|
|||
внеклеточного амилоида, окруженного короной |
|
|
|
|||
расширенных, структурно измененных нервных |
|
|
|
|||
отростков. Модифицированная окраска серебром по |
|
|
|
|||
Бельшовски. |
|
|
|
|
|
|
Fig. 14.7. Neurofibrillary Tangles and Senile Plaques |
|
|
|
|||
characteristic of Alzheimer's disease. Scattered among |
|
|
|
|||
cytologically normal neurons in this section of the |
|
|
|
|||
amygdala from an Alzheimer's patient are abnormal |
|
|
|
|||
pyramidal cells filled with darkly staining neurofibrillary |
|
|
|
|||
|
|
|||||
tangles, formed by the accumulation of bundles of paired |
|
surrounded by a halo of dilated, structurally abnormal |
|
|||
helical filaments. In the center, a senile plaque con-sists |
|
neurites. Modified Bielschowsky silver stain. (Mikrograph |
||||
of a large, compacted deposit of extracellular amyloid |
|
kindly provided by D. J.Selkoe.) |
||||
холин в коре больших полушарий и гиппокампе и утратой холинергических нейронов в базальных ядрах81). Особенно выражены такие изменения у пациентов с болезнью Альцгеимера: наблюдается прогрессирующая нейродегенерация, вызывающая утрату памяти и когнитивных функций. Для болезни Альцгеимера характерно накопление в нейронах ЦНС нерастворимых агрегатов (нейрофибриллярных сплетений или клубков), состоящих из модифицированной формы белков, в норме связанных с цитоскелетом. Происходит также образование внеклеточных сенильных бляшек, сердцевина которых состоит из нерастворимых фибрилл, являющихся продуктом неправильного расщепления амилоидных белков. Сердцевина окружена дегенерирующими аксонами (рис. 14.7)82· 83). Такие повреждения встречаются в холинергических нейронах переднего мозга и в окончаниях их аксонов в гиппокампе. Кроме того, в образцах, полученных при аутопсии базального ядра, было обнаружено существенное снижение числа холинергических нейронов. Эти изменения не отражались на числе мускариновых ацетилхолиновых рецепторов, но коррелировали со снижением числа мест связывания никотина84).
В нейронах млекопитающих было найдено 10 субъединиц никотинового ацетилхолинового рецептора. Как считают, в ЦНС преобладающей комбинацией рецептора является пентамер,
состоящий из двух α4 и трех β2 субъединиц. Роль генов, кодирующих эти белковые продукты, в развитии болезни Альцгеимера неизвестна. В то же время было установлено, что мутантные мыши, у которых не функционировал ген, кодирующий субъединицу β2, хуже выполняли задачи на ассоциативную память, и введение никотина не улучшало их поведения85). Никотиновые рецепторы могут действовать как пресинаптические модуляторы в процессе высвобождения медиатора в ЦНС86). Например, низкие дозы никотина усиливают синаптическую передачу в гиппокампе87). Наконец, некоторые наследственные нервные болезни могут быть связаны с мутациями в генах, кодирующих субъединицы никотинового рецептора. Так, семейная форма аутосомно-доминантной ночной лобной эпилепсии, описанная в австралийских88) и норвежских89) семьях, связана с двумя разными мутациями гена, кодирующего субъединицы α4 никотинового холинорецептора.
При болезни Альцгеимера нейрофибриллярные сплетения присутствуют не только в холинергических нейронах. Их можно обнаружить также в проекционных нейронах и нейронах локальных сетей, высвобождающих другие нейромедиаторы, такие как норадреналин, дофамин, серотонин, глутамат, ГАМК, соматостатин, нейропептид Y и субстанцию Р. Таким образом, прямые доказательства того, что только повреждение холинергических нейронов базальных ядер пе-
Глава 14. Нейрамедиаторы в центральной нервной системе |
301 |
реднего мозга ответственны за когнитивные нарушения при болезни Альцгеймера, отсутствуют. Поэтому попытки облегчения когнитивного дефицита веществами, которые направлены только на улучшение функции холинергических нейронов, оказывают лишь частичный эффект89).
АТФ и аденозин как медиаторы ЦНС
Аденозинтрифосфат (АТФ) обнаружен в высоких концентрациях в сйнаптических пузырьках. Он действует как нейромедиатор, соединяясь с одним из большого (и все увеличивающегося) числа открытых ионотропных или метаботропных пуринергических рецепторов91). Семейство из семи генов кодирует ионотропные пуринергические рецепторы, относящиеся к Р2Х рецепторам, которые образуют лиганд-активируемые ионные каналы92) (глава 3). Метаботропные P2Y рецепторы сопряжены с G-белками и имеют семь трансмембранных доменов. Они кодируются восемью генами, идентифицированными к настоящему времени93). К пуринергическим рецепторам относятся также рецепторы, взаимодействующие с аденозином, метаболитом АТФ, который действует как модулятор синаптической передачи во многих синапсах94· 95). Известно, что четыре гена кодируют аденозиновые (Р1) рецепторы, которые относятся к метаботропным рецепторам, сопряженным с G-белками96).
Впервые нейромедиаторная функция АТФ и аденозина была открыта в гладкой мускулатуре. Как известно, эти пурины действуют в периферической нервной системе, в том числе в ноцицептивных афферентах97) (глава 17), и выполняют важные функции в клетках внутреннего уха98)--100). Пуринергические рецепторы также обнаружены в мозге, где они осуществляют различные модуляторные воздействия и оказывают влияние на поведение. Например, у трансгенных мышей отсутствие одного типа аденозиновых рецепторов, в норме экспрессируюшихся в базальных ганглиях, приводит к снижению исследовательской активности; самцы таких нокаутных мышей демонстрируют повышенный уровень агрессивности по отношению к новой незнакомой особи того же вида101). Первый клонированный метаботропный АТФ (P2Y) рецептор был получен из мозга цыпленка102). Несколько типов ионотропных (Р2Х) АТФ рецепторов широко представлены в мозге103, 104), некоторые из них найдены на катехоламинергических нейронах105), где они опосредуют пресинаптические эффекты АТФ, высвобождающегося из катехоламин-содержащих сйнаптических пузырьков. Кроме того, что АТФ выполняет функции синаптического модулятора в ЦНС, он действует как основной синаптический медиатор в периферических ганглиях. Антагонист Р2Х рецепторов сурамин блокирует спонтанные и вызванные спнаптические токи в нейронах медиальной уздечки106, 107).
§ 2. Пептидные медиаторы в ЦНС
С тех пор как в 1902 году Бейлис и Старлинг открыли в кишечнике первый гормон — секретин108), был выделен и охарактеризован целый ряд других интестинальных гормонов. Позже было установлено, что интестинальные гормоны, такие как секретин, гастрин, брадикинин, соматостатин и холецистокинин (ССК), являются пептидами. Эти пептиды были найдены в окончаниях автономных аксонов, которые иннервируют кишечник, и в нейронах энтеральной нервной системы (глава 16). С 1950-х годов известно, что определенные нейроны в мозге могут секретировать пептидные гормоны в локальное циркуляторное русло. Например, нервные клетки гипоталамуса выделяют релизингфакторы, которые достигают эндокринных клеток передней доли гипофиза, заставляя их секретировать другие гормоны в общий кровоток109).
Совершенно неожиданным стало открытие в 1970-х годах того, что пептиды, обнаруженные в энтеральной нервной системе, широко распространены в головном и спинном мозге110) Достижения иммунологических, цитохимических и физиологических методов анализа дали возможность продемонстрировать присутствие холецистокинпна, брадикинина, гастрина, вазоактивного интестинального полипептида (V1P), бомбезина (впервые выделенного из кожи лягушки Bombina bombina, упомянутой в его названии) и других кишечных гормонов в разных регионах ЦНС. Во многих случаях было показано, что пептиды могут высвобождаться вследствие стимуляции определенных отделов интактного мозга или срезов мозга111). Напротив, пептиды, обнаруженные сначала в гипоталамусе, позднее были найдены в кишечнике и поджелудочной железе.

302 |
Раздел П. Передача информации в нервной системе |
Рис. 14.8. Проводящий путь передачи ощущения боли в спинном мозге. (А, В) Клетки ганглия заднего корешка (DRG), которые отвечают на болевые стимулы, высвобождают субстанцию Ρ (SP) и глутамат в синапсах, образованных ими на интернейронах заднего рога спинного мозга. Интернейроны желатинозной субстанции заднего рога, содержащие энкефалин (ENK), блокируют передачу, ингибируя высвобождение медиатора из окончаний клеток DRG. (С) Запись внутриклеточного отведения от клеток ганглия заднего корешка показывает, что знкефалин вызывает снижение длительности потенциала действия.
Fig. 14.8. Pathway for Transmission of Pain Sensation in the Spinal Cord. (A, B) Dorsal root ganglion (DRG) cells responding to noxious stimuli release substance Ρ (SP) and glutamate at their synapses with interneurons in the dorsal horn of the spinal cord. Interneurons containing enkephalin (ENK) in the substantia gelatinosa of the dorsal horn block transmission by inhibiting transmitter release from terminals of DRG cells. (C) Intracellular recordings from the dorsal root ganglion cell demonstrate that enkephalin acts by causing a decrease in the duration of the action potential. (C after
Mudge, Leeman, and Fischbach, 1979.)
Субстанция Ρ
Первым намеком на идентичность пептидов центральной и энтеральной нервной системы стал медиатор, известный как субстанция Р112). Субстанция Ρ была впервые выделена фон Эйлером и Гаддумом в 1931 году из кишечника и мозга113). Они показали, что субстанция Ρ вызывает сокращения гладкой мускулатуры. Субстанция Ρ состоит из 11 аминокислотных остатков и является членом небольшого семейства родственных пептидов — тахикининов (также включающего нейрокинины А и В). Были установлены три рецептора нейрокининов (ΝΚ1, ΝΚ2, ΝΚ3), которые принадлежат к суперсемейству рецепторов, сопряженных с G-белками114). Субстанция Ρ выполняет функцию медиатора в окончаниях сенсорных аксонов малого диаметра дорзальных слоев спинного мозга, связанных с восприятием боли (ноцицепцией, рис. 14.8, см. также главу 18). Элиминация субстанции Ρ или ее рецептора (ΝΚ1) у трансгенных мышей приводит к снижению болевой чувствительности115· 116). Нокаугаые по ΝΚ1 мыши имеют сниженный уровень территориальной агрессии, которая может быть связана с нормальной экспрессией рецепторов субстанции Ρ и нейрокинина в нервных волокнах и секреторных клетках гипоталамогипофизарно-надпочечниковой оси 117).
Опиоидные пептиды
Интерес к пептидам мозга еще более вырос в середине 1970-х годов после двух серий экспериментов, выполненных Костерлицем, Хьюзом, Голдштейном, Снайдером и их коллегами118)--120). Во-первых, они обнаружили в мозге и кишечнике рецепторы, с которыми с высокой специфичностью взаимодействовал морфин. Во-вторых, им удалось найти в мозге пептиды, действие которых было сходным с действием опиатов. Первыми были охарактеризованы пентапептиды энкефалины. Один из энкефалинов известен как мет-энкефалин, а другой — лей-энкефалин, в зависимости от того, какая аминокислота расположена на карбоксильном конце пептида — метионин или лейцин. Другой ключевой находкой стало то. что опиоидные пептиды (пептиды с опиатной активностью) и их рецепторы сконцентрированы в отделах мозга, связанных с восприятием боли. Стиму-
