
Nikolls_-_Ot_neyrona_k_mozgu
.pdf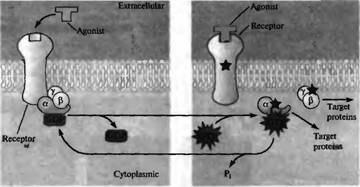
Глава 10. Механизмы непрямой синоптической передачи |
193 |
|||||||||
Рис. |
10.3. |
Метаботропные |
|
|
||||||
рецепторы |
действуют |
через |
|
|
||||||
G белки. G-белки являются |
|
|
||||||||
тримерами |
состоящими |
из |
|
|
||||||
α-, β- и γ?субъединиц. |
|
|
||||||||
Активация |
метаботролного |
|
|
|||||||
рецептора, |
|
происходящая |
|
|
||||||
при |
связывании |
агониста |
|
|
||||||
(отмечено |
|
|
звездочкой), |
|
|
|||||
вызывает |
|
замену |
|
ГТФ |
|
|
||||
(GTP) |
на 1ДФ (GDP) на α- |
|
|
|||||||
субъединице G-белка. |
Это |
|
|
|||||||
приводит к активации α- |
|
|
||||||||
субъединицы |
и |
βγ |
- |
|
|
|||||
комплекса, |
|
|
которые |
|
|
|||||
отсоединяются от рецептора |
|
|
||||||||
и друг от друга. В |
связыванию всех субъединиц в неактивный αβγ-комплекс и окончанию ответа. |
|||||||||
свободном |
|
состоянии |
||||||||
активная |
α субъединица |
и |
Fig. 10.3. Indirectly Coupled Transmitter Receptors Act through G Proteins. G proteins are |
|||||||
βγ-комллекс |
|
|
|
|
||||||
|
|
|
|
trimers of α, β/and γ−0subunits. Activation of a |
metabotropic receptor by agonist binding |
|||||
взаимодействуют с белками- |
||||||||||
(indicated by a star) promotes the exchange of GTP for GDP on the α subunit of the G protein. |
||||||||||
мишенями, |
α-субъединица |
|||||||||
This activates the α subunit and the βγ complex, causing them to dissociate from the receptor |
||||||||||
обладает |
эндогенной |
ГТФ- |
||||||||
and from one another. The free activated α-GTP subunit and βγ complex each interact with |
||||||||||
азной |
|
активностью, |
|
и |
||||||
гидролиз |
ГТФ до |
ГДФ |
с |
target proteins. Hydrolysis of GTP to GDP and inorganic phosphate (P,) by the endogenous |
||||||
образованием |
|
|
|
|
GTPase activity of the α subunit leads to association of the αβγ complex terminating the |
|||||
неорганического фосфата (Р) |
response. |
|
||||||||
приводит к обратному |
|
|
|
|
||||||
(трансдуцин), который активирует фосфодиэстеразу цГМФ (глава 19), а также две изоформы G0, которые связываются с ионными каналами. Вместе с тем, каждый из G- белков может взаимодействовать с несколькими эффекторами, а разные G-белки могут модулировать активность одних и тех же ионных каналов 8).
В неактивированном состоянии гуанозиндифосфат (ГДП) связан с α-субъединицей, и все три субъединицы объединены в тример (рис. 10.3). Взаимодействие с активированным рецептором позволяет гуанозинтрифосфату (ГТФ) заместить ГДП на α-субъединице, что приводит к диссоциации α--и βγ -субъединиц (в физиологических условиях β- и γ- субъединицы остаются связанными). Свободные α- и βγ-субъединицы связываются с белками-мишенями и модулируют их активность7, 9, 10). Свободная α-субъединица обладает ГТФ-азной активностью, вызывая гидролиз ГТФ с образованием ГДП. В результате α- и βγ-субъединицы вновь связываются, что приводит к прекращению их активности. Время жизни активированных субъединиц G-белка модулируется белками, которые называются GAP (белки, активирующие ГТФазную активность). Эти белки влияют на скорость, с которой гидролизуется ГТФ, связанная с α-субъединицей 11).
Тонкие детали взаимодействия субъединиц G-белков между собой и с их мишенями в настоящее время интенсивно исследуются с использованием методов молекулярной биологии 5) и рентгеновской кристаллографии 12) - 14).
Десенситизация
Как и в случае ионотропных рецепторов (глава 9), ответы, опосредованные G-белками, могут десенситизироваться — т. е. уменьшаться при продолжительной активации. Десенситизация может быть обусловлена двумя механизмами 15). В первом случае киназа, регулируемая вторичными посредниками, например, цАМФ-зависимая протеинкиназа, может фосфорилировать несколько типов рецепторов, связанных с G-белками. Во втором случае быстрая и специфичная к агонисту десенситизация вовлекает два других семейства белков. Первым этапом является фосфорилирование активированных рецепторов специфической киназой, связанной с G-белком (GRK), например, киназой β- адренорецептора (βARK). Затем протеин из семейства аррестинов связывается с фосфорилированным рецептором, блокируя его способность активировать G-белки, и таким образом ограничивает ответ.
194 |
Раздел II. Передача информации в нервной системе |
|
|
|
|
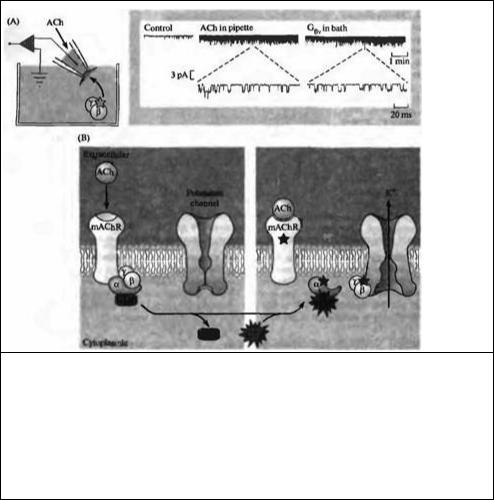
Рис. 10.4. Прямая модуляция активности ионного канала G белком (А) Аппликация Gβγ -комплекса на внутриклеточную сторону мембраны мышечной клетки предсердия вызывает увеличение тока через калиевые каналы, аналогичное эффекту ацетилхолина при его воздействии с наружной стороны мембраны. (В) Связывание АХ с мускариновым
рецептором (mAChR) активирует G-белок; активированный βγ-комплекс напрямую связывается с калиевым каналом и вызывает его открывание.
Fig. 10.4. Direct Modulation of Channel Function by G Proteins. (A) Application of the Gβγ complex to the intracellular surface
of an isolated patch of membrane from a rat atrial muscle cell (Gβγ in bath) results in an increase in potassium channel current similar to that seen when acetylcholine is added to the extracellular side of the patch (ACh in pipette). (B) Schematic representation of events in an intact cell. Binding of ACh to muscarinic receptors (mAChR) activates a G protein (indicated by a
star); activated βγ complex binds directly to and opens a potassium channel. (A after Wickman et al., 1994.)
§ 2. Прямая модуляция активности ионных каналов G- белками
G-белки вовлечены в регуляцию по крайней мере десятка различных калиевых, натриевых и кальциевых каналов посредством около 70 различных рецепторов 16). G-белки опосредуют взаимодействие рецепторов с ионными каналами либо напрямую, непосредственно связываясь с ионными каналами, либо опосредованно — с вовлечением вторичных посредников. Многообразие сигнальных каскадов делает возможным то, что один и тот же медиатор может вначале вызвать возбуждение, а затем — торможение постсинаптической клетки, равно как и другие паттерны ответов в различных типах нейронов.
Активация калиевых каналов G-белками
Замедление сердцебиений под действием ацетилхолина, впервые исследованное Леви более 70 лет назад (глава 9), опосредовано метаботропным рецептором — мускариновым ацетилхолиновым рецептором. Мускариновые рецепторы получили свое название потому, что они селективно активируются мускарином; ионотропные АХ рецепторы селективно активируются никотином и потому называются никотиновыми (главы 3 и 9). Активация мускариновых рецепторов в сердце приводит
Глава 10. Механизмы непрямой синоптической передачи |
195 |
|
||||||||
Рис. |
|
10.5. |
Локальный |
|
|
|
|
|||
примембранный |
эффект |
G |
|
|
|
|
||||
бел |
ков |
с |
прямым |
|
|
|
|
|||
механизмом |
действия. |
|
|
|
|
|||||
(А) |
|
Эффекты |
АХ |
|
|
|
|
|||
исследовались |
с помощью |
|
|
|
|
|||||
пэтч-кламп регистрации |
в |
|
|
|
|
|||||
конфигурации |
cell-attached. |
|
|
|
|
|||||
AX может |
быть добавлен |
|
|
|
|
|||||
либо |
в |
|
регистрирующую |
|
|
|
|
|||
пипетку, либо в наружный |
|
|
|
|
||||||
раствор |
|
(В) |
Записи |
|
|
|
|
|||
токов |
|
через |
одиночные |
|
|
|
|
|||
каналы |
|
до |
и |
после |
|
|
|
|
||
добавления АХ. |
Активность |
|
|
|
|
|||||
каналов |
|
возрастала |
лишь |
|
|
|
|
|||
при добавлении АХ в пэтч- |
|
|
|
|
||||||
пипетку. |
|
|
|
|
|
|
|
|
|
|
Fig. |
10.5. |
Direct |
|
or |
|
|
||||
|
|
(A) Effects of ACh were assayed by cell-attached patch clamp recording. Acetylcholine could be |
|
|||||||
Membrane-Delimited, Effects |
|
|
|
|||||||
perfused into either the patch pipette or the bath. (B) Recordings of single-channel currents before |
||||||||||
of G |
Proteins |
operate |
over |
|
and during addition of ACh. Compared with the control channel activity increased only when |
|||||
short distances. |
|
|
|
|
ACh was added to the patch pipette. (After Soejima and Noma, 1984.) |
|||||
|
|
|
|
|
|
|
|
|||
к открыванию калиевых каналов 17), вызывая гиперполяризацию. |
||||||||||
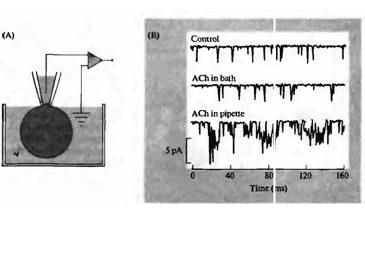
В ряде экспериментов было показано, что открывание калиевых каналов, происходящее при активации мускариновых рецепторов, опосредовано G-белками 18· 19). Так, было обнаружено, что для активации калиевых каналов необходима внутриклеточная ГТФ 20), что активация калиевых каналов мускариновыми агонистами значительно продляется при внутриклеточном введении негидролизируемого аналога ГТФ — Gpp(NH)p 21) и что мускариновая активация калиевых каналов блокируется коклюшным токсином, который инактивирует Gi-белки 20). Важная информация о механизмах активации калиевых каналов в кардиомиоцитах была получена Клэпхамом и сотрудниками в экспериментах на изолированных участках мембраны. Используя конфигурацию inside-out, они показали, что при аппликации очищенной βγ-субъединицы с внутренней стороны мембраны происходит открывание калиевого канала (рис. 10.4) 22). Этот эксперимент продемонстрировал, что βγ-субъединица ответственна за открывание калиевого канала. Последующие эксперименты с клонированным мускарин-активируемым калиевым каналом (GIRK1) показали, что βγ-субъединица взаимодействует с калиевым каналом напрямую (см. рис. 10.4В) 23· 24). Интересно то, что при регистрации в конфигурации cellattached калиевые каналы активируются при добавлении мускариновых агонистов в пипетку, добавление же мускариновых агонистов в наружный раствор не приводит к активации каналов в регистрируемом участке мембраны (рис. 10.5) 25). Таким образом, активированная βγ-субъединица не в состоянии преодолеть зону контакта между пипеткой и мембраной, что свидетельствует о весьма ограниченном радиусе действия активированной βγ -субъединицы.
Ингибирование кальциевых каналов, опосредованное G-белками
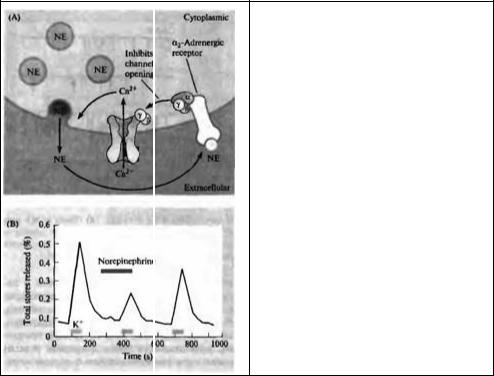
Другим примером прямого взаимодействия между G-белками и ионными каналами является саморегуляция освобождения норадреналина из нейронов симпатического ганглия лягушки 26). Освобождаемый этими нейронами норадреналин не только активирует рецепторы на постсинаптических клетках-мишенях, но также действует на сами пресинаптические нервные окончания через α2-адренорецепторы (рис. 10.6А). Активация ауторецепторов (autoreceptors) ослабляет выделение медиатора (рис. 10.6В), снижая вероятность открывания N-типа кальциевых каналов (рис. 10.7). (Кальциевые каналы разделяются на несколько классов [L, Т, N, Р, Q и R] по кинетике и фармакологическим свойствам (глава 3). Освобождение медиатора из симпатических нейронов контролируется кальцием, входящим через N-тип кальциевых каналов 27).) Эксперименты с негидролизируемыми производными ГТФ выявили, что ответ на норадреналин опосредован
196 |
Раздел II. Передача информации в нервной системе |
Рис. 10.6. Пресинаптические ауторецепторы уменьшают освобождение медиатора. (А) Норадреналин (norepinephrine, NE), освобождаемый из симпатических нейронов, связывается с α адренорецепторами (ауторе- цепторами) на мембране нервного окончания и вызывает
активацию G-белка Активный βγ1комплекс связывается с кальциевыми каналами, что приводит к уменьшению входа кальция и освобождения медиатора. (В) Норадреналин уменьшает освобождение медиатора из симпатических ганглиев. В ганглии был введен радиоактивный норадреналин. Освобождение медиатора вызывалось аппликацией раствора с высокой концентрацией ионов калия (50 ммоль). Добавление в наружный раствор немеченого норадреналина (30 мкмоль) приводило к уменьшению освобождения радиоактивного норадреналина, вызываемого калиевой деполяризацией.
Fig. 10.6. Presynaptic Autoreceptors Reduce Transmitter Release. (A) Norepinephrine (NE) released from sympathetic neurons combines with α2-adrenergic receptors in the terminal membrane (called autoreceptors), activating a G protein. The
activated βγ complex binds to calcium channels, decreasing calcium influx and so limiting further transmitter release. (B) Norepinephrine reduces the release of transmitter from sympathetic ganglia. Ganglia were loaded with radioactive norepinephrine and then enclosed in a perfusion chamber. Transmitter release was evoked by depolarization with a solution containing 50 mM potassium (light bars). Addition of 30 µM unlabeled norepinephrine to the perfusion solution (dark bar) reduced the amount of radiolabeled transmitter released in response to potassium-induced depolarization. (B after Lipscombe, Kongsamut, and Tsien, 1989.)
G-белками. Ингибирование активности кальииевых каналов в cell-attached конфигурации наблюдается лишь тогда, когда норадреналин добавляется в регистрирующую пипетку, а не снаружи, что предполагает прямое взаимодействие между G-белками и кальциевыми каналами. При повышенной экспрессии или просто инъекции α- и βγ-субъединиц в клетки было обнаружено, что кальциевые каналы N-типа блокируются βγ-субъединицей 28· 29). Такой тормозный эффект является быстрым и локальным механизмом для регуляции выброса медиатора 27).
§ 3. Активация G-белками внутриклеточных вторичных посредников
Многие G-белки взаимодействуют с ионными каналами не напрямую, а через модуляцию активности ферментов, вовлеченных в цитоплазматические системы вторичных посредников: аденилатциклазы, фосфолипазы С, фосфолипазы А2, фосфодиэстеразы и фосфатидилинозитол 3-киназы. Продукты этих ферментов, в свою очередь, оказывают воздействие на мишени, которые влияют на активность ионных каналов и других внутриклеточных процессов. В отличие от быстрых и локальных ответов, вызываемых прямым взаимодействием субъединиц G-белков с ионными каналами, ответы, опосредованные цитоплазматическими системами вторичных посредников, более медленные и имеют больший радиус действия.
β-Адренорецепторы активируют кальциевые каналы через G- белки и аденилатциклазу
Одним из наиболее хорошо изученных примеров непрямой синаптической передачи, опосредованной внутриклеточными вторичными посредниками, является активация β- адренорецепторов в сердечной мышце под действием
Глава 10. Механизмы непрямой синоптической передачи |
197 |
|
|
|||||||||
Рис. |
|
10.7. |
Норадреналин |
|
|
|
|
|
||||
ингибиру |
|
ет |
активность |
|
|
|
|
|
||||
кальциевых |
|
каналов. |
Токи |
|
|
|
|
|
||||
через |
|
одиночные |
ионные |
|
|
|
|
|
||||
каналы |
регистрировались |
в |
|
|
|
|
|
|||||
конфигурации |
cell-attached. |
|
|
|
|
|
||||||
Каналы |
|
|
активировались |
|
|
|
|
|
||||
деполяризацией |
мембраны. |
|
|
|
|
|
||||||
При |
|
|
|
|
добавлении |
|
|
|
|
|
||
норадреналина |
в |
пэтч |
|
|
|
|
|
|||||
электрод амплитуда токов |
не |
|
|
|
|
|
||||||
изменялась, |
|
однако |
каналы |
|
|
|
|
|
||||
начинали открываться реже и |
|
|
|
|
|
|||||||
на более короткое время. |
|
|
|
|
|
|
||||||
Fig. |
10.7. |
|
Norepinephrine |
|
|
|
|
|
||||
Inhitijts |
Calcium |
Channel |
|
|
|
|
|
|||||
Activity. |
|
|
Single-channel |
|
a depolarizing pulse (top trace). When norepinephrine was included in |
the patch electrode, the |
||||||
currents |
were |
recorded |
in cell- |
|
unitary currents did not change in size, but channel openings were less |
frequent and of shorter |
||||||
attached patches; channels were |
|
duration. (After Lipscombe Kongsamut, and Tsien, 1989.) |
|
|
||||||||
activated with |
|
|
|
|
|
|
|
|
|
|||
Рис. |
10.8. |
|
Активация |
β-- |
|
|
|
|
|
|||
адренорецепторов |
приводит |
|
|
|
|
|
||||||
к увеличению |
кальциевого |
|
|
|
|
|
||||||
тока в сердечной мышце. (А) |
|
|
|
|
|
|||||||
Увеличение кальциевого тока, |
|
|
|
|
|
|||||||
вызываемое |
|
активацией |
β- |
|
|
|
|
|
||||
адренорецепторов, приводит к |
|
|
|
|
|
|||||||
увеличению |
|
амплитуды |
и |
|
|
|
|
|
||||
длительности |
|
потенциала |
|
|
|
|
|
|||||
действия и |
силы сокращения |
|
|
|
|
|
||||||
мышечных клеток сердца. (В) |
|
|
|
|
|
|||||||
Вольтамперная |
|
|
|
|
|
|
|
|
||||
характеристика |
кальциевого |
|
|
|
|
|
||||||
тока |
|
в |
|
миокардиоцитах |
|
|
|
|
|
|||
измеренная |
|
в |
условиях |
|
|
|
|
|
||||
фиксации |
|
потенциала |
в |
|
|
|
|
|
||||
контроле |
|
и |
|
после |
|
|
|
|
|
|||
добавления |
|
адреналина |
— |
|
|
|
|
|
||||
агониста β-адренорецепторов. |
|
|
|
|
|
|||||||
Fig. |
10.8. |
Activation |
of |
β- |
|
|
|
|
|
|||
|
|
|
|
|
||||||||
Adrenergic Receptors in Cardiac |
|
receptors, in this case by addition of 10--6 Η norepinephrine, increases action potential |
|
|||||||||
Muscle |
Increases |
Calcium |
|
amplitude and duration and the tension produced by cardiac muscle cells. (B) Current-voltage |
||||||||
Current. |
(A) |
|
The |
increase |
in |
|
relationship of calcium current in a myocardial cell measured under voltage clamp conditions in |
|||||
calcium |
current produced |
by |
|
the absence and presence of 0,5 µΜ epinephrine, a β-adrenergic receptor agonist. (A after |
||||||||
activation of β-adrenergic |
|
|
Reuter et al., 1983; В after Reuter, 1974.) |
|
|
|
||||||
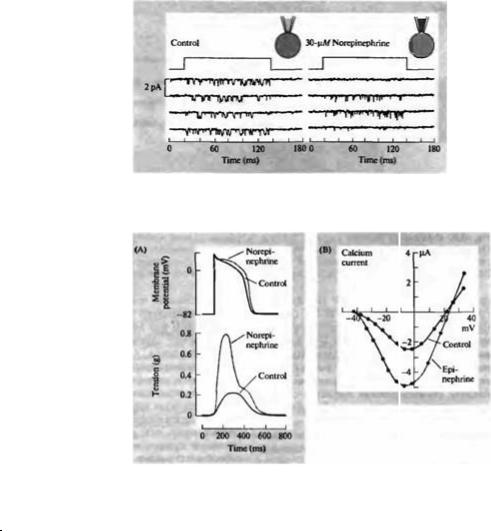
норадреналина 2, 30). Норадреналин вызывает учашение сердцебиения и усиление сокращений сердечной мышцы (рис. 10.8А). Увеличение сократительной силы отчасти обусловлено увеличением амплитуды и длительности фазы плато сердечного потенциала действия, что связано с увеличением лежащего в его основе кальциевого тока (рис. 10.8В). Регистрация одиночных каналов в кардиомиоцитах в конфигурации cell-attached подтвердила, что стимуляция β-адренорецепторов агонистами (норадреналином или изопротеренолом) вызывает увеличение активности кальциевых каналов (рис. 10.9). Более того, оказалось, что для получения ответа не обязательно добавлять агонист во внутрипипеточный раствор. Добавление изопротеренола в наружный раствор также вызывает увеличение активности кальциевых каналов в самом исследуемом кусочке (пэтче) мембраны, что является диагностическим тестом для ответов, опосредованных диффундирующими внутриклеточными вторичными посредниками 31, 32).
Активация β-адренорецепторов связана с увеличением кальциевой проводимости посредством внутриклеточного вторичного
198 |
Раздел II. Передача информации в нервной системе |
|
|
|
|
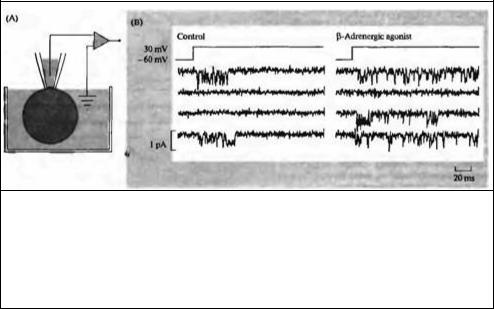
Рис. 10.9. Активация β-адренорецепторов вызывает увеличение активности кальциевых каналов. (А) Регистрация производилась в конфигурации cell-attached от небольшого участка мембраны, содержащего два кальциевых канала. (В)
Добавление в наружный раствор изолротеренола (β-адренергический агонист) вызывает увеличение вероятности открывания кальциевого канала при деполяризации мембраны.
Fig. 10.9. β1-Adrenergic Agonists Cause an Increase in Calcium Channel Activity during a depolarizing pulse. (A) Recordings are from a voltage-clamped cell-attached patch. (B) Consecutive records of the activity of a patch containing two calcium channels.
Addition of 14 µΜ isoproterenoL a βγ1adrenergic agonist to the bath causes an increase in the probability that the calcium channel will open when the cell is depolarized. (After Tsien, 1987.)
посредника циклического АМФ (цАМФ). Как проиллюстрировано на рис. 10.10, связывание норадреналина с β-адренорецепторами на клетках сердца активирует G-белок (Gs), освобождая его α- и βγ-субъединицы. В данном случае как α, так и βγ-субъединицы связываются и активируют фермент аденилатциклазу; стимулирующий эффект α- субьединицы намного сильнее, чем βγ-субъединицы (эффекты различных G0- и Gβγ- субъединиц на различные изоформы аденилатциклазы значительно различаются 33· 34)). Аденилатциклаза превращает АТФ в цАМФ — быстро диффундирующий внутриклеточный вторичный посредник, который активирует другой фермент — цАМФзависимую протеинкиназу. Каталитическая субъединица этой протеинкиназы опосредует перенос фосфата с АТФ на гидроксильные группы серина и треонина в различных ферментах и каналах, таким образом модулируя их активность.
В пользу этой схемы β-адренергической стимуляции кальциевой проводимости в кардиомиоцитах свидетельствует целая серия наблюдений 2). Например, активность кальциевых каналов увеличивается под действием форсколина, ингибиторов фосфодиэстеразы, мембранопроницаемых производных цАМФ, а также при прямой внутриклеточной инъекции цАМФ. Внутриклеточная инъекция каталитической субъединицы цАМФ-зависимой протеинкиназы также приводит к увеличению кальциевых токов, в то время как инъекция избыточного количества регуляторной субъединицы или ингибиторов протеинкиназы блокирует адренергическую стимуляцию кальциевых токов. ATPγS (аналог АТФ) усиливает адренергическую активацию кальциевых каналов путем образования стабильных фосфорилированных белков, в то время как внутриклеточная инъекция фосфатаз предотвращает адренергическую стимуляцию кальциевых токов или даже приводит к ее подавлению путем удаления фосфатных групп с фосфорилированных белков.
Регуляция активности кальциевых каналов через другие сигнальные пути
Помимо норадреналина, другие нейромедиаторы и гормоны также обладают способностью модулировать активность кальциевых каналов в сердечной мышце 2). Многие из этих веществ действуют через метаботропные рецепторы и G-белки, стимулируя или ингибируя аденилатциклазу; в действие других вовлечены иные внутриклеточные системы вторичных посредников. Например, АХ, действуя через мускариновые рецепторы, активирует Gi, который ингибирует аденилатциклазу. Это приводит к уменьшению концентрации цАМФ и подавлению активности кальциевых каналов.
Глава 10. Механизмы непрямой синоптической передачи |
199 |
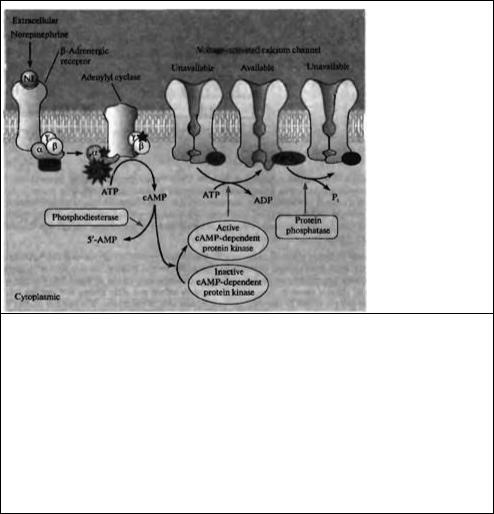
Рис. 10.10. Влияние β-адренорецепторов на кальциевые каналы опосредовано внутриклеточным вторичным посредником
цАМФ (cyclic AMP, cAMP) Связывание норадреналина с β-адренорецептором приводит посредством G-белка к активации фермента аденилатциклаза. Аденилатциклаза катализирует реакцию образования цАМФ из АТФ. цАМФ активирует цАМФависимую лротеинкиназу — фермент, который фосфорилирует белки по серино вым и треониновым гидроксильным группам. Ответ на норадреналин прекращается в результате гидролиза цАМФ до 5'-АМФ и дефосфорилирования белков фосфатазами. В кардиомиоцитах норадреналин вызывает фосфорилирование потенциалзависимых кальциевых каналов, переводя их в форму, в которой они могут быть активированы при деполяризации мембраны.
Fig. 10.10. β-Adrenergic Receptors Act through the Intracellular Second Messenger Cyclic AMP to increase calcium channel
activity. Binding of norepinephrine to β-adrenergic receptors activates, through a G protein, the enzyme adenylyl cyclase. Adenylyl cyclase catalyzes the conversion of ATP to cyclic AMP. As the concentration of cyclic AMP increases, it activates cAMP-dependent protein kinase, an enzyme that phosphorylates proteins on serine and threonine residues (—OH). The response to norepinephrine is terminated by the hydrolysis of cyclic AMP to 5' -AMP and the removal of protein phosphate residues by protein phosphatases. In cardiac muscle cells, norepinephrine causes phosphorylation of voltage-activated calcium channels, converting them to a form that can be opened by depolarization (available).
Модуляция активности кальциевых каналов посредством фосфорилирования
Приведенные выше эксперименты явно указывают на то, что эффекты β-адренергической стимуляции на кальциевые токи опосредованы увеличением цАМФ и активацией протеинкиназы. При этом, однако, оставалось неясным, какие белки подвергаются фосфорилированию. Последующие эксперименты выявили, что мишенью процесса фосфорилирования являются сами кальциевые каналы. Для этого сначала потребовалось выделить и очистить кальциевые каналы L-типа (каналы этого типа активируются при стимуляции β-адренорецепторов в сердечной мышце) из скелетных мышц, используя специфические и обладающие высоким сродством ингибиторы — дигидропиридины. Выделенные таким образом каналы были встроены в липидные везикулы 35) и искусственные мембраны 36) и подвергнуты воздействию цАМФ-зависимой протеинкиназы (рис. 10.11). В результате происходило фосфорилирование белков и вероятность открывания кальциевых каналов значительно возрастала. Это привело к выводу, что в основе β-адренергической модуляции кальциевых каналов L-типа лежит
200 |
Раздел II. Передача информации в 'нервной системе |
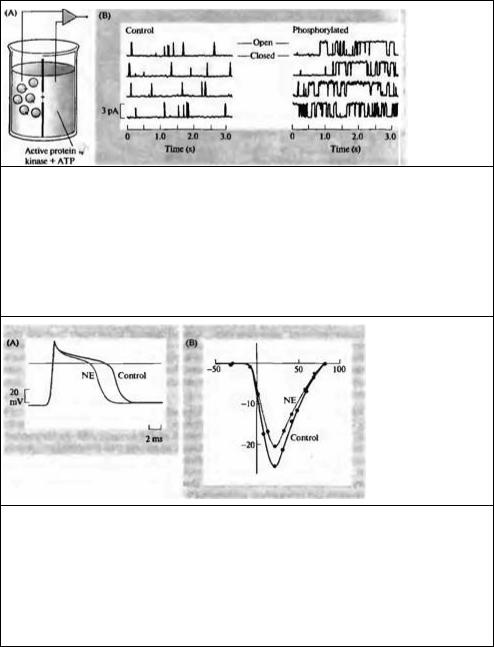
Рис. 10.11. Фосфорилирование кальциевых каналов увеличивает вероятность их открывания. (А) Встроенные в маленькие липидные везикулы (липосомы) кальциевые каналы добавляются в раствор с одной стороны искусственной бислойной мембраны. При слиянии липосом с мембраной становится возможным регистрировать активность одиночных ионных каналов. (В) Фосфорилирование увеличивает вероятность открывания каналов. Записи активности одиночных каналов до и после добавления АТФ и каталитической субъединицы цАМФ зависимой протеинкинаэы с одной стороны бислойной мембраны.
Fig. 10.11. Phosphorylation of Calcium Channels Increases Their Probability of Opening. (A) Purified calcium channels, incorporated into small lipid vesicles (liposomes), are added to the solution on one side of a phospholipid bilayer. When liposomes fuse into the bilayer membrane, single-channel events can be recorded. (B) Phosphorylation increases the probability of channel opening. Single-channel records before and after adding ATP and the catalytic subunit of cAMP-dependent protein kinase to the solution bathing one side of the bilayer. Biochemical studies demonstrate that the calcium channel itself becomes phosphorylated. (After Flockerzi et al., 1986.)
Рис. 10.12. Норадреналин уменьшает длительность потенциала действия в нейронах дорэального ганглия цыпленка. (А) Норадреналин (NE) уменьшает длительность потенциала действия при регистрации внутриклеточным электродом. (В) Вольтамперная характеристика кальциевого тока, регистрируемого в присутствии тетро дотоксина и тетраэтиламмония, в контроле и после добавления норадреналина. Норадреналин уменьшает потенциал активируемый кальциевый ток, что является причиной уменьшения длительности потенциала действия.
Fig. 10.12. Norepinephrine Decreases the Duration of Action Potentials in chick dorsal root ganglion cells in culture. (A) Norepinephrine (NE; 10--5 M) causes a decrease in the duration of the action potential recorded with an intracellular microelectrode. (B) Current-voltage relationship for calcium current recorded from cells bathed in solutions containing tetrodotoxin and tetraethylammonium, and 10 mM calcium, with or without 10--4 M norepinephrine. Norepinephrine reduces the voltage-activated calcium current which accounts for the decreased duration of the action potential. (After Dunlap and Fischbach, 1981.)
цАМФ-зависимое фосфорилирование самих кальциевых каналов. Модуляция активности кальциевых каналов L-типа другими гормонами также опосредована их фосфорилированием либо через аденилатциклазу и цАМФ-зависимую протеинкиназу, либо через другие сигнальные пути вторичных посредников и протеинкиназ 2).
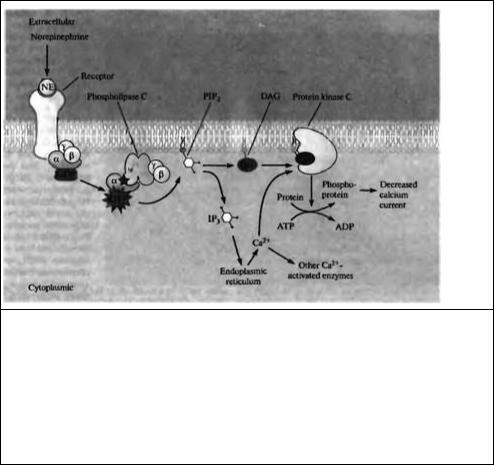
Глава 10. Механизмы непрямой синаптической передачи |
201 |
|
|
Рис. 10.13. Влияние норадреналина на кальциевые каналы в нейронах дорэального ганглия цыпленка опосредовано внутриклеточными вторичными посредниками диацилглицеролом и IP . Связывание норадреналина с рецептором приводит посредством G-белков к активации фермента фосфолипаэа С. Этот фермент гидролиэует фосфолипид фосфатидилинозитол 4,5-дифосфат (Р1Р2) с образованием двух внутриклеточных вторичных посредников: диацилглицерола (DAG) и иноэитол 1,4 5-трифосфата (IP3). IP3, вызывает освобождение кальция из зндоплазматического ретикулума в цитоплазму. Действуя вместе, DAG и кальций активируют протеинкинаэу С. Протеинкиназа С фосфорилирует ряд белков, что, в частности, приводит к уменьшению кальциевых токов.
Fig. 10.13. Norepinephrine Acts through the Intracellular Second Messengers Diacylglycerol and IP to reduce calcium current in chick dorsal root ganglion cells. The binding of norepinephrine to its receptor activates, through a G protein, the enzyme phospholipase C. This enzyme hydrolyzes the phospholtpid phosphatidylinositol 4,5-bisphosphate (PIP2), releasing two intracellular second messengers: diacylglycerol (DAG) and inositol 1,4,5-trisphosphate (IP3). IP3 releases calcium from the endoplasmic reticulum into the cytoplasm. DAG and calcium together activate protein kinase C. Protein kinase С catalyzes increased protein phosphorylation. In chick neurons, this causes a decrease in calcium current.
Двухступенчатый ферментативный каскад, вовлекающий аденилатциклазу и цАМФзависимую протеинкиназу, обеспечивает мощное усиление сигнала по сравнению с прямым открыванием или закрыванием каналов под действием активированных G- белков. Каждая активированная молекула аденилатциклазы катализирует синтез большого количества молекул цАМФ и, таким образом, активирует большое количество молекул протеинкиназ, а каждая молекула протеинкиназы может фосфорилировать большое количество белков. Таким образом, активация лишь небольшого количества рецепторов приводит к модуляции большого количества белков-мишеней на значительном расстоянии. Более того, цАМФ-зависимая протеинкиназа может фосфорилировать различные белки и таким образом модулировать широкий спектр клеточных процессов.
Активация фосфолипазы С
Модуляция кальциевого тока во время пресинаптического потенциала действия является одним из механизмов, с помошью которых может осуществляться регуляция эффективности синаптической передачи 37). Например, при внутриклеточной регистрации от нейронов, выделенных из дорзального ганглия спинного мозга и выращенных в культуральных условиях, было обнаружено, что ГАМК, норадреналин, серотонин и пептиды энкефалин и соматостатин вызывают укорочение

202 |
|
|
|
|
|
Раздел II. Передача информации в нервной системе |
||
Рис. |
10.14. |
Нейропептид |
|
|
||||
FMRFamide |
|
|
через |
|
|
|||
активацию |
|
|
|
|
|
|
|
|
внутриклеточного вторичного |
|
|
||||||
посредника — арахидоновую |
|
|
||||||
кислоту |
— |
|
увеличивает |
|
|
|||
активность калиевых каналов |
|
|
||||||
в сенсорных |
нейронах |
ЦНС |
|
|
||||
аплиэии. |
|
|
Связывание |
|
|
|||
FMRFamide |
|
с |
рецептором |
|
|
|||
приводит |
посредством |
|
G- |
|
|
|||
белков к активации фермента |
|
|
||||||
фосфолипаза |
|
Аг. |
Этот |
|
|
|||
фермент |
|
|
расщепляет |
|
|
|||
фосфолипиды |
|
мембраны, |
|
|
||||
например, |
|
Р1Р2, |
|
с |
|
|
||
образованием |
арахидоновой |
|
|
|||||
кислоты. |
|
Арахидоновая |
|
|
||||
кислота мета |
болиэируется |
|
|
|||||
по липоксигенаэному пути с |
|
|
||||||
образованием |
|
НРЕТЕ, |
|
|
||||
который |
связывается |
|
с |
|
|
|||
калиевыми каналами S-типа и |
|
|
||||||
увеличивает вероятность |
их |
|
|
|||||
открывания. |
|
|
|
|
potassium channel activity in sensory neurons in the CMS of Aplysia. |
Binding of FMRFamide |
||
|
|
|
|
|
|
|
||
Fig. |
10.14. |
The |
Neuropeptide |
to its receptor activates, through a G protein, the enzyme phospholipase A2. This enzyme |
||||
FMRFamide |
Acts |
through |
the |
degrades membrane phospholipids, such as Р1Рг, forming arachidonic acid. Arachidonic acid is |
||||
Intracellular |
Second Messenger |
metabolized along the lipoxygenase pathway to form 12-HPETE, which binds to S-current |
||||||
Arachidonic Acid to increase |
|
potassium channels and increases their probability of opening (po). |
||||||
потенциалов действия за счет уменьшения кальциевого тока (рис. 10.12) 38). Количество
выделяемого медиатора уменьшалось пропорционально уменьшению кальциевого тока
39).
Механизмы, лежащие в основе действия норадреналина и ГАМК, изображены на рис. 10.13. Связывание норадреналина и ГАМК с метаботропными рецепторами приводит к активации Gi-белка. Участие G-белка было показано в эксперименте, в котором внутриклеточное введение GDPβS (аналога ГДФ, который предотвращает активацию G- белков) блокировало уменьшение длительности потенциалов действия. Таким же эффектом обладал коклюшный токсин (pertussis toxin), который необратимо инактивирует α-субъединицу семейства Gi .
Gi активирует фосфолипазу С (рис. 10.13). Фосфолипаза С гидролизует мембранный липидфосфатидилинозитол4,5-бифосфат(РIР2) с образованием двух молекул: инозитол 1,4,5--трифосфата (IР3) и диацилглицерола (DAG). IР3 вызывает освобождение кальция из эндоплазматического ретикулума 40· 41). Повышение цитоплазматической концентрации кальция и DAG активирует протеинкиназу С. Протеинкиназа С, в свою очередь, фосфорилирует серии и треонин на белках-мишенях.
Имеются два экспериментальных доказательства того, что эффекты норадреналина и ГАМК на длительность потенциала действия опосредованы протеинкиназой С37). Вопервых, прямая активация протеинкиназы С аналогами диацилглицерола вызывает уменьшение кальциевого тока в этих нейронах. Во-вторых, ингибиторы протеинкиназы С блокируют уменьшение кальциевых токов, вызываемое как аналогами диацилглицерола, так и самими медиаторами ГАМК и норадреналином.
Активация фосфолипазы А2
Другой мишенью G-белков является фосфолипаза А2. Воздействуя на DAG и определенные мембранные липиды, например, РIР2, этот фермент вызывает освобождение арахидоновой кислоты. Арахидоновая кислота метаболизируется по двум путям: липоксигеназному, с образованием лейкотриенов
