
Nikolls_-_Ot_neyrona_k_mozgu
.pdf
(лава 11. Высвобождение медиатора |
223 |
Рис. 11.9. Распределение амплитуд потенциалов концевой пластинки в нервно-мышечном соединении млекопитающего в условиях повышенной (12,5 ммоль) внеклеточной концентрации ионов магния. На гистограмме показано количество событий с амплитудой, указанной по оси абсцисс. Максимальное количество событий имеет амплитуду 0 мВ (т. е. медиатор не выделяется вовсе); Другие пики гистограммы соответствуют 1-, 2-, 3--и 4-кратной амплитуде спонтанных миниатюрных потенциалов концевой пластинки (см. вставку), указывая на то, что ответы состоят из 1, 2, 3 и 4 квантов. Сплошная линия соответствует теоретическому распределению амплитуд потенциалов концевой пластинки, рассчитанному по уравнению Пуассона с поправкой на разброс амплитуды размера кванта. Стрелками указано предсказанное уравнением Пуассона количество нулевых событий.
Fig. 11.9. Amplitude Distribution of end-plate potentials at a mammalian neuromuscular junction in high (12,5 mW) magnesium solution. The histogram shows the number of end-plate potentials observed at each amplitude. The peaks of the histogram occur at 0 mV (failures) and at one, two, three, and four times the mean amplitude of the spontaneous miniature end-plate potentials (inset), indicating responses comprising 1, 2, 3, and 4 quanta. The solid line represents the theoretical distribution of end-plate potential amplitudes calculated according to the Poisson equation and allowing for the spread in amplitude of the quantal size. The arrows indicate the predicted number of failures. (From Boyd and Martin, 1956.)
Во многих синапсах вероятность высвобождения довольно высока, и распределение Пуассона неприложимо. В этих условиях необходимо использовать собственно биномиальное распределение. В биномиальном распределении количество единиц, способных участвовать в ответе, может быть больше или меньше, так же как и вероятность высвобождения. Необходимым остается условие того, что кванты высвобождаются независимо друг от друга. Как и ранее, если мы возьмем среднее квантовое высвобождение (m) как результат количества единиц, способных к участию в ответе n и среднюю вероятность высвобождения (р), то встречаемость множественных событий в соответствии с биномиальным распределением равна:
где пх является количеством ответов, состоящих из x квантов, N — общее количество событий и q = 1 — р.
Соответствие процесса высвобождения биномиальной статистике было впервые показано на нервно-мышечном соединении рака 32).
Таким образом, на сегодняшний день имеются веские доказательства в пользу того, что медиатор высвобождается в виде пакетов, или квантов 33· 34). Точное определение размера кванта и квантового состава важны для определения места действия различных факторов и веществ, которые модулируют синаптическую передачу (главы 10, 12, 16). В целом, пресинаптические модуляторные эффекты изменяют количество высвобождаемого медиатора, меняя квантовый состав, но не влияя на размер кванта. С другой стороны, модуляция на постсинаптическом уровне влияет на чувствительность постси-
224 |
Раздел II. Передача информации в нервной системе |
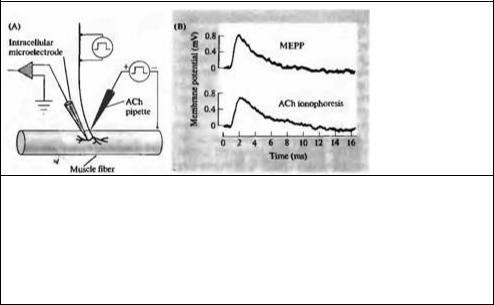
Рис. 11.10. Количество молекул АХ в одном кванте, определенное ионофоретической аппликацией АХ. (А) Внутриклеточный микроэлектрод регистрирует спонтанные миниатюрные потенциалы концевой пластинки (МПКП) и ответы на ионофоретическую аппликацию АХ. (В) МПКП практически полностью воспроизводится ионофоретическим толчком АХ. Время роста ответа, вызванного ионофорезом АХ чуть медленнее, так как пипетка с АХ находится дальше от постсинаптической мембраны, чем нервное окончание.
Fig. 11.10. The Number of ACh Molecules in a Quantum is determined by. mimicking a spontaneous miniature end-plate potential with an lonophoretic pulse of ACh. (A) An mtracellular microelectrode records spontaneous miniature end-plate potentials (MEPPs) and the response to ionophoretic application of ACh. (В) А МЕРР is mimicked almost exactly by an ionophoretic pulse of ACh. The rate of rise of the ionophoretic ACh pulse is slightly slower because the ACh pipette is further from the postsynaptic membrane than is the nerve terminal. (B after Kuffter and Yoshikami, 1975a.)
наптической клетки к медиатору и изменяет квантовый размер, не влияя на количество высвобождаемых квантов. При низкой вероятности высвобождения (р), как и в случае низкой концентрации кальция, распределение Пуассона является удобным способом для анализа флуктуации. Для описания распределения ответов при высокой вероятности высвобождения становится необходимой биномиальная статистика. В дополнение к этому, биномиальная статистика может обеспечить информацией о том, является ли изменение количества высвобождаемого медиатора следствием изменения количества доступных квантов или вероятности их высвобождения.
Квантовый состав в синапсах между нейронами
Одним из удивительных свойств нервной системы позвоночных является уменьшение среднего квантового состава при переходе от нервно-мышечного соединения, которое характеризуется очень малым уровнем интеграции (m = 200-300), к вегетативным ганглиям (m = 2-20) 35, 36) и, наконец, к синапсам центральной нервной системы (в которых m может быть равно 1) 37· 38), в которой постсинаптические клетки могут интегрировать входы от десятков тысяч пресинаптических клеток. Например, в синапсе между первичным афферентным волокном мышечного веретена и мотонейроном спинного мозга средний квантовый состав примерно равен 1 39). Это, однако, не означает, что передача в этих синапсах ненадежна, как это могло бы следовать из распределения Пуассона. Высвобождение в этих синапсах скорее соответствует биномиальной статистике с высокой вероятностью (p ~ 0,9) и малым числом доступных квантов (n ~ 1). В большинстве синапсов в ЦНС квантовое высвобождение является основным механизмом синаптической передачи. Однако во многих случаях бывает трудно применить простой Пуассоновский или биномиальный статистический анализ. Сложность и разнообразие синаптических контактов в ЦНС послужило основанием для развития более сложных статистических методов обработки данных 38· 40· 41).
Количество молекул в кванте
Хотя из экспериментов Катца, Фетта и Кастильо было очевидным, что один квант в нервно-мышечном соединении содержит более одной молекулы АХ, истинное количество молекул в одном кванте оставалось неизвестным. Куффлер и Йошиками первыми получили такого рода оценку, используя очень тонкие пипетки для ионофореза АХ на постсинаптическую мембрану мышцы змеи 24). Ответ,
Глава 11. Высвобождение медиатора |
225 |
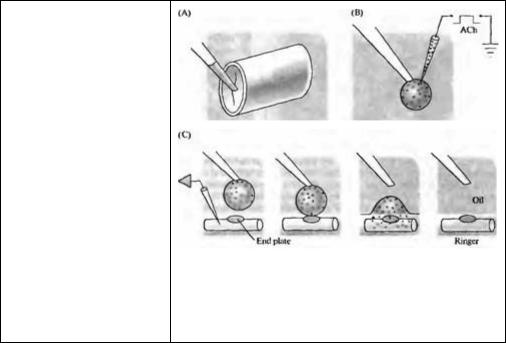
Рис. 11.11. Количественный анализ АХ выделяемого из микропипетки при ионофорезе. (А) Капелька жидкости, покрытая масляной пленкой, забирается из капилляра. (В) АХ инъецируется в эту капельку серией ионофоретических пульсов, которые использовались для воспроизведения спонтанных миниатюрных потенциалов (см. рис. 11.10В). (С) После измерения объема
заполненная |
АХ капелька |
касается |
||
поверхности |
между |
маслом |
и |
|
раствором |
Рингера |
в |
области |
|
концевой пластинки мышцы змеи, и высвобождает свое содержимое в водную фазу. Деполяризация концевой пластинки, вызываемая этой
капелькой, |
сравнивается |
с |
|
деполяризацией, |
|
вызванной |
|
капельками |
с |
известной |
|
концентрацией |
АХ. |
|
Когда |
концентрация АХ в тестовой капельке определена, можно рассчитать количество АХ высвобождаемого при одном ионофоретическом пульсе.
Fig. 11.11. Assay of ACh Ejected from a Micropipette by ionophoresis. (A) A droplet of fluid is remcved from the dispensing capillary under oil.
(B) ACh is injected into the droplet by a series of ionophoretic pulses, each identical to that used to mimic a spontaneous miniature potential (see Figure 11.10B). (C) After its volume is measured, the ACh-loaded droplet is touched against the oilRinger interface at the end plate of a snake muscle, discharging its contents into the aqueous phase. The depolarization of the end plate is measured (not shown) and compared with that produced by droplets with known ACh concentration. Once the concentration in the test droplet is determined, the amount of ACh released per pulse from the electrode can be calculated. (After Kuffter and Yoshikami. 1975b.)
вызываемый коротким пульсом АХ, практически полностью совпадал со спонтанными миниатюрными потенциалами (рис. 11.10). Для измерения количества молекул, выделяемых из пипетки, АХ выделялся повторными пульсами в капельку раствора (около 0,5 мкл), находящегося под слоем масла (рис. 11.11). Эта капелька затем наносилась на концевую пластинку мышечного волокна змеи и измерялась результирующая деполяризация. Ответ сравнивался с ответами на капельки точно такого же размера, содержащие известные концентрации АХ. Таким образом были определены концентрации АХ в тестирующей капельке и количество молекул АХ, высвобождаемых каждым пульсом. Пульс АХ, воспроизводящий спонтанный миниатюрный потенциал, содержал примерно 7 000 молекул
Количество каналов, активируемых квантом
Если квант АХ состоит из 7 000 молекул, то можно ожидать, что лишь несколько тысяч свяжутся с постсинаптическими рецепторами в нервно-мышечном соединении, а остальные будут потеряны в результате диффузии из синаптической щели или гидролиза холинэстеразой. Количество рецепторов, активируемых одним квантом, может быть определено путем сравнения проводимости, активируемой во время миниатюрного потенциала с проводимостью одиночного ионного канала, активируемого АХ42). Регистрация миниатюрных токов концевой пластинки в условиях фиксации потенциала в мышце лягушки выявила, что проводимость, активируемая на пике ответа, составляет около 40 нС. Одиночный АХ рецептор имеет проводимость около 30 пС. Следовательно, миниатюрный потенциал концевой пластинки является результатом открывания около 1 300 каналов. (Это соответствует 2 600 молекул АХ, поскольку для открывания канала требуется две молекулы АХ; см. главы 9, 13.) Схожие результаты были получены Катцем и Миледи, которые оценили вклад одиночных каналов в потенциал концевой пластинки на основании анализа шума 43). Близкое значение количества каналов, открываемых квантом медиатора, было получено в глицинэргических тормозных синапсах продолговатого мозга миноги 44). В других синапсах были
226 |
|
Раздел II. Передача информации в нервной системе |
||||
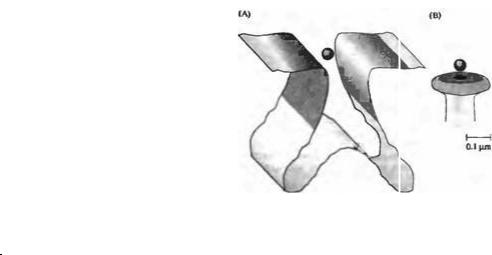
Рис. 11.12. Соотношение площади постсинаптической |
|
|
|
|||
мембраны и размера синаптической везикулы. (А) В |
|
|
|
|||
нервно-мышечном соединении лягушки рецепторы АХ |
|
|
|
|||
плотно упакованы (~ 10000/мкм2) на значительной |
|
|
|
|||
площади постсинаптической мембраны (затененные |
|
|
|
|||
области). Поэтому количество рецепторов превышает |
|
|
|
|||
количество молекул АХ, |
и размер квантового |
события |
|
|
|
|
варьирует в зависимости от количества молекул в |
|
|
|
|||
кванте. (В) В типичном |
гиппокампальном |
синапсе |
|
|
|
|
постсинаптические |
рецепторы упакованы значительно |
|
|
|
||
реже (~2800/мкм2) |
и на |
гораздо меньшей |
площади |
|
|
|
(0,04 мкм2). В результате количество молекул |
|
|
|
|||
медиатора в кванте достаточно для того, чтобы насытить |
|
|
|
|||
все доступные рецепторы, и квантовые события имеют |
|
|
|
|||
очень маленькие флуктуации по амплитуде. |
|
|
|
|
||
Fig. 11.12. The Area of Pustsynaptic Membrane |
Relative to |
|
|
|
||
the Size of a Synaptic Vesicle. (A) At the frog |
|
|
|
|||
|
|
|||||
neuromuscular junction ACh receptors are packed at high |
|
(B) At a typical hippocampal synapse, postsynaptic receptors are |
|
|||
density (~10 000/µm2) over a Large postsynaptic area |
|
packed less densely (~2 800/µm2) over a very small area (0,04 |
|
|||
(shaded). Accordingly, receptors outnumber ACh molecules, |
|
pirn2). As a result the number of transmitter molecules in a |
||||
and the size of the quantal event varies with the variation in |
|
quantum is sufficient to saturate the available receptors, and quantal |
||||
the number of molecules per quantum. |
|
|
events show very little fluctuation in amplitude. |
|||
получены меньшие значения. Например, в синапсах на гиппокампальных нейронах квантовый ответ соответствует открыванию от 15 до 65 каналов 38· 45).
Почему между синапсами существуют такие различия? Очевидно, что количество постсинаптических рецепторов, активируемых квантом медиатора, высвобождаемого из одного пресинаггтического бутона, должно соответствовать размерам клетки. В больших клетках с низким входным сопротивлением, как, например, скелетные мышечные волокна или мюллеровские клетки миноги, значительный эффект одного кванта будет наблюдаться при активации большого количества рецепторов. Активация такого же количества рецепторов в очень маленькой клетке приведет к перенасыщению и шунтированию всех других проводимостей и деполяризации клетки к потенциалу около 0, если синапс является возбуждающим, или же к фиксированию мембранного потенциала на уровне равновесного потенциала ионов хлора, если синапс является тормозным.
Каким образом достигается соответствие между размером клетки и количеством рецепторов, активируемых квантом медиатора? Уменьшается ли при этом количество молекул в кванте, или же снижается количество постсинаптических рецепторов? Точное значение количества молекул медиатора в синаптических везикулах в ЦНС пока неизвестно. Количество молекул медиатора в глутамат-содержащих везикулах было оценено в 4 000 46), т. е. того же порядка, что и количество молекул АХ в везикулах в нервно-мышечном соединении. С другой стороны, анализ квантовых флуктуации в возбуждающих и тормозных синапсах на гиппокампальных клетках предполагает, что количество доступных постсинаптических рецепторов намного меньше, чем в нервно-- мышечном соединении 38· 45). Квантовые события в гиппокампальных синапсах активируют лишь около 15-65 каналов. Амплитуда этих квантовых событий имеет очень малый разброс, что указывает на то, что количество молекул, высвобожденных одним квантом, всегда более чем достаточно для активации всех доступных рецепторов. В противоположность этому, увеличение количества молекул медиатора в кванте в нервномышечном соединении приводит к увеличению квантовых событий 47· 48). Различие в количестве доступных постсинаптических рецепторов, рассчитанном по квантовым флуктуациям, согласуется с различием в морфологии синапсов (рис. 11.12): в нервномышечном соединении рецепторы плотно упакованы (около 10 000/мкм2) на больших площадях постсинаптической мембраны, обеспечивая практически безграничное количество рецепторов для каждого кванта медиатора (глава 13). В типичном синапсе гиппокампа плотность постсинаптических рецепторов

(лава 11. Высвобождение медиатора |
227 |
|
|
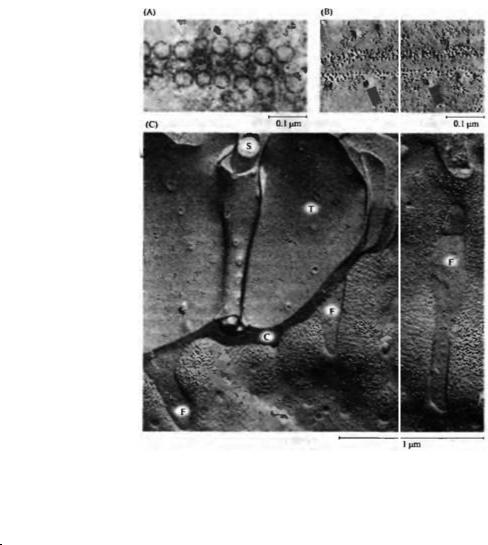
Рис. 11.13. Высвобождение нейромедиатора посредством экзоцитоза синаптических везикул. Электронные микрофотографии нервно-мышечного соединения. (А) Кластер синаптических везикул, расположенных в пресинаптическом окончании, контактирует с электронно-плотным участком пресинаптической мембраны, формируя активную зону. (В) Одиночный стимул был нанесен на двигательный нерв в присутствии 4-аминопиридина — вещества, которое значительно увеличивает высвобождение медиатора, продляя потенциал действия, — и ткань была заморожена в течение нескольких миллисекунд после стимула. Везикулы, которые находились около активной зоны, слились с пресинаптической мембраной и освободили свое содержимое в синаптическую щель путем зкзоцитоза.
Fig. 11.13. Release of Neurotransmitter by Synaptic Vesicle Exocytosis. High-power electron micrographs of frog neuromuscular junctions. (A) A cluster of synaptic vesicles within the presynaptic terminal contacts an electron-dense region of the presynaptic membrane, forming an active zone. (B) A single stimulus was applied to the motor nerve in the presence of 4-aminopyridine, a drug that greatly increases transmitter release by prolonging the action potential, and the tissue was frozen within milliseconds. Vesicles docked at the active zone have fused with the presynaptic membrane and released their contents into the synaptic cleft by exocytosis. (A, micrograph kindly provided by U. J. McMahan; В from Heuser, 1977.)
ниже (около 2800/мкм2)49), и площадь, занимаемая постсинаптической мембраной, очень мала (0,04 мкм2) 50); таким образом, на ней присутствует менее 100 постсинаптических рецепторов.
Изменение размера кванта в нервно-мышечном соединении
Хотя величина спонтанных миниатюрных потенциалов в каждом синапсе является практически постоянной величиной, в определенных условиях могут иметь место исключения из этого правила. Например, во время развития и регенерации двигательных нервных окончаний амплитуды спонтанных миниатюрных потенциалов имеют не нормальное, а скошенное распределение, уходящее в шум базовой линии; т. е. большое количество спонтанных потенциалов имеет очень маленькую амплитуду51· 52). С другой стороны, иногда наблюдаются спонтанные синаптические потенциалы, значительно превышающие обычные миниатюрные потенциалы53). В определенных условиях эти большие потенциалы связаны со спонтанным высвобождением одновременно двух или более квантов; в других случаях их размер не соотносится столь явным образом с размером нормальных квантов. Наконец, в ряде некоторых нервно-мышечных заболеваний, например, в случае злокачественной миастении, спонтанные миниатюрные и вызванные синаптические потенциалы уменьшаются в амплитуде вследствие уменьшения количества рецепторов на постсинаптической мембране54).
§ 3. Везикулярная гипотеза высвобождения медиатора
Вскоре после того, как с помошью электрофизиологических методов было показано, что высвобождение медиатора имеет квантовый характер, электронная микроскопия нервно-- мышечного соединения позволила выявить большое количество маленьких, связанных с мембраной синаптических везикул внутри аксонных терминалей (рис. 11.13А)55· 56).

228 |
Раздел II. Передача информации в нервной системе |
|
|
Рис. 11.14. Структура синаптической мембраны в нервно-мышечном соединении лягушки. Объемное изображение пресинаптической и постсинаптической мембран; каждая мембрана разделена на две части — цитоплазматическую и наружную, как зто происходит при замораживании-скалывании. Цитоплазматическая половина пресинаптической мембраны в области активной зоны обнаруживает на своей поверхности скола выступающие частицы, и соответствующие им углубления видны на сколе наружного листка мембраны. Постсинаптическая мембрана, расколотая в области складок, обнаруживает большое количество частиц на цитоплазматическом листке; эти частицы являются рецепторами АХ.
Fig. 11.14. Synaptic Membrane Structure at the frog neuromuscular junction. Three-dimensional view of presynaptic and postsynaptic membranes, with each membrane split along its intramembranous plane as might occur in freeze--frarture. The cytoplasmic half of the presynaptic membrane at the active zone shows on its fracture face protruding particles whose counterparts are seen as pits on the fracture face of the outer membrane leaflet. Vesicles fusing with the presynaptic membrane give rise to pores and protrusions on the two fracture faces. The fractured postsynaptic membrane in the region of the folds shows a high concentration of particles on the fracture face of the cytoplasmic leaflet; these are ACh receptors. (Kindly provided by U. J. McMahan.)
Это наблюдение легло в основу везикулярной гипотезы высвобождения медиатора, которая предполагает, что квант медиатора соответствует содержимому одной везикулы и что высвобождение происходит посредством экзоцитоза, при котором везикула сливается с пресинаптической мембраной и высвобождает свое содержимое в синаптическую щель (рис. 11.13В).
Ул ьтраструктура нервного окончания
В результате морфологических исследований были получены доказательства в пользу везикулярной гипотезы высвобождения. Первые исследования такого рода были проведены на нервно-мышечном соединении. Последующие эксперименты показали, что основные морфологические свойства химических синапсов схожи во всей нервной системе, то есть в химических синапсах высвобождение осуществляется путем экзоцитоза везикул, которые содержат медиатор. Небольшой участок нервно-мышечного соединения лягушки схематически изображен на рис. 11.14, как если бы пре- и Постсинаптическая мембраны были разделены с помощью методики замораживания-скалывания на цитоплазматическую и внешнюю части.
Верхняя часть рис. 11.14 изображает пресинаптическую мембрану с везикулами, которые выстраиваются с цитоплазматической стороны. Некоторые из везикул находятся в процессе экзоцитоза. Наружная поверхность цитоплазматической половины пресинаптической мембраны содержит внутримембранные частицы, выступающие с поверхности скола; соответствующие им углубления можно увидеть на сколе внешней части пресинаптической мембраны. Схожие частицы и углубления находятся также на сколах постсинаптической мембраны. В дополнении к этому на пресинаптической мембране видны экзоцитирующие везикулы в виде углублений на внешней стороне цитоплазматической части мембраны и как сколотые наросты на внутренней стороне внешней ее части.
(лава 11. Высвобождение медиатора |
229 |
|
||||||||
Рис. 11.15. |
Структура |
нерв |
|
|
|
|
||||
но-мышечного |
|
соединения |
|
|
|
|
||||
лягушки. (А) Срез через |
|
|
|
|
||||||
нервное |
|
|
окончание, |
|
|
|
|
|||
параллельный активной |
зоне, |
|
|
|
|
|||||
с |
|
|
везикулами, |
|
|
|
|
|||
выстроившимися |
вдоль |
нее в |
|
|
|
|
||||
два ряда. Получено с помощью |
|
|
|
|
||||||
электронного |
|
|
|
|
|
|
|
|
|
|
трансмиссионного |
микроскопа. |
|
|
|
|
|||||
(В) Скол цитоплазматической |
|
|
|
|
||||||
половины |
пресинаптической |
|
|
|
|
|||||
мембраны |
в области |
активной |
|
|
|
|
||||
зоны. Активная зона имеет вид |
|
|
|
|
||||||
полоски, по границам которой |
|
|
|
|
||||||
располагаются |
|
частицы |
с |
|
|
|
|
|||
диаметром около 10 нм; |
|
|
|
|
||||||
латеральнее |
располагаются |
|
|
|
|
|||||
небольшие кратеры, |
которые |
|
|
|
|
|||||
соответствуют |
местам |
слияния |
|
|
|
|
||||
синаптических |
|
везикул |
с |
|
|
|
|
|||
мембраной. |
(С) |
|
Скол |
|
|
|
|
|||
синаптическои |
области |
|
при |
|
|
|
|
|||
малом |
увеличении. |
|
Скол |
|
|
|
|
|||
вначале |
проходит |
|
через |
|
|
|
|
|||
мембрану |
пре |
синаптического |
|
|
|
|
||||
окончания (Т), обнаруживая |
|
|
|
|
||||||
наружный |
листок |
со |
стороны |
|
|
|
|
|||
скола, |
затем |
пересекает |
|
|
|
|
||||
синаптическую щель (С) и |
|
|
|
|
||||||
входит в |
постсинаптическую |
|
|
|
|
|||||
мембрану. На сколе между |
|
|
|
|
||||||
складками |
(F) |
можно |
увидеть |
|
|
|
|
|||
агрегаты |
АХ |
рецепторов |
на |
|
|
|
|
|||
цитоплазматическом |
листке. |
|
|
|
|
|||||
Можно также увидеть отростки |
|
|
|
|
||||||
шванновской |
клетки |
|
(S), |
|
|
|
|
|||
которые |
проходят |
|
между |
|
|
|
|
|||
нервным |
окончанием |
|
и |
|
|
|
|
|||
мышцей. |
|
|
|
|
|
|
|
|
|
|
Fig. 11.15. Structure of the Frog |
|
|
|
|
||||||
|
|
|
||||||||
Neuromuscular |
Junction. |
|
(A) |
|
The active zone region is delineated by particles about 10 nm in diameter and flanked by |
|
||||
Transmission electron micrograph |
|
|
|
|||||||
pores caused by fusion of synaptic vesicles with the membrane. (C) Low-power view of |
||||||||||
of a section through the |
nerve |
|
fractured synaptic region. The fracture passes first through the presynaptic terminal membrane |
|||||||
terminal parallel to an active zone, |
|
(T), showing the fracture face of the outer leaflet, then crosses the synaptic cleft (C) to enter |
||||||||
showing two lines of vesicles. (B) |
|
the postsynaptic membrane. On the fracture face between the folds (F) one sees on the |
||||||||
Fracture face of the cytoplasmic |
|
cytoplasmic leaflet aggregates of ACh receptors. A Schwann cell process (S) passes between |
||||||||
half of the presynaptic membrane |
|
the nerve terminal and the muscle. (A from Couteaux and Pecot-Dechavassine, 1970; В and С |
||||||||
in an active zone. |
|
|
|
|
|
from Heuser, Reese, and Landis, 1974.) |
|
|
||
Электронная микрофотография горизонтального среза активной зоны показана на рис. 11.15А, вид со стороны цитоплазмы нервного окончания. Упорядоченный ряд синаптических везикул выстроен с двух сторон полосы электронно-плотного материала. На рис. 11.15В показано, как выглядит соответствующий скол цитоплазматической части пресинаптической мембраны, что равносильно рассмотрению этого же участка со стороны синаптическои щели. Ряды частиц, имеющих диаметр около 10 нм, примыкают к активной зоне с обеих сторон. Латеральнее находятся углубления, которые соответствуют местам открывания экзоцитирующих везикул. Описанные ранее электрофизиологические эксперименты, в которых буферы ионов кальция инъецировались в пресинаптические окончания, указывают на близкую связь между кальциевыми каналами и местами высвобождения. Поэтому по крайней мере некоторые из мелких частиц, располагающихся непосред-
230 |
Раздел II. Передача информации в нервной системе |
ственно вдоль полос (рис. 11.15В), могут соответствовать потенциал-активируемым кальциевым каналам, запускающим экзоцитоз.
Результаты исследований, полученные на нервно-мышечном соединении лягушки и мыши с использованием различных токсинов, подтверждают данную гипотезу 57) -- 59). -конотоксин, который необратимо блокирует нервно-мышечную передачу, связываясь с пресинаптическими кальциевыми каналами 60), был соединен с флуоресцентной молекулой. При микроскопическом исследовании было обнаружено, что флюоресценция сконцентрирована в виде узких пучков, разделяемых интервалами около 1 мкм, что соответствует расстоянию между активными зонами (рис. 11.16). Одновременная окраска постсинаптических АХ рецепторов с помощью флуоресцентного α-бунгаротоксина выявила соответствие в пространственном расположении пресинаптических кальциевых каналов и постсинаптических складок, которые имеют наибольшую плотность АХ-рецепторов.
На рис. 11.15С изображен участок нервно-мышечного соединения лягушки, полученный с использованием техники замораживания-скалывания. На верхней левой его части скалывание обнажило наружную часть пресинаптической мембраны. Затем скол проходит через синаптическую щель и обнажает цитоплазматическую часть постсинаптической мембраны. Вдоль обоих сторон постсинаптических складок располагаются кластеры частиц, которые, по всей видимости, являются АХ-рецепторами, сконцентрированными в этой области концевой пластинки (глава 9)61) -- 63).
Экзоцитоз синаптических везикул
Основным из положений везикулярной гипотезы высвобождения является то, что при стимуляции все растворимое содержимое синаптических везикул должно высвобождаться в синаптическую щель. Проверка этого положения была впервые осуществлена не на нейронах, а на клетках мозгового вещества надпочечников, которые выделяют хромаффинные гранулы64). Хромаффинные гранулы — это органеллы, аналогичные синаптическим везикулам, но имеющие гораздо больший размер; они содержат адреналин, норадреналин, АТФ, фермент синтеза дофамин-β-гидролазу, а также белки, которые называются хромогранинами. Все эти компоненты высвобождаются при стимуляции мозгового вещества надпочечников, и в наружном растворе они оказываются точно в таком же соотношении, как и внутри очищенных гранул.
Высвобождаемое из нейронов вещество также хорошо соответствует содержимому везикул, хотя выделение и очистка синаптических везикул из нервных окончаний с целью изучения их содержимого является весьма сложной задачей. Например, маленькие синаптические везикулы в нейронах симпатической нервной системы содержат норадреналин и АТФ; большие электронно-плотные везикулы содержат также дофамин, β-гидроксилазу и хромогранин А. Стимуляция симпатических аксонов приводит к высвобождению всех этих везикулярных компонентов65). Везикулы, выделенные из холинэргических нейронов, содержат АХ и АТФ, и оба эти вещества выделяются при стимуляции холинэргических нервов 66).
В холинэргических нейронах было также проведено количественное исследование того, соответствует ли содержимое одной синаптической везикулы одному кванту медиатора. Синаптические везикулы, выделенные из окончаний холинэргических нейронов электрического органа морского ската Narcine brasiliensis (родственник Torpedo califomica) содержат около 47000 молекул АХ67). Если бы синаптические везикулы в нервно-мышечном соединении лягушки имели бы такую же внутри везикулярную концентрацию АХ, то с поправкой на их меньший размер они должны были бы содержать 7000 молекул АХ. Это находится в прекрасном соответствии с электрофизиологическими оценками количества молекул АХ в одном кванте 24).
Морфологическое свидетельство в пользу экзоцитоза
Хеузер и Рииз68) изобрели новый методический прием, который позволил им быстро замораживать мышцу лягушки в течение нескольких миллисекунд после одиночной стимуляции двигательного нерва с последующим исследованием с помощью методики замораживания-скалывания. В результате стало возможным получить сканирующие электронные микрографии везикул, запечатленных в момент слияния с пресинаптической мембраной, а также с определенной долей точности определить временной ход процесса слияния.

Глава 11. Высвобождение медиатора |
231 |
|
|
Рис. 11.16. Распределение кальциевых каналов в нервно-мышечном соединении. Нервно-мышечное соединение лягушки окрашено двумя метками: α-бунгаротоксином (В) и антителами к кальциевым каналам (А); фотографии получены с помощью конфокального лазерного микроскопа. Изображения кальциевых каналов (А), рецепторов АХ (В) и наложение зтих изображений (С). Расположение кальциевых каналов совпадает с активными зонами в нервном окончании, сконцентрированными в виде узких полосок напротив постсинаптических складок, которые видны по расположению АХ рецепторов (отмечены стрелками).
Fig. 11.16. Distribution of Calcium Channels at the neuromuscular junction. Mouse neuromuscular junctions double--labeled with
α-bungarotoxin (B) and with antibodies to calcium channels (A) and observed by confocal laser microscopy. Images of calcium channels (A), ACh receptors (B), and superimposed images (C). The position of the calcium channels matches that of the active zones in the nerve terminal, concentrated in narrow bands that are in register with the openings of the junctional folds, as marked by ACh receptors (arrowheads). (After Sugiura et at 1995; micrographs courtesy of C.-P. Ko.)
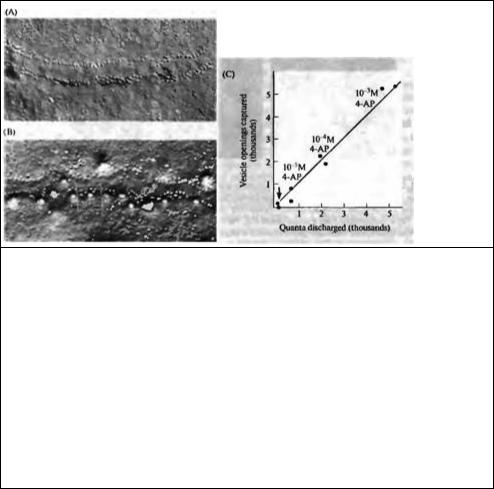
С этой целью мышца крепится к нижней поверхности падающего поршня, причем двигательный нерв прикреплен к стимулирующим электродам. В процессе падения поршня запускается стимулятор, который раздражает нерв с заданным временным промежутком до того, как мышца придет в соприкосновение с медным основанием, охлажденное жидким гелием до 4 К. Важной особенностью этого эксперимента является то, что длительность пресинаптического потенциала действия продляется 4-аминопиридином (4-АП), добавляемым в наружный раствор. 4-АП значительно увеличивает количество и длительность квантового высвобождения, вызванного одиночным стимулом, и, соответственно, количество открытий везикул, которые можно увидеть с помощью электронного микроскопа (рис. 11.17А и В).
На основании этих экспериментов было сделано два важных вывода: во-первых, наибольшее количество открываемых везикул наблюдалось в том случае, если замораживание осуществлялось через 3-5 мс после стимуляции. Это соответствует пику постсинаптического тока, регистрируемого в обработанных кураре и 4-АП мышцах. Другими словами, максимальное количество открываний везикул по времени совпадало с пиком постсинаптического физиологического ответа. Во-вторых, количество открываний везикул увеличивалось при повышении концентрации 4-АП, и это увеличение было прямо пропорционально увеличивающемуся под действием 4-АП квантовому составу потенциалов концевой пластинки, который был рассчитан по данным электрофизиологических экспериментов (рис. 11.17С). Таким образом, количество открываний везикул коррелирует с количеством и временным ходом квантового высвобождения. В последующих экспериментах Хеузер и Рииз69) дали более детальное описание временного хода открывания везикул и показали, что количество открываний увеличивается в течение периода от 3 до 6 мс после стимуляции, а затем уменьшается в течение последующих 40 мс.
Экзоцитоз был также исследован на живых клетках с помощью флуоресцентной микроскопии. В этих экспериментах пептидсодержашие везикулы были помечены флуоресцентной меткой в культивируемых клетках линии PC 12, и хромаффинные гранулы—в адреномедуллярных клетках. Высвобождение катехоламинов измерялось с помощью амперометрии — метода с очень высокой чувствительностью, в котором микроэлектрод, сделанный из угольного волокна, используется для детекции медиаторов по току, возникающему при их окислении. С
232 |
Раздел II. Передача информации в нервной системе |
|
|
Рис. 11.17. Экзоцитоз везикул соответствует квантовому высвобождению. (А) Электронная микрофотография цитоплазматической половины пресинаптической мембраны в нервном окончании лягушки (вид со стороны си наптическои щели); получено с помощью техники замораживания-скалывания. Область активной зоны имеет вид невысокого гребня, вдоль которого располагаются частицы (около 10 нм в диаметре). (В) Вид нервного окончания такой же, как на А, но полученный после заморозки в тот момент, когда нерв начал выделять большое количество квантов (5 мс после стимула). «Дыры» на мембране (одна из них отмечена квадратом) являются местами слияния везикул; широкие вмятины соответствуют везикулам, которые слились с пресинаптической мембраной после зкзоцитоза (отмечены звездочками и стрелками). (С) Сравнение количества открываний везикул (подсчитанного по изображениям, полученным с помощью замораживания-скалывания) и количества высвобожденных квантов (определенного в электрофизиологическом эксперименте). Диагональная линия является теоретической зависимостью 1 : 1, которая предполагает, что одна открывшаяся везикула высвобождает 1 квант медиатора. Количество высвобождаемого медиатора изменялось путем добавления 4-АП в различных концентрациях (стрелкой обозначен контроль).
Fig. 11.17. Vesicle Exocytosis Corresponds to Quantal Release. (A) Freeze-frarture electron micrograph of the cytoplasmic half of the presynaptic membrane in a frog nerve terminal (as if observed from the synaptic cleft). The region of the active zone appears as a slight ridge delineated by membrane particles (about 10 nm in diameter). (B) Similar view of a terminal that was frozen just at the time the nerve began to discharge large numbers of quanta (5 ms after stimulation). "Holes" (box) are sites of vesicle fusion; shallow depressions mark where vesicles have collapsed flat after opening. (C) Comparison of the number of vesicle openings (counted in freeze-fracture images) and the number of quanta released (determined from electrophysiological recordings). The diagonal line is the 1 : 1 relationship expected if each vesicle that opened released 1 quantum of transmitter. Transmitter release was varied by adding different concentrations of 4-AP (arrow indicates control, without 4-AP). (From Heuser et al., 1979; micrographs kindly provided by J. E. Heuser.)
помощью флуоресцентного микроскопа можно было наблюдать, как везикулы скапливаются у плазматической мембраны и исчезают по мере того, как их флуоресцентное содержимое высвобождается в результате экзоцитоза (рис. 11.18)70· 71). Исчезновение каждой из везикул сопровождалось высвобождением кванта медиатора, регистрируемого с помощью амперометрии. Оптические флуоресцентные методы были также использованы для исследования движения везикул внутри клеток, описания того, каким образом они подходят к плазматической мембране и скапливаются около нее перед слиянием72· 73).
Таким образом, на сегодняшний день накоплены веские доказательства в пользу того, что синаптические везикулы являются морфологическим субстратом кванта медиатора и что каждая везикула содержит несколько тысяч молекул медиатора. Содержимое везикул может высвобождаться путем экзоцитоза спонтанно, с низкой частотой высвобождения (вызывая миниатюрные синаптические потенциалы), а также в ответ на пресинаптическую деполяризацию. Существует и иная точка зрения74), однако другие механизмы, предложенные для объяснения квантового высвобождения, например, кальций-активируемые
