
Nikolls_-_Ot_neyrona_k_mozgu
.pdf
Глава 9. Основы прямой синаптической передачи |
173 |
Рис. 9.5. Синаптические потенциалы, регистрируемые внутриклеточным микроэлектродом в нервномышечном соединении, обработанном кураре. Концентрация кураре была подобрана таким образом, чтобы амплитуда синаптического потенциала лишь изредка достигала порога потенциала действия в мышечном волокне.
Fig. 9.5. Synaptic Potentials recorded with ал intracellular microelectrode from a mammalian neuromuscular junction treated with curare. The curare concentration in the bathing solution was adjusted so that the amplitude of the synaptic potential was near threshold and so on occasion evoked an action potential in the muscle fiber. (From Boyd and Martin, 1956.)
Рис. 9.6. Уменьшение амплитуды синаптических потенциалов по мере удаления от концевой пластинки мышечного волокна. При удалении регистрирующего электрода от концевой пластинки регистрируемые с помощью внутриклеточного электрода синаптические потенциалы уменьшаются в амплитуде, а время их нарастания увеличивается. Fig. 9.6. Decay of Synaptic Potentials with Distance from the end plate region of a muscle fiber. As the distance from the end plate increases, synaptic potentials recorded by an intracellular electrode decrease in size and rise more slowly. (After Fatt and Katz, 1951.)
волокна. Соответственно, они сделали вывод о том, что ПКП генерируется кратковременным импульсом тока, который входит в мышечное волокно в области концевой пластинки и вызывает быструю деполяризацию. Вызванный этим током потенциал спадает пассивно, распространяясь от концевой пластинки в обоих направлениях, и постепенно затухает.
Определение участков мышечного волокна, чувствительных к АХ
Особые свойства скелетного мышечного волокна в участке его иннервации были известны с начала двадцатого века. Так, Лэнгли 35) предположил наличие «рецептивной субстанции» около двигательных нервных окончаний, основываясь на том, что этот участок

174 |
|
|
|
Раздел II. Передача информации в нервной системе |
|
Рис. |
9.7. |
Определение |
|
||
чувствительности к АХ в области |
|
||||
нервно-мышечного |
соединения |
|
|||
лягушки с помощью ионофореза. |
|
||||
(А) Заполненная АХ пипетка |
|
||||
располагается около |
нервно- |
|
|||
мышечного соединения, и АХ |
|
||||
освобождается из нее короткими |
|
||||
положительными |
толчками |
|
|||
потенциала (ионофорез). Ответы |
|
||||
мышечного |
волокна |
на |
|
||
аппликацию АХ регистрируются |
|
||||
внутриклеточным |
электродом. |
|
|||
(В) |
|
Ответы |
на |
|
|
ионофоретическую |
аппликацию |
|
|||
АХ |
уменьшаются |
по |
мере |
|
|
удаления |
апплицирующей |
|
|||
пипетки от нервного окончания. |
|
||||
Fig. 9.7. Mapping the Distribution |
|
||||
of ACh Sensitivity by lonophoresis |
|
||||
at the frog neuromuscular junction. |
|
||||
(A) An ACh filled pipette is placed |
|
||||
close |
to |
the |
neuromuscular |
|
|
junction, and ACh is ejected from |
|
||||
the tip by a brief, positive, voltage |
(B) Responses to small ionophoretic pulses of ACh applied at different distances from the |
||||
pulse |
(lonophoresis) |
An |
|||
intracellular |
microelectrode |
is used |
axon terminal (indicated by the black dots in [A]). The amplitude and rate of rise of the |
||
to record the response from the |
response decrease rapidly as ACh is applied farther from the terminal. (After Peper and |
||||
muscle fiber. |
|
|
|
McMahan, 1972.) |
|
мышечного волокна обладает повышенной чувствительностью к различных химическим веществам, например, к никотину. Вскоре после введения в обиход стеклянных микроэлектродов для внутриклеточной регистрации, микроэлектроды стали использоваться также для локальной аппликации АХ (а впоследствии и других веществ) на концевую пластинку мышечного волокна 36). Этот методический прием проиллюстрирован на рис. 3А.
Микроэлектрод вводится в концевую пластинку мышечного волокна для регистрации мембранного потенциала, в то же время к мышечному волокну подводится микропилетка, заполненная АХ. Аппликация АХ из пипетки производится коротким положительным толчком потенциала, что вызывает выход из пипетки положительно заряженных ионов АХ. Метод подачи заряженных молекул из пипетки называется ионофорезом. Используя этот метод аппликации, Кастильо и Катц показали, что АХ деполяризует мышечное волокно только в области концевой пластинки и только при нанесении его снаружи мышечного волокна 37). Когда пипетка, заполненная АХ, находится вплотную к концевой пластинке, ионофоретическая аппликация вызывает быстрые ответы (рис. 3В). Удаление пипетки всего на несколько микрометров вызывает уменьшение амплитуды и замедление ответов.
Теперь известно, что постулированной Лэнгли рецептивной субстанцией является никотиновый ацетилхолиновый рецептор. Техника ионофореза позволила с высокой точностью определить распределение постсинаптических рецепторов АХ на мышечных волокнах 38) и нервных клетках 39). Этот метод оказался особенно полезен в тонких препаратах, в которых пре- и постсинаптические структуры можно различить с помощью интерференционного контраста 40) и положение ионофоретической пипетки по отношению к синапсу может быть определено с высокой точностью.
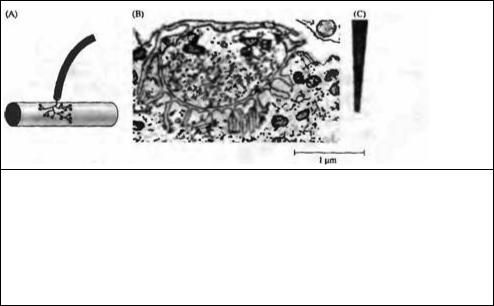
Одним из таких препаратов является нервно-мышечное соединение змеи, показанное на рис. 9.8. Концевые пластинки в мышцах змеи имеют около 50 мкм в диаметре, напоминая по своей компактности концевые пластинки у млекопитающих. Каждое окончание аксона содержит 5070 утолщений, аналогичных синаптическим бутонам, из которых выделяется медиатор. Электронная микрофотография такого синапса показана на рис. 9.8В, а на рис. 9.8С приведена электронная микрофотография типичной микропипетки для ионофореза. Размер отверстия в кончике составляет примерно 50 нм, что сравнимо с размером синаптической везикулы.
Особенно удачным препаратом для исследования чувствительности разных участков
Глава 9. Основы прямой синоптической передачи |
175 |
|
|
Рис. 9.8. Нервно-мышечное соединение змеи. (А) Концевая пластинка на скелетной мышце змеи. Аксон заканчивается в виде кластера лресинаптических бутонов. (В) Электронная микрофотография поперечного среза одного из бутонов. Синаптические везикулы, посредством которых АХ освобождается из нервного окончания, имеют диаметр около 50 нм. (С) Электронная микрофотография кончика пипетки для ионофоретической аппликации АХ, сделанная при таком же увеличении, что и на (В). Пипетка имеет внешний диаметр около 100 нм и внутренний диаметр около 50 нм.
Fig. 9.8. Skeletal Neuromuscular Junction of the Snake. (A) An end plate on a skeletal muscle of a snake. The axon terminates in a cluster of boutons. (В) Electron micrograph of a cross section through a bouton. Synaptic vesicles, which mediate ACh release from the nerve terminât are 50 nm in diameter. (C) Electron micrograph of the tip of a micropipette used for ionophoresis of ACh, shown at the same magnification as (B). The pipette has an outer diameter of 100 nm and an openinq of about 50 nm. (From Kuffler and Yoshikami, 1975.)
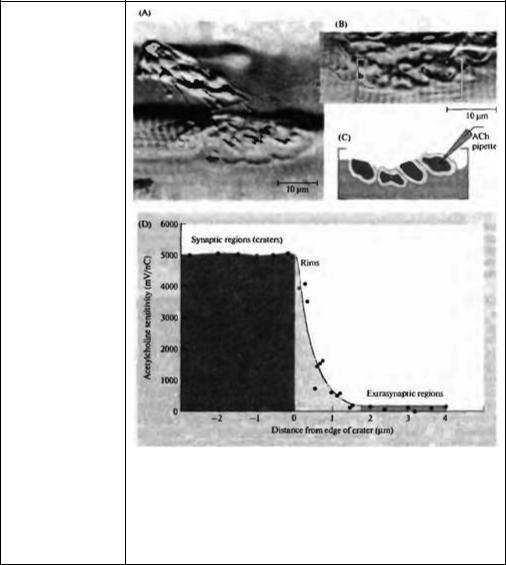
мышечного волокна к АХ является препарат, в котором двигательное нервное окончание удалено после обработки мышцы ферментом коллагеназой 41· 42). Процесс удаления окончаний показан на рис. 9.9А. На месте каждого из бутонов остается круглый кратер, дном которого является постсинаптическая мембрана. На рис. 9.9В показана пипетка, заполненная АХ, нацеленная на один из таких кратеров. Если пипетка находится непосредственно над постсинаптической мембраной, то электрический заряд в 1 пК (пикокулон) вызывает освобождение АХ, приводящее к деполяризации мышечного волокна на 5 мВ. Чувствительность мембраны таким образом составляет 5000 мВ/нК (рис. 9.9С). Удаление пипетки всего на 2 микрона от границы кратера вызывает ответ в 50-100 раз слабее. На границах между кратерами чувствительность значительно варьирует.
Другие способы для определения распределения рецепторов АХ
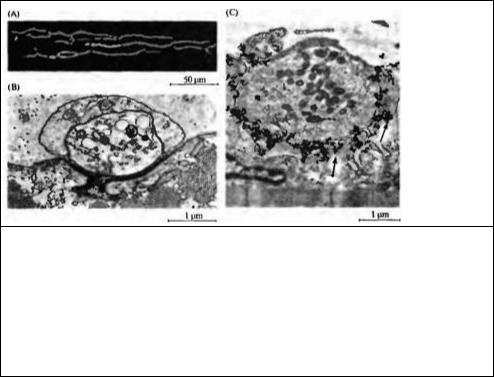
Другой способ для определения того, каким образом рецепторы АХ распределены по поверхности мышечного волокна, основан на связывании α-бунгаротоксина — токсина, содержащегося в змеином яде и связывающегося избирательно и необратимо с никотиновыми АХ рецепторами. Распределение связывания токсина можно наблюдать с использованием гистохимических методик. Например, флуоресцентные метки могут быть связаны с α-бунгаротоксином, и распределение рецепторов может быть исследовано с помощью флуоресцентного микроскопа 43) (рис. 9.10А). α-Бунгаротоксин может быть также связан с ферментом пероксидазой хрена, и плотный продукт реакции визуализован в электронном микроскопе 44) (рис. 9.10В). Эти эксперименты подтверждают, что рецепторы сконцентрированы непосредственно под окончанием аксона. Еще более точная количественная оценка концентрации АХ рецепторов может быть получена с использованием радиоактивного α-бунгаротоксина и авторадиографии (рис.9.10С) 45). Плотность рецепторов может быть определена путем подсчета количества гранул серебра в экспонированной эмульсии. Плотность рецепторов наибольшая на перегибах и верхней трети постсинаптических складок (около 104/мкм2); в экстрасинаптических участках плотность значительно меньше (около 5/мкм2) 46). Рецепторы сконцентрированы на постсинаптической мембране также в синапсах центральной и периферической нервной системы.
Нейромедиаторы и другие вещества могут подаваться на нейроны и мышечные волокна также толчками давления, подаваемыми на кончик пипетки. Преимуществом этого метода является то, что им можно подавать
176 |
Раздел II. Передача информации в нервной системе |
Рис. 9.9. Распределения АХ-рецепторов в нервно-мышечном соединении змеи. (А) Удаление нервного окончания с поверхности мышечного волокна после обработки коллагеназой. (В) Постсинаптическая мембрана после удаления нервного окончания. Заполненная АХ пипетка (справа) нацелена на один из кратеров, в котором до этого находился пресинаптический бутон. (С) Рисунок области, обозначенной скобками на части (В), с изображением четырех кратеров, в которых раньше находились пресинаптические бутоны. Центральная часть кратера, обозначенная более темным цветом, является постсинаптической мембраной, вокруг нее (светлым) — края кратера, за которыми ниже находится экстрасинаптическая область, обозначенная переходным (между темным и светлым) серым цветом. (D) Распределение чувствительности к АХ. Кратеры имеют самую высокую чувствительность к АХ (5000 мВ/нК); на краях кратеров чувствительность постепенно снижается и в экс трасинаптической области составляет всего около 100 мВ/нК.
Fig. 9.9. Acetylcholme Receptor Distribution at the skeletal neuromuscular junction of the snake.
(A) Light micrograph showing the removal of the nerve terminal from the neuromuscular junction in a muscle treated with coliagenase. (B) Light micrograph of the postsynaptic surface of the muscle cell exposed by removal of the nerve terminal. An ACh-filled pipette (entering from upper right; compare with part C) points to a crater that had been occupied by a terminal bouton. (С) Drawing of the area bracketed in B, showing the position of four craters formerly occupied by terminal boutons. Dark areas represent postsynaptic membrane within the craters, light areas are the crater rims, and grey areas are extrasynaptic regions. (D) Distribution of ACh sensitivity. The craters have a uniformly high sensitivity to ACh (5 000 mV/nC); the sensitivity declines steeply at the rims of the craters; extrasynaptic regions have a uniformly low ACh sensitivity (100 mV/nC). (After Kuffter and Yoshikami, 1975.)
электрически нейтральные молекулы. Вещества могут также подаваться на клетки или
участки мембран с использованием методики очень быстрой замены растворов заданного состава 47).
Измерение ионных токов, вызванных АХ
Каким образом АХ вызывает входящий ток в концевой пластинке? Эксперименты, прове-
Глава 9. Основы прямой синоптической передачи |
177 |
|
|
Рис. 9.10. Визуализация распределения АХ рецепторов в нервно-мышечном соединении. (А) Флуоресцентная микрофотография кожно грудной мышцы лягушки, окрашенной α бунгаротоксином, связанным с родамином. (В) Электронная микрофотография поперечного среза нервно-мышечного соединения кожно грудинной мышцы, окрашенного α?бунгаротоксином, связанным с пероксидазои хрена. Электронно-плотный продукт реакции заполняет всю синаптическую щель. (С) Авторадиограмма нервно-мышечного соединения, окрашенного [125I]-α-бунгаротоксином. Серебряные гранулы, отмеченные стрелками, сконцентрированы на верхней части постсинаптических складок.
Fig. 9.10. Visualizing the Distribution of ACh Receptors at the neurornuscular junction. (A) Fluorescence micrograph of a frog cutaneous pectoris muscle fiber stained with rhodamine a bungarotoxin. (B) Electron micrograph of a cross section of a frog cutaneous pec tons neurornuscular junction labeled with HRP-a bungarotoxin Dense reaction product fills the synaptic cleft. (C) Autoradiograph of a neuromuscular junction in a lizard intercostal muscle labeled with [125I]-o-bungarotoxin. Silver grains (arrows) show that receptors are concentrated at the tops and along the upper third of the junctional folds. (A kindly provided by W. J. Betz; В kindly provided by U. J. McMahan; С from Salpeter, 1987, kindly provided by M. M. Salpeter.)
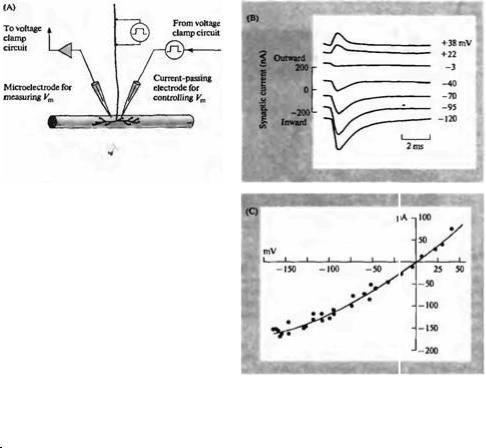
денные Феттом и Катцем, позволили сделать вывод о том, что АХ вызывает значительное неспецифическое увеличение проводимости постсинаптической мембраны для маленьких ионов 33). Две методики были использованы для исследования изменения проводимости, вызываемой АХ. В одной из них использовались радиоактивные изотопы и было показано, что возрастает проводимость ионов натрия, калия и кальция, но не хлора 48). Этот эксперимент является убедительным доказательством тому, какие ионы вовлечены в изменение проводимости, но не дает информации о деталях этих изменений, их кинетике или потенциалзависимости. Эта информация была впервые получена А. Такеуши и Н. Такеуши, которые использовали метод двухэлектродной фиксации мембранного потенциала в мышечных волокнах 49). Дизайн этого эксперимента изображен на рис. 9.11 А. Два микроэлектрода вводятся в область концевой пластинки мышечного волокна лягушки — один
из их регистрирует мембранный потенциал (Vm), a через другой пропускается ток для фиксации потенциала на заданном уровне. Постсинаптические рецепторы активируются либо АХ, освобождаемым из двигательного нерва, либо путем прямой ионофоретической аппликации. Впоследствии схожие эксперименты были проведены 50) на мышечных волокнах, обработанных глицерином, что предотвращает сокращение мышечного волокна при его деполяризации, но имеет также и тот недостаток, что мышечные волокна находятся в искусственно деполяризованном состоянии. Результаты, полученные на обработанном глицерином мышечном волокне, показаны на рис. 9.11В. При мембранном потенциале, фиксированном на уровне -40 мВ, стимуляция нерва вызывает входящий ток, который вызвал бы деполяризацию мышечного волокна в том случае, если бы потенциал мышечного волокна не фиксировался. При более· отрицательных потенциалах ток через концевую
178 |
Раздел II. Передача информации в нервной системе |
|
|
|
|
|
|
|
Рис. 9.11. Потенциал реверсии |
|
синаптических |
токов, |
|
|
|
измеренный в условиях фиксации потенциала. (А) Схема |
|
|
||||
регистрации токов двигательной концевой пластинки в |
|
|
||||
условиях фиксации потенциала. (В) Синаптические токи, |
|
|
||||
зарегистрированные при мембранных потенциалах от — |
|
|
||||
120 до +38 мВ. При отрицательных значениях |
|
|
||||
мембранного потенциала синаптические токи имеют |
|
|
||||
входящее направление. Если мембранный потенциал не |
|
|
||||
фиксировать, то входящий ток приведет к деполяризации |
|
|
||||
мышечного волокна. При положительных значениях |
|
|
||||
мембранного |
потенциала |
синаптические |
токи |
|
|
|
направлены из клетки наружу. (С) Зависимость |
|
|
||||
амплитуды синаптического тока от мембранного |
|
|
||||
потенциала близка к линейной и потенциал реверсии |
|
|
||||
синаптических токов находится около 0 мВ. |
|
|
|
|||
Fig. 9.11. Reversal Potential for Synaptic Currents measured |
|
|
||||
by voltage clamp recording. (A) Scheme for voltage clamp |
Such inward current would depolarize the muscle if it were not |
|||||
recording at the motor end plate. (B) Synaptic currents |
||||||
recorded at membrane potentials between -120 and +38 mV. |
voltage-clamped. When the end plate potential is clamped above 0 |
|||||
When the muscle membrane potential is clamped below 0 |
mV, synaptic current flows out of the cell. (C) Plot of peak end |
|||||
mV, synaptic current flows into the muscle. |
|
plate current as a function of membrane potential. The relation is |
||||
|
|
|
|
|
nearly linear, with the reversal potential close to 0 mV. (After |
|
|
|
|
|
|
Magleby and Stevens, 1972.) |
|
пластинку увеличивался, а при деполяризации мембраны — уменьшался. При еще большей деполяризации токи меняли направление и становились выходящими.
Зависимость амплитуды тока концевой пластинки от мембранного потенциала показана на рис. 9.11C. Ток реверсирует, т. е. меняет направление со входящего на выходящий около 0 мВ на постсинаптической мембране. Значение мембранного потенциала, при котором происходит реверсия тока, называется потенциалом реверсии (Vr). В более ранних экспериментах потенциал реверсии составил около -15 мВ 51).
Почему важно знать потенциал реверсии?
Потенциал реверсии тока концевой пластинки дает информацию об ионных токах, которые протекают через каналы, активируемые АХ на постсинаптической мембране. Например, если бы каналы были проницаемы только для ионов натрия, то ток через эти каналы реверсировал бы при натриевом равновесном потенциале (около +50 мВ). Другие основные ионы, калий и хлор, имеют равновесный потенциал около -90 мВ, что близко к потенциалу покоя (глава 5); равновесный потенциал для ионов кальция составляет примерно +120 мВ. Ни один из этих ионов не имеет равновесный потенциал в диапазоне от О до -15 мВ. Какие же ионы вовлечены в генерацию этих ответов? А. Такеуши и Н. Такеуши показали, что изменение наружной концентрации натрия, калия и кальция приводит к изменению потенциала реверсии, а изменение концентрации ионов хлора на нее не влияет, что согласуется с результатами с исполь-
Глава 9. Основы прямой синоптической передачи |
179 |
зованием радиоактивных изотопов 33, 52). Таким образом, был сделан вывод о том, что АХ вызывает общее увеличение катионной проводимости.
Сравнительный вклад натрия, калия и кальция в потенциал концевой пластинки
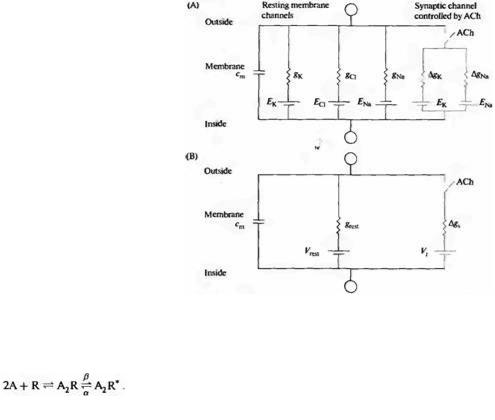
АХ открывает ионные каналы в мембране концевой пластинки, которые при потенциале покоя позволяют ионам натрия и кальция входить, а ионам калия выходить из клетки в соответствии с их электрохимическими градиентами. Поскольку проводимость кальция через каналы сравнительно мала, вкладом ионов кальция в синаптический ток можно пренебречь, так же как и вкладом других ионов, как, например, магния. (Следует заметить, что низкая кальциевая проводимость связана с низкой внутри- и внеклеточной концентрацией кальция в то время как кальциевая проницаемость составляет примерно 20 % натриевой проницаемости.) Соответствующая электрическая схема приведена на рис. 9.12А. В покое мембрана состоит из обычных натриевых, калиевых и хлорных каналов. Параллельно к ним соединены активируемые АХ натриевые и калиевые каналы, gNa и gΚ. А. и Н. Такеуши установили, что потенциал реверсии Vτ = -15 мВ, и что соотношения изменений проводимости gΝa/ gK составляет около 1,3. В действительности канал, открываемый АХ, имеет примерно одинаковую проницаемость для ионов натрия и калия 53) - 54). Однако, если принять по внимание внутри- и внеклеточную концентрацию этих ионов, то оказывается, что количество ионов натрия, доступных для перемещения через канал, превышает количество ионов калия (глава 5). Таким образом, при равном изменении проницаемости, натриевая проводимость несколько больше (глава 2).
Проводимость мембраны в покое и амплитуда синаптического потенциала
Электрическая схема, показанная на рис. 9.12А, может быть упрошена, если представить мембрану в состоянии покоя как единую проводимость, grest (равную сумме всех ионных проводимостей), и одну электрическую батарейку, Vrest (равную мембранному
потенциалу покоя). Синаптическая мембрана может быть представлена одной проводимостью gS и батарейкой с потенциалом Vr (рис. 9.12В). Свойством этой электрической схемы является то, что амплитуда синаптического потенциала зависит как от grest, так и от gS.
Для простоты давайте рассмотрим, какой потенциал образуется в том случае, если синаптическая проводимость активируется на длительное время. Если gS намного больше, чем gгеst, то мембранный потенциал должен приблизится к Vr. Если gS равно grest, то изменение мембранного потенциала, вызванное активацией синаптической проводимости, должно быть вдвое меньше. Таким образом, амплитуда синаптического потенциала может увеличиваться либо при увеличении синаптической проводимости (т. е. при активации большего количества синаптических каналов), либо при уменьшении проводимости мембраны в состоянии покоя. Уменьшение мембранной проводимости является важным механизмом модуляции эффективности синаптической передачи. Например, определенные входы на клетки вегетативного ганглия жабы вызывают закрывание калиевых каналов, что приводит к возрастанию амплитуды возбуждающих синаптических потенциалов, вызываемых другими входами на эти клетки (глава 16).
Кинетика токов через одиночные каналы, активируемые АХ
В какой степени временной ход токов концевой пластинки отражает поведение одиночных ионных каналов, активируемых АХ? Можно представить, что отдельные каналы многократно открываются и закрываются во время тока концевой пластинки с уменьшающейся со временем вероятностью открывания канала. Возможно и то, что каналы открываются лишь один раз, и временной ход интегрального тока определяется тем, как долго каналы остаются в открытом состоянии. Окончательный ответ на этот вопрос был получен с внедрением методики пэтчкламп (patch clamp), с помощью которой можно регистрировать активность одиночных ионных каналов (глава 2) 55). Было показано, что, при непрерывной аппликации АХ, каналы открываются и закрываются по принципу «все или ничего», причем время нахождения каналов в открытом состоянии соответствует длительности токов концевой пластинки 56). Актива-
180 |
|
|
|
|
|
Раздел II. Передача информации в нервной системе |
|||
Рис. |
9.12. |
Электрическая |
модель |
|
|||||
постсинаптической мембраны. Каналы, |
|
||||||||
активируемые |
|
АХ, |
|
параллельно |
|
||||
соединены с другими каналами и с |
|
||||||||
емкостью мембраны. (А) Синаптические |
|
||||||||
каналы, открываемые АХ, можно |
|
||||||||
представить |
|
на |
схеме |
как |
две |
|
|||
независимых |
проводимости |
для ионов |
|
||||||
натрия и калия. Другими каналами, |
|
||||||||
открытыми в состоянии покоя, являются |
|
||||||||
калиевые, натриевые и хлорные каналы. |
|
||||||||
(В) Синаптические каналы можно |
|
||||||||
представить в виде одной проводимости |
|
||||||||
с проводимостью |
p и электрической |
|
|||||||
батареей с потенциалом, равным |
|
||||||||
потенциалу |
|
реверсии |
V |
|
Остальная |
|
|||
мембрана может быть представлена в |
|
||||||||
виде единой проводимости grest и |
|
||||||||
батареей с потенциалом Vrest· |
|
|
|
|
|||||
Fig. |
9.12. |
Electrical |
Model |
of |
the |
|
|||
Postsynaptic |
|
Membrane |
with |
channels |
|
||||
activated by ACh in parallel with the resting |
|
||||||||
membrane channels and with the membrane |
|
||||||||
capacitance, cm. (A) The synaptic channel |
|
||||||||
opened by ACh is electrically equivalent to |
|
||||||||
two independent pathways for sodium and |
represented as a single pathway with conductance Δρ.. and a battery equal to the |
||||||||
potassium. |
The resting |
membrane |
has |
||||||
channels for |
potassium, |
chloride, |
and |
reversal potential Vr. The resting membrane can be represented as a single |
|||||
sodium. (B) The synaptic channel can be |
|
pathway with conductance grest and a battery equal to Vrest . |
|||||||
ция ионного канала может быть описана следующей схемой, в которой молекула медиатора А (агонист) взаимодействует с молекулой постсинаптического рецептора R:
Две молекулы АХ связываются с каналом (по одной молекуле АХ с каждой α- субъединицей; глава 3), который затем подвергается конформационной перестройке из закрытого (A2R) в открытое (A2R*) состояние. Переходы между открытым и закрытым состояниями характеризуются константами α к β, как обозначено на схеме. Теперь рассмотрим временной ход тока концевой пластинки (рис. 9.13). Выделенный из нервного окончания АХ практически одновременно открывает большое количество каналов. Поскольку АХ быстро удаляется из синаптической щели (в результате гидролиза холинэстеразой и диффузии), каждый канал открывается только один раз. Закрывание ионных каналов приводит к спаду синаптического тока. Таким образом, временной ход спада синаптического тока отражает скорость, с которой закрываются одиночные каналы, активируемые АХ. Каналы закрываются со скоростью α х [A2R*]; то есть многие каналы закрываются очень быстро, и все меньше и меньше каналов закрывается через большее время (рис. 9.13). Как в случае всех независимых или случайных событий, открытые времена имеют экспоненциальное распределение, со средним временем открытого состояния (τ), равным постоянной времени спада тока концевой пластинки, 1/α.
Эксперименты с использованием пэтч-кламп методики позволили выявить многие особенности активности каналов, которые невозможно было определить ранее с использованием других методик. Так, местные анестетики (например, прокаин) продлевают спад токов концевой пластинки (в дополнение к блокированию натриевых каналов и потенциалов действия). Пэтч-кламп регистрация позволила определить, что замедление синаптических токов происходит в результате того, что в присутствии прокаина ток через канал трансформируется во вспышки кратковременных открываний. Это происходит, по видимому, вследствие того, что молекула анестетика быстро перемешается внутрь канала и обратно, вызывая кратковременное блокирование тока через канал 57) - 59). Последующие эксперименты выявили, что, в дополнение к этому механизму блокирова-

Глава 9. Основы прямой синоптической передачи |
181 |
Рис. 9.13. Ток концевой пластинки является результатом сложения токов через одиночные ионные каналы. В верхней части рисунка изображен ток через шесть одиночных каналов. При активации АХ каналы открываются одновременно. АХ быстро гидролиэуется что предотвращает повторную активацию каналов. Распределение времен открытого состояния каналов имеет экспоненциальный характер. На нижней части показан интегральный ток концевой пластинки, который является результатом сложения токов через одиночные каналы; постоянная времени спада интегрального тока равна среднему времени открытого состояния одиночных каналов.
Fig. 9.13. Total End Plate Current Is the Sum of Individual Channel Currents. Current flow through six individual channels is depicted in the top panel. Channels open instantaneously in response to Adi ACh is rapidly hydrolyzed, preventing any further channel openings. Channel open times are distributed exponentially. The individual channel currents sum to give the total end plate current (lower panel). The time constant of the decay of the total current is equal to the mean open time of the individual channels.
ния канала, прокаин также ингибирует открывание канала, связываясь с рецептором вне устья канала 60). Свойства канала могут изменяться под действием многих веществ, включая кокаин 61), барбитураты 62), стероидные гормоны 63), общие анестетики 64), которые связываются с местами как внутри, так и вне поры ионного канала.
Свойства рецепторов АХ меняются в процессе развития. Существует эмбриональная форма рецептора АХ, которая имеет низкую проводимость и длительное время открытого состояния, и взрослая форма, которая имеет большую проводимость и короткое время открываний 65, 66). Переход из эмбриональной формы во взрослую происходит в результате изменения субъединичного состава (главы 3 и 23), а сплайс-варианты одной из эмбриональных субъединиц могут быть ответственны за вариации во времени открытого состояния каналов на ранних этапах развития 67).
§ 4. Прямое синаптическое торможение
В основе работы синапсов, обеспечивающих прямое химическое торможение, лежат те же механизмы, что и в основе работы прямых химических возбуждающих синапсов. Возбуждение происходит при открывании в постсинаптической мембране каналов с потенциалом реверсии более положительным, чем порог потенциала действия. В то же время прямое химическое синаптическое торможение достигается открыванием каналов, чей потенциал реверсии отрицателен по отношению к пороговым значениям. Прямое химическое синаптическое торможение происходит при активации каналов, проводящих ионы хлора. Как правило, ионы хлора имеют равновесный потенциал, равный или близкий к потенциалу покоя. Первые исследования прямой химической синаптической передачи были проведены на нервно-мышечном соединении членистоногих 68· 69), рецепторе растяжения рака 70) и мотонейронах спинного мозга кошки 71).
Потенциал реверсии тормозных потенциалов
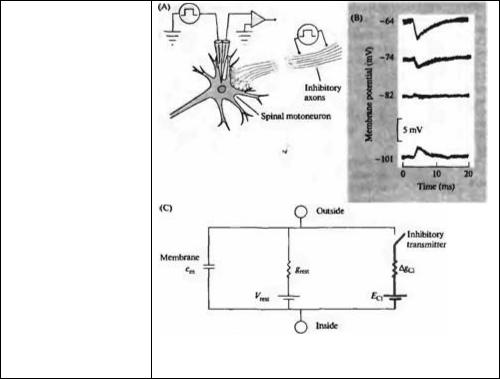
Мотонейроны спинного мозга тормозятся сенсорными входами от мышц-антагонистов через тормозные интернейроны спинного мозга. Эффект активации тормозных входов может быть исследован в эксперименте, проиллюстрированном на рис. 9.14А. В мотонейрон вводятся два микроэлектрода: один из них используется для регистрации мембранного потенциала, другой — для пропускания тока через клеточную мембрану. При потенциале покоя (около -75 мВ) стимуляция тормозных входов вызывает небольшую гиперполяризацию клетки — тормозной постсинаптический потенциал
(ТПСП, рис. 9.14В). Если деполяризовать мембрану, пропуская положительный ток в клетку, амплитуда ТПСП увеличивается. При гиперполяризации клетки
182 |
Раздел И. Передача информации в нервной системе |
Рис. 9.14. Прямая тормозная
химическая |
синаптическая |
|
передача. |
(А) |
Схема |
внутриклеточной регистрации от мотонейрона спинного мозга кошки и стимуляции тормозных синаптических входов. (В) Си наптические потенциалы, вызываемые стимуляцией тормозных входов, записанные при значениях мембранного потенциала между -64 и -101 мВ. Потенциал реверсии находится между -74 и -82 мВ.
(С) |
Электрическая |
модель |
|||
мембраны |
мотонейрона |
с |
|||
хлорными |
|
|
каналами, |
||
активируемыми |
тормозным |
||||
медиатором |
gCl и |
параллельно |
|||
соединенными grest и ст. |
|
||||
Fig. |
9.14. |
Direct |
|
Inhibitory |
|
Chemical Synaptic |
Transmission. |
||||
(A) |
Scheme |
for |
|
intracellular |
|
recording from a cat spinal motoneuron and stimulation of inhibitory synaptic inputs. The membrane potential of the motoneuron is set to different levels by passing current through a second intracellular microelectrode. (В) Intracellular records of synaptic potentials evoked at membrane potentials between -64 and -101 mV. The reversal potential is
between -74 and —82 mV. (C) Electrical model of the motoneuron membrane with chloride channels activated by the inhibitory transmitter, gCl, in parallel with the resting membrane channels, grest, and the membrane capacitance, cm. (A and В after Coombs, Eccles, and Fatt, 1955.)
до -82 мВ тормозный потенциал становится очень маленьким и изменяет свое направление (реверсирует). При мембранном потенциале -100 мВ амплитуда реверсированного тормозного потенциала увеличивается. Потенциал реверсии в данном эксперименте составляет около -80 мВ.
Тормозные каналы проводят анионы, причем проницаемость довольно хорошо коррелирует с радиусом гидратированного проникающего иона 71, 72). В физиологических условиях единственным анионом маленького размера, присутствующим в значительных количествах, является ион хлора. Введение ионов хлора в мотонейроны спинного мозга из микропипетки сдвигает хлорный равновесный потенциал, и соответственно потенциал реверсии ТПСП, в положительном направлении. Изменение внеклеточной концентрации хлорных ионов также вызывает изменение равновесного хлорного потенциала и потенциала реверсии ТПСП, однако результаты таких экспериментов не всегда однозначны. Это связано с тем, что изменение внеклеточной концентрации ионов хлора часто приводит к пропорциональному изменению внутриклеточной концентрации ионов хлора (глава 5), и поэтому изменение хлорного равновесного потенциала носит лишь кратковременный характер.
Это затруднение может быть преодолено, если полностью удалить ионы хлора из внеклеточной среды. На рис. 9.15 показан пример регистрации от ретикулоспинальной клетки продолговатого мозга, в которой тормозная синаптическая передача опосредована глицином 73). Мембранный потенциал регистрировался внутриклеточным микроэлектродом. Второй электрод использовался для пропускания в клетку коротких толчков гиперполяризующего тока; вызываемое этими толчками изменение мембранного потенциала служило для оценки входного сопротивления клетки. Наконец, третья микропипетка применялась для аппликации глицина на клетку вблизи тормозного синапса, используя кратковременные толчки давления. Аппликация глицина вызывала небольшую
