
Nikolls_-_Ot_neyrona_k_mozgu
.pdf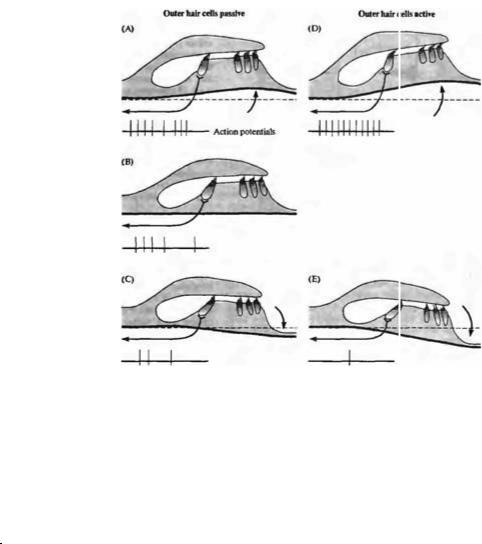
Глава 18. Обработка соматосенсорных и слуховых сигналов |
403 |
|||||||
Рис. |
18.15. |
|
Движение |
|
|
|||
структур |
|
улитки. |
Во |
|
|
|||
время |
|
волновых |
|
|
||||
колебаний |
|
жидкости, |
|
|
||||
вызванных |
|
|
звуком, |
|
|
|||
подвижные |
|
структуры |
|
|
||||
улитки |
|
(базилярная |
|
|
||||
мембрана и орган Корти) |
|
|
||||||
перемещаются |
вверх |
и |
|
|
||||
вниз. (А) Во время фазы |
|
|
||||||
разрежения |
|
звуковой |
|
|
||||
волны |
базилярная |
и |
|
|
||||
покровная |
|
мембраны |
|
|
||||
смещаются |
|
|
вверх, |
|
|
|||
приводя |
к |
отклонению |
|
|
||||
волосковых |
|
пучков |
в |
|
|
|||
направлении |
наиболее |
|
|
|||||
длинного стереоцилия — |
|
|
||||||
деполяризация |
|
|
|
|
|
|||
волосковых |
клеток |
по |
|
|
||||
сравнению с состоянием |
|
|
||||||
покоя |
|
|
(В). |
|
(С) |
|
|
|
Перемещение |
вниз |
во |
|
|
||||
время |
фазы |
|
сжатия |
|
|
|||
звуковой |
|
|
|
волны |
|
|
||
вызывает |
|
|
|
|
|
|
||
противоположное |
|
|
|
|
||||
отклонение |
волосковых |
|
|
|||||
пучков |
и |
волосковые |
|
|
||||
клетки |
|
|
|
|
|
|
|
|
гиперполяриэуются |
|
|
|
|||||
относительно спокойного |
|
|
||||||
состояния. (D) Активное |
|
|
||||||
сокращение |
наружных |
|
|
|||||
волосковых |
клеток |
во |
волосковых клеток, что отражается в паттерне активности волокон, контактирующих |
|||||
время |
деполяризации |
с наружными волосковыми клетками. |
|
|||||
усиливает направленное |
Fig. 18.15. Motion of the Cochlear Partition. During sound-evoked fluid waves, the |
|||||||
вверх |
|
|
|
смещение |
||||
базилярной |
мембраны. |
cochlear partition (basilar membrane and organ of Corti) moves up and down. (A) During |
||||||
(Е) |
Гиперполяризация |
the rarefaction phase of a sound wave, the basilar membrane and tectorial membrane |
||||||
наружных |
волосковых |
move upward, resulting in a shearing motion toward the longest stereocilia of the hair |
||||||
клеток |
приводит |
к |
их |
bundle — depolarizing the hair cells relative to the resting condition (B). (C) Downward |
||||
удлинению. |
|
|
|
|
motion during the compressive phase of a sound produces the opposite displacement of |
|||
Результирующий эффект |
the hair bundles, and hair cells are hyperpolanzed relative to rest. (D) Active contraction |
|||||||
состоит |
в |
увеличении |
of outer hair cells during depolarization accentuates the upward motion of the basilar |
|||||
смещения |
базилярной |
membrane. (E) Hyperpolarization of outer hair cells causes them to elongate. The net |
||||||
мембраны |
за |
счет |
effect is that motion of the basilar membrane is greater because of the "muscular" action |
|||||
«мышечного» действия |
of the outer hair cells, and this is reflected in the activity pattern of afferent fibers |
|||||||
наружных |
|
|
|
|
contacting the inner hair cells. The extent of motion is greatly exaggerated here for the |
|||
|
|
|
|
|
|
|
purpose of illustration. |
|
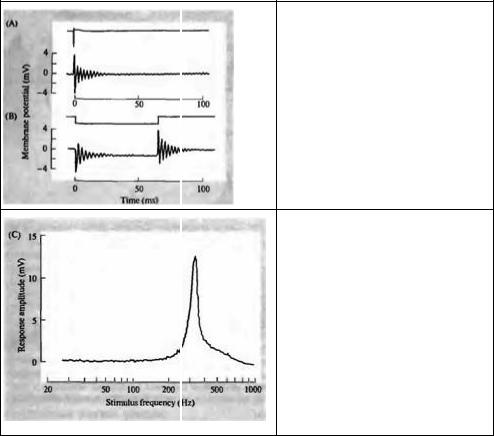
потенциала волосковой клетки или осциллирующий ответ с частотой около 350 Гц. Это та же частота, что и у чистых тонов, к которым волосковые клетки наиболее чувствительны, как показано на рис. 18.16С. Здесь тон постоянной интенсивности подавался на внешнее ухо, и его частота постепенно менялась от 20 до 1 000 Гц. Электрический ответ волосковой клетки достигал пикового значения при 350 Гц. Осцилляция потенциала, вызванная коротким звуковым сигналом, и кривая настройки, полученная путем подбора частоты, являются эквивалентными средствами для измерения частотной избирательности волосковой клетки.
Рис. 18.16В показывает, что когда микроэлектрод использовали для пропускания в клетку прямоугольного толчка тока, возникала осцилляция потенциала, частота и скорость затухания которой были идентичны той, что была вызвана звуковым входом. Вывод из этих экспериментов состоит в том, что частотная избирательность волосковых клеток зависит от электрических свойств мембраны. Электрически и акустически настраиваемые частоты волосковых клеток эквива-
404 |
Раздел III. Интегративные механизмы |
Рис. 18.16. Настройка волосковых клеток в улитке черепахи. (А) Влияние звукового щелчка (верхняя линия) на мембранный потенциал волосковой клетки (нижняя линия), зарегистрированный внутриклеточно. Щелчок вызывает затухающее колебание мембранного потенциала с частотой около 350 Гц, начальной пиковой амплитудой около 8 мВ (В) Гиперполяризующий толчок тока (верхняя линия), приложенный к той же клетке, вызывает сходные осцилляции как при включении, так и при выключении толчка, показывая, что частота колебаний является внутренним свойством волосковой клетки. (С) Если такую волосковую клетку стимулировать чистыми тонами, плавно меняющимися по частоте от 25 до 1000 Гц, пиковая амплитуда рецепторного потенциала имеет острый максимум при 350 Гц.
Fig. 18.16. Hair Cell Tuning in the turtle cochlea.
(A) The effect of an acoustic click (indicated by the upper trace) on the membrane potential of a hair cell (lower trace, relative to the resting membrane potential of —50 mV), recorded with an intracellular microelectrode. The click produces a damped oscillation in membrane potential at a frequency of about 350 Hz, with an initial peak-to-peak amplitude of about 8 mV. (B) A hyperpolarizing current pulse (upper trace) applied to the same cell produces similar oscillations at both the onset and termination of the pulse, indicating that the frequency of oscillation is an intrinsic electrical property of the hair cell. (C) When a hair cell with oscillatory responses such as those seen in A and
В is stimulated with pure tones ranging from 25 to 1 000 Hz, the peak-to-peak amplitude of the receptor potential has a sharp maximum at about 350 Hz.
(After Fettiplace, 1987.)
лентны и закономерно изменяются по длине базилярного сосочка черепахи, создавая тонотопический массив настроенных детекторов.
Калиевые каналы волосковых клеток и их настройка
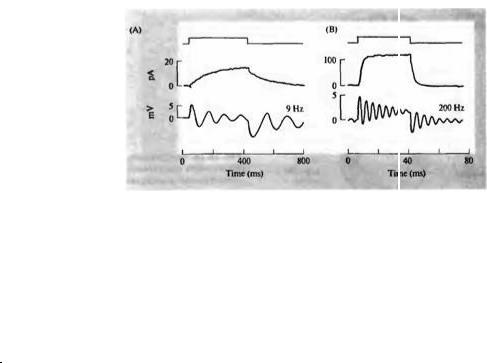
Какие свойства клеточной мембраны обеспечивают эту электрическую настройку и как эти свойства варьируют, определяя настройку на определенную частоту? Отведение от волосковых клеток мешочка лягушки (вестибулярный сенсорный орган) показало, что взаимодействия между потенциалзависимыми кальциевыми и кальций-активируемыми калиевыми каналами может вызывать осцилляцию потенциала81· 82). Исследования волосковых клеток, изолированных из уха черепахи83· 84), показали, что характеристическая частота каждой клетки определена чрезвычайно элегантным и простым путем — а именно плотностью и кинетическими свойствами кальцийактивируемых калиевых каналов в каждой клетке (рис. 18.17). Их называют ВК-каналами (от "big K+") из-за большой проводимости одиночного канала.
В клетках, настроенных на более низкие частоты, суммарная калиевая проводимость мала и медленнее активируется, и таким образом способствует возникновению относительно медленных электрических колебаний. В клетках с более высокой частотой калиевая проводимость больше и активация быстрее. В самых низкочастотных волосковых клетках еще более медленные, исключительно потенциалзависимые калиевые каналы поддерживают колебания 85). ВК-каналы в волосковых клетках цыплят86) и черепах87) кодируются геном, тРНК которого обладает альтернативным сплайсингом88, 89), и некоторые дифференциально расщепляемые изоформы канала кинетически различны90). Дополни-
Глава 18. Обработка соматосенсорных υ слуховых сигналов |
405 |
|
||||||
Рис. |
18.17. |
Частота |
|
|
|
|||
настройки |
|
и |
калиевая |
|
|
|
||
проводимость |
|
в |
|
|
|
|||
изолированной |
|
|
|
|
|
|||
волосковой |
|
клетке |
|
|
|
|||
черепахи, |
|
измеренные |
|
|
|
|||
с помощью пзтч-кламп |
|
|
|
|||||
отведения |
|
от |
целой |
|
|
|
||
клетки. (А) |
|
Средняя |
|
|
|
|||
запись |
|
|
показывает |
|
|
|
||
выходящий |
|
ток, |
|
|
|
|||
обусловленный, |
|
в |
|
|
|
|||
основном, |
|
|
калием, |
|
|
|
||
возникающий в |
ответ |
на |
|
|
|
|||
деполяризующее |
|
|
|
|
||||
смещение |
|
потенциала |
|
|
|
|||
(длительность |
которого |
|
|
|
||||
показана |
на |
верхней |
больший по величине, быстро нарастающий выходящий ток, |
свидетельствующий о |
||||
записи). Ток медленно |
||||||||
нарастает до максимума в |
более высокой плотности калиевых каналов с более быстрой |
кинетикой. Частота |
||||||
15 пА |
с |
постоянной |
настройки осцилляторного ответа также пропорционально возрастает до 200 Гц. |
|||||
времени около 200 мс. |
Fig. 18.17. Tuning Frequency and Potassium Conductance in isolated turtle hair cells |
|||||||
Небольшой |
сдвиг тока |
|||||||
такой |
же |
|
длительности |
measured by whole-cell patch clamp recording. (A) The middle record shows outward |
||||
вызывает |
осцилляторное |
current carried mainly by potassium, produced by a depolarizing voltage command |
||||||
изменение |
напряжения |
в |
(duration indicated in the top record). Current rises slowly to a maximum of 15 pA, with a |
|||||
начале |
и |
в |
конце толчка |
time constant of about 200 ms. A small current step of the same duration produces |
||||
(нижняя |
|
запись) |
с |
oscillatory voltage responses at the beginning and end of the pulse (lower record) with a |
||||
резонансной |
частотой |
9 |
resonant frequency of 9 Hz. (B) In another cell, a similar depolarizing pulse produces a |
|||||
Гц. (В) В другой клетке |
much larger, rapidly rising outward current (middle record; note the changes in current |
|||||||
сходный деполяризующий |
and timescales), indicating a greater density of potassium channels with faster kinetics. |
|||||||
толчок |
|
|
|
вызывает |
The oscillatory response to a small current pulse reveals a concomitant increase in |
|||
значительно |
|
|
|
tuning frequency to 200 Hz (lower record). (After Fettiplace, 1987.) |
||||
тельная вариабельность обеспечивается вспомогательной β-субъединицей, которая встраивается в канал и замедляет кинетику его открывания91). Эта β-субъединица экспрессируется в тонотопическом паттерне, появляясь в больших количествах в клетках вершины улитки, где обнаруживается настройка на низкие частоты.
Слуховые проводящие пути
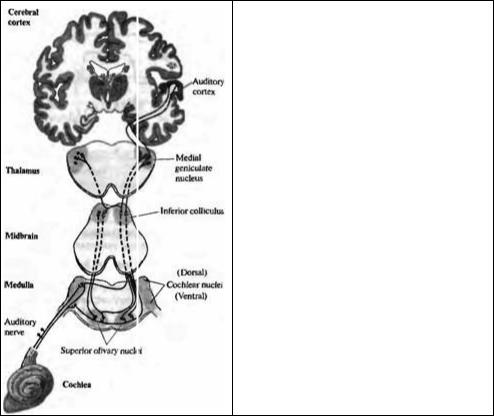
Основные слуховые пути схематично представлены на рис. 18.18. Слуховые волокна восьмой пары черепномозговых нервов направляются центрально и посылают ветви как в дорзальные, так и в вентральные кохлеарные ядра92). Аксоны второго порядка восходят в составе контралатерального бокового леминиска, иннервируя клетки в нижних бугорках четверохолмия (ядро бокового лемниска является станцией синаптического переключения для некоторых из этих волокон). Нейроны в вентральном кохлеарном ядре также дают коллатеральные ветви как к ипсилатеральным, так и к контралатеральным ядрам верхних олив. Клетки третьего порядка, расположенные в ядрах верхних олив, в свою очередь, посылают восходящие волокна в нижние бугры четверохолмия. Путь продолжается через ядра медиального коленчатого тела таламуса к слуховой области поперечной височной извилины верхней части височных долей коры головного мозга. Каждый уровень в слуховом пути тонотопически картируется.
По мере продвижения к более высоким отделам слуховой системы чистые тона становятся все менее важными в качестве стимулов для отдельных клеток. Например, клетки в дорзальном кохлеарном ядре и нижних буграх четверохолмия тормозятся тонами, которые не совпадают с их характеристической частотой93· 94). Клетки в слуховой коре реагируют на комбинации тонов, на бинауральные, но не мензуральные звуки, а также на другие сложные слуховые стимулы95)--97). Когда обнаруживаются клетки, которые действительно реагируют на чистые тона, их частотная избирательность зачастую выше, чем у первичных афферентных волокон. Таким образом, кривая настройки (отношение порога к частоте) корковых нейронов острее, чем кривая первичного афферента98) (рис. 18.19А). Это обострение частотной избирательности ответа
406 |
Раздел III. Интегративные механизмы |
Рис. 18.18. Центральные слуховые пути. Волокна слухового нерва оканчиваются билатерально в дорзальных и вентральных кохлеарных ядрах. Волокна второго порядка восходят контралатерально к нижним буграм четверохолмия; волокна от вентральных кохлеарных ядер также дают коллатерали билатерально в ядра верхних олив. Следующее билатеральное взаимодействие обеспечивается на уровне нижних бугров четверохолмия. Затем волокна восходят к ядрам медиального коленчатого тела таламуса, а оттуда направляются в слуховую кору.
Fig. 18.18. Central Auditory Pathways shown schematically on transverse sections of the medulla, midbrain, and thalamus, and a coronal section of the cerebral cortex. Auditory nerve fibers end in the dorsal and ventral cochlear nuclei. Second-order fibers ascend to the contralateral inferior colliculus; those from the ventral cochlear nucleus also supply collaterals bilaterally to the superior olivary nuclei. Further bilateral interaction occurs at the level of the inferior colliculus
Fibers then ascend to the medial geniculate nucleus of the thalamus and hence to the auditory cortex. (After Berne and
Levy, 1988.)
соответствует обострению пространственной локализации колебаний на базилярной мембране и обеспечивается за счет латерального торможения, точно так же как и в соматосенсорной системе. Таким образом, рецептивным полем этого коркового нейрона является возбужденная полоса базилярной мембраны, окруженная с обеих сторон тормозным окаймлением. Это приводит к сужению диапазона частот, которые возбуждают клетку, за счет сжатия его с обеих сторон более высокими и более низкими частотами, которые вызывают торможение (рис. 18.19В). Тормозные боковые полосы частот обусловлены частично нисходящей обратной связью из самой коры, которая формирует свойства ответа клеток, расположенных на более низких уровнях99).
Слуховая кора
Слуховой вход, осуществляемый как через дорзальные, так и вентральные кохлеарные ядра, достигает слуховой коры. Первичная слуховая кора (А,) расположена в верхнем отделе височной доли и соответствует полям 41 и 42 по Бродману. У кошек А, удобно расположена на боковой поверхности мозга, поэтому большинство комбинированных анатомо-физиологических исследований производится на этом виде100). Микроэлектродные исследования показали, что А, также имеет колончатую организацию, при которой все клетки, расположенные вдоль вертикального пути, имеют одну и ту же оптимальную частоту101)--103). Фактически A1 организована в виде изочастотных полос или пластин коры, идущих перпендикулярно к тонотопической оси.
Слуховая кора у обезьян содержит три полных кохлеотопических карты с параллельными проекциями из ядер медиального коленчатого тела на все эти области. Самая задняя из них соответствует первичной слуховой коре, как показано на основе ее гистологических свойств104). Эта центральная основа окружена вторичными слуховыми областями, кото-

Глава 18. Обработка соматосеисорных υ слуховых сигналов |
407 |
|
|
||||||||||
Рис. |
|
18.19. |
Латеральное |
|
|
|
|
|
|||||
торможение |
нейронов |
в |
|
|
|
|
|
||||||
слуховой коре. (А) Кривая |
|
|
|
|
|
||||||||
настройки |
|
для |
нейрона |
в |
|
|
|
|
|
||||
слуховой коре кошки (черная |
|
|
|
|
|
||||||||
линия). Оптимальная частота |
|
|
|
|
|
||||||||
примерно |
|
7 |
кГц. |
Для |
|
|
|
|
|
||||
сравнения, |
светлой |
линией |
|
|
|
|
|
||||||
показана |
|
более |
широкая |
|
|
|
|
|
|||||
кривая |
настройки |
волокна |
|
|
|
|
|
||||||
слухового нерва с той же |
|
|
|
|
|
||||||||
оптимальной частотой (см. |
|
|
|
|
|
||||||||
рис. 18.12). (В) Латеральное |
|
|
|
|
|
||||||||
торможение того же самого |
|
|
|
|
|
||||||||
коркового |
|
нейрона. |
Ответ |
|
|
|
|
|
|||||
возникает |
|
|
|
|
|
на |
|
|
|
|
|
||
продолжительный чистый тон |
|
|
|
|
|
||||||||
оптимальной |
|
частоты |
|
|
|
|
|
||||||
|
|
|
|
|
|||||||||
(показан |
кружком); |
|
затем |
|
Fig. 18.19. Lateral Inhibition of a Neuron in the Auditory Cortex. |
(A) Tuning curve for |
|
||||||
добавлен |
|
дополнительный |
|
|
|
|
|||||||
|
a neuron in the auditory cortex of a cat (black line). The best |
frequency is about 7 |
|||||||||||
тон, который тормозит ответ |
|
kHz. The light line shows, for comparison, the broader tuning |
curve of a mammalian |
||||||||||
на |
оптимальную |
частоту. |
|
auditory nerve fiber with the same best frequency (see Figure 18.12). (B) Lateral |
|||||||||
Кривые показывают звуковое |
|
inhibition of the same cortical neuron. A response is produced by a continuous tone |
|||||||||||
давление, |
|
которое |
|
должен |
|
at the best frequency (open circle); an additional tone is then added, which inhibits |
|||||||
иметь |
дополнительный |
тон |
|
the best-frequency response. Curves indicate the sound pressure required for the |
|||||||||
для |
того, |
чтобы уменьшить |
|
additional tone to reduce the response by 20%, thereby defining the area of surround |
|||||||||
ответ |
на |
20%, |
определяя, |
|
inhibition. .(After Arthur, Pfeiffer, and Suga, 1971.) |
|
|
|
|||||
таким |
образом, |
область |
|
|
|
|
|
||||||
окружающего торможения. |
|
|
|
|
|
|
|||||||
рые соединены не только с первичной корой, но также и с подразделами ядер медиального коленчатого тела. Таким образом, в слуховой коре происходит как последовательная, так и параллельная обработка105). Исследования с помощью электроэнцефалографического картирования и функционального магнитного резонанса представляют доказательства
подобной же организации слуховой коры у человека106, 107), и эта область коры активирована даже во время чтения по губам!108)
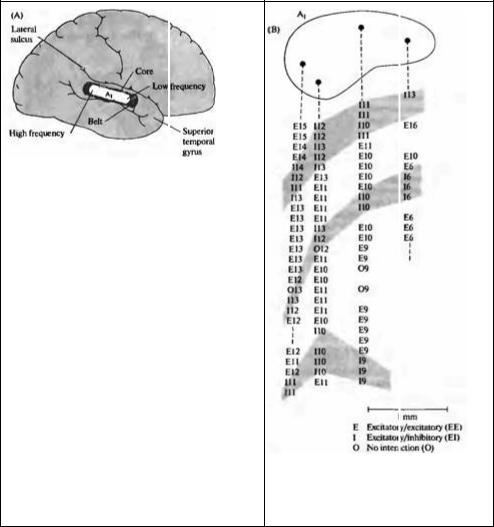
По аналогии с другими сенсорными участками коры можно ожидать, что кохлеотопическая карта А, будет подразделена на различные функциональные зоны. Если двигать электрод вдоль изочастотной полоски, большинство клеток либо возбуждаются звуком, воспринимаемым любым из ушей (ЕЕ), либо возбуждаются из одного уха и тормозятся из другого (EI) (рис. 18.20В). Эта бинауральная чувствительность закономерно меняется, и полагают, что ее значения образуют полосы, идущие под прямым углом к изочастотным контурам109). Существуют также некоторые доказательства закономерных изменений кодирования интенсивности и ширины полосы в A1110)--112). Организация ЕЕ—EI может быть выведена из бинауральных взаимодействий, которые сначала возникают в ядрах олив (см. следующий раздел), и приводит к предположению, что А, также картирована для слухового пространства, хотя в настоящее время это не доказано.
Обработка слуховых сигналов сложна113). Важные с точки зрения поведения звуки должны быть извлечены из обширного и многообразного акустического окружения114). Не только частотный состав, но также и временная последовательность входов должна быть проанализирована каким-то образом115) (например, проигрывание магнитофонной записи человеческой речи в обратную сторону воспринимается как тарабарщина). Кроме того, такая обработка у любого вида животных должна иметь дело не только с анализом окружающих звуков, но также со способами извлечения звука разными видами. У людей основные элементы речи, называемые фонемами, одинаковы для всех языков и являются звуками, которые первыми лопочут дети, прежде чем какие-то конкретные звуки будут выбраны, чтобы сочетать их в слова116). Базовые звуки могут быть проанализированы как комбинации частотно-временных отношений, например, продолжительный компонент на 1 000 Гц сопровождается вторым, частотно-модулированным компонентом, начинающимся с 5 000 Гц и быстро снижаю-
408 |
Раздел III. Интегративные механизмы |
Рис. 18.20. Слуховая кора. (А) Афференты от |
|
медиального коленчатого тела, проецированные на |
|
область верхней височной извилины мозга обезьяны, |
|
показаны здесь так, что боковая борозда развернута к |
|
поверхности. Центральная внутренняя область (А ) |
|
тонотопически картирована, обнаруживая низкие частоты |
|
в передних участках, а высокие — в задних. В |
|
близраслоложенной опоясывающей области обнаружены |
|
дополнительные тонотолические зоны. (В) С помощью |
|
последовательных тангенциальных проходов электродом |
|
вдоль изочастотных областей в At y кошки исследованы |
|
эффекты мензуральной и бинауральной подачи звуков. |
|
Для каждой встреченной клетки приведены результаты |
|
контралатерального звукового воздействия (Е = |
|
активация, I = торможение, 0 = отсутствие влияния) и |
|
оптимальная частота. Как и ожидалось, оптимальная |
|
частота была относительно постоянной для каждого |
|
прохода. Однако бинауральные стимулы выявляли |
|
выраженные кластеры клеток с усилением, ослаблением |
|
или отсутствием влияния на монауральные ответы. |
|
Fig. 18.20. Auditory Cortex. (A) Afférents from the medial |
|
gemculate nucleus project to a region of the superior temporal |
|
gyrus of the monkey brain, shown here as though the lateral |
|
sulcus were spread open. A central core region (A1) is |
|
tonotopically mapped, with low frequencies found anteriorly |
|
and high frequencies found posteriorly. Additional tonotopic |
|
areas are found in a surrounding belt region. (B) Successive |
As expected, the best frequency was relatively |
tangential electrode penetrations were made along |
|
isofrequency regions of Aj in a cat and the effects of binaural |
constant in any penetration. However, binaural |
versus monaural sound were examined. For each cell |
stimulation enhanced (E), inhibited (I), or left |
encountered, the effect of contralateral sound (E = excitatory; |
unchanged (0) the monaural response, and these |
I = inhibitory; 0 = no effect) and best frequency are listed. |
effects occurred in clusters. (B modified from |
|
Middlebrooks, Dykes, and Merzenich, 1980.) |
щимся до 500 Гц. Компоненты называются формантами.
По аналогии со зрительной системой, которая содержит клетки, распознающие разрезы, углы, края и другие геометрические формы (глава 20), мы могли бы ожидать, что обнаружим клетки высокого порядка в слуховой коре человека, которые реагируют на конкретные форманты, или, возможно, фонемы. Этот принцип, действительно, наблюдается у животных. Например, некоторые клетки в слуховой коре усатой летучей мыши реагируют на конкретные комбинации тонов постоянной и модулируемой частот, которые эквивалентны собственным звукам летучей мыши117). В то же время, мы могли бы ожидать, что напрасно будет искать клетки, отвечающие за человеческие звуковые элементы в слуховой системе летучей мыши или других млекопитающих. Такие клетки высокого порядка, однако, все же обнаружены у птицы рода Mynah, которых обучают говорить118). Кортикальные механизмы языкового кодирования могут быть обнаружены у таких видов,
Глава 18. Обработка соматосенсорных υ слуховых сигналов |
409 |
|
|
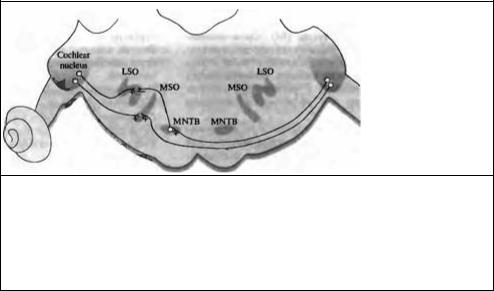
Рис. 18.21. Бинауральные связи в оливарном комплексе. Нейроны вентрального кохлеарного ядра проецированы ипсилатерально в боковую верхнюю оливу (LSO), но контралатерально в среднее ядро трапециевидного тела (ΜΝΤΒ) и в среднюю верхнюю оливу (MSO) Таким образом, нейроны MSO возбуждаются от обоих ушей, а нейроны LSO возбуждаются ипсилатерально, но тормозятся контралатерально за счет вмешательства тормозных интернейронов, расположенных в ΜΝΤΒ
Fig. 18.21. Binaural Connections in the Olivary Complex. Neurons in the ventral cochlear nucleus project to the ipsilateral lateral superior olive (LSO) but to the contracterai medial nucleus of the trapezoid body (MNTB) and the contralateral medial superior olive (MSO). Thus, MSO neurons are excited by both ears, and LSO neurons are excited ipsilaterally but inhibited contralaterally by way of the intervening inhibitory interneuron in the MNTB.
как мармозетки, которые используют ограниченный и стереотипный набор призывов («слов») для общения96).
Локализация звука
Чрезвычайная чувствительность и частотная избирательность слуховой системы была представлена у животных задолго до того, как развилась человеческая речь. В значительной степени тонкости слуховой системы возникли, чтобы улучшить способность организма определять местоположение звука в пространстве. Преимущества этого очевидны: сигналы, передающиеся на большие расстояния как звуковые волны, могут помочь обнаружить хищника или жертву при отсутствии зрительной и другой информации. Однако, в отличие от зрительной или соматосенсорной систем, звуковой нейроэпителий не может быть использован для кодирования места (локации), поскольку он приспособлен для тонотопического картирования. Вместо этого направление звука вычисляется на основе бинаурального сравнения временного хода и интенсивности сигналов, которое производится в центральной слуховой системе. Слуховой проводящий путь, поэтому, сложен и включает в себя многочисленные подкорковые синаптические переключения и многочисленные перекрещивания почти на каждом уровне.
Дорзальное кохлеарное ядро в основном предназначено для мензурального частотного анализа119) и обеспечивает относительно прямую, тонотопически организованную проекцию на контралатеральную область А1. Напротив, нейроны второго порядка в вентральном кохлеарном ядре проецируются как ипсилатерально, так и контралатерально на комплекс верхних олив в стволе мозга. Большинство нейронов в медиальной верхней оливе (MSO) возбуждаются стимуляцией любого из ушей (и, таким образом, соотносятся с ЕЕ-нейронами, см. рис. 18.21), но реагируют лучше всего, когда тон подается на оба уха с характерной задержкой, соответствующей достижению сначала одного уха, потом другого. Скорость звука в воздухе составляет 340 м/с, так что максимальная временная разница, создаваемая человеческой головой (около 18 см в диаметре), составляет 0,5 мс для звука, приходящего вдоль оси между обоими ушами, и значительно меньшие задержки для звуков, приходящих спереди. В дополнение к разнице во времени прибытия, постоянный источник звука вызывает фазовый сдвиг между двумя ушами.
Клетки латеральной верхней оливы (LSO) получают возбуждение ипсилатерального вентрального кохлеарного ядра (рис. 18.21). Клетки в контралатеральном вентральном кохлеарном ядре проецируются на противоположную сторону и образуют синапсы на медиальном ядре трапециевидного тела (MNTB). Клетки MNTB тормозят нейроны в LSO.
410 |
Раздел III. Интегративные механизмы |
Таким образом, нейроны в LSO возбуждаются ипсилатеральным и подавляются контралатеральным звуком (El). Такое взаимодействие может быть полезным для выявления различий в интенсивности звука в двух ушах. На высоких частотах обнаруживается 10-кратная разница в частоте, для которой голова служит как эффективное затенение звука.
Различия как по фазе, так и по интенсивности изменяются как функция частоты. Для головы человека разница по фазе значительна на частотах ниже 2 кГц, тогда как отличия по интенсивности становятся более существенными на более высоких частотах. Психофизические исследования показали, что локализация осуществляется сопоставлением различий между двумя ушами по времени прихода сигнала и/или интенсивности входящего звука120, 121). Таким образом, если подаются щелчки через наушники с различными задержками, звук локализуется по направлению к уху, к которому он приходит раньше. Если щелчки подаются одновременно, но с разной интенсивностью, то звук локализуется с той стороны, где щелчок громче. Фактически сигналы локализации зависят в точности от частотного содержания. Голова и внешнее ухо отфильтровывают специфические компоненты частоты, в зависимости от места в пространстве, откуда исходит звук122). Эти спектральные метки являются важными сигналами, которые используются для локализации звука123, 124). Люди могут различать интерау ральную временную разницу всего в 5 мкс — очень высокое разрешение, если учесть, что длительность потенциала действия составляет примерно 1 мс; это показывает важность точной временной организации для слуховых функций.
Выводы
·Соматосенсорные рецепторы в коже отвечают на разнообразные стимулы, такие как прикосновение, давление, вибрация и перемена температуры. Рецепторы различаются по скорости адаптации и по размеру рецептивного поля.
·Адаптация сенсорных ответов зависит от механических свойств вспомогательных структур и от изменений в возбудимости. Быстро адаптирующиеся рецепторы «настроены» на более высокочастотную стимуляцию.
·Центральные соматосенсорные проводящие пути соматотопически картированы. Соматотопическая карта коры подразделена на функциональные области, отражающие специфичность стимула периферических рецепторов.
·Рецептивные поля нейронов в соматосенсорной коре организованы по принципу «центр — окружение».
·Механическая настройка базилярной мембраны у млекопитающих обеспечивает частотную избирательность ответов слуховых афферентов. Потенциалзависимая подвижность внешних волосковых клеток вносит вклад в акустическую чувствительность улитки млекопитающих.
·Электрическая настройка обеспечивает избирательность волосковых клеток низших позвоночных. Взаимодействие потенциалзависимых кальциевых каналов с кальцийактивируемыми калиевыми каналами приводит к усилению ответа мембранного потенциала на частоте, равной характеристической частоте звука для каждой волосковой клетки.
·Волосковые клетки улитки подвергаются эфферентному торможению холинергическими нейронами ствола мозга. Эфферентное торможение изменяет чувствительность и настройку афферентов улитки.
·Центральные слуховые проводящие пути, включая кору, тонотопически картированы. Свойства ответов клеток в слуховой коре сложны и включают бинауральные взаимодействия и зависимость от временных комбинаций тонов.
·Бинауральные комбинации интенсивности и временных параметров звука используются для того, чтобы вычислять местоположение источника звука в пространстве. Эти вычисления выполняются синаптическими связями в ядрах верхней оливы.

Глава 18. Обработка соматосенсорных и слуховых сигналов |
411 |
Рекомендуемая литература
Обзоры
оFettiplace, R., and Fuchs, P. A. 1999. Mechanisms of hair cell tuning. Anna. Kev. Physiol. 61: 809-834.
A. 1999. Mechanisms of hair cell tuning. Anna. Kev. Physiol. 61: 809-834.
оKaas, J. H., Hackeit, Т.Д., and Tramo, M.J. 1999. Auditory processing in primate cerebral cortex. Curr. Opin. Neurobiol. 9: 164-170.
оMountcastle, V. B. 1995. The parietal system and some higher brain functions. Cerebral Cortex 5: 377-390.
оMountcastle, V. B. 1997. The columnar organization of the neocortex. Brain 120: 701-722.
оPatuzzi, R. 19%. Cochlear micromechanics and macromechanics. In P. Dallos, A. N. Popper, and R. R. Fay (eds.), The Cochlea. Springer, New York, pp. 186-257.
оPeri, E. R. 1996. Cutaneous polymodal receptors: Characteristics and plasticity. Prog. Brain Res. 113: 21-37.
оvon Bekesy, G. I960. Experiments in Hearing. McGraw-Hill, New York.
оWillis, W. D., and Westlund, K. N. 1997. Neu-roanatomy of the pain system and of the pathways that modulate
pain. J. Clin. Neurophysiol. 14: 2-31.
Статьи
оArt, J. J., and Fettiplace, R. 1987. Variation of membrane properties in hair cells isolated from the turtle cochlea. /. Physiol. 385: 207-242.
оArt, J.J., Fettiplace, R., and Fuchs, P. A. 1984. Synaptic hyperpolansation and inhibition of turtle cochlea hair cells. J. Physiol. 356: 525-550.
A. 1984. Synaptic hyperpolansation and inhibition of turtle cochlea hair cells. J. Physiol. 356: 525-550.
оAshmore, J. F. 1987. A fast motile response in guinea-pig outer hair cells: The cellular basis of the cochlear amplifier. J. Physiol. 388: 323-347.
оCrawford, A. C, and Fettiplace, R. 1981. An electrical tuning mechanism in turtle cochlear hair cells. J. Physiol. 312: 377-412.
оHarris, J.A., Petersen, R. S., and Diamond, M. 1999. Proc. Natl. Acad. Sci. USA 96: 7587-7591.
оHudspeth, A. J., and Lewis, R. S. 1988. Kinetic analysis of voltageand ion-dependent conductances in saccular hair cells of the bull-frog, Rana catesbeiana. У. Physiol. 400: 237-274.
оJohansson, R.S.. and Vallbo, A. B. 1979. Detection of tactile stimuli. Thresholds of afferent units related to psychophysical thresholds in the human hand. У. Physiol. 297: 405-422.
оMiddlebrooks, J. C., Dykes, R. W., and Merzenich, M. M. 1980. Binaural response-specific bands in primary auditory cortex (AI) of the cat: Topographical organization orthogonal to isofrequency contours. Brain Res. 181: 31-48.
оMountcastle, V.B. 1957. Modality and topographic properties of single neurons of cat's somatic sensory cortex.
J. Neurophysiol. 20: 408-434.
оNelken, I., Rotman, Y, and Bar Yosef, O. 1999. Responses of auditory cortex neurons to structural features of natural sounds. Nature 397: 154-157.
оPons, T. P., Garraghty, P. E., and Mishkin, M. 1987. Physiological evidence for serial processing in somatosensory cortex. Science 237: 417-420.
оWinslow, R.L., and Sachs, M.B. 1987. Effect of electrical stimulation of the crossed olivocochlear bundle on auditory nerve response to tones in noise. /. Neurophysiol. 57: 1002-1021.
Цитированная литература
1.Johansson, R. S., and Vallbo, A. B. 1979. J. Physiol. 297: 405-422.
2.Vallbo, А. В., and Hagbarth, K.-E. 1968. Exp. Neural. 21: 270-289.
3.Iggo, A. 1974. In The Peripheral Nervous System. Plenum, New York, pp. 347-404.
4.LaMotte, R. H., and Mountcastle, V. B. 1975. У. Neurophysiol. 38: 539-559.
5.Johnson, K. O., Hsiao, S. S., and Twombly, I. A. 1995. In The Cognitive Sciences. MIT Press, Cambridge, MA, pp. 253-268.
6.Hsiao, S. S., Johnson, K. O., and Twombly, I. A. 1993. Ado Psychol. (Amst.) 84: 53-67.
A. 1993. Ado Psychol. (Amst.) 84: 53-67.
7.Brisben, A. J., Hsiao, S. S., and Johnson, K. O. 1999. J. Neurophysiol. 81: 1548-1558.
8.Penfield, W., and Rasmussen, T. 1950. The Cerebral Cortex of Man: A Clinical Study ofLocaliiation of Function. Macmillan, New York.
Man: A Clinical Study ofLocaliiation of Function. Macmillan, New York.
9.Woolsey, C.N. 1958. In The Biological and Biochemical Bases of Behavior. University of Wisconsin Press, Madison, p. 63-82.
10.Rasmusson, D. D. 1982. J. Сотр. Neural. 205: 313-326.
11.Krubitzer, L., et al. 1995. J. Сотр. Neural. 351: 261-306.
12.Elbert, T., et al. 1995. Science 270: 305-307.
13.Xerri, C., et al. 1999. Cerebral Cortex 9: 264-276. 14: Mountcastle, V. B. 1957. / Neurophysiol. 20:
408-434.
15. Powell, T. P. S., and Mountcasile, V. B. 1959. Bull. Johns Hopkins Hasp. 105: 133-162.

412 |
Раздел III. |
Интегративные |
|
механизмы |
16.Mountcastle, V. В. 1997. Brain 120: 701-722.
17.Tanji, J., and Wise, S. P. 1981. J. Neurophys. 45: 467-481.
18.Woolsey, Т.Д., and Van der Loos, H. 1970. Broin Res. 17: 205-242.
19.Van der Loos, H., and Woolsey, T. A. 1973. Science 179: 395-398.
20.Bina, К. G., Park, M., and O'Dowd, D. K. 1998. J. Сотр. Neural. 397: 1-9.
G., Park, M., and O'Dowd, D. K. 1998. J. Сотр. Neural. 397: 1-9.
21.Gierdalski, M., et al. 1999. Brain Res. Mol. Brain Res.7l: 111-119.
22.Welker, C. 1976. У. Сотр. Neural. 166: 173-190.
23.Simons, D. J., and Woolsey, Т.Д. 1979. Brain Res. 165: 327-332.
24.Harris, J. A., Petersen, R. S., and Diamond, M. 1999. Proc. Nail. Acad. Sci. USA 96: 7587-7591.
25.Iwamura, U., et al. 1993. Exp. Brain Res. 92: 360-368.
U., et al. 1993. Exp. Brain Res. 92: 360-368.
26.Kaas, J. H. 1993. Ann. Anal. 175: 509-518.
27.Pons, T. P., Garraghty, P. E., and Mishkin, M. 1987. Science 237: 417-420.
28.Pons, T. P., Garraghty, P. E., and Mishkin, M. 1992. J. Neurophysiol. 68: 518-527.
29.Turman, А. В., et al. 1992. J. Neurophysiol. 67: 411-429.
30.Jiang, W., Tremblay, F., and Chapman, С. Е. 1997. У. Neurophysiol. 77: 1656-1662.
31.Whitsel, B.L., Petrucelli, L.M., and Werner, G. 1969. J. Neurophysiol. 32: 170-183.
32.Perl, E.R. 1996. Prog. Brain Res. 113: 21-37.
33.Collins, W. E, Jr., Nelson, E E., and Rajidt, C.T. 1960. Arch. Neural. 3: 381-385.
34.Konietzny, E, et al. 1981. Exp. Brain Res. 42: 219-222.
35.Torebjork, H. E., and Hallin, R.G. 1973. Exp. Brain Res. 16: 321-332.
36.Ochoa, J., and Torebjork, E. 1989. J. Physiol. 415: 583-599.
37.von Econome, G., and Koskinas, G. N. 1925. Die Cytoarchitecktonik der Himrinde des envachsenen Menschen. Julius Springer, Heidelberg.
38.Willis, W. D., and Westlund, K.N. 1997. У. Clin. Neurophysiol. 14: 2—31.
39.Poggio, G. E, and Mountcastle, V. B. 1960. Bull. Johns Hopkins Hasp. 106: 266-316.
40.Melzack, R., and Wall, P.D. 1965. Science 150: 971-979.
41.Hughes, J. (éd.). 1983. Br. Med. Bull. 39: 1-106.
42.Basbaum, A. I., and Fields, H. L. 1979. J. Сотр. Neural. 187: 513-522.
43.Fields, H. L., and Besson, J-M. (eds.). Pain Modulation Issue. 1988. Prog. Brain Res. 77.
44.Fields, H. L. 1987. Pain. McGraw-Hill, New York.
York.
45.Fields, H. L., and Basbaum, A. I. 1978. Anna. Rev. Physiol. 40: 217-248.
46.Huxley, A. 1928. Point Counter Point. Harper Collins, New York, Chapter 3.
47.Bosher, S. K., and Warrren, R. L. 1978. Nature 273: 377-378.
48.Anniko, M., and Wroblewski, R. 1986. Hear. Res. 22: 279-293.
49. Spoendlin, H. 1972. A da Otolaryngol. 73: 235-248.
50.Kiang, N. Y, et al. 1982. Science 217: 175-177.
51.Brown, M. C. 1987. J. Сотр. Neural. 260: 591-604.
52.Warr, W. B. 1975. J. Сотр. Neural. 161: 159-182.
53.von Bekesy, G. 1960. Experiments in Hearing. McGraw-Hill, New York.
54.Rasmussen. C. L. 1946. У. Сотр. Neural. 84: 141-220.
55.Galambos, R. 1956. J. Neurophysiol. 19:424-437.
56.Jasser, A., and Guth, P. S. 1973. /. Neurochem. 20: 45-53.
57.Winslow, R. L., and Sachs, M. B. 1987. /. Neurophysiol. 57: 1002-1021.
58.Liberman, M. C. 1988. /. Neurophysiol. 60: 1779-1798.
59.Robertson, D., Anderson, C-J., and Cole, K. S. 1987. Hear. Res. 25: 69-76.
60.Liberman, M.C., and Brown, M.C. 1986. Hear. Res. 24: 17-36.
61.Wiederhold, M. L, and Kiang, N. Y. S. 1970 У Acousl. Soc. Am. 48: 950-965.
62.Rajan, R. 1995. /. Neurophysiol. 74: 598-615.
63.Maison, S. E and Liberman, M. C. 2000. /. Neu-rosci. 20:4701-4707.
64.Art, J.J., Fettiplace, R., and Fuchs, PA. 1984. J. Physiol. 356: 525-550.
65.Art, J.J., et al. 1985. J. Physiol. 360: 397-421.
66.Fuchs, P. A., and Murrow, B. W. 1992. J. Neurosci. 12: 800-809.
67.Martin, A. R., and Fuchs, PA. 1992. Proc. R. Soc. Land, β 250: 71-76.
68.Housley, G., and Ashmore, J. 1991. Proc. R. Soc. Land. В 244: 161-167.
69.Blanchet, C., et al. 1996. У. Neurosci. 16: 2574-2584.
70.Evans, M. I996. У. Physiol. 491: 563-578.
71.Elgoyhen, А. В., et al. 1994. Cell 79: 705-715.
72.Glowatzki, E., et aL 1995. Proc. R. Soc. land. B 262: 141-147.
1995. Proc. R. Soc. land. B 262: 141-147.
73.Park, H-J., Niedzielski, A. S., and Wenthold, R. J. 1997. Hear. Res. 112: 95-105.
74.Brownell, W. E., et al. 1985. Science 227:194-196.
75.Ashmore, J. F. 1987. У. Physiol. 388: 323-347.
76.Hallworth, R., Evans, B.N., and Dallos, P. 1993. У. Neurophysiol. 70: 549-558.
77.Geleoc, G. S., et al. 1999. Nature Neurosci. ï. 713-719.
78.Zheng, J., et al. 2000. Nature 405: 149-55.
79.Patuzzi, R. 1996. In The Cochlea. Springer, New York, p. 186-257.
