
Nikolls_-_Ot_neyrona_k_mozgu
.pdf
Глава 21. Функциональная архитектура зрительной коры |
483 |
Рекомендуемая литература
Обзоры
« Callaway, Ε. Μ. 1998. Local circuits in primary visual cortex of the macaque monkey. Anna Kev. Neunsci. 21: 47-74.
оCasagrande, V. A. 1994. A third parallel visual pathway to primate area VI. Trends Neurosci. 17: 305-310.
оCourtney, S. M., and Ungerleider, L. G. 1997. What fMRI has taught us about human vision. Curr. Opin. Neurobiol. 7: 554-561.
оHubel, D. H. 1988. Eye, Brain and Vision. Scientific American Library, New York.
оHubel, D. H., and Wiesel, T. N. 1977. Functional architecture of macaque monkey visual cortex (Ferrier Lecture). Proc. R. Soc. Land. В 198: 1-59.
оKomatsu, H. 1998. Mechanisms of central color vision. Curr. Opin. Neurobiol. 8: 503-508.
оMerigan, W. H., and Maunsell, J. H. R. 1993. How parallel are the primate visual pathways? Anna. Rev. Neurosci. 16: 369-402.
оNewsome, W. T., and Wurlz, R. H. 1988. Probing visual cortical function with discrete chemical lesions. Trends Neunsci. 11: 394-400.
оTootell, R. В., Dale, A. M., Sereno, M. I., and Malach, R. 1996. New images from human visual cortex. Trends Neurosci. 19: 481-489.
оZeki, S. 1990. Colour vision and functional specialisation in the visual cortex. Disc. Neurosci. 6: 1-64.
Статьи
оGilbert, C. D., and Wiesel, T. N. 1989. Columnar specificity of intrinsic horizontal and corticocortical connections in cat visual cortetx. J. Neurosci. 9: 2432-2442.
оGroh, J. M., Born, R. T., and Newsome, W.T. 1997. How is a sensory map read out? Effects of microstimulation in visual area MT on saccades and smooth pursuit eye movements. /. Neurosci. 17: 4312-4330.
оHubel, D. H., and Wiesel, T. N. 1962. Receptive fields, binocular interaction and functional architecture in the cat's visual cortex. J. Physiol. 160: 106-154.
оHubener, M., Shoham, D., Grinvald, A., and Bonhoeffer, T. 1997. Spatial relationships among three columnar systems in cat area 17. J. Neurosci. 17: 9270-9284.
оKanwisher, N., McDermott, J., and Chun, M. M. 1997. The fusiform face area: A module in human extrastnate cortex specialized for face perception. J. Neurosci. 17: 4302-4311.
оLand, E. H. 1983. Recent advances in retinex theory and some implications for cortical computations: Color vision and the natural image. Proc Natl. Acad. Sci. USA 80: 5163-5169.
оLivingstone, M.S., and Hubel, D.H. 1987. Connections between layer 4B of area 17 and the thick cytochrome oxidase stripes of area 18 in the squirrel monkey. /. Neurosci. 7: 3371-3377.
оZeki, S., Watson, J. D., Lueck, C. J., Friston, K.J., Kennard, C, and Frackowiack, R.S. 1991. A direct demonstration of functional specialization in human visual cortex. /. Neurosci. 11: 641-649.
Цитированная литература
1.Hubel, D. H., and Wiesel, T. N. 1963. J. Physiol. 165: 559-568.
2.Hubel, D. H., and Wiesel, T. N. 1974. /. Сотр. Neural. 158: 267-294.
3.Grinvald, A., et al. 1986. Nature 324: 361-364.
4.Ts'o, D. Y., et al. 1990. Science 249: 417-420.
5.Blasdel, G. G. 1989. Annu. Kev. Physiol. 51: 561-581.
6.Sokoloff, L. 1977. J. Neurochem. 29: 13-26.
7.Bonhoeffer, T., and Grinvald, A. 1991. Nature 353: 429-431.
8.Swindale, N.V., Matsubara, J.A., and Cynader, M.S. 1987. J. Neurosci. 7: 1414-1427.
9.Coppola, D. M., et al. 1998. Proc. Natl. Acad. Sci. USA 95: 2621-2623.
10.Linsker, R. 1989. Proc. Natl. Acad. Sci. USA 83: 8779-8783.
11.Hubener, M., et al. 1997. J. Neurosci. 17: 9270-9284.
12.Blasdel, G. G., Obermayer, K., and Kiorpes, L.
1995. Vis. Neurosci. 12: 589-603.
13.Crair, M. C, et al. 1997. /. Neurophysiol. 77: 3381-3385.
14.Lôwel, S., et al. 1998. Eur. J. Neurosci. 10: 2629-2643.
15.Obermayer, K., and Blasdel, G. G. 1993. J. Neurosci. 13:4114-4129.
G. 1993. J. Neurosci. 13:4114-4129.
16.Weliky, M., Bosking, W. H., and Fitzpatrick, D.
1996. Nature 379: 725-728.
17.Tootell, R. В., Silverman, M. S., and De Valois, R. 1981. Science 214: 813-815.
18.LeVay, S., and Voight, T. 1988. Vis. Neurosci. 1: 395-414.
19.Hubel, D.H., and Wiesel, T.N. 1972. /. Сотр. Neural. 146:421-450.
20.Fitzpatrick, D., Lund, J. S., and Blasdel, G. G. 1985. /. Neurosci. 5: 3329-3349.
21.Sclar, G., Maunsell, J. H. R., and Lennie, P. 1990. Vision Res. 30: 1-10.

484 |
Раздел III. Интегративные механизмы |
22.Lachica, Ε. Α., and Casagrande, V.A. 1992. /. Сотр. Neurol. 319: 141-158.
Α., and Casagrande, V.A. 1992. /. Сотр. Neurol. 319: 141-158.
23.Komatsu, H. 1998. Curr. Opin. Neurobiol. 8: 503-508.
24.Wong-Riley, M. 1989. Trends Neurosci. 12: 94-101.
25.Zheng, D., LaMantia, A. S., and Purves, D. 1991. J. Neurosci. 11: 2622-2629.
26.Livingstone, M. S., and Hubel, D. H. 1984. J. Neurosci. 4: 309-356.
27.Hendrickson, A. E. 1985. Trends Neurosci. 8: 406-410.
28.Ts'o, D.Y., and Gilbert, C.D. 1988. J. Neurosci. 8: 1712-1727.
29.Livingstone, M.S., and Hubel, D. 1988. Science 240: 740-749.
30.Yabuta, N. H., and Callaway, E. M. 1998. J. Neurosci. 18: 9489-9499.
31.Merigan, W. H., and Maunsell, J. H. R. 1993. Annu. Rev. Neurosci. 16: 369-402.
32.Olavarria, J. F., and Van Essen, D. C. 1997. Cerebral Cortex 7: 395-404.
33.Livingstone, M. S., and Hubel, D. H. 1987. /. Neurosci. 7: 3371-3377.
34.DeYoe, E.A., et al. 1990. Vis. Neurosci. 5: 67-81.
35.Grusser, O.J., and Landis, T. 1991. Visual Agnosias. Voi. 12 of Vision and Visual Dysfunction. CRC, Boca Raton, FL.
36.Ungerleider, L. G., and Mishkin, M. 1982. In The Analysis of Visual Behavior. MIT Press, Cambridge, MA, pp. 549-586.
37.Maunsell, J. H., and Newsome, W. T. 1987. Annu. Rev. Neurosci. 10: 363-401.
38.Zekl, S. M. 1974. /. Physioi. 236: 549-573.
39.Maunsell, J. H. R., and Van Essen, D. C. 1983. /. Neurophysiol. 49: 1127-1147.
40.Albright, Т.О. 1984. J.Neurophysiol. 52: 1106-1130.
41.Malonek, D., Tootell, R. B. H., and Grinvald, A. 1994. Proc. R. Soc. Land. В 258: 109-119.
42.Newsome, W.T., and Pare, E. B. 1988. /. Neurosci. 8:2201-2211.
43.Dursteler, R. M., Wurtz, R. H., and Newsome, W.T. 1987. J. Neurophysiol. 57: 1262-1287.
44.Groh, J. M., Born, R. T., and Newsome, W. T. 1997. /. Neurosci. 17: 4312-4330.
45.Robinson, D. A., and Fuchs, A. F. 1969. J. Neurophysiol. 32: 637-648.
46.Wiesel, T.N., and Hubel, D. H. 1966. J. Neurophysiol. 29: 1115-1156.
47.Zeki, S. 1990. Disc. Neurosci. 6: 1-64.
48.Zeki, S., et al. 1991. J. Neurosci. 11: 641-649.
49.Takechi, H., et al. 1997. Neurosci. Lett. 230: 17-20.
50.Sakai, K., et al. 1995. Proc. R.Soc. Land. В 261: 89-98.
51.Cowey, A., and Heywood, C. A. 1995. Behav. Brain Res. 71: 89-100.
52.Heywood, C.A., Kentridge, R. W., and Cowey, A. 1998. Exp. Brain Res. 123: 145-153.
53.Pearlman, A. L., Birch, J., and Meadows, J. C. 1979. Ann. Neurol. 5: 253-261.
54.Leonards, U, and Singer, W. 1997. Vision Res. 37: 1129-1140.
55.Barbur, J. L., Harlow, A. J., and Plant, G.T. 1994. Proc. R.Soc. Land. В 258: 327-334.
56.Hubel, D. H. 1988. Eye, Brain and Vision. Scientific American Library, New York.
57.Livingstone, M. S., and Hubel, D. H. 1987. /. Neurosci. 7: 3416-3468.
58.Helmholtz, H. von. 1962/1927. Helmholtz's Treatise on Physiological Optics. Dover, New York
59.Land, E.H. 1986. Vision ties. 26: 7-21.
60.Land, E. H. 1986. Proc. Natl. Acad. Sci. USA 83: 3078-3080.
61.Land, E. H. 1983. Proc. Natl. Acad. Sci. USA 80: 5163-5169.
62.Daw, N.W. 1984. Trends Neurosci. 7: 330-335.
63.Daw, N.W. 1968. /. Physioi. 197: 567-592.
64.Hubel, D. H., and Livingstone, M. S. 1987. J. Neurosci. T. 3378-3415.
Neurosci. T. 3378-3415.
65.Hubel, D. H., and Livingstone, M. S. 1990. J. Neurosci. 10: 2223-2237.
66. Tootell, R. В., et al. 1988. J. Neurosci. 8: 1569-1593.
67.Lennie, P., Krauskopf, J., and Sclar, G. 1990. J. Neurosci. 10:649-669.
Neurosci. 10:649-669.
68.Yoshioka, T., Dow, B. M., and Vauiin, R. G. 19%. Behav. Brain Res. 76: 51-70.
69.Lachica, E.A., Beck, P. D., and Casagrande, V.A. 1992. Proc. Natl. Acad. Sci. USA 89: 3566-3570.
70.Sawatari, A., and Callaway, E. M. 19%. Nature 380: 442-446.
71.Gilbert, C. D., and Wiesel, T. N. 1979. Nature 280: 120-125.
72.Gilbert, C. D., and Wiesel, T. N. 1983. /. Neurosci. 3: 1116-1133.
73.Gilbert, C. D., and Wiesel, T. N. 1989. /. Neurosci. 9: 2432-2442.
74.Katz, L. C., Gilbert, C. D., and Wiesel, T. N. 1989. J. Neurosci. 9: 1389-1399.
Neurosci. 9: 1389-1399.
75.Callaway, E. M., and Wiser, A. K. 1996. Vis. Neurosci. 13: 907-922.
76.Bosking, W. H., et al. 1997. /. Neurosci. 17: 2112-2127.
77.Kisvardy, Z. F, et al. 1997. Cerebral Cortex T. 605-618.
78.Schmidt, K. E., et al. 1997. J. Neurosci. 17: 5480-5492.
79.Ts'o, D. Y, Gilbert, C. D., and Wiesel, T. N. 1986. J. Neurosci. 6: 1160-1170.
80.Gray, C. M., et al. 1989. Nature 338: 334-337.
81.Schwarz, C., and Bolz, J. 1991. J. Neurosci. 11: 2995-3007.

Глава 21. |
Функциональная архитектура зрительной |
|
норы |
485 |
82.Hubel, D. H., and Wiesel, T. N. 1962. J. Physioi. 160: 106-154.
83.Hubel, D. H., and Wiesel, T. N. 1959. /. Physioi. 148: 574-591.
84.Barlow, H. В., Blakemore, C., and Pettigrew, J. D. 1967. J. Physioi. 193: 327-342.
Physioi. 193: 327-342.
85.Fischer, В., and Poggio, G. F. 1979. Proc. R. Soc. Land. В 204: 409-414.
86.Ferster, D. 1981. J. Physioi. 311: 623-655.
Physioi. 311: 623-655.
87.Masson, O.S., Busettini, C, and Miles, F.A. 1997. Nature 389: 283-286.
88.DeAngelis, G. C, Gumming, B. G., and New-some, W.T. 1998. Nature 394: 677-680.
89.Hubel, D. H., and Wiesel, T. N. 1967. /. Neuro-physiol. 30: 1561-1573.
90.Hering, E. 1986. Outline of a Theory of the Light Sense. Harvard University Press, Cambridge, MA.
91.Schiller, P. H., and Lee, K. 1991. Science 251: 1251-1253.
92.Fox, P. T., and Raichle, M.E. 1986. Proc. Nail. Acad. Sci. USA 83: 1140-1144.
T., and Raichle, M.E. 1986. Proc. Nail. Acad. Sci. USA 83: 1140-1144.
93.Sereno, M. I., et al. 1995. Science 268: 889-893.
94.DeYoe, E.A., et al. 19%. Proc. Nail. Acad. Sci. USA 93: 2382-2386.
95.Tootell, R. В., et al. 1996. Trends Neurosci. 19: 481-489.
96.Courtney, S. M., and Ungerleider, L. G. 1997. Curr. Opin. Neurobiol. 7: 554-561.
97.Martin, A., et al. 1995. Science 270: 102-105.
98.Watson, J. D., et al. 1993. Cerebral Cortex 3: 79-94.
99.Tootell, R. В., et al. 1995. J. Neurosci. 15: 3215-3230.
100.Eden, G. F, et al. 1996. Nature 382: 66-69.
101.Livingstone, M. S., et al. 1991. Proc. Noli. Acad. Sci. USA 88: 7943-7947.
102.Damasio, A. R., Tranel, D., and Damasio, H. 1990. Annu. Rev. Neurosci. 13: 89-109.
103.Kanwisher, N., McDermott, J., and Chun, M. M. 1997. /. Neurosci. 17: 4302-4311.
104.Sperry, R.W. 1970. Proc. Res. Assoc. Nerv. Ment. Dis. 48: 123-138.
105.Gazzaniga, M.S. 2000. Brain 123: 1293-1326.
106.Gazzaniga, M.S. 1989. Science 245: 947-952.
107.Shatz, C. J. 1977. J.Comp. Neural. 173: 497-518.
108.Berlucchi, G., and Rizzolatti, G. 1968. Science 159: 308-310.
109.Farah, M. J. 1990. Visual Agnosia. MIT Press, Cambridge, MA.
110.De Renzi, E. 1997. Prosopagnosia. In Behavioral Neurology and Neuropsychology. McGraw-Hill, New York, pp. 245-255.
111.Pallis, C. A. 1955. J. Neural. Neurosurg. Psychiatry 18: 218-224.
A. 1955. J. Neural. Neurosurg. Psychiatry 18: 218-224.
112.Meadows, J. C. 1974. J. Neural. Neurosurg. Psychiatry 37: 489-501.
113.Puce, A., et al. \996.J.Neurosci. 16:5205-5215.
114.Damasio, A. R., and Damasio, H. 1983. Neurology 33: 1573-1583.
115.Gauthier, 1., et al. 2000. Nature Neurosci. 3: 191-197.
Глава 22. Клеточные механизмы двигательного контроля
Так же как в сенсорных системах, нейрональная организация двигательного контроля является иерархической, с интеграцией простых элементов в более комплексные системы нейронов. Сенсорные системы и двигательные команды более высокого порядка сходятся на «общем конечном пути», каким является спинальный мотонейрон, контролирующий скелетные мышцы. Один из входов на мотонейрон представляет собой путь, идущий от мышечных рецепторов растяжения (афференты группы la). Каждый la афферент дивергирует для обеспечения контакта со всеми мотонейронами, которые иннервируют данную мышцу. Эффект одиночного импульса Ia афферента достаточно слабый, однако суммарное влияние от афферентов может значительно возрастать благодаря временной или пространственной суммации.
Спинальные интернейроны участвуют в рефлексах, которые направлены на координированное движение конечностей. Это свидетельствует о сложных программах, которые закодированы в нейронных сетях спинного мозга. Предназначение сенсорных систем заключается в адаптации двигательных программ к изменяющимся условиям внешней среды. Двигательный аппарат спинного мозга имеет медиальный компонент, контролирующий мышцы туловища и проксимальную группу мышц конечностей. Эти мышцы важны для сохранения осанки, ходьбы и дыхания. Латеральный компонент двигательного контроля отвечает за дистальные мышцы конечностей, которые обеспечивают тонкие произвольные движения.
Двигательная кора организована соматотопически. Корковые нейроны возбуждаются пропорционально силе сокращения мышцы или малой группы мышц, контролирующих движение в каждом конкретном суставе. Направление движения закодировано вовлечением определенных нейронов двигательной коры. Сенсомоторная интеграция происходит в ассоциативных зонах коры, таких как премоторная и париетальная кора.
Мозжечок выполняет функцию дополнительного сенсомоторного интегратора. Нарушения функции мозжечка проявляются в потере координации и баланса, хотя и не приводят к заметным изменениям в чувствительной сфере. Базальные ганглии формируют нейронную сеть, отвечающую за механизмы обратной связи. Патология базальных ганглиев проявляется в возникновении спонтанных ошибочных сигналов к мышцам, в ограничении произвольных движений.
Для того, чтобы пиявка или рыба могла плыть, сова или кошка могла поймать мышь, медведь или ребенок мог освоить катание на велосипеде, мышцы должны быть вовлечены в сокращение в правильном порядке, порой очень быстро, причем сокращение должно гармонично чередоваться с расслаблением. Где, в каком отделе мозга принимается решение начать произвольное движение, на сегодняшний день остается еще малоизученным вопросом. Тем не менее ясно, что нейронные механизмы произвольных движений представляют собой важнейшие вопросы нейрофизиологии. В отличие от сенсорной системы, наше понимание организации моторного контроля прогрессирующе уменьшается по мере перехода от периферии к центральным механизмам. Тому есть объективное основание, поскольку к мотонейрону конвергирует огромное число нейронных путей от высших центров. В свою очередь, высшие центры также получают колоссальное число входных сигналов. Так как в процессе изучения этой сложной иерархии мы движемся от периферии к центру, то есть в направлении, обратном естественной сигнализации, мы неизбежно вынуждены либо ограничить число рассматриваемых связей, либо выбрать строго
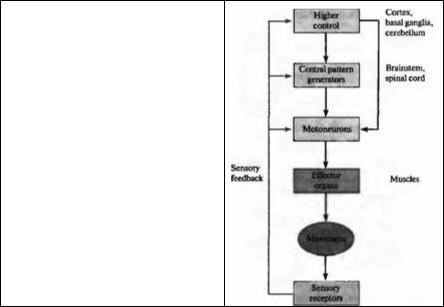
Глава 22. Клеточные механизмы двигательного контроля |
487 |
Рис. 22.1. Общая схема организации двигательной системы. Мышцы конечностей контролируются мотонейронами и интернейронами спинного моэга. Интернейроны спинного моэга и ствола моэга формируют генератор центрального ритма, управляющий двигательным аппаратом. Двигательные команды планируются и корректируются моторной корой, базальными ганглиями и мозжечком. На каждом уровне двигательной системы сенсорная импульсация служит для запуска, оповещения о ходе выполнения и модуляции выходных сигналов.
Fig. 22.1. A General Scheme for Motor System Organization. Limb muscles are controlled by motoneurons and interneurons of the spinal motor apparatus. Interneurons within the spinal cord and brainstem make up central pattern generators that direct the motor apparatus. Motor output is planned and refined by the motor cortex, basal ganglia, and cerebellum. At every level of motor control, sensory input serves to initiate, inform, and modulate output.
один специфический путь, что в любом случае приводит к ограниченной информации об устройстве моторного контроля.
Так же как в сенсорной системе, принципы организации стали ясны из довольно простых тестов. Первый принцип заключается в том, что моторный контроль организован иерархически. Наиболее сложные двигательные команды формируются в высших центрах (рис. 22.1). На более низком уровне, в спинном мозге, сенсорные нейроны образуют синапсы с мотонейронами для замыкания простых рефлексов, для которых нет необходимости вовлекать высшие центры. Кроме того, интернейроны спинного мозга и ствола мозга образуют генераторы центрального ритма для координации множественных моторных единиц (отвечающих, например, за локомоцию или дыхание). Над ними есть «надзирающий» контроль со стороны нейронов двигательной коры, мозжечка и базальных ганглиев, которые могут изменить программу низшего уровня или сформировать более сложную двигательную команду.
Второй важный принцип заключается в том, что, за редким исключением, все выходные двигательные команды выверяются и модулируются механизмами обратной связи. Сенсорный контроль происходит на каждом уровне двигательной системы. Для этого используются как положительные, так и отрицательные обратные связи. В частности, для временной организации и координации высших центров в ходе выполнения корковых двигательных команд важными являются петли обратных связей базальных ганглиев и мозжечка.
Наконец, параллельные потоки двигательных команд могут быть правильно организованы соответственно вовлечению проксимальной и дистальной группы мышц. В этом случае кажущееся чисто анатомическим деление на группы приобретает важнейшее функциональное назначение. Мускулатура туловища и проксимальные мышцы конечностей обеспечивают осанку и ритмические акты, такие как локомоция и дыхание. Дистальная группа мышц, особенно управляющая кистями и пальцами, вовлечена в произвольные сложные движения, в том числе базирующиеся на обучении и тренинге. Соответственно этому делению, проксимальная и дистальная группы мышц обеспечиваются отдельными ядрами ствола мозга и раздельными нисходящими нервными путями.
Клеточные механизмы, лежащие в основе спинальных рефлексов, изучены относительно хорошо, и поэтому мы начнем описание двигательных систем именно с рассмотрения свойств спинальных мотонейронов и синаптической организации связанных с ними рефлексов. Следующим шагом будет освещение вопроса об организации нейронных сетей, лежащих в основе ритмических координированных движений, таких как локомоция и дыхание. Затем мы перейдем к вопросу о функции двигательной коры, базальных ганглиев и мозжечка.
488 |
Раздел III. Интегративные механизмы |
§ 1. Двигательная единица
Шеррингтон считал мотонейроны спинного мозга «общим конечным путем», поскольку все нервные импульсы, имеющие отношение к движению или сохранению позы, обязательно конвергируют на мотонейроне. Основной мотонейрон спинного мозга называется α- мотонейрон (мотонейроны малого размера, которые контролируют функцию мышечных веретен, называются γ-мотонейроны и будут рассмотрены позже). Одиночный α-мотонейрон, иннервируюший группу мышечных волокон, вместе с этими мышечными волокнами образуют моторную (или двигательную) единицу. Число мышечных волокон в двигательной единице варьирует от всего нескольких волокон, например в мышце, управляющей движением пальцев, до нескольких тысяч, как это представлено в проксимальных мышцах конечностей.
Возбуждение двигательной единицы приводит к одновременному сокращению всех мышечных волокон, входящих в нее. Таким образом, двигательная единица образует элементарный компонент двигательного акта мышцы. Плавность и точность движения обеспечивается вариацией числа и времени вовлечения отдельных двигательных единиц1). Участие отдельных двигательных единиц в общем сокращении мышцы не всегда очевидно, так как есть асинхронность их участия и эластичность самой мышечной ткани, что приводит к эффекту сглаживания. Например, 25000 мышечных волокон в камбаловидной мышце кошки обеспечиваются 100 α-мотонейронами. Одиночное сокращение такой мышцы, таким образом, может быть разделено на 100 элементарных шагов, обеспечиваемых сокращением отдельных двигательных единиц. Продленное сокращение (тетанус), основанное на повторной активации двигательных единиц, может быть организовано еще более тонко. Это связано с тем, что каждый мотонейрон может генерировать свою собственную частоту потенциалов действия, что в свою очередь будет проявляться разной формой суммации мышечных волокон, входящих в состав этой двигательной единицы.
Синаптические входы на мотонейрон
Вовлечение и тонкий контроль мотонейронов, направленные на формирование координированных движений, требуют, чтобы множественные команды, поступающие к мотонейрону, были организованы в определенной последовательности и были правильно сбалансированы. Поэтому не удивительно, что мотонейрон в среднем имеет до нескольких тысяч синаптических входов2) (рис. 1.11А в главе 1). Эти синаптические входы передают команды от высших двигательных центров и снабжают мотонейрон сенсорной информацией разной модальности, поступающей с периферии. Поступающие импульсы вызывают возбуждающие и тормозные постсинаптические потенциалы (ВПСП и ТПСП). Пресинаптическое ингибирование селективно регулирует эффективность поступающих сигналов. Если мотонейрон деполяризован до некоего критического уровня, то в специализированной зоне, в аксонном холмике, генерируется потенциал действия, направляемый к периферии.
Благодаря активным исследования в этой области, прежде всего работам Ллойда3), а также Экклса с коллегами1), достигнут существенный прогресс в понимании синаптической передачи в мотонейронах и в механизмах взаимодействия между ВПСП и ТПСП. Важнейший синаптический вход передает информацию, поступающую с мышечных веретен (глава 17). Афференты группы Ia образуют моносинаптические возбуждающие входы на мотонейроне. В скрупулезных отведениях от всех мотонейронов, иннервирующих определенную мышцу (так называемый моторный пул), Мендел и Хенман4) показали, что одиночный Ia афферент посылает сигналы к 300 мотонейронам, то есть практически ко всем мотонейронам, иннервирующим данную мышцу. В некоторых больших мышцах аксоны формируют небольшие ответвления для иннервации определенных групп мышечных волокон. В этой ситуации сенсорные волокна Ia афферентов от этого участка мышцы образуют синаптические контакты преимущественно с соответствующими мотонейронами.
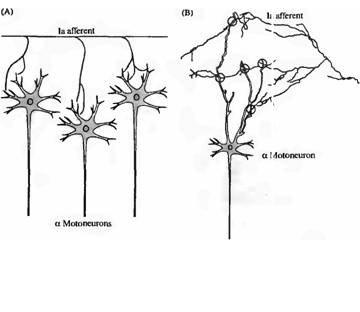
Синаптические контакты отдельного Ia афферента могут быть прямо продемонстрированы с помощью внутриклеточной инъекции фермента пероксидазы хрена (ПХ). Аксоны меченного ПХ Ia афферента интенсивно разветвляются в спинном мозге, образуя множественные контакты с мотонейронами (рис. 22.2). Более детальное исследование афферентов с использованием ПХ позволяет идентифицировать точные места контакта сенсорных окончаний с мотонейроном (рис. 22.2В). Конвергенция афферентов к мотонейрону приводит к образованию от двух
Глава 22. Клеточные механизмы двигательного контроля |
489 |
|
||||||
Рис. 22.2. |
Синаптические |
|
|
|
|
|||
контакты |
|
|
между |
|
|
|
|
|
афферентами |
рецепторов |
|
|
|
|
|||
растяжения |
|
|
и |
|
|
|
|
|
спинальными |
|
|
|
|
|
|
|
|
мотонейронами. |
(A) |
la |
|
|
|
|
||
афферент |
от |
одиночного |
|
|
|
|
||
мышечного |
|
волокна |
|
|
|
|
||
посылает |
отростки |
к |
|
|
|
|
||
нескольким |
|
|
|
|
|
|
|
|
мотонейронам. (В) Более |
|
|
|
|
||||
детализированная |
|
|
|
|
|
|||
картина, |
показывающая |
|
|
|
|
|||
первичный |
|
афферент |
|
|
|
|
||
проходящий |
|
через |
|
|
|
|
||
множественные |
|
|
|
|
|
|
||
разветвления дендрита, с |
|
|
|
|
||||
указанием |
|
|
|
|
|
|
|
|
предположительных |
|
|
|
|
|
|||
синаптических |
|
контактов |
|
|
|
|
||
(показаны |
|
кружками). |
|
|
|
|
||
Картина |
|
иннервации |
|
|
|
|
||
|
|
|
|
|||||
такого рода |
может |
быть |
|
Fig. 22.2. The Contacts between Stretch Receptor Afférents and Spinal Motoneurons. |
|
|||
получена |
путем |
мечения |
|
|
|
|||
(A) A single muscle spindle fiber (la) afferent sends branches to several motoneurons. |
||||||||
афферентов |
|
|
или |
|
(6) More detailed view shows the afferent fiber passing over multiple dendritic branches, |
|||
мотонейронов с помощью |
|
indicating possible points of synaptic contact (circles). Innervation patterns of this kind |
||||||
пероксидазы хрена. |
|
|
can be seen experimentally by labeling afferent fibers and motoneurons with histological |
|||||
|
|
|
|
|
|
|||
|
|
|
|
|
|
markers such as horseradish peroxidase (HRP). (After Burke and Glenn, 1996.) |
||
до пяти синаптических контактов на дендритном дереве6). Все контакты Ia афферента локализуются в определенном районе дендритного дерева, хотя не обязательно на одинаковом расстоянии от сомы7). Все эти контакты представляют собой разветвления одного аксона, тогда как другие ветви того же аксона проходят дальше, для иннервации другого мотонейрона.
Одиночные синаптические потенциалы мотонейронов
Импульс, приходящий по одиночному волокну Ia афферента приводит к генерации в мотонейроне только небольшого моносинаптического возбуждающего потенциала, соответствующего, в среднем, выделению одного или двух квантов трансмиттера. Общее число контактов одиночного волокна достигает 7. Это означает, что на нервный импульс не каждый синаптический бутон освобождает квант медиатора. Детальные количественные оценки этих событий были впервые представлены Куно8), который рассекал тонкие пучки сенсорных волокон в дорзальных корешках и регистрировал потенциалы, вызванные стимуляцией одиночных Ia афферентных волокон.
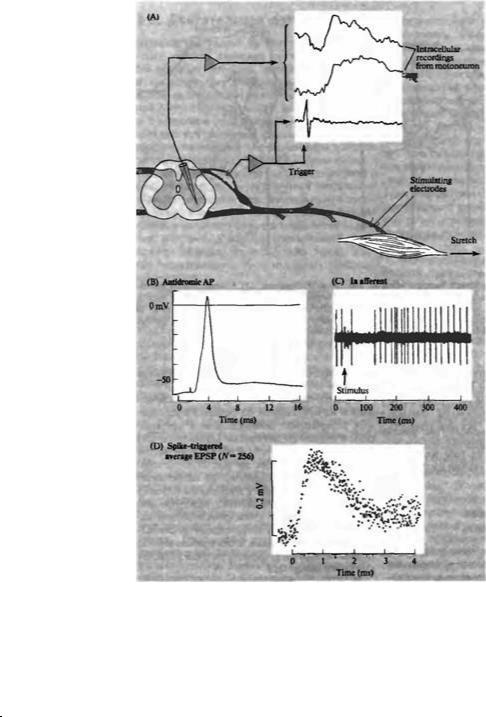
Другой способ оценки вклада отдельных входов на мотонейрон заключается в усреднении потенциалов, возникающих в мотонейроне в результате активации одиночного мышечного рецептора9· 10). Схема такого эксперимента представлена на рис. 22.3. Сенсорные импульсы, приходящие по одиночному la волокну, отводились в дорзальном корешке и использовались для запуска усредняющего устройства, которое суммировало потенциалы, генерируемые в мотонейроне после каждого входного сигнала. Суммация позволяла получить типичную картину разряда нескольких сотен импульсов.
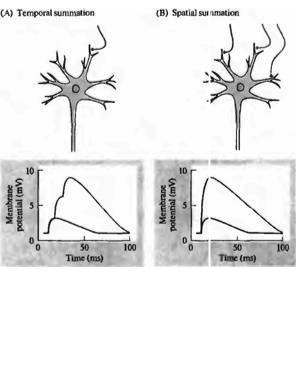
ВПСП, возникший в теле мотонейрона в результате активации одиночного Ia афферента имел амплитуду около 200 мВ. Хотя такой небольшой сигнал не мог оказать существенного влияния на функцию мотонейрона, но их суммация во время залповой активности или суммация нескольких входов могла оказать весьма существенный эффект (рис. 22.4). При высокочастотной активации Ia афферента происходит временная суммация ВПСП, приводящая к резкому возрастанию суммарной деполяризации. Кроме того, стоит
Глава 22. Клеточные механизмы двигательного контроля |
491 |
||||||||
Рис. |
22.4. |
|
Временная |
и |
|
|
|||
пространственная |
суммация |
(А) |
|
|
|||||
потенциал действия в одиночном la |
|
|
|||||||
афференте |
продуцирует |
синаптический |
|
|
|||||
потенциал в мотонейроне с амплитудой |
|
|
|||||||
менее 1 мВ. Когда по аффе рентам |
|
|
|||||||
проходит залп импульсов, последующие |
|
|
|||||||
ВПСП возникают на фазе спада от |
|
|
|||||||
предыдущего, |
увеличивая |
суммарную |
|
|
|||||
деполяризацию, |
|
что |
|
называется |
|
|
|||
временной суммацией. (В) Мышца, такая |
|
|
|||||||
как m. soleus кошки, может иметь до 100 |
|
|
|||||||
мышечных веретен и такое же |
|
|
|||||||
количество la афферентов. Все они |
|
|
|||||||
дивергируют |
|
в |
спинном |
мозге, |
|
|
|||
контактируя |
|
с |
|
большинством |
|
|
|||
мотонейронов в моторном ядре. В |
|
|
|||||||
результате |
на |
каждом |
мотонейроне |
|
|
||||
конвергирует до 100 la афферентов. |
|
|
|||||||
Сильное растяжение мышцы, способное |
|
|
|||||||
активировать |
|
большинство |
la |
|
|
||||
аффрентов, |
вызывает одновременную |
|
|
||||||
генерацию множества одиночных ВПСП, |
|
|
|||||||
приводя к значительной деполяризации |
|
|
|||||||
в |
результате |
пространственной |
When the afferent fires at a higher frequency, the successive EPSPs ride |
||||||
суммации. |
|
|
|
|
|
|
|||
Fig. |
22.4. |
Temporal |
and |
Spatial |
on the falling phase of the previous one, so they build up to a larger |
||||
depolarization — temporal summation. (B) A muscle, such as the soleus |
|||||||||
Summation. (A) |
An |
action |
potential in a |
in a cat may have as many as 100 muscle spindles, and so an |
|||||
single |
la afferent |
produces |
a |
synaptic |
equivalent number of la afferent fibers. These all diverge to contact the |
||||
potential in a motoneuron that is only a |
majority of motoneurons in the motor pool. Thus, 100 la afférents |
||||||||
fraction of a millivolt. |
|
|
|
|
converge onto each motoneuron. A strong stretch of the muscle is likely |
||||
|
|
|
|
|
|
|
|
to activate all la afférents, so their individual EPSPs add to depolarize |
|
|
|
|
|
|
|
|
|
the motoneuron by spatial summation. |
|
учесть, что сильное растяжение мышцы, такой как m. soleus способно привести к активации всех 50 рецепторов растяжения. Поскольку каждый Ia афферент дивергирует ко всем нейронам моторного пула, каждый мотонейрон, соответственно, получает импульсацию от всех 50 аффеернтов. Такая пространственная суммация всех синаптических входов может приводить к возбуждению мотонейрона (рис. 22.4В). Поскольку в мотонейроне может возникнуть и торможение, интеграция возбуждающих и тормозных постсинаптических потенциалов будет определять, приведет ли приходящая активность к достижению порога и генерации потенциала действия или нет.
Принцип размера и градуальное сокращение
Как организована активность мотонейрона, в результате которой возникают плавные движения конечностей? Как указывалось ранее, сила мышечных сокращений может быть увеличена вовлечением дополнительных мотонейронов или усилением частоты их активации. Однако следует уточнить, что это вовлечение мотонейронов определенным образом связано с их размерами. Мотонейроны малого размера с тонкими аксонами иннервируют небольшое число мышечных волокон. Поэтому их вовлечение слабо скажется на результирующем сокращении. Мотонейроны большого размера с толстыми аксонами контактируют с большим числом мышечных волокон. Поэтому нервный импульс, проходящий по такому аксону, приводит к сильному мышечному сокращению. Во время сокращения первоначально активируются малые нейроны, приводя к плавному началу сокращения. Затем вовлекаются крупные мотонейроны, что проявляется в значительном усилении сокращения11). Таким образом, за счет вовлечения малых и крупных мотонейронов достигается плавность и градуальность сокращения. Последовательное включение мотонейронов разного размера известно как принцип размера (size principle).
Максимальное сокращение, основанное на вовлечении всех моторных единиц, достигает более 3,5 кг. Ясно, что участие мелких нейронов мало скажется тогда, когда максимальное сокращение уже достигнуто. С другой стороны, редкая активация крупных мотонейронов может нарушить плавность движений, упра-
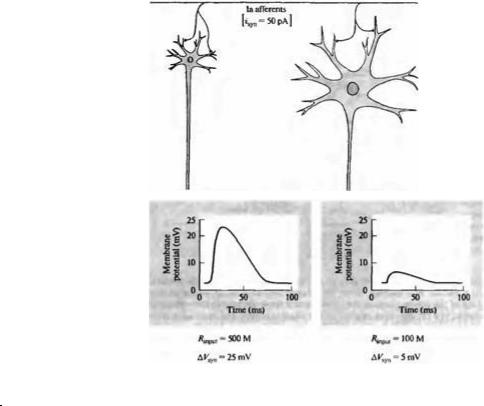
492 Раздел III. Интегративные механизмы
Рис. 22.5. Принцип клеточного |
|
||||||||||
размера. Ток, протекающий |
|
||||||||||
через |
клетку, |
производит |
|
||||||||
изменения |
|
|
мембранного |
|
|||||||
потенциала, |
|
|
которые |
|
|||||||
пропорциональны |
входному |
|
|||||||||
сопротивлению клетки (rjnput). |
|
||||||||||
Входное |
|
|
|
сопротивление |
|
||||||
обратно |
|
|
пропорционально |
|
|||||||
радиусу |
клетки, |
поэтому |
один |
|
|||||||
и |
тот |
же |
синаптический |
ток |
|
||||||
(г |
) |
|
вызовет |
у |
малых |
|
|||||
мотонейронов |
|
большую |
|
||||||||
деполяризацию (AVsyn = isynrinput). |
|
||||||||||
В данном случае la афферент |
|
||||||||||
снабжает |
одинаковым |
числом |
|
||||||||
си |
наптических |
контактов |
два |
|
|||||||
мотонейрона |
в |
одном |
из |
|
|||||||
моторных |
|
ядер. |
Тот |
же |
|
||||||
синаптический ток (50 пА) |
|
||||||||||
производит |
гораздо |
больший |
|
||||||||
эффект в малых мотонейронах. |
|
||||||||||
Fig. |
22.5. |
The |
Size |
Principle. |
|
||||||
Current flow into a cell produces a |
|
||||||||||
change in membrane potential |
|
||||||||||
that is proportional to the input |
|
||||||||||
resistance (rinput). Input resistance |
|
||||||||||
is inversely proportional to the |
|
||||||||||
radius of the cell so equivalent |
|
||||||||||
synaptic currents (isyn) produce |
|
||||||||||
greater |
depolarization |
( |
Vsyn = |
|
|||||||
isynrinput) of smaller motoneurons. |
|
||||||||||
Here la spindle afferent input is |
|
||||||||||
provided equally to two members |
|
|
|||||||||
afférents innervating the muscle). The same synaptic current (50 pA) produces a |
|||||||||||
of the motor |
pool (representing |
|
|||||||||
the |
spatial |
summation |
of a large |
|
greater effect in the smaller motoneuron. |
||||||
number of spindle |
|
|
|
|
|
|
|||||
вляемых мелкими мотонейронами. Тот факт, что мотонейроны вовлекаются в сокращение согласно их размеру, приводит к тому, что участие каждой последующей двигательной единицы добавляет около 5 % к текущему мышечному усилию. Например, при активации мелкого мотонейрона, управляющего m. soleus кошки, эта мышца развивает усилие величиной 5 г, а при активации крупного мотонейрона — более 100 г.
Тот факт, что вовлечение очередной моторной единицы добавляет к текущему напряжению определенную фиксированную фракцию, находит проявление и в сенсорных аспектах моторной активности. Например, мы судим о весе предметов по мышечной силе, необходимой для их удержания. При этом мы можем различить предметы весом 2 и 3 г, но не заметим разницы между предметами весом 2 002 и 2 003 г. То, что важно относительное изменение, наиболее ясно сформулировано в принципе Вебера—Фехнера
(глава 17).
Могут ли клеточные свойства мотонейронов объяснить принцип размера? Представьте, что все мотонейроны, иннервирующие мышцу, получают один и тот же синаптический вход. Падение напряжения, продуцированное синаптическим током в отдельном мотонейроне, зависит от входного сопротивления, которое, в свою очередь, является функцией размера клетки (рис. 22.5). Как показано в главе 7, входное сопротивление обратно пропорционально радиусу клетки. Поэтому один и тот же входной сигнал вызовет гораздо большее падение напряжение в нейронах малого размера, что более вероятно вызовет в них генерацию потенциала действия, чем в крупных нейронах. По мере увеличения сенсорного притока нейроны все более крупного размера будут генериро-
