
Nikolls_-_Ot_neyrona_k_mozgu
.pdfГлава 23. Развитие нервной системы |
563 |
дят как симметричные белки с различными основными регионами, которые определяют свойства рецептора при встраивании его в мембрану (рис. 23.34)171).
На ранних периодах развития, до того, как произойдет иннервация периферических мишеней сенсорными нейронами, клеткам нервного гребня и сенсорным нейронам в ДСГ и ганглии тройничного нерва необходимы МНФ и NT-3 для пролиферации, дифференцировки и выживания172). На таких ранних стадиях нейротрофины, по-видимому, секретируются самими нейронами, либо мезенхимальными тканями, расположенными вдоль роста аксонов сенсорных нейронов173). В более поздние периоды, после того, как аксоны достигают своих целей, сенсорные нейроны начинают экспрессировать рецепторы к ФРН и становятся зависимыми от ФРН, секретируемого их мишенями174).
Нейротрофины в ЦНС
Особенный интерес представляет нахождение популяции клеток, чувствительной к ФРН, в ЦНС175). Таковыми являются холинергические нейроны, которые расположены в базальной области переднего мозга и которые иннервируют несколько различных структур, в том числе гиппокамп — область ЦНС, которая, как считают, связана с процессами памяти и обучения (главы 12 и 14). Если аксоны этих нейронов у взрослой крысы перерезать, то клетки погибают. Однако, если после перерезания вводить в ЦНС ФРН, то клетки выживают после аксотомии. Число этих клеток, которые окрашиваются маркерами холинергических нейронов, уменьшается с возрастом, вместе со способностью крыс запоминать лабиринт и выполнять другие пространственные задачи176). Если ФРН вводится взрослым крысам, число клеток, которые окрашиваются, увеличивается и улучшается выполнение крысами пространственных задач177). Эти наблюдения показывают, что выживание и рост нейронов в ЦНС, скорее всего, зависит от факторов, которые одинаковы или близки к тем, которые были идентифицированы для периферических нейронов. Полученные результаты позволяют предполагать, в терминах молекулярной биологии, возможные дефекты этих факторов, которые могут привести к нарушениям развития мозга, и возможные пути борьбы с этими дефектами178).
МНФ и NT-3 широко распространены в ЦНС как во время развития, так и у взрослых. Клетки коры и гиппокампа, скорее всего, нуждаются в МНФ и NT-3 для выживания, хотя изменения в выживаемости клеток в ЦНС трудно проследить179). МНФ, как было показано, влияет на рост и сложность ветвления аксонов и дендритов в развивающейся ЦНС180). Анализ мышей с генетическим дефицитом представляет многообещающий подход к пониманию роли нейротрофинов в развивающейся нервной системе 181).
Нейротрофины также могут играть определенную роль и в ЦНС взрослых животных180). Физиологическая активность вызывает экспрессию определенных нейротрофинов в разных областях ЦНС и в ответ на различные стимулы. В свою очередь, нейротрофины, как было показано, способны влиять на физиологическую активность, облегчая синаптическую передачу и увеличивая или уменьшая возбудимость нейронов посредством регуляции экспрессии ионных каналов.
Рецепторы к нейротрофинам
Нейротрофины взаимодействуют с двумя типами рецепторов на поверхности нейронов-- мишеней (см. рис. 23.34)182, 183). Все нейротрофины связываются с относительно одинаковой и низкой активностью (Кd = 10--9 М) с мембранным рецептором, который был первоначально описан как низкоаффинный быстрый рецептор ФРН, или p75NGFR; более правильно называть этот рецептор низкоаффинным рецептором к нейротрофинам, или p75LNTR этот рецептор экспрессируется как в нейрональных, так и в ненейрональных клетках. Также существуют высокоаффинные (Кd = 10-11 М) рецепторы к нейротрофинам. Результаты биологических проб показывают, что эффекты нейротрофинов на выживание клеток и на рост отростков нервов обусловливаются высокоаффинными рецепторами.
Хотя высокоаффинные рецепторы к ФРН обычно расположены только на нейронах, они были первоначально обнаружены в клетках карциномы толстой кишки человека, как часть продукта синтеза онкогена trk (онкогенами называют гены, которые управляют трансформацией
клеток). Аналог онкогена trk, находящийся в нормальных клетках, кодирует белок с массой около 140 кДа, называемый pl40prototrk или просто Trk. Структура белка Trk, предсказанная на
основе его аминокислотной последовательности, состоит из внеклеточного домена, содержащего сайт

564 |
Раздел IV. Развитие нервной системы |
Рис. 23.34. (См. цветную вклейку после с. 640.) Высоко- и низкоаффинные рецепторы нейротрофинов Димер нейротрофина связывается с двумя высокоаффиными Trk рецепторами при помощи консервативных областей нейротрофинов, которые взаимодействуют со всеми типами Trk рецепторов и уникальными регионами, специфичными для определенного Trk рецептора. Регионы, которые сохраняются у всех нейротрофинов, участвуют в связывании димера нейротрофина с двумя низкоаффинными p75NGFR молекулам.
Fig. 23.34. Highand Low-Affinity Neorotrophin Receptors. The neurotrophin dimer (NGF is shown) binds to two highaffinity Trk receptors through conserved regions of the neurotrophins that interact with all Trk receptors and unique regions specific for a particular Trk receptor. Regions that are conserved in all neurotrophins mediate binding of the neurotrophin dimer to two low-affinity p75NGFR molecules. (After Wiesmann et al., 1999.)
связывания нейротрофина, короткий трансмембранный сегмент, а также внутриклеточный домен, кодирующий тирозинкиназу (рис. 23.34). Существуют по крайней мере три члена семейства про-онкогенов trk, каждый из которых является высокоаффинным рецептором для одного или нескольких нейротрофинов: TrkA — рецептор к ФРН и NT-6; TrkB, по видимому, является рецептором к МНФ и NT-4/5, a TrkC является рецептором к NT-3 (см. табл. 23.2).
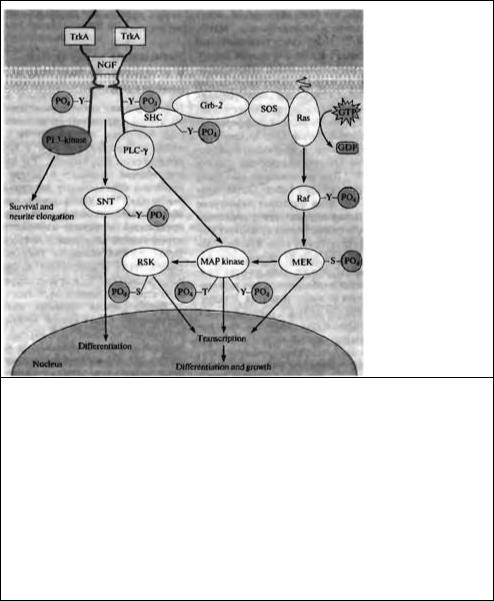
Связывание нейротрофинов с высокоактивными рецепторами приводит в первую очередь к увеличению фосфорилирования тирозина рецепторами. Это происходит вследствие аутофосфорилирования; вызванное лигандом образование рецепторного димера способствует приближению друг к другу внутриклеточных доменов тирозинкиназы каждого рецептора таким образом, что они фосфорилируют друг друга. Фосфорилирование рецептора Trk активирует четыре внутриклеточных сигнальных пути: фосфорилирование тирозина белка,
названного SNT (suc-associated neurotrophic factor-induced tyrosine-phosphorylated target,
связанная с suc и тирозин-фосфорилируемая в ответ на нейтрофические факторы мишень), фосфолипазу С, фосфоинозитол-3-киназу и каскад Ras-MAP киназы (рис. 23.35) 184).
Таблица 23.2. Нейротрофины и рецепторы нейротрофинов.
Table 23.2. Neurotrophins and neurotrophin receptors.
Neurotrophin |
High-affinity |
Low-affinity |
|
receptor |
receptor |
a Originally termed p75NGFR.
b NT-3 also binds TrkB and TrkA, bui wilh lower affinity.
Функция низкоаффинного рецептора, который не имеет внутриклеточных доменов, неизвестна. В некоторых клетках он может взаимодействовать с высокоаффинным рецептором во время связывания нейротрофинов. В других клетках, особенно в тех, в которых нет высокоаффинных рецепторов, он может управлять гибелью клеток 185) или обеспечивать механизм ограниченной диффузии для установления высокой локальной концентрации нейтротрофинов, что необходимо для регенерации периферического нерва (глава 24).
§9. Конкурентные взаимодействия во время развития
После того как аксон достигает своих мишеней и образует синаптические связи, два процесса управляют паттерном иннервации. Одним является период гибели клеток, когда большое количество нейронов, которые установили синаптические связи, погибает. Вторым является уменьшение количества аксонов и синапсов, что сопровождается реорганизацией оставшихся связей, формирующих взрослый паттерн иннервации. Каждый из этих процессов регулируется конкуренцией за ограниченное количество факторов роста.
Гибель нейронов
Удивительной особенностью развития нервной системы является то, что многим ее нейронам суждено погибнуть во время развития. У беспозвоночных интенсивная гибель нейронов сопровождается стремительными изменениями, происходящими во время метаморфоза, и регулируется гормонами186). Однако в развивающейся ЦНС как позвоночных, так и беспозвоночных гибель клеток происходит также и в отсутствие значительных морфологических изменений187).
Эксперименты, выполненные Гамбургером и Леви-Монтальчини, впервые выявили
Глава 23. Развитие нервной системы |
565 |
Рис. 23.35. Связывание димера фактора роста нервов с двумя TrkA рецепторами приводит к тому, что домен внутриклеточного белка тирозинкиназы каждого из TrkA рецепторов фосфорилирует остатки тирозина другого TrkA рецептора. Это запускает четыре внутриклеточных сигнальных каскада, которые приводят к росту и дифференцировке. Активация фосфоинозитол-3-киназы (PI 3-kinase) способствует удлинению отростков и их выживанию. Фосфорилирование тирозина SNT приводит к дифференцировке. Активация фосфолипазы C-γ (PLC-τ) стимулирует MAP киназы, которые индуцируют экспрессию генов, дифференцировку и рост как непосредственно, так и через фосфорилирование RSK. MAP киназа также активируется через сигнальный каскад, который включает связывание белков SHC, Grb-2, SOS и Ras, а также киназ Raf и МЕК. — S— Р04 — фосфорилирование серина; — Т — Р04 — фосфорилирование треонина; — Y — Р04 — фосфорилирование тирозина.
Fig. 23.35. Binding of the Nerve Growth (actor Dimer to two TrkA receptors brings each TrkA receptor's intracel-lular protein tyrosine kinase domain into position to phosphorylate tyrosine residues on the other TrkA receptor. This triggers four intracellular signaling cascades, which lead to growth and differentiation. Activation of phosphatidylinositol 3-kinase (PI 3-kinase) promotes survival and neurite elongation. Tyrosine phosphorylation of SNT promotes differentiation. Activation of phospholipase C-γ (PLC-γ) stimulates MAP kinase, which induces gene expression, differentiation, and growth, both directly and by phosphorylating RSK. MAP kinase is also stimulated through a signaling cascade that involves the coupling proteins SHC, Grb-2, SOS, and Ras, and the kinases Raf and MEK. — S— P04 = serine phosphorylation; — T— P04 = threonine phosphorylation; — Y— P04 = tyrosine phosphorylation.
запрограммированную гибель нейронов эмбрионов позвоночных, а также показали, что степень гибели клеток может зависеть от размеров ткани-мишени160· 188). Они показали, например, что в развивающейся конечности в то время, когда формируются первые синаптические связи с миофибриллами, от 40 до 70 % мотонейронов, которые послали аксоны в эту конечность, погибают. Имплантация дополнительной конечности уменьшает долю погибающих мотонейронов, а удаление одного из зачатков конечностей приводит к увеличению числа гибнущих клеток, что дает основания для предположения, что мотонейроны конкурируют за некие трофические вещества, выделяемые тканью-мишенью.
В самом деле, большое разнообразие нейротрофических белков, в основном вырабаты-
566 |
Раздел IV. Развитие нервной системы |
ваемых в мышце, как было обнаружено, могут управлять развитием мотонейронов: МНФ, NT- 3 и NT-4/5, ИФР (инсулиноподобный фактор роста, IGF, insulin-like growth factor), CNTF (ciliary neurotrophic factor, нейротрофический фактор ресничек), GDNF (glial-derived neurotrophic factor, глиальный нейротрофический фактор), CDF (cholinergic differentiation factor, фактор холинергической дифференцировки, также называемый LIF, leukemia inhibitory factor, фактор подавляющий лейкемию) и ИФР-I (инсулиноподобный фактор роста 1)189)--192). При введении их эмбриону эти белки предупреждают гибель мотонейронов, которые без этих факторов неминуемо погибли бы. Однако существует и несколько доказательств, включая анализ мутантных мышей, у которых отсутствует один или несколько подобных белков или их рецепторов, которые показывают, что ни один из этих факторов не является необходимым для выживания мотонейрона во время развития. Наилучшим кандидатом для фактора,
регулирующего выживание мотонейрона, является еще пока неидентифицированный лиганд рецептора CNTF 193).
Избыточная продукция нейронов, после которой следует период гибели клеток, является характерной чертой развития нервной системы позвоночных. Некоторые из нейронов, которые погибают, возможно, не смогли образовать синапсов, или образовали их с неподходящей клеткой-мишенью. В подобных случаях гибель клеток связана с особенностью иннервации194). Однако большинство клеток, которые гибнут, достигают и иннервируют правильные клеткимишени. Таким образом, гибель клеток является основным механизмом, который поддерживает равновесие между количеством нейронов и их мишеней.
Неожиданной находкой явилось то, что ингибиторы образования мРНК или синтеза белка предотвращали гибель нейронов в отсутствие необходимых им нейротрофинов195). Результаты этих и более поздних экспериментов показали, что гибель нейронов типично происходит путем апоптоза. Апоптоз — это процесс, который активирует внутреннюю «суицидальную» программу клетки, которая приводит к упорядоченному (запрограммированному) распаду ДНК и белков в клетке. Существенно, что для этого необходим предварительный синтез протеолитических ферментов или их активаторов196· 197).
Уменьшение числа связей и исчезновение полинейрональной иннервации
После того как популяция нейронов, иннервирующих определенную мишень, уменьшается благодаря гибели клеток, оставшиеся нейроны конкурируют друг с другом за синаптическую территорию. Это конкурирование обычно приводит к потере некоторых первично образованных веточек и синапсов («обрезка»)198). Уменьшение числа связей обеспечивает механизм для формирования правильной и полной иннервации мишени определенной популяцией нейронов. В некоторых случаях механизм уменьшения числа связей также
обеспечивает механизмы коррекции ошибок199); в других случаях он отражает стратегию поиска пути аксоном200).
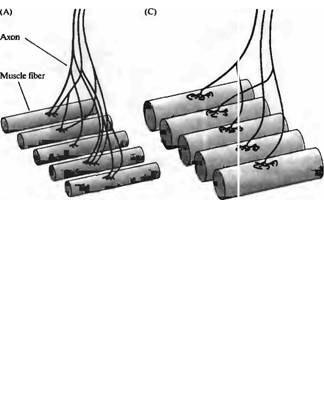
Особо яркий пример конкурентного уменьшения числа связей можно увидеть в развивающейся скелетной мышце. У взрослых животных каждый мотонейрон иннервирует группу до 300 мышечных волокон, формируя двигательную единицу (глава 22), но каждое мышечное волокно иннервируется только одним аксоном. Однако в развивающейся мышце мотонейроны бурно ветвятся, так что каждое мышечное волокно в итоге иннервируется аксонами от нескольких мотонейронов (рис. 23.36), что называется полинейрональной иннервацией201· 202). В каждом развивающемся мышечном волокне синаптические окончания всех аксонов разбросаны вокруг одного участка, вблизи скоплений рецепторов АХ и других компонентов постсинаптического аппарата. По мере развития веточки аксонов исчезают, что приводит в конечном итоге к формированию взрослого паттерна. Этот процесс не вызывает гибель клетки (которая обычно происходит на более ранних стадиях развития), а только уменьшение количества мышечных волокон, иннервируемых каждым из мотонейронов.
Исчезновение полинейронной иннервации регулируется конкуренцией между аксонами различных мотонейронов за синаптическое пространство на мышечных клетках. Наиболее ярким примером являются эксперименты на развивающихся мышцах лапки крысы203). Когда все кроме одного моторные аксоны, иннервирующие эту мышцу, были
Глава 23. Развитие нервной системы |
567 |
|
|||||||||
Рис. 23.36. (Рис. 23.36В, 23.36D |
|
|
|
|
|||||||
см. на цветной вклейке после с. |
|
|
|
|
|||||||
640.) |
|
|
Полинейрональная |
|
|
|
|
||||
иннервация и ее исчезновение в |
|
|
|
|
|||||||
нерв |
но |
мышечном |
|
соединении |
|
|
|
|
|||
позвоночных. |
(А) Во время |
|
|
|
|
||||||
развития |
эмбриона |
веточки |
|
|
|
|
|||||
аксонов |
моторных |
|
нейронов |
|
|
|
|
||||
иннервируют |
|
|
множество |
|
|
|
|
||||
мышечных волокон, и каждое |
|
|
|
|
|||||||
мышечное волокно иннервируется |
|
|
|
|
|||||||
несколькими |
мотонейронами |
|
|
|
|
||||||
(полинейрональная |
иннервация). |
|
|
|
|
||||||
(В) Флуоресцентная микрограмма |
|
|
|
|
|||||||
нервно-мышечного |
|
соединения |
|
|
|
|
|||||
мыши |
|
(стадия |
|
|
Е18), |
|
|
|
|
||
показывающая |
распределение |
|
|
|
|
||||||
терминалей двух аксонов, каждый |
|
|
|
|
|||||||
из которых помечен при помощи |
|
время исчезновения полинейрональной иннервации. Два аксона, |
|
||||||||
липофильной метки. В период |
|
|
|||||||||
иннервирующих синапс, были помечены как в В. Все терминали одного |
|||||||||||
полинейрональной |
|
иннервации |
|
||||||||
терминальные ветвления аксонов |
|
аксона исчезли, и сам аксон подвергся ретракции. |
|||||||||
мотонейронов, |
иннервирующих |
|
Fig. 23.36. Polyneuronal Innervation and Its Elimination at the vertebrate |
||||||||
определенное мышечное волокно, |
|
skeletal neuromuscular junction. (A) During embryonic development, motor |
|||||||||
переплетаются |
в |
|
областях |
|
axons branch to innervate many muscle fibers, and each muscle fiber is |
||||||
отдельных синапсов. (С) После |
|
innervated by several motor axons (polyneuronal innervation). (В) Fluorescence |
|||||||||
рождения |
|
полинейрональная |
|
micrograph of a neuromuscular junction of an E18 mouse showing the |
|||||||
иннервация исчезает |
по |
мере |
|
distribution of terminals of two axons, each labeled with a lipophilic probe. |
|||||||
того, |
как |
веточки |
аксонов |
|
During the period of polyneuronal innervation, the terminal arbors of all motor |
||||||
подвергаются |
ретракции, |
в |
|
axons innervating a particular muscle fiber interdigitate at a single synaptic site. |
|||||||
результате чего каждое мышечное |
|
(C) After birth, polyneuronal innervation is eliminated as axon branches retract |
|||||||||
волокно |
получает |
иннервацию |
|
leaving each muscle fiber innervated by a single motor axon. (D) Fluorescence |
|||||||
только от одного мотонейрона. (D) |
|
micrograph of a mouse neuromuscular junction during the period of removal of |
|||||||||
Флуоресцентная |
|
|
|
|
polyneuronal innervation. Two axons innervating the junction were labeled as in |
||||||
микрофотография |
|
нервно- |
|
||||||||
|
|
B. All |
terminals of one axon have been eliminated, and the axon is being |
||||||||
мышечного соединения мыши во |
|
withdrawn. (Micrographs kindly provided by 3. W. Lichtman.) |
|||||||||
|
|
|
|
|
|
|
|
||||
перерезаны на раннем этапе развития, оставшийся аксон подвергся ветвлению и начал иннервировать большое количество волокон данной мышцы. В то время, когда обычно происходит исчезновение полинейрональной иннервации, ни один синапс не исчез. В отсутствие конкуренции для выживания мотонейрон поддерживает контакты с каждой миофибриллой, которую он ранее иннервировал. В экспериментах Лихтмана с коллегами были получены яркие картинки этого процесса при помощи визуализирования нервных терминалеи у животных in vivo при помоши витальных красителей и наблюдения за изменениями синаптической структуры во время исчезновения синапсов204· 205). Подобная же ретракция избыточного количества связей была показана в автономном ганглии неонатальных крыс и морских свинок206). Каждая ганглионарная клетка первоначально получает большое количество связей, больше пяти, однако к возрасту 5 недель из них обычно остается только одна.
Активность нервов и исчезновение синапсов
Физиологические эксперименты показывают, что активность нейронов играет определенную роль в исчезновении синапсов, влияя как на интенсивность, так и на и результат конкуренции между терминалями аксонов. Стимулирование мышцы через нерв при помощи имплантированных металлических электродов увеличивает интенсивность исчезновения синапсов207· 208). Уменьшение активности путем добавления тетродотоксина в пространство вокруг нерва для блокирования потенциалов действия приводит к ингибированию синаптической передачи и замедлению исчезновения синапсов209· 210). На мышцах, которые получают сигналы от аксонов двух различных нервов, возможно проведение интересных экспериментов по блокированию проведения импульсов избирательно в одном из нервов211· 212). В таких случаях неактивные нейроны не могут, очевидно, нормально конкурировать: аксоны блокированных нейронов
568 |
Раздел IV. Развитие нервной системы |
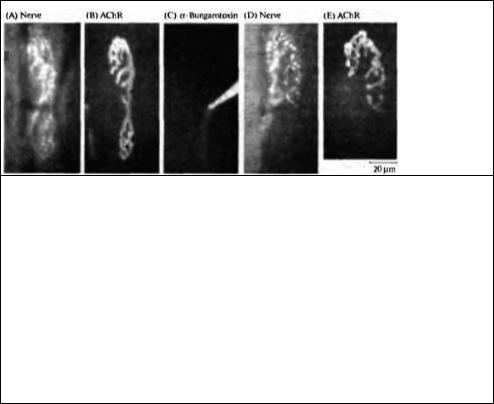
Рис. 23.37. Конкуренция между веточками одного мотонейрона, зависящая от активности. (А, В) Флуоресцентные микрофотографии нервно-мышечного соединения грудинососцевидной мышцы мыши, показывающие пресинаптическую терминаль (А), окрашенную при помощи 4-Di-2-Asp (который окрашивает
митохондрии) и постсинаптическую мембрану (В), окрашенную при помощи родамин-связанного α бунгаротоксина в низкой дозе (который окрашивает рецепторы АХ). (С) Рецепторы АХ в нижней части
соединения блокированы при помощи насыщающей дозы немеченного α-бунгаротоксина, что приводит к блокаде нервно-мышечной передачи селективно в этой области синапса. (D, Е) Через 31 день тот же самый синапс, что показан на А и В, был заново исследован. Терминаль аксона (D) и постсинаптические рецепторы (Е) исчезли из блокированной области. Таким образом локальная блокада передачи приводит к локальному исчезновению синапса.
Fig. 23.37. Activity-Dependent Competition between Branches of a single motor ахоп. (А, В) Fluorescence micrographs of a neuromuscular junction in the mouse stemomastoid muscle showing the presynaptic terminal (A), stained with 4-Di-2-Asp (which labels mitochondria) and the postsynaptic membrane (B), stained with a low dose of rtiodamineconjugated o-bungarotoxin (which labels ACh receptors). (C) ACh receptors in the lower part of the junction are blocked by a saturating dose of unlabeled α bungarotoxin, which results in a blockade of neuromuscular transmission selectively in this portion of the junction. (D, E) After 31 days, the same junction is labeled as in A and В and reexamined. Both the axon terminal (D) and the postsynaptic ACh receptors (E) have been removed from the blocked region. Thus, focal blockade of transmission resulted in focal synapse elimination. (After Bahce Gordon and
Lichtman, 1994; micrographs kindly provided by J. W. Lichtman.)
иннервируют двигательных единиц меньше, чем в норме; аксоны активных нервов иннервируют волокон больше, чем обычно. Однако доминирование неблокированных нервных волокон не полное, что говорит о роли других факторов, кроме активности, в исчезновении синапсов.
Конкуренция в зависимости от активности также происходит на уровне веточек отдельного аксона двигательного нейрона213). Если в небольшой области зрелого синапса произвести точечную аппликацию α-бунгаротоксина, то неактивный регион синапса подвергается элиминации (рис. 23.37). Если же блокировать весь синапс, его исчезновения не происходит. Молекулярные механизмы этой конкуренции, а также механизмы, посредством которых активность влияет на исчезновение синапсов, пока не открыты.
Сходная конкуренция за синаптические мишени возникает во время развития нервных путей в ЦНС214). Примером может служить образование глазодоминантных колонок в зрительной коре (глава 25), где аксоны из ядра ЛКТ, несущие информацию от разных глаз, первоначально значительно перекрываются в слое 4 коры, но затем формируются колонки правого и левого глаза. Таким образом, паттерн активности терминалей от обоих глаз играет решающую роль в определении результата этой конкуренции.
Нейротрофины и уменьшение количества связей
Уменьшение количества связей может возникать вследствие конкуренции за ограниченное количество трофических факторов, вырабатываемых клеткой-мишенью. Например, при развитии зрительной коры добавление избыточного количества МНФ блокирует образование колонок глазного доминирования, предотвращая потерю веточек аксонами ЛКТ (глава 25)215). Эксперименты на симпатических нейронах, выращиваемых в трехсекционных камерах, могут также быть примером того, что обеспечение нейротрофинами может определять выживание или гибель индивидуальных веточек нейронов (см. рис. 23.33)216).
Глава 23. Развитие нервной системы |
569 |
В этом эксперименте среда во всех трех секциях изначально содержала ФРН. Клетки помещались в центральную секцию, а их отростки направлялись в каждую из двух боковых секций. ФРН затем удалялся из одной из боковых секций. Аксоны в центральной секции и в боковой секции, которая содержала ФРН, выживали, а аксоны в секции, из которой был удален ФРН, подвергались дегенерации (рис. 23.33С). Таким образом, в пределах ткани-мишени конкуренция между терминалями аксона за ограниченное количество нейротрофинов может приводить к изменениям синаптического ветвления аксонов, способствовать росту одних веточек и дегенерации других.
§ 10. Общие размышления о нейронной специфичности
В последнее время наблюдается значительный прогресс в нашем понимании того, как нервная клетка находит свои мишени и устанавливает связи. Однако когда начинаешь рассуждать о несчетном количестве связей, которые должны сформироваться во время развития нервной системы, проблема нервной специфичности кажется просто пугающей. Даже банальная аналогия имеет очень сильный эффект. Представим, что мы не знаем ничего об устройстве и работе почтовой системы. Глава этой книги о нервной системе, без иллюстраций, отправляется из Триеста, Италия в Сандерланд, Массачусетс, куда она доходит за несколько дней. Как это происходит? Автор этой книги знает только ближайший к нему почтовый ящик и даже не знает, где находится почтовое отделение его района. Почтовый работник, который вынимает письма из ящика, знает, где находится почтовое отделение; там есть клерк, который может не знать, где находится Сандерланд, однако он знает, что посылку надо послать в аэропорт, и так далее, в нужную страну, город, улицу, здание и в конце концов конкретному человеку. Если этого не достаточно, то иллюстрации к главе высылаются из Денвера и Балтимора по тому же адресу, и они приходят почти одновременно с текстом из Триеста. После чего почта идет через те же самые почтовые ящики и отделение в обратном направлении к исходным отправителям.
Важной особенностью этой аналогии является то, что проблема кажется непостижимой на первый взгляд. Конечно, можно разгадать эту загадку с почтой, следуя за письмом шаг за шагом, пока оно не достигнет своего адресата. Это позволит выявить некоторые моменты в логике и структуре организации почты (не раскрывая сущность создателя этой системы). На каждом ее шаге выполняется ограниченное количество инструкций и используется ограниченное количество средств.
Некоторые механизмы нервной специфичности могут быть похожи на эту систему. Ганглиозная клетка сетчатки посылает свои отростки за пределы глаза, где они образуют зрительный нерв вместе с отростками других ганглиозных клеток сетчатки. Зрительный перекрест представляет следующую точку выбора, где решение о том, к какому, правому или левому, ЛКТ должен направляться отросток, может быть принято на основе химических сигналов. В ЛКТ аксоны сетчатки могут организовываться и иннервировать мишени основываясь на градиенте молекул-репеллентов. Аксоны нейронов ЛКТ подобным же образом следуют к своим мишеням в коре, останавливаясь на пути для формирования временных связей с промежуточными нейронами. Таким образом, задача по формированию специфических связей между ганглиозными клетками сетчатки и нейронами зрительной коры, кажущаяся такой сложной, может быть разбита на серию относительно простых, независимых шагов. Более того, при формировании связей во время развития расстояния между шагами очень малы; пути значительно удлиняются по мере созревания нервной системы.
Выводы
·У позвоночных в период эмбриогенеза происходит диффузия протеинов из Шпемановских организационных центров, что приводит к формированию нервной пластинки, края которой загибаются вверх и формируют нервную трубку.
·Клетки, расположенные в стенках нервной трубки, быстро делятся. Постмитотические нейроны и клетки-предшественники глии мигрируют в различных направлениях с вентральной поверхности нервной трубки и образуют ЦНС.
·Миграция нейронов происходит вдоль радиально расположенных глиальных клеток и клеточных путей, обозначенных различными метками на поверхности клеток и компонентами экстраклеточного матрикса.

570 |
Раздел IV. Развитие нервной системы |
·Конечное идентифицирование клеток определяется их происхождением и индукционными взаимодействиями с другими клетками.
·Гомеотические гены являются управляющими генами, которые контролируют и координируют экспрессию групп других генов и, таким образом, определяют формирование различных частей тела.
·В ЦНС позвоночных судьба развивающихся нейронов зависит в первую очередь от их расположения в росгрокаудальном направлении и уже затем от расположения в дорзовентральном направлении. Нох семейство гомеотических генов определяет идентифицирование клеток в зависимости от расположения в рострокаудальном направлении в заднем мозге. Белок, называемый Sonic hedgehog («Звучащий ежик»), синтезируемый в области хорды, управляет судьбой клеток, расположенных вентрально вдоль нервной трубки.
·Сигналы, управляющие дифференцировкой клеток, очень часто передаются через рецептор, связанный с тирозинкиназой, активирующей сложные внутриклеточные сигнальные каскады, которые приводят к изменениям в экспрессии генов. Примером подобной регуляции является развитие фоторецептора Drosophila.
·В коре ГМ млекопитающих развитие происходит таким способом, что нейроны, расположенные в более глубоких слоях, рождаются первыми.
·Нейроны нервного гребня возникают у края нервной складки и мигрируют из нервной трубки, образуя ПНС, пигментные клетки, а также кости черепа.
·Постоянное деление стволовых нервных клеток в ЦНС взрослых птиц и млекопитающих приводит к образованию новых нервных клеток.
·Кончик растущего аксона вытягивается, образуя конус роста.
·Поверхность клеток и молекулы адгезии, расположенные во внеклеточном матриксе, управляют конусом роста при помощи привлекающих и отталкивающих механизмов, действующих на короткой дистанции.
·Нетрины играют роль хемоаттрактантов, а семафорины — хеморепеллентов,
действующих на большой дистанции, для многих типов аксонов.
·Эфрины (Ephrines) и Eph семейство рецепторов, связанных с тирозинкиназой, при помощи хемореппелентных механизмов управляют процессом поиска пути нервом, миграцией клеток и образованием связей между клетками.
·При соприкосновении конуса роста с мышечной клеткой в течение нескольких
последующих минут устанавливается функционирующая нервно-мышечная передача.
·Выделение агрина из пресинаптических терминалей вызывает образование постсинаптической специализации в скелетной мышце.
·Нейронам для выживания и дифференцировки необходимы различные трофические факторы.
·Запрограммированная гибель нейронов довольно частое явление в развитии нервной системы.
·Синаптические связи, установленные однажды, в дальнейшем могут изменяться для обеспечения надежной и полной иннервации своей мишени. Перемоделирование связей осуществляется на основе конкуренции между терминалями аксона за нейротрофические факторы, выделяемые клеткой-мишенью в зависимости от активности терминалей.
Рекомендуемая литература
Обзоры
оCapecchi, M. R. 1997. Нох genes and mammalian development. Cold Spring Horb. Symp. Quant. Biol. 62: 273281.
оDupin, E., Zillcr, C., and Le Douarin, N. M. 1998. The avian embryo as a model in developmental studies: Chimeras and in vitro clonal analysis. Cuir. Top. Dev. Biol. 36: 1-35.
оFrade, J.M., and Barde, Y.
Y. A. 1998. Nerve growth factor: Two receptors, multiple functions. BioEssays 20: 137145.
A. 1998. Nerve growth factor: Two receptors, multiple functions. BioEssays 20: 137145.
оFrancis, N.J., and tandis, S. C. 1999. Cellular and molecular determinants of sympathetic neuron development.
Annu. Rev. Neurosci. 22: 541-566.

Глава 23. Развитие нервной |
|
системы |
571 |
оGilbert, S. F. 2000. Developmental Biology, 6th Ed. Sinauer Associates, Sunderland, MA.
оLevi-Montalcini, R. 1982. Developmental neuro-biology and the natural history of nerve growth factor. Annu.
Rev. Neurosci. 5: 341-362.
оLumsden, A., and Krumlauf, R. 1996. Patterning the vertebrate neuroaxis. Science 274: 1109-1115.
оMcAllister, A. K., Katz, L. C., and Lo, D. C. 1999. Neurotrophins and synaptic plasticity. Annu. Rev. Neurosci. 22: 295-318.
оMcConnell, S. K. 1995. Constructing the cerebral cortex: Neurogenesis and fate determination. Neuron 15: 761768.
оMueller, В. К. 1999. Growth cone guidance: First steps towards a deeper understanding. Annu. Rev. Neurosci. 22: 351-388.
оO'Leary, D. D., and Wilkinson, D. G. 1999. Eph receptors and ephrins in neural development. Curr. Opin. Neurobiol. 9: 65-73.
оOppenheim, R.W. 1991. Cell death during development of the nervous system. Annu. Rev. Neurosci. 14: 453501.
оSanes, J. R., and Lichtman, J.W. 1999. Development of the vertebrate neuromuscular junction. Annu. Rev. Neurosci. 22: 389-442.
оSong, H-J., and Poo, M-M. 1999. Signal transduc-tion underlying growth cone guidance by diffusible factors.
Curr. Opin. Neurobiol. 9: 355-363.
оWalsh, F. S., and Doherty, P. 1997. Neural cell adhesion molecules of the immunoglobulin super-family: Role in axon growth and guidance. Annu Rev. Cell Dev. ВЫ. 13: 425-456.
оZigmond, M.J., Bloom, F. E., Landis, S.C., Roberts, J.L., and Squire, L. R. (eds.). 1999. Fundamental Neuroscience. Academic Press, New York.
Статьи
оAnderson, M.J., and Cohen, M.W. 1977. Nerve-induced and spontaneous redistribution of acetyl-choline receptors on cultured muscle cells. /. Phys-iol. 268: 757-773.
оBalice-Gordon, R.J., and Lichtman, J.W. 1993. In vivo observations of preand postsynaptic changes during the transition from multiple to single innervation at developing neuromuscular junctions. /. Neurosci. 13: 834-855.
оBriscoe, J., Sussel, L., Serup, P., Hartigan-O'Connor, D., Jessell, T. M., Rubenstein, J. L. R., and Ericson, J. 1999. Homeoboxgene Nkx2.2 and specification of neuronal identity by graded Sonic hedgehog signaling. Nature 398: 622-627.
оBrown, M. C., Jansen, J. K. S., and Van Essen, D. 1976. Polyneuronal innervation of skeletal muscle in newborn rats and its elimination during maturation. /. Physiol. 261: 387-422.
оCampenot, R. B. 1982. Development of sympathetic neurons in compartmentalized cultures. II.
Local control of neurite survival by nerve growth factor. Dev. Biol. 93: 13-21.
оСох, Е.С., Muller, В., and Bonhoeffer, F. 1990. Axonal guidance in the chick visual system: Posterior tectal membranes induce collapse of growth cones from the temporal retina. Neuron 4: 31-47.
оCraig, A. M., Blackstone, C. D., Huganir, R. L., and Banker, G. 1994. Selective clustering of glutamate and 7- aminobuiyric acid receptors opposite terminals releasing the corresponding transmitters. Proc. Nail. Acad. Sri. USA9\: I2373-I2377.
оGhosh, A., Antonini, A., McConnell, S. K., and Shatz, C. J. 1990. Requirement for subplate neurons in the formation of thalamocortical connections. Nature 347: 179-181.
оGomez, T. M., and Spitzer, N. C. 1999. In vivo regulation of axon extension and pathfinding by growth-cone calcium transients. Nature 397: 350-355.
оHollyday, M., and Hamburger, V. 1976. Reduction of the naturally occurring motor neuron loss by enlargement of the periphery. /. Сотр. Neural. 170: 311-320.
оKennedy, T. E., Serafini, T., de la Torre, J. R., and Tessier-Lavigne, M. 1994. Netrins are diffusible chemotropic factors for commissural axons in the embryonic spinal cord. Cell 78: 425-435.
оLumsden, A. G. S., and Davies, A. M. 1986. Chemotropic effect of specific target epithelium in the developing mammalian nervous system. Nature 323: 538-539.
оLuskin, M. 1993. Restricted proliferation and migration of postnatally generated neurons derived from the forebrain subventricular zone. Neuron 11 : 173-189.
оLuskin, M. В., Pearlman, A. L., and Sanes, J. R. 1988. Cell lineage in the cerebral cortex of the mouse studied in vivo and in vitro with a recombinant retrovirus. Neuron 1: 635-647.
оSchlaggar, B. L., and O'Leary, D. D. M. 1991. Potential of visual cortex to develop an array of functional units unique to somatosensory cortex. Science 252: 1556-1560.
оSong, H-J., Ming, G-L., and Poo, M-M. 1997. cAMP-induced switching in turning direction of nerve growth cones. Nature 388: 275-279.
оTurner, D. L., and Cepko, C. L. 1987. A common progenitor for neurons and glia persists in rat retina late in development. Nature 328: 131-136.
оWalter, J., Henke-Fahle, S., and Bonhoeffer, F. 1987. Avoidance of posterior tectal membranes by temporal retinal axons. Development 101: 909-913.
оYamada, T., Placzek, M., Tanaka, H., Dodd, J., and Jessell, T. M. 1991. Control of cell pattern in the developing nervous system: Polarizing activity of the floor plate and notochord. Cell 64: 635-647.

572 |
Раздел IV. Развитие нервной системы |
Цитированная литература
1.Gilbert, S. F. 2000. Developmental Biology, 6lh Ed. Sinauer, Sunderland, MA.
2.Zigmond, M.J., et al. (eds.). 1999. Fundamental Neuroscience. Academic Press, New York.
3.Quiring, R., et al. 1994. Science 265: 785-789.
4.Streisinger, G., et al. 1981. Nature 291: 293-296.
5.Detrich, H.W., 111, Westerfield, M., and Zon, L. I. 1999. Methods Cell Biol. 59: 3-10.
6.Wylie, C. (éd.). Zebrafish Issue. 1996. Development 123: 1-481.
7.Sasai. Y. 1998. Neuron 21: 455-458.
8.Rakic. P. 1981. Trends Neurosci. 4: 184-187.
9.Goldowitz, D. 1989. Neuron 2: 1565-1575.
10.Hatten, M. E., Liem, R. K. H., and Mason, C. A. 1986. /. Neurosci. 6: 2676-2683.
11.Zheng, C., Heintz, N.. and Hatten, M. E. 1996. Science 272: 417-419.
12.Anton, E.S., Kreidberg. J.A., and Rakic, P. 1999. Neuron 22: 277-289.
13.Wray, S., Grant, P., and Gainer, H. 1989. Proc. Nail. Acad. Sci. VSA 86: 8132-8136.
14. Bronner-Fraser, M. 1985. J. Cell Biol. 101: 610-617.
15.Debby-Brafman, A., et al. 1999. Neuron 22: 475-488.
16.Lumsden, A., and Krumlauf, R. 1996. Science 274: 1109-1115.
17.Graba, Y, Aragnol, D., and Pradel, J. 1997. Bio£ssays 19: 379-388.
18.Capecchi, M. R. 1997. Cold Spring Harb. Symp. Quant. Biol. 62: 273-281.
19.Morrison, A. D. 1998. BioEssays 20: 794-797.
20. Boncinelli, E., Mallamaci, A., and Broccoli, V. 1998. Adv. Genet. 38: 1-29.
21.Walsh, C.A. 1999. Neuron 23: 19-29.
22.Gould, A., Itasaki. N., and Krumlauf, R. 1998. Neuron 21: 39-51.
23.Yamada, T.. et al. 1991. Cell 64: 635-647.
24.Roelink, H., et al. 1995. Ceil 81: 445-455.
25.Brisco, J., et al. 1999. Nature 398: 622-627.
26.Rubenstein, J. L, and Beachy, PA. 1998. Curr. Opin. Neurobiol. 8: 18-26.
27.Rubenstein, J. L., et al. 1998. Annu. Rev. Neurosci. 21: 445-477.
28.Ericson, J., et al. 1995. Cell 81: 747-756.
29.Ye, W., et al. 1998. Cell 93: 755-766.
30.Lee, K.J., and Jessell, T. M. 1999. Annu. Rev. Neurosci. 22: 261-294.
31.Simon, H., Hornbruch, A., and Lumsden, A. 1995. Curr. Biol. 5: 205-214.
32.Shankland, M. 1995. J. Neurobiol. 27: 294-309.
33.Doe, C. Q., and Skeath, J. B. 1996. Curr. Opin. Neurobiol. 6: 18-24.
34.Sengupta, P., and Bargmann, C. I. 1996. Dev. Genet. 18: 73-80.
35.Stent, O.S., et al. 1992. Int. Rev. Neurobiol. 33: 109-193.
36. Long, Q., et al. 1997. Development 124: 4105-4111.
37.Nelson, B. H., and Weisblat, D.A. 1992. Development 115: 103-115.
38.Isaken, D. E., Liu, N. J., and Weisblat, D. A. 1999. Development 126: 3381-3390.
39.Ready, D. 1989. Trends Neurosci. 12: 102-110.
40 Harris, W.A., and Hartenstein, V. 1999. Fundamental Neuroscience. Academic Press, New York, pp. 481-517.
481-517.
41.Zipursky, S. L., and Rubin, G. M. 1994. Annu. Rev. Neurosci. 17: 373-397.
42.Dickson, B.J. 1998. Curr. Biol. 8: R90-R92.
43.Rossant, J. 1985. Phil. Trans. R.Soc. Lond.B3\2: 91-100.
44.Turner, D. L., and Cepko, C. L. 1987. Nature 328: 131-136.
45.Luskin, M. В., Pearlman, A. L., and Sanes, J. R. 1988. Neuron 1: 635-647.
46.Moriyoshi, K., et al. 1996. Neuron 16: 255-260.
47.Cepko, C. L., et al. 1996. Proc. Nail. Acad. Sci. USA 93: 589-595.
48.McConnell, S.K. 1995. Neuron 15: 761-768.
49.Angevine, J. В., and Sidman, R. L. 1961. Nature 192: 766-768.
50.Rakic, P. 1974. Science 183: 425-427.
51.Luskin, M. В., and Shatz, C. J. 1985. У. Сотр. Neural. 242:611-631.
52.McConnell, S. K. 1988. /. Neurosci. 8: 945-974.
53.Caviness, V. S., Jr. 1982. Dev. Brain Res. 4: 293-302.
54.D'Arcangelo, G., et al. 1997. /. Neurosci. 17: 23-31.
55.Meyer, G., et al. 1998. /. Сотр. Neural. 397: 493-518.
56.Howell, В. W, et al. 1997. Nature 389: 733-737.
57.TrommsdorfT, M., et al. 1999. Cell 97: 689-701.
58.Schlaggar, В. L., and O'Leary, D. D. M. 1991. Science 252: 1556-1560.
59.O'Leary, D. D. M., et al. 1995. Ciba Found. Symp. 193: 214-230.
60.Nottebohm, F. 1989. Sci. Am. 260(2): 74-79.
61.Kim, J. R., and Nottebohm, F. 1993. J. Neurosci. 13: 1654-1663.
62.Rasika, S., Alvarez-Buylla, A., and Nottebohm, F. 1999. Neuron 22: 53-62.
63.Altman, J., and Das, G. D. 1965. У. Сотр. Neural. 124: 319-335.
64.Kornack, D. R., and Rakic, P. 1999. Proc. Nail. Acad. Sci. USA 96: 5768-5773.
65.Reynolds, B.A., and Weiss, S. 1996. Dev. Biol. 175: 1-13.
66.Johansson, С. В., et al. 1999. Cell 96: 25-34.
