
Nikolls_-_Ot_neyrona_k_mozgu
.pdfГлава 23. Развитие нервной системы |
523 |
Упорядоченность связей, образованных нервными клетками между собой, а также между ними и другими тканями на периферии является одним из условий для нормального функционирования нервной системы. Для создания такой точной нервной архитектуры во время развития необходимо, чтобы сформировались нейроны определенных типов в необходимом количестве и в строго определенных местах нервной системы, которые затем должны образовать связи со своими уникальными клетками-мишенями. Например, чтобы работал рефлекс растяжения, необходимо, чтобы афферентный сенсорный нейрон типа Ia спинномозгового ганглия послал свой аксон к определенному месту в области мышечного веретена, а другой аксон, идущий в ЦНС, должен образовать синаптический контакт исключительно с тем мотонейроном, который иннервирует мышцу, где находится это мышечное веретено. Другие веточки этого центрального аксона заканчиваются на спинальных интернейронах или уходят в дорзальные столбы для иннервации клеток, расположенных в ядрах спинного мозга. Кроме того, количество сенсорных и моторных нейронов должно находиться в определенном соотношении в зависимости от размеров мышцы и количества мышечных веретен, которые эта мышца содержит.
Большой спектр вопросов возникает при рассмотрении данного примера. Каким образом клетки дифференцируются в нейроны или клетки глии? По каким меткам следует нейрон, мигрируя к своему месторасположению? Какие клеточные механизмы позволяют нейрону направлять свой аксон строго к определенной цели, одной из мириада возможных, чтобы образовать на ней синапс? В поиске ответов на эти вопросы мы вспоминаем, что в нервной системе имеется 1010-1012 нервных клеток, причудливо связанных друг с другом, при этом количество генов, которые могут определять эту структуру, составляет всего 105 или около того. Более того, ЦНС демонстри-
рует большую гибкость во время критических периодов развития и даже у взрослых, у которых образуются новые синапсы, а старые либо изменяют свои свойства, либо просто исчезают, — и все это как результат изменения активности клеток (глава 25).
Спектр проблем, относящихся к развитию, образованию синапсов, нервной специфичности и изменению свойств связей, настолько широк, что дать их полный обзор не представляется возможным. Многие аспекты этого уже подробно освещены в других руководствах1· 2). В этой главе мы осуществим короткий экскурс в нейроэмбриологию и опишем отдельные экспериментальные подходы к вопросам развития нервной системы. Темы будут освещаться нами в том порядке, как происходит процесс развития НС: начиная с нейроэктодермы и раннего морфогенеза нервной системы, затем мы рассмотрим региональную спецификацию нервной ткани и факторы, которые определяют идентификацию отдельных нейронов и клеток глии, и в конце мы поговорим о механизмах роста аксонов, иннервации ими определенной цели, образовании синапсов, а также о роли факторов роста и конкуренции в окончательном формировании нервной системы.
Терминология
Основная терминологическая проблема возникает при изучении развития на молекулярном уровне. В последние годы описывается все больше и больше молекул, для которых известен механизм их действия. Сюда относятся также белки и гены, важные для выживания клетки, ее роста и дифференцировки, для формирования аксона и его навигации, для образования синапса и управления его свойствами. Для того, чтобы еще больше усложнить ситуацию, большинство этих белков и генов получили своеобразные имена, связанные с историей их открытия или благодаря выдумке их первооткрывателей в лабо-

524 |
Раздел IV. Развитие нервной системы |
раториях. где впервые описывались их свойства. В результате этого читатель (который уже должен был познакомиться с таким чужеродным понятием, как «замедленное выпрямление» (delayed rectification) из нашей дискуссии о передаче сигнала, сейчас вынужден привыкать к серии новых необычных названий, таких как "Sonic hedgehog" («звучащий ежик») и эфрин ("Ephrin"), a также к бесконечному числу сокращений, типа "N-CAM", "BDNF" и "Elf-2", ни одно из которых непосредственно не говорит о функции того или иного агента. Мы постарались представить здесь минимальное количество генов и белков и, где возможно, использовать их полные имена.
Генетические подходы к пониманию процесса развития
Основные достижения последних лет привели к значительному скачку в нашем понимании молекулярных механизмов тех процессов и явлений, которые ранее были только констатированы. Первым достижением является разработка новых молекулярных биотехнологий для контроля и управления экспрессией генов. Вторым является открытие механизмов и молекул, которые управляют развитием нервной системы удивительно сходным образом у различных животных. Например, как мы уже упоминали в главе 1, гены, которые управляют развитием глаза у развивающегося цыпленка, мышонка или человека очень сходны с генами, определяющими формирование глаза дрозофилы3). Таким образом, гены, определяющие развитие дрозофилы, грибов-дрожжей и нематод (C.elegans), часто имеют гомологов среди генов, определяющих развитие позвоночных. Третьим достижением является использование полосатой коралловой рыбы (zebra fish, официальное русское название «полосатый данио», Brachydanio rerio), впервые предложенной Страйзингером4), как особенно удачного объекта для изучения развития позвоночных5). Эмбрион полосатого данио прозрачен, что позволяет непосредственно наблюдать за отдельными клетками во время эмбриогенеза, который у данио происходит довольно быстро. Наиболее важным является то, что были разработаны приемы, при помощи которых у данио могут быть вызваны, контролированы и поддержаны на определенном уровне направленные мутации, что открывает дорогу к обнаружению важных генов позвоночных, которые могут иметь гомологов у некоторых видов более просто устроенных беспозвоночных6).
§ 1. Развитие нервной системы в раннем периоде
В раннем периоде морфогенеза позвоночных область гаструлы, из которой в дальнейшем формируется нервная система, представляет
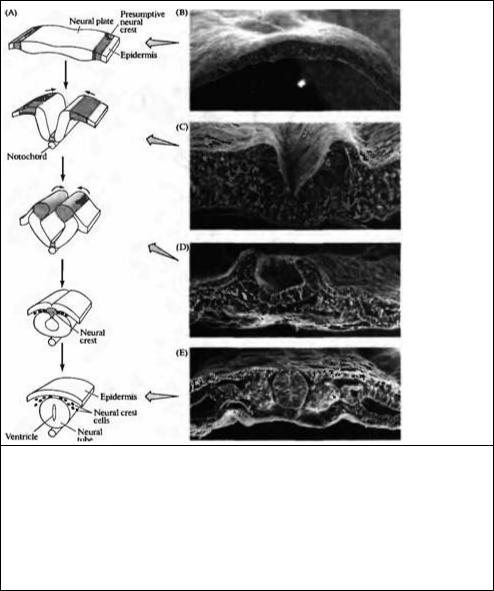
Рис. 23.1. Ранний морфогенез в эмбрионе позвоночного. Вид сзади на развивающийся эмбрион цыпленка в первый день жизни. (А) 5-6 ч.: образование и удлинение первичной полоски (В) 15-16 ч.: образование первичного желобка и Гензеновского узелка. (С) 19-22 ч.: образование головного отростка и нервной пластинки. (D) 23-24 ч.: образование нервного валика, хорды и мезодермальных сомитов.
Fig. 23.1. Early Morphogenesis in the vertebrate embryo. Dorsal views of the first day in the development of a chick embryo. (A) 5-6 h: formation and elongation of the primitive streak. (B) 15-16 h: formation of the primitive groove and Hensen's node. (C) 19-22 h: formation of the head process and neural plate. (D) 23-24 h: formation of the neural fold, notochord, and mesodermal somites. (After Gilbert, 2000.)
Глава 23. Развитие нервной системы |
525 |
|
|
Рис. 23.2. Образование нервной трубки в эмбрионе цыпленка. (А) Диаграмма нейруляции (В-Е) Микрофотограммы образования нервной трубки, сделанные при помощи сканирующего электронного микроскопа. (В) Нервная пластинка, образованная продолговатыми клетками в дорзальной области эктодермы. (С) Нервный желобок, образованный продолговатыми неирозпителиальными клетками и окруженный мезенхимальными клетками. (D) Нервные валики, покрытые уплощенными зпидермальными клетками. (Е) Нервная трубка, покрытая эпидермисом с расположенными по обеим сторонам сомитами и хордой внизу.
Fig. 23.2. Formation of the Neural Tube in the chick embryo. (A) Diagram of neurulation. (B-E) Scanning electron micrographs of neural tube formation. (B) Neural plate, formed by elongated cells in the dorsal region of the ectoderm.
(C) Neural groove, formed by elongated neuroepithelial cells and surrounded by mesenchymal cells. (D) Neural folds, covered by flattened epidermal cells. (E) Neural tube, covered by presumptive epidermis and flanked on the sides by somites and on the bottom by the notochord. (After Gilbert 2000; photographs kindly provided by K.W Tosney )
собой простую полоску эктодермы (рис. 23.1). Клетки этой полоски находятся под влиянием факторов роста (включая два белка из семейства костных морфогенетических белков, ВМР-2 и ВМР-4), которые подавляют нервную дифференцировку и приводят к развитию эпидермальной ткани7). Затем из особого «организационного» региона гаструлы, названного Шпемановским организационным центром (Spemann organizer, в яйцах амфибий) или
Гензеновским узелком (Hensen's node, у эмбрионов цыпленка и млекопитающих), происходит выделение свободно диффундирующих белков, которые блокируют действие этих факторов роста. Эти белки (известные как фоллистатин (follistatin), ноггин (noggin) и хордин (chordin)) активируют сигнальные каскады в клетках, расположенных рядом с организационным центром, что приводит к дифференцировке клеток в нейроны и формиро-
526 |
Раздел IV. Развитие нервной системы |
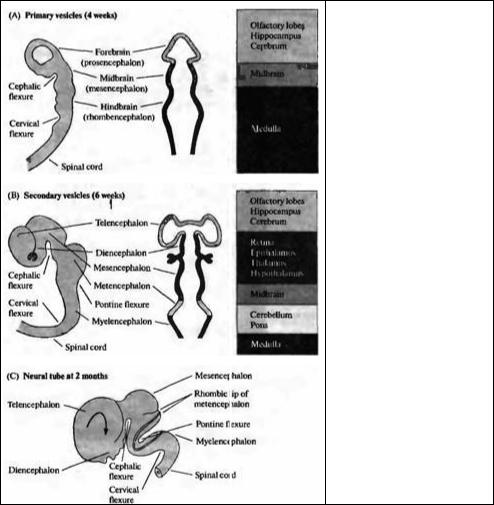
Рис. 23.3. Ранний период развития головного мозга человека. Вид сбоку на развивающийся мозг и схематический горизонтальный срез через пузыри. (А) На 4 неделе развития ЦНС человека состоит из трех первичных пузырей. (В) К 6 неделе развития можно различить пять вторичных пузырей. (С) В возрасте 2 месяцев серии складок, сужений и утолщений образуют различные области мозга. Дальнейшее развитие характеризуется преимущественным ростом конечного мозга в форме буквы «С» (показано стрелками).
Fig. 23.3. Early Human Brain Development. Lateral views of the developing brain and corresponding schematic horizontal sections through the vesicles. (A) At 4 weeks of development the human CNS consists of three primary vesicles. (B) At 6 weeks of development five secondary vesicles can be distinguished. (C) By 2 months, a series of flexures, constrictions, and swellings form the various regions of the brain. Further development is dominated by rapid growth of the telencephalon in a "C" shape (arrow). (After Nolte, 1988.)
ванию нервной пластинки. Нервная пластинка представляет собой полоски продолговатых нейроэктодермальных клеток, из которых в дальнейшем будет сформирована нервная система.
Нервная пластинка затем утолщается по своему краю, края ее приподнимаются, образуя нервные валики, которые сливаются друг с другом по средней линии, образуя полую нервную трубку (рис. 23.2). Процесс, благодаря которому осуществляется формирование нервной пластинки и превращение ее в нервную трубку, называется нейруляцией Некоторые из клеток, расположенные по краям нервных валиков, остаются между нервной трубкой и вышележащей эктодермой. Эти клетки формируют нервный гребень. Клетки нервного гребня мигрируют в направлении от нервной трубки и образуют большое разнообразие периферических тканей, в том числе нейроны и клетки-спутники в сенсорной, симпатической и парасимпатической нервной системе, клетки надпочечника, пигментные клетки эпидермиса, кости и соединительные ткани в области головы.
По мере развития в передней (головной или ростральной) части нервной трубки формируется серия утолщений, сужений и изгибов, образующих отдельные анатомические области мозга (рис. 23.3). Каудальная часть нервной трубки остается относительно простой по строению, сохраняя вид полой
Глава 23. Развитие нервной системы |
527 |
трубки, и в дальнейшем на ее основе формируется спинной мозг.
Образование предшественников нервных клеток и глии
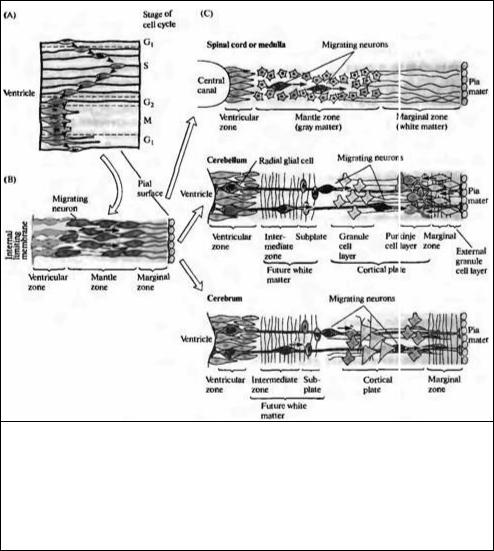
Стенка нервной трубки первоначально состоит из одного слоя быстро делящихся клеток. Каждая клетка простирается от полостного, вентрикулярного края к наружной, пиальной поверхности. По мере того, как каждая клетка проходит свой клеточный цикл, ее ядро мигрирует вверх и вниз от вентрикулярной (желудочковой) к пиальной поверхности (рис. 23.4А). Синтез ДНК происходит в то время, когда ядро расположено у пиальной поверхности; во время деления клетки (cytokinesis) ядро лежит у вентрикулярной поверхности и на некоторое время клетка теряет связь с пиальной поверхностью. После деления одна или обе дочерние клетки могут потерять контакт с вентрикулярной поверхностью и мигрировать вверх. Этот момент является переломным: они превращаются либо в нейроны, либо в клетки глии. Если они мигрируют в направлении от вентрикулярной зоны, большинству этих клеток суждено стать нейронами в постмитотической фазе (то есть они уже никогда не смогут делиться). Предшественники глиальных клеток, с другой стороны, могут делиться даже после достижения своего окончательного месторасположения.
По мере того, как все больше и больше формируется постмитотических клеток, нервная трубка утолщается и приобретает трехслойное строение: наиболее глубоко расположена вентрнкулярная зона (где продолжается деление клеток), затем средняя зона в виде мантии (плащевая зона), где находятся тела мигрирующих нейронов, а также поверхностный краевой (маргинальный) слой, состоящий из отростков более глубоко расположенных клеток (рис. 23.4В). Такая трехслойная структура сохраняется в спинном и продолговатом мозге (рис. 23.4С). В других областях, таких как кора больших полушарий и мозжечок, некоторые нейроны мигрируют в краевую зону и формируют корковую пластинку, которая затем созревает и формирует взрослую кору.
Миграция нейронов в ЦНС
Во многих областях развивающегося мозга, например в коре полушарий и мозжечке, миграция нейронов зависит от радиально расположенных глиальных клеток (глава 8). Эти клетки поддерживают контакты с вентрикулярной и пиальной поверхностями нервной трубки. По мере утолщения нервной трубки из-за продолжающегося деления клеток в области вентрикулярного слоя и накопления нейронов в промежуточной зоне мантии и кортикальной пластинки, радиальные клетки глии значительно удлиняются. При помощи детального изучения развития мозжечка и коры методами световой и электронной микроскопии Ракич с коллегами8) показали, что нейроны движутся по «этажерке» из радиально расположенных клеток глии для того, чтобы достичь своего правильного расположения в коре (см. рис. 8.10). Наблюдения за мутантными мышами9) и опыты на клетках, выращенных в культуре10) подтвердили данное наблюдении о миграции нейронов. Сейчас начинают описываться белки, управляющие подобной миграцией нейронов. Они представляют собой нейрональный гликопротеин, известный как астротактин (astrotactin)11) и изоформы семейства рецепторов интегрина к молекулам адгезии экстрацеллюлярного матрикса (о чем мы поговорим ниже)12).
Нейроны способны мигрировать также и в направлении тех областей нервной системы, где нет радиально расположенных глиальных клеток. Одна интересная популяция нейронов,
экспрессируюших гормоны гонадотропина (gonadotropin-releasing hormone (GnRH)),
мигрирует с периферии в ЦНС (см. также главу 16). GnRH клетки проходят расстояние около 2 мм, мигрируя из области обонятельной ямки, эктодермальное производное (плакода) которой также образует эпителий носа, в область гипоталамуса по пути предварительно спроецированного туда аксона13).
Белки адгезии внеклеточного матрикса и миграция клеток нервного гребня
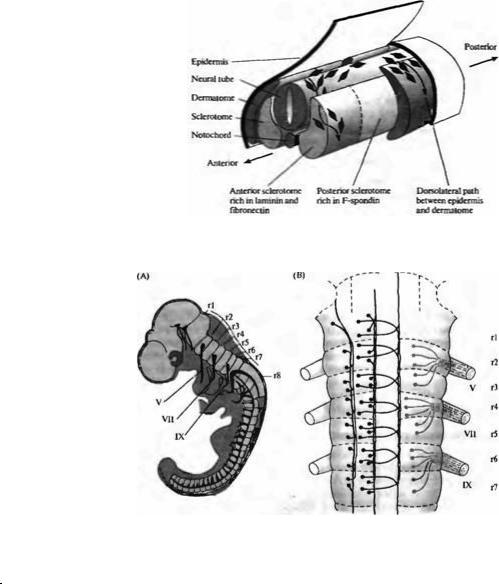
В периферической нервной системе клетки нервного гребня не мигрируют по путям предварительно спроецированного аксона или вдоль структур глиальных клеток. Их миграция управляется механизмами привлечения и отталкивания при контакте с поверхностью клеток и компонентами внеклеточного матрикса. Два белка адгезии внеклеточного матрикса, ламинин (laminin) и фибронектин (fibronectin), концентрируются вдоль путей миграции клеток нервного гребня у эмбриона (рис. 23.5)14). Агенты, которые угнетают
528 |
Раздел IV. Развитие нервной системы |
Рис. 23.4. Дифференцировка клеток стенок нервной трубки. (А) Расположение ядер в клетках в первичной нервной трубке в зависимости от стадии клеточного цикла. (В) Клетки, становясь постмитотическими, мигрируют прочь от вентрикулярной зоны и образуют плащевую зону. Их отростки направляются в краевую зону. (С) Трехслойная организация сохраняется в спинном мозге. В мозжечке и головном мозге нейроны мигрируют в краевую зону и образуют там многослойную кору.
Fig. 23.4. Differentiation of the Walls of the Neural Tube. (A) The position of the nuclei in cells in the primitive neural tube varies during the cell cycle. (B) Cells become postmitotic, migrate away from the ventricular zone, and form the mantle zone. Their processes make up the marginal zone. (C) The three-layered organization persists in the spinal cord. In the cerebellum and cerebrum, neurons migrate into the marginal zone to form a multilayered cortex. (After Gilbert, 1991.)
взаимодействие между рецепторами интегрина и компонентами внеклеточного матрикса, блокируют перемещение in vitro клеток нервного гребня вдоль поверхности, покрытой молекулами адгезии внеклеточного матрикса, а также миграцию in vivo клеток нервного гребня. Другой белок внеклеточного матрикса, Ф-спондин (F-spondin), экспрессируется в областях, граничащих с маршрутами миграции клеток нервного гребня. Он ингибирует перемещение клеток гребня, таким образом направляя их на правильный путь15).
§ 2. Региональная спецификация нервной ткани
У взрослых животных клетки различных областей нервной системы имеют существенные отличия в своем фенотипе в зависимости от той функции, которую они выполняют. Клетки мозжечка отличаются от клеток коры полушарий, и оба типа клеток — от сетчатки. Каким образом происходит формирование таких различных фенотипов клеток в процес-
Глава 23. Развитие нервной системы |
529 |
|||||||||
Рис. 23.5. Миграция клеток нервного |
|
|
||||||||
гребня в область туловища у |
|
|
||||||||
эмбриона цыпленка. Клетки гребня |
|
|
||||||||
мигрируют |
|
вентрально |
через |
|
|
|||||
передний склеротом — регион, |
|
|
||||||||
богатый |
|
ламинином |
и |
|
|
|||||
фибронектином, — и избегают |
|
|
||||||||
задний склеротом, который богат Ф- |
|
|
||||||||
спондином. Эти клетки становятся |
|
|
||||||||
нейронами |
|
дорзальных |
рогов |
|
|
|||||
спинного |
мозга |
и |
автономных |
|
|
|||||
ганглиев, шванновскими клетками, и |
|
|
||||||||
хромаффинными |
|
|
|
клетками |
|
|
||||
надпочечников. На более поздних |
|
|
||||||||
этапах |
развития |
клетки |
нервного |
|
|
|||||
гребня |
мигрируют |
дорзолатерально |
|
|
||||||
под |
|
эпидермис |
и |
формируют |
|
|
||||
образующие пигмент меланоциты. |
|
|
||||||||
Fig. |
23.5. |
Migration |
of |
Neural Crest |
|
|
||||
Cells in the trunk region of the chick |
|
|
||||||||
embryo. Crest |
cells |
migrate |
ventrally |
region rich in F-spondin. These cells become neurons of the dorsal root |
||||||
through the anterior sclerotome, a |
and autonomie ganglia, Schwann cells, and adrenal chromaffin cells. Later |
|||||||||
region |
rich |
in laminin and fibronectin, |
in development, crest cells migrate dorsolaterally beneath the epidermis to |
|||||||
and avoid the posterior sclerotome, a |
form pigment-producing melanocytes. |
|||||||||
|
|
|
|
|
|
|
|
|||
Рис. |
|
23.6. |
Развитие |
|
|
|
|
|||
заднего |
|
|
мозга |
|
|
|
|
|||
позвоночных |
β |
виде |
|
|
|
|
||||
сильно |
|
|
|
|
|
|
|
|
|
|
сегментированной |
|
|
|
|
|
|
||||
структуры. |
|
|
(А) |
|
|
|
|
|||
Диаграмма |
|
|
|
|
|
|
|
|
||
трехдневного |
эмбриона |
|
|
|
|
|||||
цыпленка, |
|
|
|
|
|
|
|
|
||
иллюстрирующая |
|
|
|
|
|
|
||||
сегментарную |
|
|
|
|
|
|
|
|||
организацию |
|
|
|
|
|
|
|
|||
ромбомеров (r1-r8) в |
|
|
|
|
||||||
заднем |
мозге. |
(В) |
|
|
|
|
||||
Паттерн |
организации |
|
|
|
|
|||||
клеток в ромбомерах r1- |
|
|
|
|
||||||
r7 |
трехдневного |
мозга |
|
|
|
|
||||
цыпленка. |
Ретикулярные |
|
|
|
|
|||||
нейроны |
(слева) |
и |
|
|
|
|
||||
брахиомоторные нейроны |
|
|
|
|
||||||
(справа) |
|
образуют |
|
|
|
|
||||
сегментарный |
|
|
|
|
|
|
|
|||
повторяющийся паттерн. |
|
Conspicuously Segmented Structure. (A) Diagram of a 3-day chick embryo, illustrating |
||||||||
Мотонейроны и их аксоны |
|
|||||||||
|
the segmentai arrangement of rhombomeres (rl-r8) in the hindbrain. (B) Pattern of cell |
|||||||||
образуют |
|
черепно- |
|
|||||||
|
|
organization in rhombomeres rl to r7 of the 3-day chick embryonic hindbrain. Reticular |
||||||||
мозговые нервы V, VII |
и |
|
||||||||
|
neurons (left side) and branchiomotor neurons (right) occur in a segmentally repeating |
|||||||||
IX пары. |
|
|
|
|
|
|||||
|
|
|
|
|
pattern. Motor neurons |
send their axons into cranial nerves V, VII, and IX. (After |
||||
Fig. |
23.6. |
The |
Vertebrate |
|
||||||
|
Keynes and Lumsden, 1990, and Lumsden and Krumlauf, 1996.) |
|||||||||
Hindbrain Develops as a |
|
|
||||||||
се развития? Как и у других клеток, фенотип нейрона определяется тем, какие гены он экспрессирует, что, в свою очередь, контролируется факторами транскрипции, белками, которые связываются с регуляторными зонами одного или нескольких генов и влияют на процессы их транскрипции. Развитие характеризуется последовательной и иерархической экспрессией факторов транскрипции, каждый из которых влияет на экспрессию последующего и ограничивает конечный фенотип клетки.
Исследованию региональной спецификации нервной ткани в мозгу позвоночных зна-

530 |
Раздел IV. Развитие нервной системы |
Рис. 23.7. Сегментарная экспрессия генов в ромбомерах с r1 до r8 в заднем мозге позвоночных. Серые полоски указывают ромбомеры, в которых происходит экспрессия генов; черные полоски указывают высокий уровень экспрессии. Ранние факторы транскрипции, рецептор тирозинкиназы семейства Eph и его лиганды образуют сегментарный паттерн ромбомеров Семейство гомеобоксных генов Нох определяет судьбу клеток в пределах каждого ромбомера в зависимости от сегмента. Данные получены на эмбрионах цыплят и мышей.
Fig. 23.7. Segmentai Expression of Genes in Rhombomeres rl to r8 of the vertebrate hindbrain. Grey bars indicate rhombomeres in which each gene is expressed; black bars indicate a high level of expression. Early transcription factors, Eph family receptor tyrosine kinases, and
Eph ligands establish the segmentai pattern of rhombomeres. The Hox homeobox genes determine the fate of cells within each rhombomere in a segmentally specific way. Data from chick and mouse. (After Lumsden and KrumUuf,
1996.)
чительно помогло то, что были открыты гомологи генов плодовой мухи дрозофилы, которые определяют расположение и зависящую от расположения дифференцировку клеток эмбриона. Эти гены оказались сходными с генами позвоночных и часто выполняют сходные функции. Большинство из этих генов кодирует факторы транскрипции.
Гомеотические гены и сегментация
Удивительными примером подобного сходства в функционировании генов у настолько разных животных являются результаты исследований заднего мозга позвоночных. В отличие от всего остального мозга позвоночных, задний мозг эмбриона (rhombencephalon) имеет четкое сегментарное строение. Каждый сегмент его демонстрирует общий паттерн нервной дифференцировки, однако от сегмента к сегменту дифференцировка имеет свои особенности (рис. 23.6). Было идентифицировано несколько генов, паттерны экспрессии которых на ранних стадиях развития коррелируют с границами сегментов заднего мозга (рис. 23.7)16). Эти гены делятся на две категории:
(1) Гены первой категории играют роль в создании общей структуры, состоящей из повторяющихся сегментных единиц. Некоторые гены этой группы кодируют факторы транскрипции (kreisler, Krox-20), другие кодируют рецептор тирозинкиназы (Sek-l по Sek- 4) или его лиганды (Elf-2). (Рецептор тирозинкиназы представляет собой трансмембранный белок, у которого внутриклеточный домен, представляющий собой фермент тирозинкиназу, активируется при связывании лиганда с внеклеточным доменом.)
(2) Вторая категория содержит гены, которые определяют судьбу каждого сегмента. Эти гены образуют высококонсервативное семейство Нох генов.
Свойства Нох генов были впервые описаны у дрозофилы, у которой они регулируют гомеостаз17). Гомеотические гены представляют собой управляющие гены, которые координируют экспрессию многих других генов во время развития. Например, мутация гомеотических генов семейства Нох у дрозофилы приводит к тому, что одна часть тела заменяется другой; таким образом на месте антенны может развиться нога. Гомеотические гены содержат консервативную последовательность ДНК, гомеобокс. Гомеобокс кодирует последовательность из 60 аминокислот, которые
Глава 23. Развитие нервной системы |
531 |
распознают и связываются с определенной последовательностью ДНК серии подчиненных генов. Каждый гомеотический ген, таким образом, координирует экспрессию большого числа генов, которые вместе определяют строение одного сегмента эмбриона.
Сегментарный паттерн экспрессии генов семейства Нох наблюдается в заднем мозгу цыплят и грызунов, что приводит нас к предположению, что Нох гены могут играть роль гомеотических управляющих генов, регулирующих процессы развития позвоночных и создания определенных структур относительно рострокаудальной оси в определенных областях заднего мозга эмбриона. Данные, полученные при помоши трансплантации, выключения определенных генов и эктопической экспрессии, согласуются с этими идеями18· 19). Дополнительным доказательством является изучение мутаций Нох генов и других
гомеобоксных генов у человека, которые приводят к изменениям в определенных областях
ЦНС20·21).
Следующий очевидный вопрос: а что определяет паттерн экспрессии Нох генов? Ответом, по крайне мере частично, является градиент ретиноевой кислоты22). Ретиноевая кислота вырабатывается в Гензеновском узелке, который называется Шпемановским организатором (Spemann organizer) у эмбрионов птиц и позвоночных (см. рис. 23.1). Но ретиноевая кислота не просто активирует транскрипцию всех Нох генов: была описана систематическая разница чувствительности различных генов Нох семейства к ретиноевой кислоте. Таким образом, диффузия ретиноевой кислоты из Гензеновского узелка способствует формированию градиента, который играет большую роль в упорядоченной экспрессии различных Hax генов в рострокаудальном направлении в заднем мозге.
Хорда и базальная пластинка
Строение и функпчонирование нервной системы позвоночных варьируют в дорзовентральном и рострокаудальном направлении. Например, полоска специализированных глиальных клеток, названных базальной пластинкой (floor plate), расположена по средней линии вдоль вентральной поверхности спинного мозга. Соседние, более латерально расположенные базальиые области нервной трубки образуют мотонейроны, более дорзальные зоны дают начало интернейронам, и самые дорзальные области образуют нервный гребень.
Характерные свойства вентральной хорды, такие как дифференцировка базальной пластинки и образование мотонейронов, регулируются сигналом из спинного мозга (notochord)23). Таким образом, если пересадить в эмбрион еше одну хорду, рядом с нервной трубкой, то это приведет к формированию второй базальной пластинки и второй группы мотонейронов (рис. 23.8), а если у эмбриона удалить хорду, то ни мотонейроны, ни базальная пластинка не формируются.
Сигналы из хорды, которые управляют формированием клеток базальной пластинки и мотонейронов, являются продуктами транскрипции гена Sonic hedgehog24). Белок Sonic hedgehog синтезируется клетками хорды (а затем также клетками базальной пластинки), концентрируется на их поверхностях и диффундирует к соседним клеткам. Высокий уровень Sonic hedgehog на поверхности хорды приводит к формированию клеток базальной пластинки из клеток нервной трубки. Более низкий уровень ведет к экспрессии гомеотического гена (Mkx-2.2), что вызывает развитие клеток в висцеральные мотонейроны25). Еще более низкий уровень Sonic hedgehog вызывает транскрипцию Рах-6, которые угнетают экспрессию Nkx-2.2, что позволяет клеткам развиваться по их основному пути и становиться соматическими мотонейронами.
Общая схема региональной дифференцировки
Рострокаудальный и дорзовентральный градиенты факторов транскрипции определяют локальную идентификацию клеток в пределах ЦНС26·27). Эти же факторы способны приводить к развитию довольно различных свойств в зависимости от того, в каком месте эмбриона они экспрессируются. Например, белок Sonic hedgehog определяет вентральный фенотип вдоль рострокаудальной оси, приводя к образованию мотонейронов в спинном мозге, серотонинергических нейронов в передней части заднего мозга, дофаминергических нейронов в задней части заднего мозга, глазодвигательных нейронов в передней области среднего мозга28· 29). Подобным же образом другие факторы транскрипции (ВМР-4 и ВМР-7) приводят к образованию дорзального фенотипа30). Общим правилом является то, что возможные пути развития плюрипотентной клетки-предшественницы в определенной области развивающейся

532 |
Раздел IV. Развитие нервной системы |
|
|
Рис. 23.8. Индуцированное хордой образование базальной пластинки и двигательных нейронов во время развития спинного мозга. (А и В) Специфическая окраска при помощи антител к клеткам базальной пластинки
(F). (А) Нормальный эмбрион цыпленка. (В) Добавление клеток второй хорды (N) вызывает образование второй базальной пластинки. (С и D) Специфическая окраска при помощи антител к клеткам базальной пластинки, двигательным нейронам и афферентам спинального ганглия. (С) Нормальный эмбрион. (D) При удалении хорды клетки базальной пластинки и двигательной пластинки отсутствуют, а клетки спинального ганглия (D) занимают необычное вентральное положение. Аксоны сенсорных интернейронов, которые обычно идут в составе вентральной части спинного мозга, сейчас формируют пучки волокон, которые покидают спинной мозг (стрелка).
Fig. 23.8. The Notochord Induces Formation of the Floor Plate and Motor Neurons during development of the spinal cord. (A and B) Specific labeling with an antibody that recognizes floor plate cells (F). (A) Normal chick embryo. (B) Addition of a second notochord (N) induces a second floor plate. (C and 0) Specific labeling with an antibody that recognizes floor plate cells, motor neurons, and dorsal root ganglion afférents. (С) Normal embryo. (D) If the notochord is removed, floor plate cells and motor neurons are absent and the dorsal root ganglia (D) occupy an unusually ventral position. Axons of sensory interneurons, which normally run within the ventral cord, now form a fiber bundle the exits the cord (arrowhead). (After Placzek et al., 1991.)
нервной системы в первую очередь ограничиваются ее положением относительно переднезадней оси, например, путем экспрессии Нох генов (рис. 23.9)31). Возможные клеточные фенотипы в дальнейшем еще более ограничиваются с учетом дорзовентрального положения по средней линии при помощи таких посредников, как Sonic hedgedog.
§ 3. Происхождение нейронов и клеток глии
У позвоночных индукционные взаимодействия между клетками играют важную роль в определении их дальнейшей судьбы. У более простых организмов судьба клетки может быть определена автономно на основании ее происхождения.
Происхождение клеток и индукционные взаимодействия в простых нервных системах
Происхождение клеток наиболее хорошо исследовано на примере простых беспозвоночных, таких как пиявка, кузнечик, плодовая муха и маленькая нематода Caenorhabditis elegans31)--34). В этих препаратах возможно проследить развитие каждой клетки и исследовать формирование таких характеристик, как свойства мембраны, трансмиттеры, рост аксонов и их ветвление. У С. elegans, которая содержит всего около 300 нейронов, эмбрион настолько маленький и прозрачный, что мож-
