
Nikolls_-_Ot_neyrona_k_mozgu
.pdf
Глава 24. Денервация |
и |
регенерация |
|
|
|
синоптических связей |
|
603 |
Цитированная литература
1.Matthey, R. 1925. С. R.Soc. Βiol. 93: 904-906.
2.Purves, D., and Lichtman, J.W. 1985. Principles of Neural Development. Smaller Sunderland, MA.
3.von Bernhardi, R., and Muller, K.J. 1995. J. Neurobiol. 27: 353-366.
4.Grafstein, B. 1983. In Nerve, Organ, and Tissue Regeneration: Research Perspectives. Academic Press, New York, pp. 37-50.
5.Lieberman, A. R. 1971. Int. Rev. Neurobiol. 14: 49-124.
6.Muller, H.W., and Stoll, G. 1998. Curr, Opin. Neural. 11: 557-562.
7.Purves, D. 1975. J. Physiol. 252: 429-463.
8.Brenner, H. R., and Johnson, E. W. 1976. J. Physiol. 260: 143-158.
9.Brenner, H. R., and Martin, A. R. 1976. J. Physiol. 260: 159-175.
10.Matthews, M. R., and Nelson. V. H. 1975. У. Physiol. 245:91-135.
11.Rotshenker, S. 1988. Trends Neurosci. II: 363-366.
12.Lindsay, R. M. 1996. Cita Found. Symp. 196: 39-48.
13.Nja, A., and Purves, D. 1978. Physiol. 277:55-75.
14.Cannon, W. В., and Rosenbluth, A. 1949. The Supersensitivity of Denervated Structures: Law of Denervation. Macmillan, New York.
15.Purves, D., and Sakmann, B. 1974. J. Physiol. 239: 125-153.
16.Belmar, J., and Eyzaguirre, C. 1966. J. Neuro-physiol. 29: 425-441.
17.Brown, G. L. 1937. J. Physiol. 89: 438-461.
18.Kallen, R.G., et al. 1990. Neuron 4: 233-242.
19.Guth, L. 1968. Physiol. Rev. 48: 645-687.
20.Spector, S.A. 1985. J. Neurosci. 5: 2189-2196.
21.Attaix, D., et al. 1994. Reprod. Nutr. Dev. 34: 583-597.
22.Axelsson, J., and ThesIefC, S. 1959. J. Physiol L 147: 178-193.
23.Miledi, R. 1960. J. Physiol. 151: 1-23.
24.Katz, В., and Miledi, R. 1964. J. Physiol. 170: 389-396.
25.Fambrough, D. M. I979. Physiol. Rev. 59: 165-227.
26.Salpeter, M. M., and Loring, R. H. 1985. Prog. Neurobiol. 25: 297-325.
27.Scheutze, S. M., and Role, L. M. 1987 Annu. Rev. Neurosci. 10: 403-457.
Annu. Rev. Neurosci. 10: 403-457.
28.Merlie, J. P., and Sanes, J. R. 1985. Nature 317: 66-68.
29.Bursztajn, S., Berman, S.A., and Gilbert, W. 1989. Proc. Nat/. Acad. Sci. USA 86: 2928-2932.
30.Fontaine, В., and Changeux,).-P. 1989, J. Cell Biol. 108: 1025-1037.
31.Salpeter, M. M., and Marchaterre, M. 1992. J. Neurosci. 12: 35-38.
32.Sala, C., et al. 1997. У. Neurosci. 17: 8937-8944.
33.Xu, R., and Salpeter, M. M. 1995. /. Cell. Physiol. 165: 30-39.
34.Mishina, M., et al. 1986. Nature 321: 406-411.
35.Shyng, S.-L, and Salpeter, M. M. 1990. J. Neurosci. 10: 3905-3915.
36.O'Malley, J., Moore, C.T., and Salpeter, M. M. 1997. У. Ceil Blol. 138: 159-165.
37.Lemo, T., and Rosenthal, J. 1972. /. Physiol 221: 493-513.
38.Berg, D. K., and Hall, Z. W. 1975. J. Physiol. 244: 659-676.
39.Witzemann, V., Brenner, H-R., and Sakmann, B. mi. J. Cell Biol, 114: 125-141.
40.Purves, D., and Sakmann, B. 1974. У. Physiol. 237: 157-182.
41.Duclert, A., and Changeux, J. P. 1995. Physio! Rev. 75: 339-368.
42.Fumagalli, G., et al. 1990. Neuron 4: 563-569.
43.Rotzler, S., Schramek, H., and Brenner, H. R. 1991. Nature 349: 337-339.
44.Shyng, S.-L, Xu, R., and Salpeter, M. M. 1991. Neuron 6: 469-475.
45.Caroni, P., et
et al. I993./.Meurosci. 13: 1315-1325.
al. I993./.Meurosci. 13: 1315-1325.
46.Lemke, G. 1996. Mol Celt. Neurosci. 7: 247-262.
47.Si, J., and Mei, L 1999. Brain Res. MoL. Brain Res. 67: 18-27.
48.Tansey, M. G., Chu, G. C, and Merlie, J. P. 1996. У. Cell Biol. 134:465-476.
49.Si, J., Luo, Z., and Mei, L 1996. Biol. Chem. 271: 19752-19759.
50.Altiok, N.. Altiok, S., and Changeux, J. P. 1997. EMBOJ. 16: 717-725.
51.Harris, A.J., Kuffler, S.W., and Dennis, M. L. 1971. Proc. R. Soc. Land. B 177: 541-553.
52.Wilson Horch, H.L., and Sargent, P. B. 1996. У. Neurosci. 16: 1720-1729.
53.Sargent, P. В., and Pang, D. Z. 1989. /. Neurosci. 9: 1062-1072.
54.Kuffler, S.W., Dennis. M.J., and Har-ris, A.J. 1971. Proc. R. Soc. Land. В 177: 555-563.
55.Dennis, M. J., and Sargent, P. B. 1979. J. Physiol 289: 263-275.
56.Sargent, P. В., et al. 1991. У. Neurosci. 11: 3610-3623.
57.Streichert, L. С, and Sargent, P. Β. Ι992. /. Physiol. 445: 249-260.
58.McEachern, A. E., Jacob, M. H., and Berg, D. K. 1989. У. Neurosci. 9: 3899-3907.
59.Loring, R. H., and Zigmond, R. E. 1987. /. Neurosci. 7: 2153-2162.
60.Dunn, P. M., and Marshall, L. M. 1985. /, Physiol 363:211-225.

604 |
Раздел IV. Развитие |
|
нервной |
|
системы |
61.Wilson Horch, H.L., and Sargent, P. В. 1995. J. Neurosci. 15: 7778-7795
62.Jansen,J.K.S.,etal. 1973. Менее 181: 559-561.
63.Son, Y. J., and Thompson, W. J. 1995. Neuron 14: 125-132.
64.Thesleff, S. 1960. /. Physiol. 151: 598-607.
65.Fex, S., et al. 1966. /. />Л>>«о/. 184: 872-882.
66.Diamond, J., and Miledi, R. 1962. /. Physiol. 162: 393-408.
67.Frank, E., and Fischbach, G. D. 1979. У. CellBiol. 83: 143-158.
68.Van Essen, D., and Jansen, J. K. 1974. Ada Physiol. Seancl. 91: 571-573.
69.Cohen, M.W. 1972. Brain Res. 41: 457-463.
70.Meier, T., and Wallace, B.C. 1998. BioEssays 20: 819-829.
71.Brown, M. C., Holland, R. L, and Hop-kins, W.G. 1981. Anna. Rev Neurosci. 4: 17-42.
72.Brown, M.C.. and Ironton, R. 1977. Nature 265: 459-461.
73.Duchen, L.W., and Strich, S.J. 1968. Q. J. Exp. Physiol. 53: 84-89.
74.Holland, R. L. and Brown, M. C. 1980. Science 207:649-651.
75.Son, Y-J., and Thompson, W. J. 1995. Neuron 14: 133-141.
76.Bowling, D., Nicholls, J. G., and Parnas, 1. 1978. /. Physiol. 282: 169-180.
77.Blackshaw, S. E., Nicholls, J. G., and Parnas, 1. 1982. У. Physiol. 326: 261-268.
78.Parnas, 1. 1987. J. Exp. Biol. 132: 231-247.
79.Korneev, S., et al. 1997. /ην. Neurosci. 3:185-192.
80.Délier, T., and Frotscher, M. 1997. Prog. Neuro-biol. 53: 687-727.
81.Guenard, V., Xu, X. M., and Bunge, M. B. 1993. Sem. Neurosci. 5: 401-411.
82.Heumann, R., et al. 1987. J. Cell Biol 104: 1623-1631.
83.Meyer, M., et al. 1992. J. Cell BioL 119: 45-54.
84.Johnson, E. M., jr., Taniuchi, M., and DiStefano, P.S. 1988. Trends Neurosci. Il: 299-304.
85.Skene, J. H. P., and Shooter, E. M. 1983. Proc. Nail. Acad. Sci. USA So: 4169-4I73.
86.Fullerton, S. M., Strittmatter, W. J., and Matthew, W.D. 1998. Exp. Neurol. 153: 156-163.
87.Goodrum, J. F, et al. 1995. /. Neurochem. 64: 408-416.
88.Banner, L R., and Patterson, P. H. 1994. Proc. NailAcad. Sd. USA9\: 7109-7113.
89.Livesey, F.J., et al. 1997. Nature 390: 614-618.
90.Wigston, D. J., and Sanes, J. R. 1985. /. Neurosci. 5: 1208-1221.
91.Purves, D., Thompson, W., and Yip, J.W. 1981. / Physiol 3l 3:49-63.
3:49-63.
92.Laskowski, M. В., and Sanes, J. R. 1988. / Neurosci. 8: 3094-3099.
93.Fawcett, J. W., and Keynes, R. J. 1990. Anna. Rev. Neurosci. 13: 43-60.
94.Dennis, M. J., and Yip, J. W. 1978. J. Physiol 274: 299-310.
95.Bixby, J. L. and Van Essen, D. C. 1979. Nature 282: 726-728.
96.Langley, J. N.. and Anderson, H. К. 1904. У. Physiol. 31:365-391.
97.Grinnell, A. D., and Rheuben, M. B. 1979. J. Physiol. 289:219-240.
98.Kuffler, S. W, and Vaughan Williams, E. M. 1953. J. Physiol. 121:289-317.
99.Miledi, R., Stefani, E., and Steinbach, A. B. 1971. У. Physiol. 217: 737-754.
100.Close, R. 1.1972. Physiol. Rev. 52: 129-197. 101. Salmons, S., and Sreter, F. A. 1975. У. Anat. 120: 412-415.
102.Sanes, J. R., Marshall, L M., and McMahan, U. J. 1978. /. Cell Biol. 78: 176-198.
103.Burden, S.J., Sargent, P. В., and McMahan, U. J. 1979. J. Cell Biol. 82: 412-425.
104.McMahan, U.J., and Slater, C. R. 1984. У. Cell Biol. 98: 1453-1473.
105.Anglister, L, and McMahan, U. J. 1985. У. Cell Biol. 101: 735-743.
106.McMahan, U.J., and Wallace, B.C. 1989. Dev. Neurosci. 11: 227-247.
107.Bowe, M.A., and Fallen, J. R. 1995. Annu. Rev. Neurosci. 18: 443-462.
108.McMahan, U.J. 1990. Cold Spring Harb. Symp. Quant. Biol. 50: 407-418.
109.Bray, G. M., et al. 1991. Ann. N. Y. Acad. Sci. 633: 214-228.
110.Nicholls, J., and Saunders, N. 1996. Trends Neurosci. 19: 229-234.
111.Schwab, M. E., and Bartholdi, D. 1996. Physiol. Лек 76:319-370.
112.Aguayo, A. J., et al. 1978. Neurosci. Left. 9: 97-104.
113.Davies, S. J. A., et al. 1997. Nature 390:680-683.
114.Fawcett, J. W., and Asher, P. A. 1999. Brain Res. Bull. 49: 377-391.
A. 1999. Brain Res. Bull. 49: 377-391.
115.Schwab, M. E., and Caroni, P. 1988. /. Neurosci. 8: 2381-2393.
116.Schnell, L, and Schwab, M. E. 1990. Nature 343: 269-272.
117.Bregman, B. S., et al. 1995. Nature 378: 498-501.
118.Z'Graggen, W.J., et al. 1998. У. Neurosci. 18: 4744-4757.
119.Rabchevsky, A. G., and Streit, W. J. 1997. /. Neurosci. Res. 47: 34-48.
120.Fitch, M.T., and Silver, J. 1999. In CNS Regeneration: Basic Sdence and Clinical Advances. Academic Press, San Diego, pp. 55-88.
121.Richardson, P. M., McGuinness, U. M., and Aguayo, A.J. 1980. Nature 284: 264-265.
122.Xu, X.M., et al. 1997. У. Neurocytol. 26: 1-16.

Глава 24. |
Денервация |
и регенерация |
|
|
|
синаптических |
|
связей |
|
605 |
123.Menei, P., et al. 1998. Ear. J, Neurosci. 10: 607-621.
124.Ramon-Cueto, A., et al. I998. У. Neurosci. 18: 3803-3815.
125.Li, Y., Field, P. M., and Raisman, G. I998. У. Neurosci. 18: 10514-10524.
126.David, S., and Aguayo, A. J. 1981. Science 214: 931-933.
127.Zagrebelsky, M., et aL 1998. /. Neurosci. 18: 7912-7929.
128.Treherne, J. M., et al. 1992. Proc. Nail. Acad. Sci. USA 89: 431-434.
129.Lepre, M., Fernandez, J., and Nicholls, J. G. 1998. Eur. J. Neurosci. 10: 2500-2510.
130.Saunders, N. R., et al. 1998. J. Neurosci. 18: 339-355-
131.Varga, Z. M., et al. 1995. Eur. J. Neurosci. 7: 2119-2129.
132.Keirstead, H. S., et al. 1995. У. Neurosci. 15: 6963-6974.
133.Bjorklund.A. 1991. Trends Neurosci. 14:319-322.
134.Ridley, R. M., and Baker, H. F. I99I. Trends Neurosci. 14: 366-370.
135.Bjorklund, A., et al. 1980. Broin Res. 199: 307-333.
136.Luskin, M. 1993. Neuron II: 173-189.
137.Radel, J. D., Kustra, D. )., and Lund, R. D. 1995. Neuroscience 68: 893-907.
)., and Lund, R. D. 1995. Neuroscience 68: 893-907.
138.Zhou, W., Raisman, G., and Zhou, C. 1998. Brain Res. 788: 202-206.
139.Zhou, W., et al. 1998. Broin Res. 792: 97-104.
140.Sotelo, C., and Alvarado—Mallart, R. M. 1991. Trends Neurosci. 14: 350-355.
141.Sotelo, C, etal. 1994. У Neurosci. 14: 124-133.
142.Martinez—Serrano, A., and Bjorklund, A. 1997. Trends Neurosci. 20: 530-538.
Глава 25. Критические периоды развития зрительной и слуховой систем
Последствия правильного и неправильного установления связей изучались в зрительной системе новорожденных котят и обезьян. Рецептивные поля нейронов сетчатки, латерального коленчатого тела и зрительной коры уже к рождению имели строение, аналогичное взрослым животным, кроме слоя 4 зрительной коры. К моменту рождения кортикальные клетки в слое 4 управляются обоими глазами, и в течение первых 6 недель жизни они формируют связи подобные таковым у взрослых, когда каждая клетка слоя 4 отвечает только на сигналы от одного глаза, в то время как клетки, локализующиеся в других слоях, продолжают получать бинокулярную информацию. Если в течение первых трех месяцев жизни один из глаз остается закрытым, это приводит к слепоте на этот глаз и потере его способности управлять кортикальными клетками. Кортикальные колонки, получающие сигналы от депривированного глаза, уменьшаются в размерах, в то время как колонки, получающие сигналы от противоположного, недепривированного, — увеличиваются.
Закрытие глаза у взрослого животного не влияет на колоночную архитектуру зрительной коры или на ответы корковых клеток. Во время критических периодов можно добиться обратного развития изменений, вызванных сенсорной депривацией, если открыть ранее закрытый глаз и закрыть недепривированный. Дополнительным доказательством наличия конкуренции между двумя глазами служит эксперимент, в котором оба глаза остаются закрытыми в раннем возрасте. Когда ни один из глаз не имеет преимуществ, продолжает развиваться нормальная колоночная архитектура, однако каждая клетка в коре при этом управляется только одним глазом. Подобным же образом при подрезании мышц глазного яблока у детенышей обезьян (что приводило к косоглазию (страбизму)), только небольшое количество нейронов получало сигналы от обоих глаз, хотя каждый глаз получал нормальное количество света. Роль функциональной активности в доминировании того или иного глаза также может быть показана в экспериментах, в которых блокада импульсов в обоих зрительных нервах при помощи тетродотоксина предотвращала разделение коры на колонки глазного доминирования. Спонтанная импульсная активность и нейротрофины (neurotrophins) могут также влиять на правильное формирование связей коры.
У незрелых совят развитие слуховой системы также значительно выражено в критические периоды. Призмы, помещенные перед глазами, приводят к смещенному расположению рецептивных полей. Таким образом возникает диспропорция между картами окружающего пространства в четверохолмии (tectum), соответствующими зрительным (верхние холмики) и слуховым (нижние холмики) ощущениям. В течение первых месяцев жизни это несоответствие корректируется в результате изменения карты окружающего пространства в слуховой коре. По прошествии критического периода подобного рода сдвиги становятся уже невозможны. У сов, выращиваемых в специальных условиях, когда они получают большое количество сенсорного опыта, критический период, в течение которого возможны изменения в связях коры, удлиняется. Эксперименты с сенсорной депривацией являются важными для понимания развития высших функций мозга.
Мы несколько раз подчеркивали, что для правильной работы нервной системы требуется высокая специфичность ее связей. Также понятно, что развитие связей между нейронами продолжается и после рождении на протяжении различного периода времени у разных животных. Например, котята рождаются слепыми на оба глаза. Если мы поднимем веко.
Глава 25. Критические периоды развития зрительной и слуховой систем |
607 |
чтобы свет попал в глаз, это приведет к сужению зрачка, хотя раньше этот котенок никогда не видел света и является полностью слепым1). К 10-му дню жизни котенка появляются первые признаки зрения, и, таким образом, он начинает распознавать объекты и паттерны. Когда котята вместо нормальных условий выращиваются в темноте, у них сохраняется зрачковый рефлекс, однако они остаются слепыми. Как полагают, имеется иерархия уровней восприятия, с «постоянными» и «переменными» связями, образующимися в разных частях мозга.
Изменения в функционировании зрительной системы во время развития порождают ряд вопросов. Каковы удельные доли генетических факторов и приобретаемого опыта в данном процессе? До какой степени те нейронные сети, которые необходимы для зрения, уже сформировались и готовы к работе к моменту рождения? Какое значение в их развитии имеет свет, падающий на сетчатку? В чем причина того, что котенок, выращенный в темноте, слепой: связано ли это с тем, что не сформировались какие-то связи в коре, или произошло разрушение каких-то ранее сформированных связей? Все эти концепции можно охарактеризовать одной фразой: «природа и воспитание»*). С накоплением знаний это выражение трансформировалось в «природа или воспитание» или даже более строго: «природа против воспитания». В этой главе будет показано, что оба эти фактора (как и следовало ожидать) являются необходимыми.
Зрительная система является удобным объектом для прямого изучения вопросов, связанных с развитием, потому что пункты переключения сигнала в коре (relay stations) легко достижимы и количество света, а также естественные стимулы можно легко варьировать. В пределах зрительной системы мы опять отдельно выделяем эксперименты, выполненные на обезьянах и кошках. Для достижения цели более удобно начать эту главу с подробного рассмотрения работ, результаты которых логически следуют из материалов, представленных в главах 20 и 21. Работы, выполненные на незрелой зрительной системе, дают основу для анализа других сенсорных систем, в частности слуховой системы амбарной совы (barn owl). Они также дают возможность предполагать, какие механизмы играют роль в модификации корковых связей в начальный период жизни.
§ 1. Зрительная система у новорожденных обезьян и котят
Имеется много данных об организации корковых связей, которые лежат в основе восприятия зрительной информации у взрослых кошек и обезьян. Простая клетка в коре избирательно «узнает» один строго определенный тип зрительных стимулов, такой как движение узкой вертикально ориентированной полоски света, расположенной в определенном месте зрительного поля обоих глаз. Подобного рода ответы возможны благодаря точным и определенным образом организованным связям между клетками коры, сетчатки и латерального коленчатого тела (главы 20 и 21). Естественным является любопытство: присутствуют ли эти клетки и связи уже в мозгу новорожденного животного, или они развиваются как результат приобретенного зрительного опыта, когда зрительные образы в раннем периоде жизни каким-то образом переориентируют случайный набор существующих связей, модифицируя его под определенную задачу.
Для изучения обезьян, не имеющих зрительного опыта, новорожденных обезьян отбирали сразу после рождения (или кесарева сечения), после чего за ними ухаживали таким образом, чтобы исключить зрительные стимулы. Для предотвращения формирования зрения до того периода, когда обезьяны станут достаточно взрослыми для изучения, проводили сшивание век или на роговицу накладывали полупрозрачный материал, который пропускал свет, однако изображение воспринималось очень размыто. Подобным же образом в течение первых недель жизни исследовались не имеющие зрительного опыта котята и хорьки2)--5).
Рецептивные поля и свойства кортикальных клеток новорожденных животных
Новорожденные обезьяны сразу проявляют выраженную зрительную активность и способны к фиксации взгляда. Ответы корковых нейронов во многом сходны с ответа-
*' В оригинале эта фраза звучит "Nature and nurture". — Прим перев.

Глава 25. Критические периоды развития зрительной и слуховой систем |
609 |
Рис. 25.2. Распределение глазного доминирования в зрительной коре новорожденной обезьяны. Клетки в группах 1 и 7 гистограммы управляются только одним глазом (ипсилатеральным или контралатераль ным). Все другие клетки получают сигналы от обоих глаз. В группах 2, 3, 5 и 6 один из глаз доминирует. В группе 4 оба глаза оказывают одинаковое влияние. (А) Нормальная взрослая обезьяна, (В) Нормальная 2-дневная обезьяна.
Fig. 25.2. Ocular Dominance Distribution in the visual cortex of newborn monkey. Cells in groups 1 and 7 of the histograms are driven by one eye only (ipsilateral or contralateral). All other cells have input from both eyes. In groups 2, 3, 5, and 6, one eye predominates. In group
4, both eyes have equal (A) Normal adult monkey. (B) Normal 2-day-old monkey. (After Wiesel and Hubel 1974.) influence.
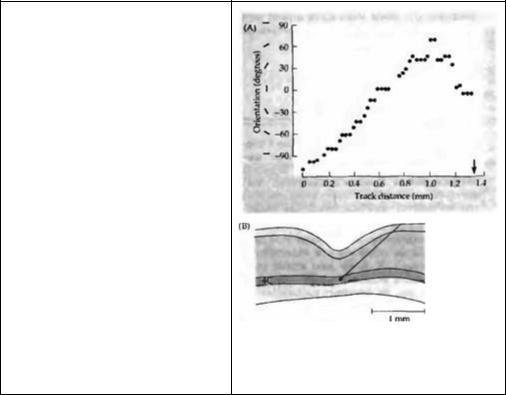
Рис. 25.3. Возрастная зависимость паттернов ветвления аксонов нейронов ЛКТ, заканчивающихся в слое 4, выявленных при введении пероксидазы хрена. (А) Аксон 17дневного котенка. Аксон разветвляется на большой непрерывной территории слоя 4 зрительной коры. (В) У взрослой кошки аксон нейрона ЛКТ заканчивается на двух различных лучках, между которыми находятся неокрасившиеся волокна, идущие от другого глаза.
Fig. 25.3. Age Dependence of
Branching Patterns of Axons from
Lateral Geniculate Nucleus ending in layer 4, labeled by injection with horseradish peroxidase. (A) Axon of a 17-day-old kitten. The axon spreads over a large uninterrupted territory in layer 4 of the visual cortex. (B) In the adult cat the geniculate axon ends in two discrete tufts, interrupted by unlabeled fibers coming from the other eye. (After Wiesel 1982.)
почтения. Однако они не отражают важной и поразительной разницы между новорожденными и взрослыми обезьянами, что касается свойств клеток слоя 4. В пределах этого слоя у новорожденных обезьян клетки управляются от обоих глаз, а после 6 недель развития — только от одного6). Вне слоя 4 кортикальные клетки новорожденных обезьян демонстриру-
610 |
|
|
|
|
|
|
|
Раздел IV. Развитие нервной системы |
||
Рис. |
|
|
|
25.4. |
|
|
|
|
||
Глазодоминантные |
|
|
|
|
|
|
||||
колонки |
|
в |
слое |
4 |
|
|
|
|
||
стриарной |
|
|
коры |
|
|
|
|
|||
зрительно |
«наивной» |
|
|
|
|
|||||
обезьяны |
и |
|
более |
|
|
|
|
|||
зрелого |
|
|
животного, |
|
|
|
|
|||
которое |
|
|
|
имело |
|
|
|
|
||
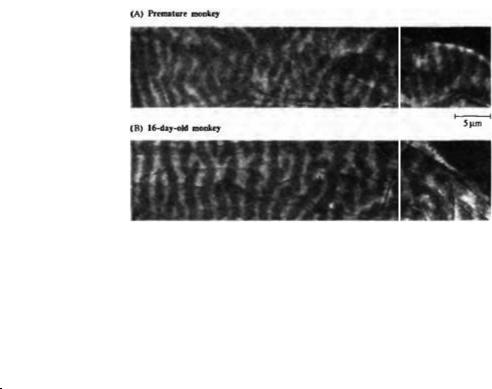
зрительный опыт. (А) |
|
|
|
|
||||||
Обезьяна была рождена на |
|
|
|
|
||||||
8 дней раньше срока, |
|
|
|
|
||||||
незрелой, |
при |
помощи |
|
|
|
|
||||
кесарева |
|
сечения. |
|
Для |
|
|
|
|
||
проведения |
|
сечения |
|
|
|
|
||||
использовались |
|
|
|
|
|
|
|
|||
инфракрасные |
очки |
и |
|
|
|
|
||||
операция |
проходила |
в |
|
|
|
|
||||
полной темноте. На второй |
|
|
|
|
||||||
день жизни в правый глаз |
|
|
|
|
||||||
был введен радиоактивный |
|
|
|
|
||||||
пролин, |
|
после |
|
чего |
|
содержащегося в нормальных световых условиях. За 9 дней до опыта в правый |
|
|||
животное |
держали |
в |
|
|
||||||
глаз ввели радиоактивный пролин. Границы колонок глазного доминирования |
||||||||||
темноте |
еще |
7 |
дней. |
|
||||||
Авторадиография |
|
|
|
хорошо различимы. |
||||||
|
|
|
|
|
|
|||||
показывает |
|
слой |
4 |
|
Fig. 25.4. Ocular Dominance Columns in Layer 4 of the visual cortex in a visually naive |
|||||
ипсилатеральной |
|
|
|
monkey and in an older animal that had been exposed to light. (A) The monkey was |
||||||
первичной |
зрительной |
|
||||||||
|
delivered 8 days prematurely by cesarean section. Infrared night vision goggles were |
|||||||||
коры. |
Уже |
различимы |
|
used in complete darkness for the delivery and for the injection of radioactive proline |
||||||
колонки |
|
|
глазного |
|
into the right eye 1 day later. The animal was maintained in complete darkness for 7 |
|||||
доминирования. |
|
|
(В) |
|
more days. The autoradiograph shows layer 4 of the ipsilateral primary visual cortex. |
|||||
Подобное |
сечение |
через |
|
Ocular dominance columns can be discerned. (B) Similar section through layer 4 in a |
||||||
слой |
4 |
16-дневного |
|
16 day-old |
monkey that had been born naturally and raised under normal lighting |
|||||
детеныша |
|
обезьяны, |
|
conditions. |
The right eye was injected with radioactive proline at 9 days. The |
|||||
рожденного в срок и |
|
|
|
boundaries of the ocular dominance columns are better defined. (After Morton and |
||||||
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
Hocking, 1996a; photographs kindly provided by J. Morton.) |
|||
ют ответы, аналогичные клеткам взрослых, за исключением того, что сигналы от некоторых клеток могут быть менее интенсивными или временно отсутствовать.
Формирование глазодоминантных колонок
Вслое 4 Ле Вей, Визель и Хьюбелъ7) (а также Ракич12·13), см. ниже) нашли важное и поразительное анатомическое различие между взрослыми и новорожденными. Причиной того, что клетки в пределах слоя 4 у новорожденных управляются обоими глазами
заключается в том, что ветвления нервных окончаний волокон из ЛКТ значительно перекрывают друг друга (рис. 25.3 и 25.4)8). Отдельные аксоны, достигающие слоя 4 из ЛКТ, у новорожденных простираются на более широкий участок, чем у взрослых. В результате зоны, получающие информацию от каждого из глаз, перекрываются. Это отличается от паттерна строения этого слоя у взрослых, когда глазодоминантные колонки, отвечающие на сигналы от правого или левого глаза, имеют четко определенные границы. На рис. 25.4 показано, что глазодоминантные колонки могут быть обнаружены у обезьяны еще при рождении, хотя их развитие к этому моменту еще не закончено.
Границы колонок у обезьян, не имеющих зрительного опыта, выглядят более смазанными и менее четко определены9'.
Втечение первых 6 месяцев жизни животного аксоны из ЛКТ, направляющиеся в слой 4, подвергаются ретракции, что приводит к уменьшению ветвистости, напоминая «подрезанное» дерево (рис. 25.3). Таким образом, в пределах слоя 4 устанавливаются отдельные корковые области, каждая из которых управляется только одним глазом (рис.
25.5). Сравнимые изменения во время развития происходят и на предыдущем этапе зрительного пути, в латеральном коленчатом теле10, 11). Волокна зрительного нерва от обоих глаз врастают в ЛКТ, области их ветвления значительно перекрываются, до тех пор пока они не разделятся на отдельные слои. Постнатальное развитие колонок глазного доминирования и слоев ЛКТ происходит и у животных, выращенных в полной темноте. Эти морфологические наблюдения могут объяснить изменения в глазном доминировании.
Глава 25. Критические периоды развития зрительной и слуховой систем |
611 |
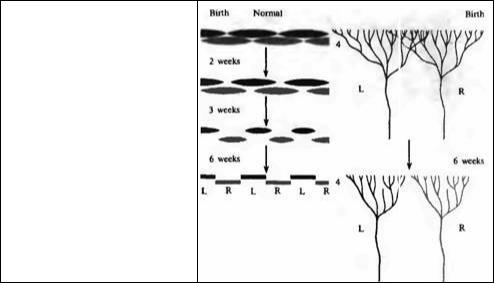
Рис. 25.5. Ретракция окончаний аксонов ЛКТ в пределах слоя 4 коры в течение первых 6 недель жизни. На рисунке показано перекрытие сигналов, исходящих из правого (R) и левого (L) глаза, имеющееся с рождения, и последующее разделение в различные кластеры, связанные с соответствующими колонками глазного доминирования. Перекрытие при рождении больше у котят, чем у детенышей обезьян.
Fig. 25.5. Retraction of Lateral Geniculate
Nucleus Axons ending in layer 4 of the cortex during the first 6 weeks of life. The figure shows the overlap of inputs from the right (R) and left (L) eyes present at birth and the subsequent segregation into separate clusters corresponding to ocular dominance columns.
The overlap at birth is greater in kittens than in monkeys. (After Hubel and Wiesel 1977.)
происходящие во время развития, и служить их количественной мерой.
«Пятна» в области первичной зрительной коры, выявленные при окрашивании на цитохромоксидазу, определяются анатомически уже к моменту рождения, что связано с нормальным развитием глазодоминантных колонок9). Полоски в зрительной области 2 (зона 18) четко различимы у новорожденных обезьян, не имеющих зрительного опыта
(рис. 25.6).
Развитие строения коры в эмбрионе
Ракич7· 12· 13), Хортон и Хокинг9) показали, до какого уровня происходит развитие глазодоминантных колонок и «пятен» цитохромоксидазы к моменту рождения. В глаза обезьян на различных стадиях развития в матке были введены радиоактивные аминокислоты (глава 20) так, чтобы пометить клетки в области ЛКТ и их аксоны в пределах слоя 4 коры. Колонки и «пятна» также выявляли при помощи окраски на цитохромоксидазу (глава 21). На ранних стадиях развития зародыша в отсутствии какихлибо зрительных сигналов почти все зоны управления правого и левого глаза перекрывались. За несколько дней до рождения колонки глазного доминирования, «пятна», толстые и тонкие полоски зрительной зоны 2 были различимы и имели нормальные пропорции по отношению друг к другу.
У котят колонки глазного доминирования в зрительной коре четко разграничиваются только к возрасту около 30 дней8). Хорьки и сумчатые рождаются даже на более ранних стадиях развития и, следовательно, большая степень формирования зрительных сетей у них происходит в постнатальном периоде.
Генетические факторы в развитии зрительных сетей
Принципиальное утверждение этого параграфа не является большим сюрпризом: определенные свойства основных нейронных сетей формируются еще до того, как животное получает шанс что-либо увидеть. Другие свойства развиваются только в течение первой недели жизни. Ретракция аксонов ЛКТ в слое 4 является неким аналогом событий, происходящих при развитии нервно-мышечного синапса у новорожденных крыс: при рождении каждая концевая пластинка получает сигналы от множества мотонейронов, но в течение нескольких недель большинство аксонов подвергается ретракции, таким образом каждое мышечное волокно получает иннервацию только от одного мотонейрона 14). (глава 23).
В результате генетических дефектов в зрительной системе появляются интересные и
612 |
Раздел IV. Развитие нервной системы |
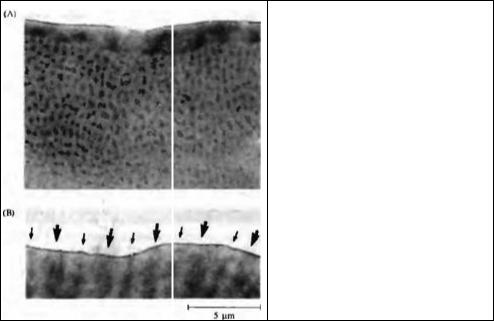
Рис. 25.6. Архитектура зрительной коры новорожденной обезьяны, не имеющей зрительного опыта (как на рис. 25.4А), рожденной кесаревым сечением на 8 дней раньше срока и содержащейся в темноте в течение 7 дней. (А) Окраска на цитохромоксидазу, выявляющая пятна в зоне 17. (В) Толстые и тонкие полоски в зрительной зоне 2, отмеченные толстыми и тонкими стрелками.
Fig. 2S.6. Architecture of the Visual Cortex of Newborn Monkey without visual experience (as in Figure 25.4A), delivered by cesarean section 8 days prematurely and kept in total darkness for 7 days. (A) Cytochrorne oxidase staining shows blobs in area 17.
(B) Thick and thin stripes in visual area 2, labeled with thick and thin arrows. (After Morton and Hocking,
1996a; photographs kindly provided by J. Morton.)
важные системные аномалии. Например, цветовая слепота у мышей линии reeler, которые имеют аномальное строение зрительной коры15· 16). Также примером может служить дефект гена альбинизма у сиамских кошек и у альбиносов, который не только определяет цвет глаз животного через синтез меланина, но также способствует развитию косоглазия в результате систематических ошибок в соединениях между нейронами зрительной коры17)--19). В этой главе мы больше уделим внимания аномальному сенсорному опыту в ранние периоды жизни, и тому, как это может коренным образом изменить анатомию и физиологию центральной нервной системы на всю оставшуюся жизнь животного.
§ 2. Последствия аномального сенсорного опыта в ранние периоды жизни
В этом разделе описывается три типа экспериментов, большой частью выполненных впервые еше Хьюбелем и Визелем, когда животное лишали нормальных зрительных стимулов6· 20). Они изучали физиологические ответы нервных клеток и структуру зрительной системы после (1) закрытия век обоих глаз; (2) предотвращения развития образного зрения (form vision), при сохранном доступе света в глаз; (3) при нормальном попадании света и формирующемся образном зрении, но в условиях искусственно вызванного страбизма (косоглазия) с одной стороны. Эти манипуляции вызывали значительное нарушение в функции и анатомии коры. Особенностью работы Хьюбеля и Визеля является то, что все результаты являются хорошо воспроизводимыми, явными и впечатляющими.
Развитие слепоты после закрытия век
Когда веки одного глаза были сшиты вместе на протяжении первых двух недель жизни, обезьяны и котята продолжали развиваться нормально и использовали неоперированный глаз. Через 1—3 месяца, однако, когда открывался оперированный глаз, а нормальный закрывался, становилось очевидным, что животные были практически полностью слепы на оперируемый глаз. При этом котята ударялись о находящиеся вокруг предметы и падали со стола6· 21), но не было обнаружено какого-либо значительного физиологического дефекта в оперированных глазах, зрачковый рефлекс оставался нормальным, как и электроретинограмма, которая представляет собой карту суммарной электрической активности
