
Nikolls_-_Ot_neyrona_k_mozgu
.pdf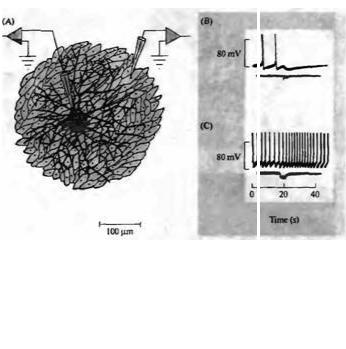
Глава 23. Развитие нервной системы |
543 |
|
|
|
|
|||||||||
Рис. |
23.17. |
Отдельные |
|
|
|
|
|
|
|
|||||
нейроны |
|
|
симпатических |
|
|
|
|
|
|
|
||||
ганглиев |
способны |
выделять |
|
|
|
|
|
|
|
|||||
как ацетилхолин, так и |
|
|
|
|
|
|
|
|||||||
норадреналин |
в |
синапсах |
|
|
|
|
|
|
|
|||||
на |
культуре |
клеток |
сердца. |
|
|
|
|
|
|
|
||||
(А) |
|
|
|
Микрокультура, |
|
|
|
|
|
|
|
|||
содержащая |
|
отдельные |
|
|
|
|
|
|
|
|||||
симпатические |
|
нейроны, |
|
|
|
|
|
|
|
|||||
выращенные |
|
на |
островке |
|
|
|
|
|
|
|
||||
клеток |
|
сердечной |
мышцы. |
|
|
|
|
|
|
|
||||
(В) Короткая серия импульсов |
|
|
|
|
|
|
|
|||||||
в |
нейроне |
(10 Гц, |
показано |
|
|
|
|
|
|
|
||||
в |
виде |
|
отклонений нижней |
|
|
|
|
|
|
|
||||
записи) |
|
|
|
|
вызывает |
|
|
|
|
|
|
|
||
ингибирование |
спонтанной |
|
|
|
|
|
|
|
||||||
активности миоцита из-за |
|
|
|
|
|
|
|
|||||||
высвобождения АХ |
(верхняя |
|
|
|
|
|
|
|
||||||
запись). |
|
(С) |
Добавление |
|
|
|
|
|
|
|
||||
атропина (10--7 М) блокирует |
|
|
|
|
|
|
|
|||||||
тормозный |
холинергический |
|
|
|
|
|
|
|
||||||
ответ, |
|
что |
|
приводит |
к |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|||||||
проявлению |
|
возбуждающего |
|
(A) A microculture containing a single sympathetic neuron |
grown on an island of |
|
||||||||
эффекта, |
|
вызванного |
|
|
|
|
||||||||
|
cardiac muscle cells. (B) A brief train of impulses in the neuron |
(10 Hz, deflection of |
||||||||||||
высвобождение |
|
|
|
lower trace) produced inhibition of spontaneous myocyte activity due to release of |
||||||||||
норадреналина. |
|
|
|
|||||||||||
|
|
|
ACh (upper trace). |
(C) Addition of atropine (10~ |
7 |
M) blocked the inhibitory |
||||||||
|
|
|
|
|
|
|
|
|
|
|||||
Fig. 23.17. Single Neurons from |
|
cholinergic response, revealing an excitatory effect which is due to the release of |
||||||||||||
Sympathetic |
|
Ganglia |
Can |
|
norepinephrine. (After Furshpan et al., 1976.) |
|
|
|
|
|||||
Release Both Acetylcholine and |
|
|
|
|
|
|
|
|||||||
Norepinephrine at synapses on |
|
|
|
|
|
|
|
|||||||
heart cells in culture. |
|
|
|
|
|
|
|
|
|
|||||
крысенка и вырашивались в культуре в отсутствие клеток других типов, они все содержали фермент тирозингидроксилазу, синтезировали и образовывали запасы катехоламинов73). Однако, если нейроны вырашивались в присутствии определенных типов ненейрональных клеток, таких как клетки сердечной мышцы или потовых желез, нейроны постепенно переставали синтезировать катехоламины и начинали синтезировать вместо этого фермент холинацетилтрансферазу и ацетилхолин74). Для того, чтобы окончательно установить, что подобные изменения возможны в одиночных нейронах, они культивировались на микроостровках клеток миокарда (рис. 23.17)75). Нейроны быстро вытягивали свои отростки и образовывали синаптические контакты с клетками миокарда. Сначала эти синапсы были чисто адренергическими, затем, по прошествии нескольких дней, клетки начинали выделять вместе норадреналин и ацетилхолин. В конечном счете передача становилась полностью холинергической.
Фактор, который вызывал холинергическую дифференцировку симпатических нейронов, был выделен из среды клеток сердца и клонирован76). Оказалось, что это фактор ингибирующий развитие лейкемии (leukemia inhibitory factor, LIF), белок, который ранее был описан по его способности индуцировать дифференцировку клеток иммунной системы. Два других близких цитокина, цилиарный нейротрофический фактор (ciliary neurotrophic factor, CNTF) и кардиотрофин-1, как было обнаружено, вызывают сходные эффекты в культуре нейронов72). Все эти три фактора активируют рецепторный комплекс (называемый LlFR/3-gpl30 рецептор), блокирование которого угнетает развитие холинергических свойств нейронов, культивируемых вместе с клетками потовых желез. Однако иннервация потовых желез у мутантных мышей, не имеющих L1F и CNTF, формируется нормально, а результаты других экспериментов заставляют предположить, что кардиотрофин-1 не является фактором, который может вызывать переключение в клеточной иннервации потовых желез in vivo. Хотя еще не описано генетическое выключение всех трех генов, вполне возможно, что скоро будет описан новый, еще не идентифицированный фак-
544 |
Раздел IV. Развитие нервной системы |
|
|
|
|
|
|
|
|
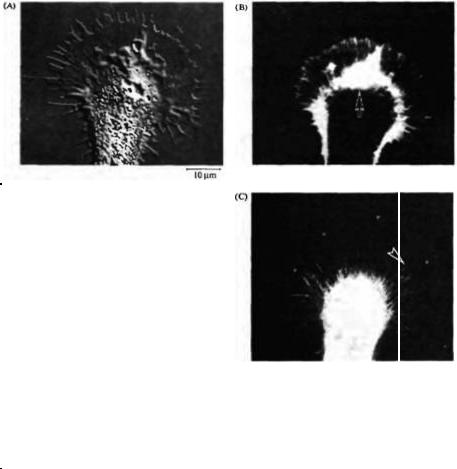
Рис. 23.18. Морфология конусов роста. (А) Конус |
|
|
|||||
роста в интерференционном микроскопе. (В) |
|
|
|||||
Флуоресцентная микрофотография, |
показывающая |
|
|
||||
распределение |
филамент |
ного |
актина, |
|
|
||
визуализируемого вместе со связанным с |
|
|
|||||
родамином фаллоидином. Актиновые филаменты |
|
|
|||||
ориентированы |
в |
виде |
филоподий, |
или |
|
|
|
микроспайков, на периферии от конусов роста; |
|
|
|||||
случайным образом ориентированные филаменты |
|
|
|||||
часто концентрируются вокруг |
центрального |
|
|
||||
домена (показано стрелкой). (С) Распределение |
|
|
|||||
микротрубочек, визуализированное при помощи |
|
|
|||||
антитубулиновых антител и вторичных антител, |
|
|
|||||
связанных с флуоресцеином. Микротрубочки |
|
|
|||||
сконцентрированы в аксоне. Большинство из них |
|
|
|||||
прерывается на центральном домене конуса роста; |
|
|
|||||
некоторые (показано стрелкой) направляются к |
cone--randomly oriented filaments are often concentrated |
||||||
границам конуса роста (показано звездочками). |
near the central domain (arrow). (C) Microtubule distribution |
||||||
|
|
|
|
|
|
||
Fig. 23.18. The Morphology of Growth Cones. (A) |
visualized with antitubulin antibodies and fluorescein- |
||||||
Growth cone observed by differential interference |
conjugated secondary antibodies. Microtubules are |
||||||
contrast microscopy. (B) Fluorescence micrograph |
concentrated in the axon. Most terminate in the central |
||||||
showing the distribution of filamentous actin visualized |
domain of the growth cone; some (arrowhead) extend toward |
||||||
with rhodamineconjugated phalloidin. Actin filaments |
the growth cone margin (asterisks). (After Forscher and |
||||||
align with filopodia, or microspikes, in the periphery of |
Smith, 1988; micrographs kindly provided by S.3. Smith.) |
||||||
the growth |
|
|
|
|
|
|
|
тор потовых желез, являющийся лигандом для LIFRβ-gpl30 рецептора.
§ 4. Рост аксона
Конус роста, удлинение аксона и роль актина
Кончик растущего аксона удлиняется, образуя конус роста. Рамон-и-Кахаль первым обнаружил, что конус роста является частью аксона, ответственной за навигацию и удлинение его в направлении конечной цели (рис. 23.18). Конус роста удлиняется и сокращается за счет широких пластинок, называемых ламмелиподиями, и тонких, остроконечных выпячиваний, называемых филоподиями Филоподий достигают размеров в несколько десятков микрометров и могут удлиняться и сокращаться, как бы ощупывая субстрат во всех направлениях77). Филоподий адгезируют к определенному субстрату и тянут конус роста в этом направлении.
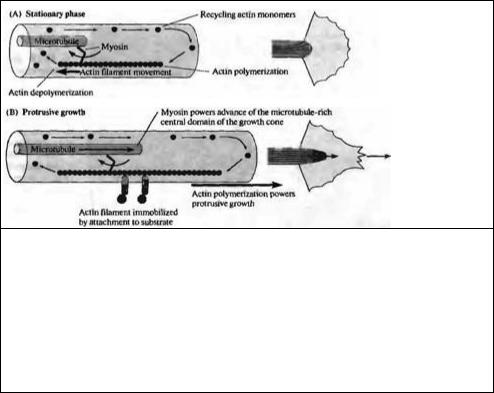
Актин играет ключевую роль в подвижности конуса роста (рис. 23.19) 78)--80). Как ламеллиподии, так и филоподий богаты филаментным актином и веществами, ингибирующими полимеризацию актина, такими как грибной токсин цитохалазин В, обездвиживающий конусы роста. Выпячивание и ретракция ламеллиподий и филоподий, а также движение вперед самого конуса роста, скорее всего, управляется двумя процессами: (1) полимеризацией и разборкой актиновых филаментов и (2) зависимой от миозина транслокацией актиновых филаментов прочь от ведущего края конуса роста. Оба процесса ис-
Глава 23. Развитие нервной системы |
545 |
Рис. 23.19. Модель подвижности конусов роста на основе актина. (А) Поперечный срез (слева) и вид сверху (справа) на конус роста в стационарной фазе. Миозин, связанный с микротрубочками, обеспечивает движение актиновых филаментов в направлении назад, в то время как в филаментах постоянно происходит процесс полимеризации со стороны ведущего края конуса роста и деполимеризация в центре. (В) Аналогичные изображения конуса роста во время роста. Актиновые филаменты иммобилизировались присоединением к субстрату. Полимеризация актина в этом случае приводит к продвижению конуса роста, в то время как миозин обеспечивает движение микротрубочек вперед, продвигая центральный домен конуса роста.
Fig. 23.19. Model for Actin-Based Motility of Growth Cones. (A) Cross section (left) and top view (right) of a growth cone in stationary phase. Microtubule-attached myosin powers rearward movement of actin filaments, while filaments are undergoing continuous polymerization at the leading edge of trie growth cone and depolymerization centrally. (B) Similar views of a growth cone during protrusive growth. Actin filaments are immobilized by attachment to the substrate. Actin polymerization now causes protrusion of the growth cone, while myosin cycling moves microtubules forward, advancing the central domain of the growth cone. (After Suter et al., 1998.)
пользуют энергию гидролиза АТФ и могут управляться белками, связывающими актин. Кальций, протеинкиназы и другие внутриклеточные вторичные посредники управляют активностью актин-связывающих белков. Например, остановка роста и ретракция конуса роста, два частых события в процессе роста аксонов, связаны с входящим током кальция и
увеличением частоты кратковременных повышений концентрации кальция в цитоплазме клетки81· 82).
Молекулы адгезии клетки и внеклеточного матрикса и рост аксона
Молекулы клеточной адгезии управляют ростом аксона, обеспечивая наиболее благоприятное окружение для вытягивания конуса роста. Клеточные молекулы адгезии представляют собой трансмембранные или связанные с мембраной гликопротеины, характеризующиеся структурными мотивами своих внеклеточных частей, которые во многом гомологичны постоянным доменам иммуноглобулинов и фибронектина 3 типа (рис. 23.20). Представителями надсемейства этих иммуноглобулинов (Ig) являются клеточные молекулы адгезии (N-CAM), молекулы адгезии нейроглии САМ (NgCAM), TAG-1, MAG, и DCC83). Эти молекулы обеспечивают адгезию клеток друг к другу посредством гетерофильных связей между различными надсемействами иммуноглобулинов (например, связь между NrCAM и TAG-1). Дополнительно присутствующей везде молекулой клеточной адгезии является молекула N-кадгерина (N-cadherin, рис. 23.20), которая обеспечивает кальций-зависимую адгезию между клетками84).
В культуре клеток экспрессия N-CAM и N-кадгерина в клетках приводит к их агрегации, вытягиванию аксонов в сторону клеточных субстратов, но не субстратов внеклеточного матрикса, а также соединению отдельных растущих аксонов в пучки (фасцикулы, fascicles). Стимуляция роста аксонов молекулами клеточной адгезии не обеспечивается просто «липкостью» субстрата; она управляется активацией рецепторов, связанных с тиро1инкиназой, например рецептора к фактору

546 |
Раздел IV. Развитие нервной системы |
Рис. 23.20. Два класса молекул адгезии нервных клеток. (А) N-кадгерин способствует гомофильной кальций-зависимой адгезии. (В) Члены надсемейства иммуноглобулинов характеризуются многочисленными повторами связанных друг с другом дисульфидными мостиками циклов, которые гомологичны доменам, впервые описанным в постоянной части молекул иммуноглобулина. Многие из этих молекул клеточной адгезии также содержат несколько доменов, сходных с повторами в фибронектине III типа (показано в виде прямоугольников). У различных видов животных имеется большое количество гомологичных белков со сходными именами.
Fig. 23.20. Two Classes of |
|
|||
Neural |
Cell |
|
Adhesion |
|
Molecules. |
(A) |
N-cadhenn |
(B) Members of the immunoglobulin superfamily are characterized by multiple repeats |
|
mediates |
|
homophilic, |
||
calcium-dependent |
cell |
of disulfide-linked loops homologous to domains first characterized in the constant |
||
adhesion. |
|
|
|
region of immunoglobulin molecules. Many of these cell adhesion molecules also |
|
|
|
contain multiple domains similar to trie type III repeat of fibronectin (rectangles). |
|
|
|
|
|
|
|
|
|
|
Multiple names denote homologous proteins in different species. |
роста фибробластов (fibroblast growth factor, FGF). Рецептор FGF включает внутриклеточный каскад, связанный с фосфорилированием тирозина, что приводит к удлинению аксона. Белковая тирозинфосфатаза, фермент, удаляющий остатки фосфата с тирозина, также участвует в регулировании этих сигналов. Молекулы адгезии внеклеточного матрикса, включая ламинин, фибронектин, тенасцин (Л, цитотактин), а также перлецан, тоже являются благоприятным субстратом для роста нервных отростков85· 86). Эти гликопротеины с большой массой имеют две или более сходные субъединицы, удерживаемые вместе благодаря дисульфидным мостикам (рис. 23.21). Каждая субъединица характеризуется повторяющимися структурными мотивами. Белки внеклеточного матрикса взаимодействуют с клетками через семейство рецепторов, называемых интегринами. Было идентифицировано большое количество изоформ α и β- субъединиц интегрина. Каждая αβ комбинация приводит к формированию рецепторов с различными свойствами. Интегрины обеспечивают структурные связи между белками внеклеточного матрикса и внутриклеточным актиновым цитоскелетом, регулируя форму клетки и ее миграцию. Кроме того, они активируют внутриклеточные сигнальные пути, которые управляют ростом клетки, пролиферацией и дифференцировкой87).
Исследования при помощи специальных блокирующих антител показывают, что конусы роста редко используют только один субстрат для своего движения; несколько типов молекул адгезии клетки и внеклеточного матрикса могут обеспечивать рост нервных отростков у определенных типов нейронов. Например, для полного ингибирования роста аксонов в сторону шванновской клетки необходимо применять одновременно антитела к
Ll/NgCAM, N-кадгерину и интегринам. Один тип антител сам по себе не может помешать росту аксона88· 89).

Глава 23. Развитие нервной системы |
547 |
|
|
Рис. 23.21. Белки внеклеточного матрикса, опосредующие адгезию клеток к субстрату и отталкивание. (А) Схематическое представление доменной структуры цепей, состоящей из фибронектина, ламинина (А цепь), перцелана и тенасцина-С, а также участков, к которым присоединяются клетки, коллаген, гепарин, фибронектин, интегрин, фибрин и альфа-дистрогликан. S указывает на расположения остатков цистеина, которые образуют дисульфидные мостики между цепочками. Тенасцин-С содержит как связывающие, так и отталкивающие домены; основной его эффект, однако, отталкивание клеток и конусов роста. (В) Молекулы, изображенные в определенном масштабе. Все, кроме перцелана, являются олигопротеинами, цепи связаны друг с другом дисульфидными мостиками. Пунктирной линией показан гепарансульфат 90 и 170 нм длиной, связанный с N терминальным доменом перцелана. (Из Engel Л., 1992.)
Fig. 23.21. Extracellular Matrix Proteins that mediate cell-substrate adhesion and repulsion. (A) Schematic representations of the domain structure of the chains that comprise fibronectin, laminin (A chain), perlecan, and tenascin-C, and the sites at which cells, collagen, heparin, fibronectin, integrin, fibrin, and α-dystroglycan bind. S indicates positions of Cys residues involved in interchain disulfide bridging. Tenascin-C contains both binding and repulsive domains; the predominate effect of the whole protein is repulsion of cells and growth cones. (B) Molecules drawn approximately to scale. All but perlecan are oligomeric proteins; the chains are linked by disulfide bonds.
Dashed lines indicate the 90to 170-nm-long heparan sulfate chains attached to the N-terminal domain of perlecan. (After Engel, J., 1992.)
548 |
Раздел IV. Развитие нервной системы |
§ 5. Управление ростом аксона
Аксоны нервных клеток могут достигать 1 метра и более в длину, образуя синапсы в определенном месте на строго определенной клетке в области, где имеется большое количество других потенциальных клеток-мишеней. Две основные теории, касающиеся того, каким образом устанавливается такая специфичность в синаптических связях во время развития, были предложены в первой четверти двадцатого века. Согласно одной, нейроны и их мишени заранее запрограммированы на образование определенных синаптических связей90). Другая теория считает, что первоначально связи устанавливаются более или менее случайно, а затем часть из них реорганизовывается благодаря влияниям на нейроны со стороны клеток-мишеней, в результате чего происходит устранение ошибочных синапсов и гибель неправильно соединенных клеток91). Экспериментальные доказательства, полученные к настоящему времени, говорят в пользу того, что рост аксонов и образование синаптических связей является селективным процессом; аксон направляется строго к своей цели благодаря определенным сигналам в своем окружении92).
Навигация аксона, зависящая и не зависящая от клетки-мишени
Какие внеклеточные сигналы управляют конусом роста? Рамон-и-Кахаль сначала предложил хемоаттрактантную модель управления аксоном, согласно которой конусы роста аксонов следуют по градиенту концентрации некоторых молекул, вырабатываемых клетками-мишенями. Такой механизм возможен для роста аксона, когда расстояние между телом нейрона и его мишенью очень короткое. Например, Лумсден и Дэвис изучали рост аксонов из ганглия тройничного нерва, расположенного в голове мыши, в соседние эпителиальные ткани, расстояние до которых составляло менее 1 мм93) (эти аксоны в конечном счете образовывали сенсорную иннервацию вибрисс, глава 18). Если развивающийся ганглий тройничного нерва помещался в культуру вблизи эксплантантов из нескольких периферических тканей, нервные отростки росли из ганглия в направлении собственной клетки-мишени, игнорируя другие ткани. Эксплантаты эпителия тканимишени оказывали подобное действие на рост аксонов только в том случае, если они брались у эмбриона в период становления иннервации.
В противоположность этому, способность аксонов спинальных мотонейронов расти в направлении конечностей не зависит от наличия мышечной клетки-мишени. Это было показано путем удаления в раннем периоде сомита, из которого развивается мускулатура конечностей94). Аксоны мотонейронов направляются нормально из спинного мозга, врастают в конечность и образуют определенный паттерн мышечных нервов, даже в отсутствие мышцы. Таким образом, факторы, которые управляют ростом аксонов мотонейронов к определенной мишени на конечности, не выделяются мышцами, с которыми аксоны в конечном итоге образуют связи.
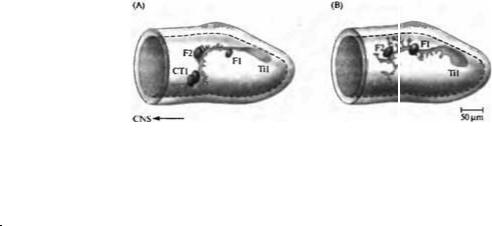
Рис. 23.22. Конусы роста |
|
|
|
|||||
периферических |
нейронов |
|
|
|
||||
используют |
|
клетки- |
|
|
|
|||
ориентиры для навигации в |
|
|
|
|||||
конечностях кузнечика. |
(А) |
|
|
|
||||
В |
нормальном |
эмбрионе |
|
|
|
|||
аксоны |
Ti1 |
нейрона |
|
|
|
|||
встречают на своем пути в |
|
|
|
|||||
центральную |
нервную |
|
|
|
||||
систему |
серию |
клеток- |
|
|
|
|||
ориентиров: клетки Fl, F2 и |
|
|
|
|||||
две |
клетки |
СТ1. |
(В) Если |
|
|
|||
Fig. 23.22. Growth Cones of Peripheral Neurons Rely on Guidepost Cells to navigate |
|
|||||||
СТ1 клетку убить на ранней |
|
|
|
|||||
through the limb of the grasshopper. (A) In normal embryos, the axon of the Til neuron |
||||||||
стадии |
развития, нейрон |
|
encounters a series of guidepost cells on its route to the central nervous system: Fl, |
|||||
Ti1 |
образует |
несколько |
|
F2, and two CT1 cells. (B) If the CT1 cells are killed early in development the Til |
||||
аксональных |
веточек |
из |
|
neuron forms several axonal branches at the site of cell F2, with growth cones |
||||
точки, где находится F2, и |
|
extending in abnormal directions. (After Bentley and Caudy, 1983.) |
||||||
конусы |
|
|
роста |
|
|
|
||
направляются |
|
в |
|
|
|
|||
неправильном |
|
|
|
|
|
|||
направлении. |
|
|
|
|
|
|||
Глава 23. Развитие нервной системы |
549 |
Навигация по клеткам-ориентирам (guidepost cells)
Когда дистанция от нейрона до его цели составляет больше чем несколько сотен микрон, его путь обозначен специальными промежуточными целями. Например, конус роста, идущий от сенсорной клетки конечностей у развивающегося кузнечика, делает несколько резких поворотов на своем пути в ЦНС (рис. 23.22)95). Эти повороты происходят в тот момент, когда конус роста касается так называемых клеток-ориентиров (guidepost cells)96· 97). Такое поведение указывает на наличие взаимодействия с клетками-ориентирами, ответственными за перенаправление конусов роста. Этими клетками чаше всего являются незрелые нейроны. Эти взаимодействия можно продемонстрировать при помощи удаления клеток-ориентиров лучом лазера до того, как их достигнет конус роста. В этом случае не происходит соответствующего изменения в траектории движения конуса роста.
Синаптические взаимодействия с клетками-ориентирами
В некоторых случаях аксоны образуют кратковременные синаптические контакты с клеткамиориентирами во время развития. В развивающемся гиппокампе, например, аксоны из энторинальной коры сначала образуют синапсы с временной популяцией нейронов, клетками Кахаля—Ретциуса98· 99). Позднее, по мере появления гранулярных клеток и их созревания, энторинальные аксоны покидают клетки Кахаля—Ретциуса и образуют связи с дендритами гранулярных клеток. После этого клетки Кахаля—Ретциуса исчезают. В другом примере аксоны нейронов из ядра ЛКТ в зрительной системе млекопитающих достигают развивающуюся корковую пластинку раньше, чем образуются их синаптические мишени — пирамидные клетки слоя 4. Поэтому аксоны ядра ЛКТ образуют синапсы с нейронами подпластинки 100), которые образуются в раннем эмбриогенезе. Нейроны подпластинки лежат под развивающейся корковой пластинкой, и им суждено исчезнуть вскоре после рождения101). Через нескольких недель, когда пирамидные клетки слоя 4 достигают своего месторасположения в коре, аксоны из ЛКТ разрывают свои связи с нейронами подпластинки и направляются в кору, чтобы образовать связи, характерные для взрослого животного. Если нейроны подпластинки удалить в раннем периоде развития местной аппликацией нейротоксинов, аксоны ядра ЛКТ прорастают за пределы развивающейся зрительной коры и не могут образовать синаптических связей со своими мишенями102).
Механизмы управления аксоном
Молекулы, которые управляют конусом роста, действуют четырьмя основными путями: как аттрактанты или репелленты, на короткой или длинной дистанции. В табл. 23.1 представлено большое количество управляющих молекул и рецепторов, которые мы обсуждаем в этой главе. Некоторые коротко-дистантные сигналы управления аксоном обеспечиваются посредством контакта конуса роста с клеточной поверхностью или с белками адгезии внеклеточного матрикса, которые были описаны ранее в этой главе как промоторы роста аксона103). Молекулы адгезии и их рецепторы могут также играть ведущую роль в связывании отдельных аксонов в пучки (так называемая фасцикуляция). Характер роста аксона и иннервация клеткимишени in vivo и в культуре клеток нарушалась при изменении активности специфических молекул адгезии или их рецепторов, в генетических экспериментах с выключением определенных генов, а также при добавлении определенных типов антител 104)--106).
Другое влияние молекул внеклеточного матрикса на растущий аксон показано в экспериментах на отдельных клетках, выделенных из ЦНС пиявки и растущих в культуре (рис. 23.23)107). Субстраты, которые содержат тенасцин или ламиннн, способствуют не только быстрому образованию нервных отростков у нейронов пиявки, но также влияют на характер роста этих отростков и на распределение кальциевых каналов в клетке. Различные нейроны поразному отвечают на определенные молекулы внеклеточного матрикса. Таким образом возникает экономная схема, когда несколько молекул адгезии могут обеспечивать разнообразные эффекты.
С другой стороны, изучение поведения конуса роста в клеточной культуре показывает, что клетки и молекулы адгезии внеклеточного матрикса не являются сигналами на длинных дистанциях. Например, конусы роста не направляются по или против градиентов концентрации молекул адгезии клетки или матрикса108). Конусы роста также не используют различия в силе адгезии с разными

550 |
Раздел IV. Развитие нервной системы |
Таблица 23.1. Примеры хемоаггракции и хемоотталкивания на большой и короткой дистанции. Table 23.1. Examples of shortand long-range chemoattraction and chemorepulsion.
Ligand |
Receptor/ligand |
Attraction/repulsion |
Short-range (contact mediated) |
|
|
|
|
|
TAG-1 |
NrCAM |
Attraction |
Slit |
Robo |
Repulsion |
N-CAM |
N-CAM |
Attraction |
ECM adhesion proteins |
Integrins |
Attraction |
Ephrins |
Eph receptors |
Repulsion |
Long-range (diffusible ligand) |
|
|
Netrin |
DCC |
Attraction |
Semaphorins |
Neuropilins |
Repulsion |
Slit |
? |
Repulsion |
Netrin |
9 |
Repulsion |
Рис. 23.23. Молекулы внеклеточного матрикса определяют паттерн роста нервных отростков в культуре нейронов пиявки. Одиночный нейрон выращен в клеточной культуре на субстрате определенного паттерна. С левой стороны край чашки был покрыт конканавалином A (Con A), а с правой стороны экстрактом, содержащим внеклеточный матрикс (ЕСМ) из глиальных капсул ганглиев пиявки.
Fig. 23.23. Extracellular Matrix Molecules Determine the Pattern of neurite outgrowth from leech neurons in culture. A single neuron grown in cell culture on a patterned substrate. On the left side of the border the plate was coated with Concanavalin A (Con A), on the right with extracellular matrix (ECM)-containing extracts of leech ganglion capsules. (From GrumbacherReinert 1989; kindly provided by S. GrumbacherReinert.)
поверхностями для навигации; все молекулы адгезии либо способствуют росту, либо нет109). Управление ростом аксона на большом расстоянии включает в себя движение аксона вдоль градиента концентрации растворимого фактора.
Навигация конусов роста в спинном мозге
Хороший пример разнообразия механизмов и молекул, которые используют конусы роста для навигации к своим клеткам-мишеням, представляют аксоны комиссуральных интернейронов спинного мозга позвоночных В раннем периоде развития комиссуралъные интернейроны, которые лежат в дорзальной части спинного мозга, «выпускают» аксоны, которые начинают расти в вентральном направлении, пересекая среднюю линию, и затем
растут вдоль спинного мозга по направлению к своим синаптическим мишеням (рис. 23.24) 110).
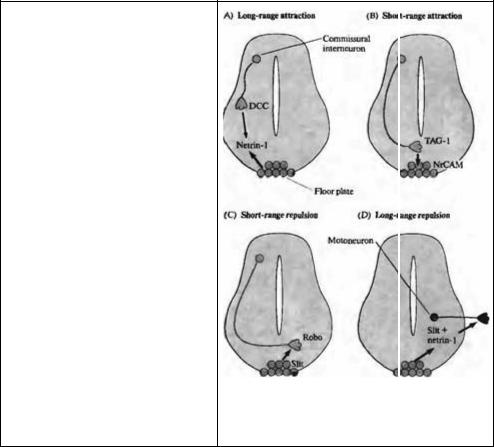
Аксоны комиссуральных нейронов первоначально привлекаются к вентральной средней линии белком нетрин-1, растворимым хемоаттрактантом, образуемым специальными клетками базальной пластинки, лежащими вдоль средней линии спинного мозга (рис. 23.24А)111). Нетрин-1 взаимодействует с рецептором, экспрессируемым комиссуральными нейронами, называемым DCC (который
Глава 23. Развитие нервной системы |
551 |
Рис. 23.24. Хемоаттракция на большой и короткой дистанции и хемоотталкивание направляют развивающийся аксон в спинном мозге позвоночных. (А) Нетрин-1, действующий как хемоаттрактант на большой дистанции, высвобождается клетками базальной пластинки и связывается со своим рецептором (DCC) на комиссуральных нейронах, чьи конусы роста он привлекает. (В) TAG-1, расположенный на конусах роста комиссуральных аксонов, связывается с NrCAM на клетках базальной пластинки. Такая хемоат тракция на короткой дистанции облегчает продвижение конусов роста комиссуральных аксонов вдоль базальной пластинки. (С) Robo, находящийся на конусах роста комиссуральных аксонов, связывается с белком slit на клетках базальной пластинки. Такая близкое хемоотталкивание предупреждает повторное пересечение аксонами базальной пластинки. (D) Slit и нетрин-1, высвобождаемые базальной пластинкой, взаимодействуют с рецепторами на конусах роста двигательных нейронов и отталкивают их. Такое отталкивание на больших расстояниях помогает направлять рост аксонов двигательных нейронов прочь от спинного мозга.
Fig. |
23.24. |
Long- |
and |
Short-Rangé |
|
|||
Chemoattraction |
and |
Chemorepulsion |
guide |
|
||||
developing axons in the vertebrate spinal cord. (A) |
|
|||||||
Netrin-1, acting as a long-range chemoattractant, |
|
|||||||
is released by cells of the floor plate and binds to |
|
|||||||
its receptor (DCC) on commissural neurons, |
( |
|||||||
attracting their growth cones. (B) TAG-1 on |
||||||||
commissural Axon growth cones binds to NrCAM |
This short-range chemorepulsion prevents the axons from |
|||||||
on |
floor |
plate |
cells. |
This |
short-range |
recrossing the floor plate. (D) Slit and netrin-1, released from the |
||
chemoattraction |
facilitates |
extension |
of |
floor plate, interact with receptors on growth cones of motor |
||||
commissural axon growth cones across the floor |
neurons and repel them. This long-range chemorepulsion helps |
|||||||
plate. (C) Robo on commissural axon growth |
direct the growth of motor axons away from the cord. |
|||||||
cones binds to slit on floor plate cells. |
|
|
|
|||||
уже упоминался ранее из-за своего взаимодействия с молекулами клеточной адгезии, см. рис. 23.20) 112). Существование растворимого фактора, образующегося в базальной пластинке, который способен привлекать (attract) аксоны комиссуральных нейронов, было впервые показано при культивировании кусочков дорзальной части спинного мозга изолированно, либо вместе с кусочками базальной пластинки (рис. 23.25) 110). Аксоны комиссуральных нейронов растут четко по направлению к базальной пластинке, даже если эксплантаты находятся друг от друга на расстоянии нескольких сотен микрон. Эта дистанция слишком велика для того, чтобы ее прошел филоподий конуса роста и требует растворимого фактора. Такой фактор, нетрин-1, входящий в семейство секреторных белков, характеризуется сходством доменов с N-концевыми доменами 7 цепи ламинина-1 (рис. 23.25А)111, 92). Гомологи нетрина также играют роль в росте аксонов у дрозофилы и
С. elegans.
Далее аксоны комиссурального нейрона пересекают вентральную среднюю линию, что они делают только однажды, таким образом оставаясь на контралатеральной стороне (рис. 23.24В, С). Это пересечение облегчается взаимодействиями между двумя адгезивными молекулами клеточной поверхности: TAG-1, которая экспрессируется на поверхности аксона спаечного нейрона, и NrCAM, экспрессируемого на клетках базальной пластинки113, 114). После пересечения средней линии экспрессия TAG-1 в аксонах ингибируется сигналами от клеток базальной пластинки, под действием которых в аксонах начинает синтезироваться протеин, называемый robo115). Robo представляет собой рецептор для другого белка, называемого slit, который высвобождается клетками базальной пластинки116). Взаимодействие между slit и
552 |
Раздел IV. Развитие нервной системы |
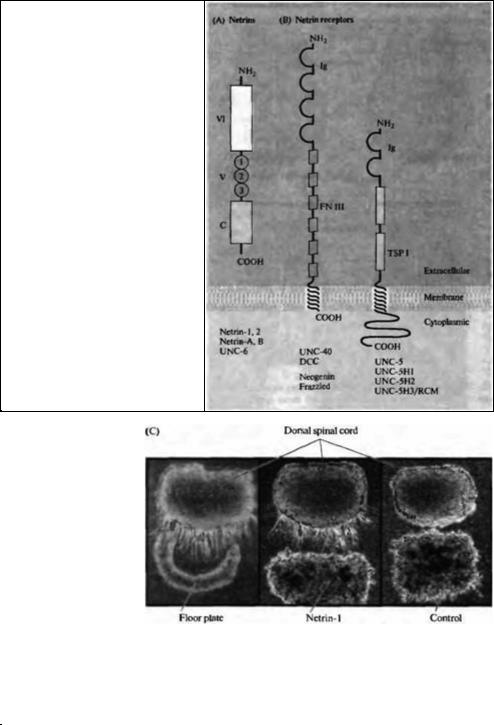
Рис. 23.25. Роль нетрина и его рецепторов в аттракции и отталкивании на большом расстоянии. (А) N-концевая аминокислотная часть секреторного белка нетрина состоит из доменов VI и V, которые гомологичны доменам аминокислотного конца 7 цепи ламинина. Домен V содержит три ECGповтора. С-концевой домен этой цепи не имеет гомологии с ламинином. (В) Рецепторы нетрина имеют внеклеточный домен, однократно пересекающий мембрану, и внутриклеточный домен. Внеклеточный домен семейства DCC рецепторов нетрина имеет четыре иммуноглобулиновых домена (Ig) и шесть повторов фибронектина III (FN III). DCC и их гомологи также могут играть роль молекул адгезии. Семейство рецепторов к нетрину UNC-5 имеет два иммуноглобулиновых домена и два домена, гомологичных тромбоспондину 1-го типа (TSP I), которые расположены внеклеточно, а также длинную цитоплазматическую последовательность. (С) Микрофотографии кусочков дорзального спинного мозга эмбрионов крысы (сверху на каждой из панелей), культивированных вместе с кусочками ткани базальнои пластинки (слева), вместе с CDS клетками, секрета рующи ми рекомбинантный нетрин 1 (в центре), и с контрольными COS клетками (справа). Нижняя пластинка и нетрин 1 оба способны вызывать значительный и направленный рост пучков комиссуральных аксонов из дорзаль ной области спинного мозга.
Fig. |
23.25. |
Netrins |
and Netrin |
|
||||
Receptors function in long-- |
|
|||||||
range attraction |
and |
|
repulsion. |
|
||||
(A) The ami no-terminal portion of |
|
|||||||
the secreted protein netrin is |
|
|||||||
made up of domains VI and V, |
|
|||||||
which |
are |
homologous |
to |
|
||||
domains at the amino terminus |
|
|||||||
of the 7 chain of laminin. Domain |
|
|||||||
V |
contains |
three |
|
EGF-like |
|
|||
repeats. |
The |
carboxy-terminal |
|
|||||
domain С has no homology to |
|
|||||||
laminin. (B) Netrin receptors have |
|
|||||||
an extracellular domain, a single |
|
|||||||
membrane-spanning region, and |
|
|||||||
an |
intracellular |
domain. |
The |
|
||||
extracellular domain of the DCC |
|
|||||||
family of netrin receptors has four |
|
|||||||
immunoglobulin domains (Ig) and |
(C) Micrographs of pieces of dorsal spinal cord from embryonic rats (top in each |
|||||||
six fibronectin III repeats (FN III). |
||||||||
DCC and |
its homologues |
also |
panel) cultured with a piece of floor plate tissue (left), an aggregate of CDS cells |
|||||
function |
as |
neural cell |
adhesion |
secreting recombinant netrin-1 (middle), or control COS cells (right). The floor plate |
||||
molecules. The UNC-5 |
family of |
and netrin-1 both elicit the profuse and directed outgrowth of bundles of |
||||||
netrin |
receptors |
has |
two |
commissural axons from the dorsal spinal cord tissue. (After Tessier-Lavigne et al., |
||||
immunoglobulin |
and |
two |
1988 and Kennedy et al., 1994; micrographs kindly provided by M. Tessier- |
|||||
thrombospondin |
type |
I |
domains |
Lavigne.) |
||||
(TSP I) extracellularly, and a |
|
|||||||
large cytoplasmic region. |
|
|
||||||
