
Nikolls_-_Ot_neyrona_k_mozgu
.pdf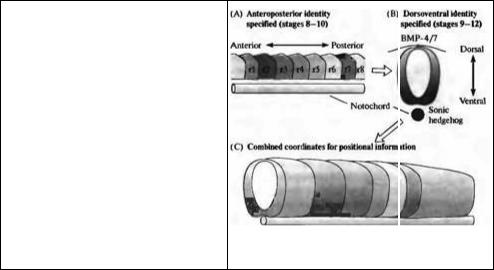
Глава 23. Развитие нервной системы |
533 |
Рис. 23.9. Система координат пространственной информации в заднем мозге позвоночных, устанавливаемая в два этапа. (А) Сначала определяется рострокаудальная позиция, например по экспрессии гена Hox. (В) После этого дорзовентральная позиция определяется градиентами сигналов средней линии, такими как
Sonic Hedgehog и BMP 4/7. (С) Результирующая двумерная система координат пространственной информации ограничивает возможный репертуар клеточной дифференцировки плюрипотентных клеток-предшественников,
Fig. 23.9. A Coordinate System of Positional Information in the Vertebrate Hmdbrain is established in two steps. (A) First anteroposterior position is encoded — for example, by Hox gene expression.
(B) Subsequently, dorsoventral position is encoded by gradients of midline signals such as Sonic hedgehog and BMP-4/7. (C) The resulting twodimensional coordinate system of positional information restricts the repertoire of cell fates available to pluripotent precursor cells. (After Simon,
Hornbruch, and Lumsden, 1995.)
но идентифицировать каждый нейрон и проследить его работу при помощи микроскопа. Альтернативным подходом может быть маркирование отдельных клеток и определение того, какие типы клеток из них получаются. Такого рода анализ, впервые предложенный Вайсблатом, Стентом и их коллегами для эмбрионов пиявки, включает в себя введение внутриклеточных маркеров, таких как флуоресцентный декстран или фермент пероксидаза хрена (HPR), в отдельные клетки и таким образом исследование дальнейшего потомства либо на живом эмбрионе, либо после окраски эмбриона, когда можно увидеть клетки, в которых находится фермент35). Можно провести сравнительные эксперименты, вводя комплементарные цепи ДНК, кодирующие гены флуоресцентного белка, или создавая трансгенных животных, которые экспрессируют этот протеин36).
Эксперименты подобного рода показывают, что у простых беспозвоночных вполне возможно воспроизвести определенную последовательность в делении и дифференцировке клеток. Таким образом, используя луч лазера можно вызывать гибель отдельных идентифицированных клеток с целью проследить, каким образом это повлияет на судьбу оставшихся клеток. В большинстве случаев выжившие клетки игнорируют потерю своего соседа, направление их развития определено автономно, на основании того, к какой клеточной линии они принадлежат. У подобных клеток экспрессия генов определяется факторами, которые изначально находятся в их цитоплазме или ядре и представляют собой независимые внутриклеточные сигналы37). В других случаях, однако, потеря соседа может повлиять на судьбу выживших клеток38). Таким образом, даже у животных, у которых имеются жестко определенные паттерны деления клеток, их дальнейшее развитие может изменяться в зависимости от индукционных взаимодействий.
Индукционные взаимодействия при развитии глаз дрозофилы
Стереотипно происходящее развитие сложного глаза дрозофилы представляет собой еще одну систему, в которой возможно прямое наблюдение для идентификации отдельных клеток и прослеживания их дальнейшего развития39). Кроме того, генетика дрозофилы дает очень большие возможности для оценки роли происхождения клеток и индукционных взаимодействий между ними в дифференцировке нервной ткани. Возможно выделение мутантов, у которых нет определенного клеточного типа или у которых паттерн дифференцировки лишь незначительно нарушен, что позволяет определить их влияние на судьбу остальных клеток.
Подобная техника была использована в экспериментах Бензера, Реди, Рубина, Толимсона, Цирупски и их коллег, которые исследовали дифференцировку нейронов и сопутствующих (опорных) клеток глаза. Глаз дрозофилы состоит из кристаллоподобного

534 |
Раздел IV. Развитие нервной системы |
Рис. 23.10. Индукционные взаимодействия, регулирующие развитие фоторецепторных клеток у дрозофилы. (А) Сканограмма сложного глаза дрозофилы. Каждая фасетка представляет собой один омматидий. (В) Нормальное развитие дифференцировки восьми фоторецепторов в каждом омматидий. Seven/ess (sev-- ) и bride of seven (boss ) мутации нарушают дифференцировку R7. (С) Сигнальные каскады, регулирующие дифференцировку R7. Продукт boss гена, интегральный мембранный белок, экслрессируемый в R8 (Boss), активирует продукт гена sev, рецептора тирозинкиназы (SevRTK). Sev киназа запускает внутриклеточный сигнальный каскад, активирующий MAP киназу, которая имеет несколько мишеней. MAP киназа фосфорилирует протеин Van (который бы иначе блокировал дифференцировку), приводя к его распаду. MAP киназа также вызывает экспрессию белка Phyl который вместе со вторым протеином, Sina, приводит к распаду фактора транскрипции Ttk88 Ttk88 предотвращает нервную дифференцировку. MAP киназа также активирует Pntp2 и АР- 1, два фактора транскрипции, которые способствуют нейрональной дифференцировке.
Fig. 23.10. Inductive Interactions Regulate Development of photoreceptor cells in
Drosophila. (A) Scanning electron micrograph of a compound eye in Drosophila.
Each facet is an ommatidium.
(B) Normal progression of differentiation of the eight photoreceptors in each ommatidium. Seventess (sev~) and bride o/ seven/ess
(boss- ) mutations each prevent differentiation of R7.
(C)Signaling pathway
regulating |
the |
|
differentiation |
|
||||
of R7. The product of the |
|
|||||||
boss |
gene, |
|
an |
integral |
|
|||
membrane protein expressed |
|
|||||||
in R8 |
(Boss), |
activates the |
|
|||||
product of the sev gene, a |
|
|||||||
receptor |
tyrosine |
kinase |
|
|||||
(SevRTK). |
The |
Sev kinase |
|
|||||
triggers |
an |
|
intracellular |
|
||||
signaling |
|
cascade |
that |
|
||||
activates |
MAP |
kinase, |
which |
|
||||
has several |
targets. |
MAP |
|
|||||
kinase |
phosphorylates |
the |
|
|||||
protein Van, causing it to be |
|
|||||||
degraded. |
|
|
Van |
|
would |
|
||
otherwise |
|
|
|
|
|
block |
|
|
differentiation. |
MAP |
kinase |
|
|||||
also causes expression of the |
|
|||||||
protein |
PhyL |
which |
together |
|
||||
with a second protein, Sina, |
|
|||||||
causes the transcription factor |
|
|||||||
Ttk88 to be degraded by the |
|
|||||||
ubiquitin-proteasome |
|
|
|
|||||
pathway. |
|
Ttk88 |
prevents |
|
||||
neuronal |
differentiation. MAP |
|
||||||
kinase |
also |
activates |
Pntp2 |
|
||||
and AP-1, two transcription |
(After Dickson, 1998; micrograph kindly provided by D. F. Ready.) |
|||||||
factors that promote neuronal |
|
|||||||
differentiation. |
|
|
|
|
|
|||
Глава 23, Развитие нервной системы |
535 |
набора повторяющихся единиц, называемых омматидиями (рис. 23.10A), каждый из которых содержит 8 фоторецепторов (R1-R8). Первая клетка, которая определяет начало дифференцировки в каждом омматидии, является одним из фоторецепторов, R8. Клетки R8 появляются хаотично в области нейроэпителия. Как только началась дифференцировка клетки R8, это приводит к ингибированию дифференцировки ее соседей в клетки R8. Затем дифферениировке подвергаются клетки R2 и R5, после чего R4, R1 и R6 и, наконец, R7 (рис. 23.10В). Были обнаружены две мутантные линии, в которых глаза развиваются нормально, за исключением того, что не образуется R7 (рис. 23.10В). Такие линии были названы sevenless (sev--) и brideof-sevenless (boss-- ) для обозначение отсутствия образования R7. При детальном исследовании этих мутантных линий впервые были изучены молекулярные механизмы того, как индукционные взаимодействия между клетками могут влиять на дальнейшее развитие клеток40)--42). Ген sevenless кодирует рецептор (называемый Sevenless, или Sev), для которого продукт экспрессии bride-of-sevenless гена, названный Boss, является лигандом. Во время развития R8 индуцирует образование R7. Это происходит, когда Boss, экспрессируемый на поверхности клетки R8, связывается с Sev, который расположен на клетке-предшественнице R7 (рис. 23.10С). Взаимодействие между Boss и Sev активирует внутриклеточный домен Sev рецептора, тирозинкиназу, которая инициирует сигнальный каскад в клетке R7, приводящий к ее дифференцировке. Сигнальный каскад является сложным путем, который включает в себя последовательную активацию серии протеинкиназ (ферментов, которые фосфорилируют белки), что приводит к ингибированию негативного влияния, а также увеличению позитивного влияния на экспрессию генов R7. Большое количество сигналов, которые приводят к изменениям в эспрессии генов, осуществляют это через тирозинкиназы, которые управляют данными клеточными каскадами.
Происхождение клеток в ЦНС млекопитающих
Изучать последовательность развития клеток в ЦНС млекопитающих технически более сложно, потому что отдельные клетки труднее идентифицировать и заполнить красителем. Удачными методиками исследования здесь показали себя картирование путей развития генетически помеченных клеток у химерных животных — эмбрионов и взрослых43), а также инфицирование клеток ЦНС развивающихся животных специально созданными вирусами (рис. 23.11)44)--46). Подобные вирусы сконструированы таким образом, что они перманентно включаются в состав хромосом клетки-хозяина, реплицируются во время деления клетки, и, следовательно, передаются потомкам этой клетки. Таким образом, информация, находящаяся в вирусе, не уменьшается при делении клеток. Присутствие вируса может быть затем обнаружено на любой стадии развития клеток, используя белок, который он кодирует. При условии, что изначально количество инфицированных клеток мало, в дальнейшем можно будет сделать вывод, что кластер клеток, содержащих данный белок, является клоном, потомством той самой клетки, которая была ранее инфицирована.
Например, когда такой вирус был введен в глаз новорожденного крысенка, а сетчатка была исследована во взрослом возрасте, белок содержали как глиальные клетки, так и несколько типов нейронов44). Таким образом, общая клетка-предшественница в сетчатке при делении образует как нейрональные, так и глиальные клетки.
В отличии от пиявки или дрозофилы, в сетчатке грызунов нет специфической последовательности развития клеток, когда одна клетка образует несколько различных типов нейронов. В данном случае, вероятно, клетка--предшественник имеет некоторую внутреннюю информацию (intrinsic competence) о том, как отвечать на внешние сигналы и сигналы, которые находятся в окружающей ее среде. Эти сигналы меняются со временем, что приводит к последовательному формированию клеток разных типов47). С другой стороны, когда подобные эксперименты проводились в коре больших полушарий, клоны, которые содержали бы и глиальные клетки, и нейроны, были довольно редки. Это дает основания полагать, что в момент инфицирования отдельные популяции клетокпредшественииков глиальных и нервных клеток уже сформировались в вентрикулярной области коры45). Более того, клоны большей частью содержали исключительно пирамидные или непирамидные клетки, показывая, что разделение между этими двумя линиями происходит на раннем этапе нейрогенеза48).

536 |
|
|
|
|
|
Раздел IV. Развитие нервной системы |
|
Рис. 23.11. Клетки одного |
|
|
|
||||
клона помечены при помощи |
|
|
|
||||
введения |
|
ретровирусных |
|
|
|
||
маркеров в сетчатку крысы. |
|
|
|
||||
(А) Ретровирус, кодирующий |
|
|
|
||||
бета-галактозидазу |
был |
|
|
|
|||
введен |
в |
глаз |
между |
|
|
|
|
сетчаткой |
|
и пигментным |
|
|
|
||
эпителием |
|
в |
|
раннем |
|
|
|
периоде |
|
развития, |
что |
|
|
|
|
привело |
|
к |
заражению |
|
|
|
|
нескольких |
|
|
|
|
|
|
|
предшественников |
клеток |
|
|
|
|||
сетчатки. (В) Окрашивание |
|
|
|
||||
сетчатки |
|
взрослого при |
|
|
|
||
помощи |
|
гистохимической |
|
|
|
||
|
мюллеровскую глиальную клетку (mg). |
||||||
реакции |
|
на |
|
бета |
|
Fig. 23.11. (tonally Related Cells Are Labeled by Injecting Retroviral Markers into the |
|
галактозидазу |
выявляет |
|
rat retina. (A) A retrovirus encoding β-galactosidase is injected into the eye between |
||||
кластеры, содержащие метку |
|
||||||
и являющиеся |
потомками |
|
the retina and the pigment epithelium early in development infecting a few retinal |
||||
одной |
|
|
|
клетки- |
|
precursor cells. (B) Staining the adult retina with a histochemical reaction for β- |
|
предшественницы. |
|
|
galactosidase reveals a cluster of labeled progeny of a single precursor cell. Camera |
||||
Изображение |
5 |
клона |
|
lucida drawing of a clone that includes five rods (r), one bipolar cell (bp) juxtaposed to |
|||
включает |
в |
себя |
палочек |
|
the terminal of a rod cell (t), and a Muller glial cell (mg). (After Turner and Cepko, |
||
(г), одну биполярную клетку |
|
1987.) |
|
||||
(bp) находящуюся вблизи к |
|
|
|
||||
терминали палочки (t), |
|
|
|
||||
Резюмируя вышесказанное, в нервной системе простых организмов возможный спектр дальнейшего развития клетки (lineage history) ограничивает потенциал ее развития. В ЦНС более сложных животных существуют индукционные взаимодействия между клетками, которые играют исключительную роль в направлении развития клетки. В хорошо известной и искрометной аналогии Сидней Бреннер охарактеризовал два пути развития клетки как «план по-американски» и «план по-европейски»: «по-европейски» то, кто ты есть (какой нейрон), определяется твоими предками; «по-американски» это определяется твоими соседями.
Взаимосвязь между временем образования нейронов и судьбой клеток
Существен ли для развития нейрона момент времени, когда его клетка-предшественница прекращает делиться и мигрирует прочь от вентрикулярной зоны? На данный вопрос можно ответить при помощи маркировки нейронов в то время, когда они переходят в постмитотическое состояние, или «рождаются». В этой технике, впервые разработанной Ангевином и Сидманом49), производится однократное введение [3Н]-тимидина либо внутриматочно, либо внутривенно в определенный день развития. Эта метка захватывается и встраивается в ДНК клетки, находящейся в стадии деления в данный момент. Невстроившийся тимидин быстро исчезает из кровотока. Таким образом, клетки, находящиеся в постмитотической стадии, не содержат метки. В клетке, которая продолжает делиться после введения метки (глиальные клетки и клеткипредшественницы, которые остаются в вентрикулярной зоне), метка может уменьшаться в концентрации во время удвоения ДНК и следующего за ним деления клетки. Однако, если клетка делится во время пика концентрации [3Н]-тимидина и одна или обе дочерние клетки прекращают деление, мигрируя прочь от вентрикулярной зоны и дифференцируясь в нейроны, тогда эти нейроны имеют очень высокую концентрацию [3Н]-тимидина. Таким образом, путь развития нейрона, образовавшегося в определенный день развития, может быть визуализован путем однократного введения эмбриону [3Н]- тимидина в данный день, после чего продолжается нормальное развитие эмбриона, и в дальнейшем ауторадиография используется для обнаружения помеченных клеток.
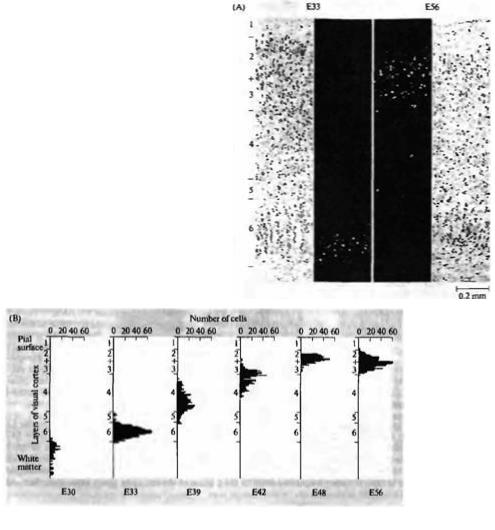
Использование этой техники позволило выявить, что в головном мозге (ГМ) млекопитающих имеется систематическая взаимосвязь между временем образования нейрона и местом его окончательного расположения в коре ГМ; развитие происходит по принципу «наоборот» (inside-out fashion) (рис. 23.12)50· 51).
Глава 23. Развитие нервной системы |
537 |
|
|||
Рис. 23.12. Нейрогенез первичной |
зрительной |
|
|
||
коры кошки. (А) Ауторадиограмма срезов коры |
|
|
|||
взрослого животного с [3Н]-тимидином, введенным |
|
|
|||
эмбриону на 33-й (ЕЗЗ) и 56 (Е56) день. |
|
|
|||
Микрофотография этих же срезов в светлом поле, |
|
|
|||
окрашенных крезил виолетом, показывает, что |
|
|
|||
наиболее окрашенные клетки расположены в слое |
|
|
|||
6 коры после введения в возрасте ЕЗЗ и в слоях 2 |
|
|
|||
и 3 после введения в возрасте Е56. (В) |
|
|
|||
Гистограмма, |
показывающая |
распределение |
|
|
|
клеток, помеченных в разные сроки между Е30 и |
|
|
|||
Е56, иллюстрирует inside-out паттерн развития |
|
|
|||
зрительной коры. |
|
|
|
|
|
Fig. 23.12. Neurogenesis of the |
Primary Visual |
|
|
||
Cortex of the cat. (A) Autoradiographs of sections of |
|
|
|||
the adult visual cortex of animals injected with [3H]- |
|
|
|||
thymidine on embryonic day 33 (E33) or 56 (E56). |
|
|
|||
Bright-field micrographs of the same sections |
|
|
|||
stained with cresyl violet indicate that heavily labeled |
|
|
|||
cells are located in layer 6 after the £33 injection, and |
|
|
|||
layers 2 and 3 after injection on E56. (B) Histograms |
|
|
|||
showing the distribution of cells labeled on various |
|
|
|||
days between E30 and E56 illustrate the inside-out |
|
|
|||
pattern of neurogenesis in the visual cortex. (After |
|
|
|||
Luskin and Shatz, 1985; micrograph kindly provided |
|
|
|||
by M. B. Luskin.) |
|
|
|
|
|
|
|
|
|
|
|
Нейроны самых глубоких кортикальных слоев образуются в первую очередь. Нейроны самых поверхностных слоев образуются позднее и мигрируют через клетки более глубоких слоев к месту своего окончательного расположения в коре. Схожее соответствие между временем образования и окончательным расположением нейрона наблюдается и в других отделах нервной системы, хотя и не во всех.
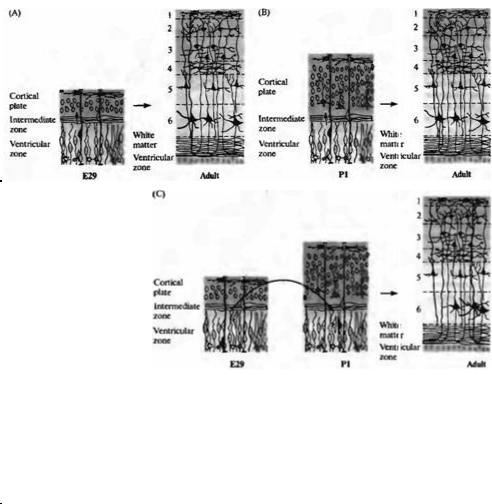
Каким образом мигрируют нейроны? Происходит ли этот процесс спонтанно в направлении изнутри наружу, пока они не достигнут поверхности развиваюшейся коры, или мигрирующий нейрон способен распознавать определенный слой, куда он должен мигрировать? Эксперименты на развивающихся хорьках показали, что кортикальные нейроны способны мигрировать в строго определенную позицию (рис. 23.13)48· 52). Клетки, в том числе эмбриональные предшественники нейронов слоя 5 и 6, извлекались из вентрикулярной зоны эмбрионов на ранних стадиях и трансплантировались в вентрикулярную зону эмбрионов на более поздних сроках, в область клеток, являющихся предшественниками более поверхностных слоев 2 и 3. Клетки-предшественники, которые были трансплантиро-
538 |
Раздел IV. Развитие нервной системы |
Рис. |
23.13. |
Слой |
определяет |
|
|
|
|||||
направление |
дифференциров |
|
|
|
|||||||
ки в коре хорька. (А) Ней |
|
|
|
||||||||
роны, образовавшиеся на сроке |
|
|
|
||||||||
Е29, мигрируют и образуют слой |
|
|
|
||||||||
6 кортикальной |
пластинки |
у |
|
|
|
||||||
взрослых. |
|
(В) |
|
Нейроны, |
|
|
|
||||
образовавшиеся в первый день |
|
|
|
||||||||
постнатального |
развития |
(Р1) |
|
|
|
||||||
мигрируют и образуют слой 2/3 |
|
|
|
||||||||
кортикальной |
|
|
пластинки |
|
|
|
|||||
взрослых. |
|
|
(С) |
|
Клетки, |
|
|
|
|||
пересаженные |
|
|
|
|
из |
|
|
|
|||
вентрикулярной |
|
зоны |
Е29 |
|
|
|
|||||
эмбриона |
|
в |
вентрикулярную |
|
|
|
|||||
зону |
Р1 |
|
новорожденных, |
|
|
|
|||||
следуют |
|
одним |
|
из |
двух |
|
|
|
|||
|
|
|
|
||||||||
возможных |
путей |
развития. |
|
Клетки, пересаженные во время фазы S клеточного цикла (показано серым), |
|
||||||
Клетки, |
пересаженные |
|
на |
|
|
||||||
|
меняют свою дифференцировку и мигрируют в слой 2/3. |
||||||||||
поздних |
|
стадиях |
своего |
|
|||||||
|
|
|
|
||||||||
последнего |
клеточного |
цикла |
|
Fig. 23.13. Laminar Fate Determination in the Cerebral Cortex of the ferret. (A) |
|||||||
или |
уже |
как постмитотические |
|
Neurons born on day E29 migrate to form layer 6 of the cortical plate in the adult. |
|||||||
нейроны, |
|
|
еще |
|
|
не |
|
(B) Neurons born on postnatal day 1 (PI) migrate to form layer 2/3 of the adult |
|||
мигрировавшие |
|
|
|
|
из |
|
cortical plate. (C) Cells transplanted from the ventricular zone of E29 embryos to |
||||
вентрикулярной зоны |
(показано |
|
the ventricular zone of PI neonates adopted one of two fates. Cells transplanted |
||||||||
черным), |
|
сохраняют |
свою |
|
while in the late stages of their final cell cycle or postmitotic neurons that had not |
||||||
исходную |
дифференцировку |
и |
|
yet migrated from the ventricular zone (black) maintained their original identity and |
|||||||
мигрируют в слой 6. |
|
|
|
|
migrated to layer 6. Cells transplanted while in the S phase of the cell cycle (grey) |
||||||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
were «specified and migrated to layer 2/3. |
|
ваны в ранней S фазе клеточного цикла (когда происходит синтез ДНК), изменяли свое развитие: нейроны, образовавшиеся из них, мигрировали в слои 2 и 3. Однако, если клетки были трансплантированы на более поздних стадиях их последнего клеточного цикла или уже являлись постмитотическими нейронами, мигрировавшими из вентрикулярной зоны, они сохраняли свою исходную дифференцировку. Они мигрировали только в пределах слоя 6, где останавливались и образовывали связи, характерные для своего типа дифференцировки. Таким образом, область, куда будет мигрировать кортикальный нейрон определяется, пока он находится в вентрикулярной зоне, непосредственно перед финальными митозом клетки.
Генетические аномалии строения коры у мышей линии reeler
Другой пример того, как определяется дальнейшее развитие нейрона до того, как он достигнет своего окончательного расположения, обнаружен у мутантных мышей линии reeler*) (названных так из-за своей неровной походки). В развивающейся коре мышей reeler более молодые нейроны не ми-
*) Reeler от английского to reel — идти, пошатываясь и спотыкаясь. — Прим перев.
Глава 23. Развитие нервной системы |
539 |
грируют сквозь слои других клеток53). Таким образом, их расположение друг относительно друга у взрослых противоположное: нейроны, образованные раньше, располагаются в более поверхностных слоях, а нейроны, рожденные позже, — в более глубоких. Несмотря на аномальное расположение, нейроны имеют правильную исходную морфологию (определяемую моментом рождения) и образуют между собой связи в зависимости от времени образования. Получается, что морфология корковых нейронов и природа их синаптических взаимодействий определяются в момент рождения нейрона и могут проявляться независимо от его расположения. Такой reeler фенотип является результатом большого количества мелких изменений в результате мутации в коре и других областях мозга.
Продуктом экспрессии гена reeler является большой гликопротеин внеклеточного матрикса, называемый reelin54). Он не экспрессируется в кортикальных клетках, не мигрирующих правильным образом, а в основном экспрессируется в клетках Кахаля—Ретциуса в краевой зоне коры55). Нарушения экспрессии других генов в кортикальных клетках могут приводить к сходным с reeler фенотипам проявления. Например, мутация цитоплазматического белка,
содержащего фосфотирозин (cytoplasmic phosphotyrosine-containing protein), названного
Disabled-1, также приводит к reeler фенотипу56), как и генетическое выключение (knock-out) рецептора липопротеинов низкой плотности вместе с рецепторами 2 типа к аполипопротеину Е57). На основании этого можно судить о том, что эти три белка являются частью внутриклеточного механизма, который позволяет кортикальным клеткам распознавать сигнал с reelin-белка, передающийся через внеклеточный матрикс, и использовать этот сигнал для установления правильной структуры слоев коры. Большое количество других генетических мальформаций в коре ГМ человека связано с нарушением миграции нейронов21).
Влияние локальных сигналов на корковую архитектуру
Примером способности корковых нейронов изменять свое строение после того, как они мигрировали прочь от вентрикулярной зоны, является эксперимент, в котором кусочек развивающейся зрительной коры был пересажен в область представления вибрисс соматосенсорной коры крысы58, 59). Нейроны в трансплантанте реорганизовались и сформировали четко различимую колончатую структуру, характерную для их нового месторасположения (глава 18), образуя фенотип, не характерный для зрительной коры. Таким образом, внутренние влияния могут определять особенности фенотипов корковых нейронов.
Гормональный контроль за развитием нервной системы
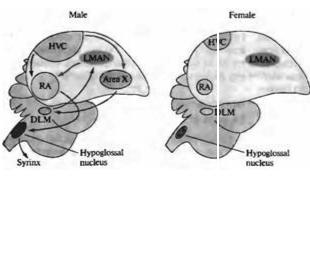
В некоторых областях ЦНС развитие нейронов находится под гормональным контролем. Это особенно заметно в областях мозга, определяющих сексуальное поведение. Например, у таких певчих птиц, как канарейки, ядро высшего вокального центра (ВВЦ, high vocal center, HVC) играет ключевую роль в приобретении и запоминании песни — что является исключительно мужским поведением60). Эта зона мозга больше развита у самцов, чем у самок (рис. 23.14). Однако пение можно вызывать даже у взрослых самок введением тестостерона, в результате чего ядро ВВЦ и другие структуры, связанные с воспроизведением песни, увеличиваются.
Ядра ВВЦ у взрослых самцов и самок канарейки являются особенными центрами, так как там происходит постоянный кругооборот нейронов61· 62). Образование (recruitment) новых нейронов ВВЦ у самцов происходит максимально осенью и весной, сразу после пика гибели старых нейронов. Таким образом, в это время происходит модификация их песен для нового брачного сезона. Период гибели нейронов совпадает с падением уровня тестостерона, а образование новых — с его пиком. Назначение тестостерона самкам приводит к увеличению образования новых нейронов в ВВЦ, которые, как их предшественники, получают определенные синаптические сигналы и посылают свои аксоны к определенным мишеням. Эти удивительные наблюдениям показывают, что в зрелом мозге возможно не только образование новых нейронов, но также их включение в сложно устроенную и функционирующую систему, что приводит к перемоделированию такого свойственного птицам поведения, как их песни.
Стволовые нервные клетки
ВВЦ певчих птиц является не единственным примером того, когда новые нейроны включаются в состав нервной системы взрослых
540 |
|
|
|
|
|
|
Раздел IV. Развитие нервной системы |
|||
Рис. 23.14. Половой диморфизм в |
|
|
|
|||||||
головном мозге птиц. Схематическая |
|
|
|
|||||||
диаграмма основных зон мозга и путей, |
|
|
|
|||||||
участвующих в формировании песни у |
|
|
|
|||||||
певчих птиц. Высший вокальный |
|
|
|
|||||||
центр |
(HVC), |
|
крепкое |
ядро |
|
|
|
|||
архистриатума |
(RA) |
и |
подъязычное |
|
|
|
||||
ядро |
формируют |
задний |
вокальный |
|
|
|
||||
моторный путь (показано черным). |
|
|
|
|||||||
HVC, |
зона |
|
X, |
|
медикальное |
|
|
|
||
дорзолатеральное |
ядро |
|
тала |
муса |
|
|
|
|||
(DLM) |
|
и |
|
|
латеральное |
|
|
|
||
магноцеллюлярное |
ядро |
переднего |
|
|
|
|||||
неостриатума |
|
(LMAN) |
|
образуют |
|
|
|
|||
передний путь (показано серым). HVC, |
|
|
|
|||||||
подъязычное ядро и RA имеют |
|
|
|
|||||||
The higher vocal center (HVC), robust nucleus of the archistriatum (RA), |
|
|||||||||
значительно |
большие |
|
размеры у |
|
|
|||||
самцов; зона X не обнаруживается в |
|
and hypoglossal nucleus form the posterior, vocal motor pathway (black). |
||||||||
мозге самок зябликов. |
|
|
|
|
|
The HVC, area X, medial dorsolateral nucleus of the thalamus (DLM), and |
||||
Fig. 23.14. Sexual Dimorphism in the |
|
lateral magnocellular nucleus of the anterior neostriatum (LMAN) form the |
||||||||
|
anterior pathway (grey). HVC, hypoglossal nucleus, and RA are |
|||||||||
Avian Brain. Schematic diagram of the |
|
significantly larger in male birds; area X has not been observed in brains |
||||||||
major brain areas and pathways involved |
|
of female finches. |
||||||||
in production of song in songbirds. |
|
|
|
|
||||||
животных. Нейроны также постоянно обновляются в гиппокампе и обонятельной луковице у взрослых млекопитающих63· 64). Однако как образуются эти клетки? Нервные стволовые клетки, которые обладают способностью к самообновлению, были выделены из стенок желудочков и из гиппокампа взрослого мозга и было прослежено их размножение in vitro 65). Эти клетки могут дифференцироваться в нейроны, олигодендроциты и астроциты. Нейроны, постоянно добавляющиеся в обонятельной луковице in vivo, происходят из медленно делящихся стволовых клеток самого внутреннего, эпендимального слоя стенок боковых желудочков (остаток начальной вентрикулярной зоны)66). Один из потомков каждого клеточного деления направляется в субэпендимальную зону, чтобы стать там клеткой-предшественницей. Клеткапредшественница быстро делится, образуя незрелые нейроны, которые мигрируют в ростральном направлении в область луковицы, где они дифференцируются в интернейроны и интегрируются в имеющиеся сети67). При повреждении ЦНС клеткапотомок стволовых клеток становится астроцитом, а не нейроном, мигрирует в область повреждения и принимает участие в образовании рубца в области повреждения. Таким образом, судьба потомка стволовой клетки у взрослых может быть изменена под влиянием внешних сигналов.
Стволовые нервные клетки, таким образом, представляют собой популяцию клеток, способных размножаться в культуре и подвергаться дифференцировке либо в глиальные клетки, либо в нейроны. Это обеспечивает возможность использования этих клеток в качестве резерва нейронов или глиальных клеток при лечении заболеваний нервной системы, при которых наблюдается гибель клеток ГМ или их дисфункция (глава 24)68).
Контроль за фенотипом нейронов в ПНС
Сходны ли механизмы, определяющие судьбу клеток в ПНС позвоночных с механизмами, определяющими развитие ЦНС? Например, какую роль играют происхождение клеток, время их образования и локальные сигналы в определении пути развития периферических нейронов и глиальных клеток? Запрограммированы ли клеткипредшественницы на формирование клеток определенного типа, например клеток автономной, а не сенсорной системы, или на использование этими клетками ацетилхолина, а не норадреналина, в качестве трансмиттера?
Подобные вопросы изучались в нервной системе цыплят и перепелок Ле Дуарином, Вестоном и другими69· 70). В эмбрионе позвоночных клетки нервного гребня, расположенные в разных местах вдоль нервной оси, образуют различные типы клеток ПНС (рис. 23.15А). Для изучения того, определен ли фенотип клеток, развивающихся из нервно-
Глава 23. Развитие нервной системы |
541 |
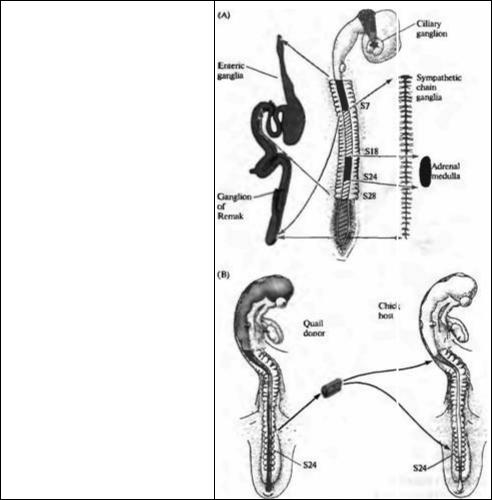
Рис. 23.15. Судьба клеток нервного гребня определяется окружением. (А) Клетки нервного гребня образуют большое количество различных периферических ганглиев. Ресничный ганглий образован клетками из мезенцефального нервного гребня. Ганглий Ремака и кишечные ганглии тонкой кишки образуются из клеток вагальной (сомиты 1-7) и люмбосакральной (каудальнее S28) областей нервного гребня. Ганглии симпатической цепочки происходят из всех областей нервного гребня каудальнее S5. Надпочечник заселяется клетками нервного гребня из S18-S24. (В) Если клетки нервного гребня из S18-S24, которые должны образовать надпочечник, пересадить от донора-перепелки в вагальную или люмбосакральную область эмбриона цыпленка, они будут следовать пути развития, характерному для своего нового положения и заселят ганглий Ремака или кишечный ганглий тонкой кишки.
Fig. 23.15. The Fate of a Neural Crest Cell is determined by environmental cues. (A) Neural crest cells give rise to a variety of peripheral ganglia. The ciliary ganglion is formed by cells from the mesencephalic neural crest. The ganglion of Remak and the enteric ganglia of the gut are formed by cells from the vagal (somites 1- 7) and lumbosacral (caudal to S28) regions of the neural crest. The ganglia of the sympathetic chain are derived from all regions of trie neural crest caudal to S5. The adrenal medulla is populated by crest cells from S18-S24. (B) If crest cells from S18-S24, which are destined to form the adrenal medulla, are transplanted from a quail donor to the vagal or lumbosacral region of a host chick embryo, they will adopt the fate appropriate to their new location and populate the ganglion of Remak and the enteric ganglia of the gut. (After
Le Douarin, 1986.)
го гребня, уже на ранних стадиях развития или он может изменяться при перемещении клеток в другое место вдоль нервной оси, Ле Дуарин пересаживал клетки из одного региона нервного гребня в другой регион эмбрионахозяина и затем исследовал развитие пересаженных клеток. В этих экспериментах клетки доноры брались из эмбриона перепелки и затем имплантировались в эмбрион-хозяин цыпленка таким образом, чтобы пересаженные клетки можно было различить по очевидным цитологическим отличиям между клетками перепелки и цыпленка (рис. 23.15В). После пересадки клетки куропатки развивались согласно своему новому расположению. Например, клетки, взятые из области, которая при нормальном развитии образовывала надпочечник, вместо этого образовывали иннервацию кишечника.
Близким вопросом является то, определен ли фенотип клеток нервного гребня до того, как клетки мигрируют прочь от нервной трубки или после того, как они достигнут своего окончательного месторасположения на периферии. Ответ на этот вопрос получен в исследованиях клеток нервного гребня, выделенных из одного периферического месторасположения: предшественника (primordiurn) надпочечника эмбриона млекопитающих71). В культуре эти клетки образуют либо хромаффинные клетки, либо клетки мозгового вещества надпочечников, либо адренергические симпатические нейроны. Глюкокортикоиды (синтезируемые клет-
542 |
Раздел IV. Развитие нервной системы |
|
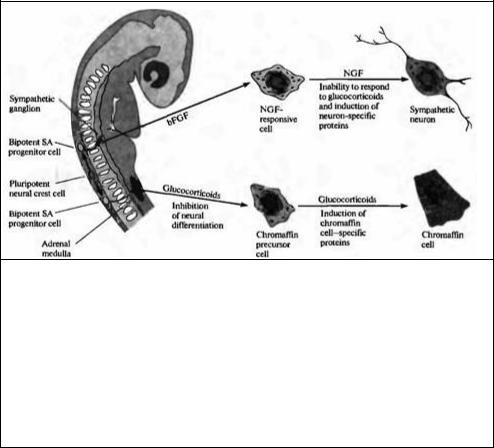
|
Рис. 23.16. Определение направления развития клеток нервного гребня, образующих симпатоадреналовую (SA) систему. Плюрипотентные клетки нервного гребня образуют бипотентные SA клетки-предшественники. Судьба SA клеток-предшественников зависит от сигналов извне. SA клетки-предшественники, которые мигрируют в область надпочечника, подвергаются влиянию глюкокортикоидов, ингибирующих нервную дифференцировку и способствующих дифференцировке их в хромаффинные клетки. Альтернативным образом, SA клетки-предшественницы, которые мигрируют в область развивающейся симпатической цепочки, подвергаются воздействию основного фактора роста фибробластов, который приводит к экспрессии ФРН в SA предшественниках. Последующее действие ФРН приводит к тому, что клетки, нечувствительные к дифференцировке в ответ на глюкокортикоиды, начинают дифференцироваться в симпатические нейроны.
Fig. 23.16. Cell Fate Determination in the neural crest sympathoadrenal (SA) lineage. Pluripotent neural crest cells give rise to bipotent SA progenitor cells. The fate of SA progenitor cells depends on environmental signals. SA progenitors that migrate to the region of the adrenal medulla are exposed to glucocorticoids, which inhibit neural differentiation and induce chromaffin cell differentiation. Alternatively, SA progenitor cells that migrate to the region of the developing sympathetic chain are exposed to basic fibroblast growth factor (bFGF), which induces the expression of nerve growth factor (NGF) receptors in the SA progenitors. Subsequent exposure to NGF renders the cells insensitive to glucocorticoid-induced differentiation and induces them to differentiate as sympathetic neurons.
ками коры надпочечника) вызывают экспрессию ферментов, специфических для хромаффинных клеток (рис. 23.16). И наоборот, два белка, присутствующие в местах образования симпатических ганглиев, называемые основной фактор роста фибробластов
(basic fibroblast growth factor, bFGF) и фактор роста нерва (nerve growth factor, NGF), в
культуре клеток вызывают дифференцировку клеток-предшественниц в симпатические нейроны. Таким образом, фенотип клеток нервного гребня может быть определен после того, как они мигрировали прочь от нервной трубки, при помощи факторов, находящихся на периферии.
Выбор трансмиттера в ΠНС
При пересаживании клеток нервного гребня в относительно раннем периоде их дальнейшее развитие может изменяться вплоть до того, что они могут в дальнейшем использовать абсолютно другой трансмиттер, например ацетилхолин, вместо норадреналина. В некоторых случаях такая смена медиатора происходит в ходе нормального развития. Например, симпатические нейроны, иннервирующие потовые железы, изначально синтезируют норадреналин, но в период между второй — третьей неделями постнатального развития факторы, выделяемые железой, приводят к тому, что они начинают вырабатывать ацетилхолин72). На более поздних стадиях клетки нервного гребня становятся уже слишком зрелыми и теряют способность менять свою дифференцировку в соответствии с изменениями окружающей среды.
Изучение механизма смены трансмиттера проводилось на культурах клеток симпатических ганглиев. Когда нейроны выделялись из верхнего шейного ганглия новорожденного
