Nikolls_-_Ot_neyrona_k_mozgu
.pdf
Глава 23. Развитие нервной |
|
системы |
573 |
67.Luskin, M. 1993. Neuron II: 173-189.
68.Yandava, В. G., Billinghurst, L. L., and Sny-der, E.Y. 1999. Proc. Nall. Acad. Sci. USA 96: 7029-7034.
69.Wcston, J. 1970. Adv. Morphogenesis 8: 41-114.
70.Dupin, Ε., Ziller, С., and Le Douarin, N. M. 1998. Curr. Top. Dev. Biol. 36: 1-35.
71.Anderson, D.J. 1993. Annu. Rev. Neurosci. 16: 129-158.
72.Francis, N.J., and Landis, S.C. 1999. Annu. Rev. Neurosci. 22: 541-566.
73.Mains, R. E.. and Patterson, P. H. 1973. J. Cell Biol. 59: 329-345.
74.Patterson. P. H., and Chun, L. L. Y. 1977. Dev. Biol. 56: 263-280.
75.Furshpan. E.J., et al. 1976. Proc. Noll. Acaa. Sci USA 73: 4225-4229.
76.Yamamori, T., et al. 1989. Science 246: 1412-1416.
77.Smith, S.J. 1988. Science 242: 708-715.
78.Letourneau, P. C. 1996. Perspect. Dev. Neurobiol. 4: 111-123.
79. |
Lin, |
C-H., Thompson, C. A., |
and Forscher, P. |
|
1994. |
Curr. Opin. Neurobiol. 4: 640-647. |
|||
80. |
Suter, |
D, M., |
et al. 1998. |
/. Cell Biol. 141: |
227-240. |
|
|||
81.Grumbacher-Reinert, S., and Nicholls, J. 1992. J. Exp. Biol. 167: 1-14.
82.Gomez, T. M., and Spitzer, N. C. 1999. Nature 397: 350-355.
83.Walsh. F. S., and Doherty, P. 1997. Annu. Rev. Cell Dev. Biol. 13: 425-456.
84.Takeichi, M. 1995. Curr. Opin. Cell Biol. 7: 619-627.
85.Lander, A. D. 1989. Trends Neurosci. 12: 189-195.
D. 1989. Trends Neurosci. 12: 189-195.
86.Reichardt, L. F., and Tomaselli, K.J. 1991. Annu. Rev. Neurosci. 14: 531-570.
87.Giancotli, F. G., and Ruoslahti, E. 1999. Science 285: 1028-1032.
G., and Ruoslahti, E. 1999. Science 285: 1028-1032.
88.Bixby, J. L., Lilien, J., and Reichardt, L. F. 1988. J. Cell Biol. 107:353-361.
89.Seilheimer, В., and Schachner, M. 1988. J. Cell Biol. 107:341-351.
90.Langley, J.N. 1895. / Pliysiol. 18: 280-284.
91.Weiss, P. 1936. Biol. Rev. Il: 494-531.
92.Mueller, В. К. 1999. Annu. Rev. Neurosci. 22: 351-388.
93.Lumsden, A. G. S., and Davies, A. M. 1986. Nature 323: 538-539.
94.Phelan, Κ. Α., and Hollyday, M. 1990../. Neurosci. 10: 2699-2716.
95.Bentley, D., and Caudy, M. 1983. Cold -Spring llarb. Symp. Quant. Biol. 48: 573-585.
96.Palka. J., Whitlock, K. E., and Murray, M. A. 1992. Curr. Opin. Neurobiol. 2: 48-54.
97.Sato, Y, et al. 1998. J. Neurosci. 18: 7800-7810.
98.Délier, T., Drakew, A., and Frotscher, M. 1999 Exp. Neurol. 156: 239-253.
99.Del Rio, J.A., et al. 1997. Nature 385: 70-74.
100.Shatz, C. J., and Luskin, M. B. 1986. /. Neurosci. 6: 3655-3658.
101.Luskin, M. B. and Shatz, C. J. 1985. /. Neurosci. 5: 1062-1075.
102.Ghosh, Α., et al. 1990. Nature 347: 179-181.
103.Goodman, C. S. 1996. Annu. Rev. Neurosci. 19: 341-377.
104.Brittis, P.A.. et al. 19%. Mol. Cell Neurosci. 8: 120-128.
105.McFarlane, S., et al. 1996. Neuron 17: 245-254.
106.Hoang, В., and Chiba, A. 1998. /. Neurosci. 18: 7847-7855.
107.Masuda-Nakagawa, L. M. and Nicholls, J. G. 1991. Phil. Trans. R. Soc. Lond. 5331: 323-335.
108.McKenna, M. P. and Râper, J.
P. and Râper, J. A. 1988. Dev. Biot. 130: 232-236.
A. 1988. Dev. Biot. 130: 232-236.
109.Isbister, C. M. and O'Connor, T. P. 1999. /. Neurosci. 19: 2589-2600.
110.Tessier-Lavigne, M., et al. 1988, Nature 336-775-778.
111.Kennedy, T. E., et al. 1994. Cell 78: 425-435.
112.Fazeli, A., et al. 1997. Nature 386: 796-804.
113.Stoeckli, E.T. and Landmesser, L.T. 1995. Neuron 14: 1165-1179.
114.Stoeckli, E.T., et al. 1997. Neuron 18: 209-221.
115.Kidd, T., et al. 1998. Cell 92: 205-215.
116.Kidd, T., Bland, К.S., and Goodman, C.S. 1999. Cell 96: 785-794.
117.Colamarino, S.A. and Tessier-Lavigne. M. 1995. Cell 81:621-629.
118.Brose, K.. et al. 1999. Cell 96: 795-806.
119.Kolodkin, A. L. 1998. Prog. Brain Res. 117: 115-132.
120.Luo, Y, étal. 1995. Neuron 14: II3I-I140.
121.Fujisawa, H., and Kitsukawa, T. 1998. Curr. Opin. Neurobiol. 8: 587-592.
122.Song. H.-J-, and Poo, M. M. 1999. Curr. Opin. Neurobiol. 9: 355-363.
123.Ming, G.-L., et al. 1997. Neunn 19: 1225-1235.
124.Song, H.-J.. Ming, G.-L., and Poo, M.-M. 1997. Nature 388: 275-279.
125.Song, H.-J.. étal. 1998. Science 281: 1515-1518.
étal. 1998. Science 281: 1515-1518.
126.Walter, J., et al. 1987. Development 101: 685-696.
127.Walter, J., Henke-Fahle, S., and Bonhoeffer, F. 1987. Development 101: 909-913.
128.Drescher, U, et al. 1995. Cell 82: 359-370.
129.O'Leary, D.D. and Wilkinson, D.G. 1999. Curr. Opin. Neurobiol. 9: 65-73.
130.Сох, Е.С., Millier, В., and Bonhoeffer, F. 1990. Neuron 4: 31-47.
131.Mellitzer, G., Xu,Q., and Wilkinson. D. G. 1999. Nature 400: 77-81.
G. 1999. Nature 400: 77-81.

574 |
Раздел IV. Развитие нервной системы |
132.Holder, Ν., and Klein, R. 1999. Development 126: 2033-2044.
133.Dodd, J. and Jessell, T. M. 1988. Science 242: 692-699.
134.Ichijo, H. and Bonhoeffer, F. 1998. /. Neurosci. 18: 5008-5018.
135.Constantine-Paton, M., Cline, H.T., and Debski, E. 1990. Annu. Rev. Neurosci. 13: 129-154.
136.Salpeter, M.M. (éd.). 1987. The Vertebrate Neu-romuscular Junction. Alan R. Liss, New York.
137.SanesJ. R.,and Lichtman, J.W. \999.Annu. Rev. Neurosci. 22: 389-442.
138.Evers, J., et al. 1989. J. Neurosci. 9: 1523-1539.
Neurosci. 9: 1523-1539.
139.Anderson, M. J., and Cohen, M. W. 1977. /. Physiol. 268: 757-773.
140.Frank, E, and Fischbach, G. D. 1979. /. Cell Biol. 83: 143-158.
141.McMahan, U.J., and Wallace, B.C. 1989. Dev. Neurosci. 11:227-247.
142.Bowe, M.A., and Fallon, J. R. 1995. Annu. Rev. Neurosci. 18: 443-462.
143.Denzer, A.J., et al. 1998. EMBOJ. 17: 335-343.
144.Gautam, M., et al. 1996. Cell 85: 525-535.
145.Burgess, R. W., et al. 1999. Neuron 23: 33-44.
146.DeChiara, T. M., et al. 1996. Cell 85: 501-512.
147.Gautam, M., et al. 1995. Nature 377: 232-236.
148.Fischbach, G. D., and Rosen, Κ. Μ. 1997. Annu. Rev. Neurosci. 20: 429-458.
149.Cohen, I., et al. 1997. Mol. Cell. Neurosci. 9: 237-253.
150.Noakes, P. G., et al. 1995. Nature 374: 258-262.
151.Craig, A.M., et al. 1994. Proc. Nail. Acad. Sci. USA 91: 12373-12377.
152.Rao, A., et al. 1998. /. Neurosci. 18: 1217-1229.
153.Koulen, P. et al. 1998. Euro. J. Neurosci. 10: 115-127.
154.Wassle, H., et al. 1998. Vision Res. 38:1411-1430.
155.Sassoe-Pognetto, M., and Wassle, H. 1997. /. Сотр. Neural. 381: 158-174.
156.Dolkart-Gorin, P. and Johnson, E. M. 1979. Proc. Nail. Acad. Scl. USA 76: 5382-5386.
157.Crowley, C, et al. 1994. Cell 76: 1001-1011.
158.Smeyne, R.J., et al. 1994. Nature 368: 246-249.
159.Campenot, R. B. 1977. Proc. Nail. Acad. Sci. USA 74:4516-4519.
160.Hendry, 1. A., et al. 1974. Brain Res. 68: 103-121.
161.Black, I. В. \9П.Аппи. Rev. Neurosci. I: 183-214.
162.Levi-Montalcini, R. 1982. Annu. Rev. Neurosci. 5: 341-362.
163.Hamburger, V. 1939. Physiol. Zoo/. 12: 268-284.
164.See Levi-Montalcini, R. and Angeletti, P. U. 1968. Physiol. Rev. 48: 534-569 for references to earlier work.
165.Cohen, S. 1959. / Biol. Chem. 234: 1129-1137.
166.Cohen, S. 1960. Proc. Nail. Acad. Sci. USA 46: 302-311.
167.Levi-Montalcini, R. and Cohen, S. 1960. Ann. N. Y. Acad. Sci. 85: 324-341.
168.Greene, L.A., and Shooter, E. M. 1980. Annu. Rev. Neurosci. 3: 353-402.
169.Barde, Y-A. 1989. Neuron 2: 1525-1534.
170.Lewin, G.R., and Barde, Y-A. 1996. Annu. Rev. Neurosci. 19: 289-317.
171.McDonald, N.Q., and Chao, M. V. 1995. /. Biol. Chem. 270: 19669-19672.
V. 1995. /. Biol. Chem. 270: 19669-19672.
172.Farinas, I., et al. 1996. Neuron 17: 1068-1078.
173.Kokaia, Z., et al. 1993. Proc. Nail. Acad. Sci. USA 90:6711-6715.
174.Davies, A. M., and Lumsden, A. 1990. Annu. Rev. Neurosci. 13: 61-73.
175.Gage, F. H., et al. 1988. J. Сотр. Neural. 269: 147-155.
176.Fischer, W., Gage, F. H., and Bjorklund, A. 1989. Eur. J. Neurosci. I: 34-45.
177. Fischer, W., et al. 1991. J. Neurosci. 11: 1889-1906.
178.Winkler, J., et al. 1998. /. Л/о/. Men. 76: 555-567.
179.Alcantara, S., et al. 1997. /. Neurosci. 17: 3623-3633.
180.McAllister, A. K., Katz, L. C., and Lo, D. C. 1999. Annu. Rev. Neurosci. 22: 295-318.
181.Conover, J. C., and Yancopoulos, G. D. 1997. Rev. Neurosci. 8: 13-27.
182.Bothwell, M. 1995. Annu. Rev. Neurosci. 18: 223-253.
183.Frade, J. M., and Barde, Y. A. 1998. BioEssays 20: 137-145.
184.Segal, R.A., and Greenberg, M. E. 1996. Annu. Rev. Neurosci. 19: 463-489.
185.Frade, J. M., Rodriguez-Tebar, A., and Barde, Y-A. 1996. Nature 383: 166-168.
186. Truman, J.W, Thorn, R. S., and Robinow, S. 1992. /. Neurobiol. 23: 1295-1311.
187.Oppenheim, R.W. 1991. Лили. Rev. Neurosci. 14: 453-501.
188.Hollyday, M., and Hamburger, V. 1976. /. Сотр. Neural. 170:311-320.
189.Sendtner, M., Holtmann, В., and Hughes, R.A. 1996. Neurochem. Res. 21: 831-841.
190.Oppenheim, R.W, et al. 1995. Nature 373: 344-346.
191.Caroni, P., and Grandes, P. 1990. /. Cell Biol. 110: 1307-1317.
192.McManaman, J. L., Haverkamp, L. J., and Oppenheim, R.W. 1991. Adv. Neural. 56: 81-88.
193.DeChiara, T. M., et al. 1995. Cell 83: 313-322.
194.O'Leary, D. D. M., Fawcett, J.W, and Cowan, W. M. 1986. /. Neurosci. 6: 3692-3705.
195.Martin, D. P., et al. 1988. J. Cell Biol. 106: 829-844.
196.Friedlander, R. M., and Yuan, J. 1998. Cell Death Differ. 5:823-831.

Глава 23. |
Развитие нервной |
|
|
|
системы |
575 |
197.Bergmann, Α., Agapite, J., and Steller, H. 1998. Oncogene 17: 3215-3223.
198.O'Leary, D. D. 1992. Curr. Opin. Neurobiol. 2: 70-77.
199.Nakamura, H., and O'Leary, D. D. M. 1989. /. Neurosci. 9: 3776-3795.
200.O'Leary, D. D.M., and Terashima, T. 1988. Neuron 1: 901-910.
201.Redfern, P.A. 1970. /. Physiol. 209: 701-709.
202.Brown, M. C., Jansen, J. K. S., and Van Essen, D. 1976. /. Physiol. 261: 387-422.
203.Betz, W. J., Caldwell, J. H., and Ribchester, R. R. 1980. /. Physiol. 303: 265-279.
204.Balice-Gordon, R.J., and Lichtman. J.W. 1993. J. Neurosci. 13: 834-855.
205.Can, W-B., and Lichtman, J.W. 1998. Science 282: 1508-1511.
206.Purves, D., and Lichtman, J.W. 1983. Annu. Rev. Physiol. 45: 553-565.
207.O'Brien, R.A. D., Ostberg, A.J.C., and Vrbova, G. 1978. /. Physiol. 282: 571-582.
208.Thompson, W 1983. Nature 302: 614-616.
209.Thompson, W, Kuffler, D. P., and Jansen, J. K. S. 1979. Neuroscience 4: 271-281.
210.Brown, M. C, Hopkins, W.G., and Keynes, R.J. 1982. /. Physioi. 329: 439-450.
211.Ribchester, R. R., and Taxt, T. 1983. /. Physiol. 344:89-111.
212.Ribchester, R. R., and Taxt, T. 1984. / Physiol. 347:497-511.
213.Balice-Gordon, R.J., and Lichtman, J.W. 1994. Nature 372: 519-524.
214.Katz, L.C., and Shatz, C.J. 1996. Science 274: 1133-1138.
215.Cabelli, R.J., Hohn, A., and Shatz, C.J. 1995. Science 267: 1662-1666.
216.Campenot, R.B. 1982. Dev. Bid. 93: 13-21.
Глава 24. Денервация и регенерация синаптических связей
В нервной системе позвоночных при нарушении целостности аксона происходит дегенерация дистальной части этого отростка. Кроме того, развивается комплекс дегенеративных явлений в самом поврежденном нейроне, в иннервируемой им клетке, а также в нейроне, являющемся пресинаптическим по отношению к поврежденному. Изменения происходят вследствие нарушения аксонального транспорта трофических факторов, которые контролируют нейрональную дифференцировку и выживание нейронов, а также как результат перестройки паттерна электрической активности.
Волокна скелетной мышцы позвоночных после денервации становятся более чувствительными к ацетилхолину и начинают экспрессировать ацетилхолиновые рецепторы по всей своей поверхности. Прямая электрическая стимуляция денервированных гиперчувствительных мышц приводит к сужению участка, чувствительного к ацетилхолину, до размеров исходной концевой пластинки. Активность мышцы влияет также на скорость оборота ацетилхолиновых рецепторов. Эффекты активности опосредуются входом ионов кальция в клетку и активацией внутриклеточных вторичных посредников. В отличие от иннервированных мышечных волокон, денервированные мышцы допускают иннервацию в любом месте своей поверхности. Денервированные мышечные волокна не только обладают повышенной склонностью к реиннервации, но даже стимулируют неповрежденные нервные окончания к разрастанию и формированию новых отростков (спраутинг). Подобным же образом нейроны, лишенные иннервации, становятся гиперчувствительными к трансмиттерам и стимулируют развитие близлежащих нервных окончаний.
Способность поврежденных аксонов к регенерации и реиннервации исходных мишеней колеблется в широких пределах от вида к виду. У безпозвоночных и низших позвоночных, таких как лягушки и тритоны, поврежденные аксоны успешно регенерируют и с высокой точностью восстанавливают исходные синаптические контакты. К этому способны и аксоны у эмбрионов и новорожденных высших позвоночных, включая млекопитающих. У высших позвоночных аксоны периферической нервной системы взрослых животных также отрастают после их повреждения. Если периферический нерв был передавлен, регенерирующие аксоны направляются к их исходным периферическим мишеням с помощью эндоневрия и базальной мембраны шванновских клеток. В результате этого возможно полное восстановление потерянной функции. Если же периферический нерв был перерезан, реиннервация мишеней бывает часто неполная и неточная. Аргин и другие факторы, ассоциированные с синаптической частью базальной мембраны мышечного волокна, инициируют образование специализированных пре--и постсинаптической структур в регенерирующем нерве и мышечных клетках.
Для центральной нервной системы взрослых млекопитающих способность к регенерации весьма ограничена. Нейроны ЦНС взрослых млекопитающих обладают способностью к спраутингу и формированию новых синапсов только на коротких дистанциях. Рост аксонов на большие расстояния может происходить или через трансплантаты, полученные из периферических нервов, или через неповрежденные участки ЦНС. Кроме того, эмбриональные нейроны и стволовые клетки, имплантированные в ЦНС взрослых животных, способны к дифференцировке, удлинению отростков и могут адекватно интегрироваться в сохранившиеся нейрональные сети. Техника трансплантации позволяет надеяться на преодоление функционального дефицита, возникающего в результате повреждений ЦНС и нейродегенеративных заболеваний.
Глава 24. Денервоция и регенерация синоптических связей |
577 |
Нервная система многих видов имеет поразительную способность успешно восстанавливать специфические синаптические соединения, которые были нарушены в результате травмы. Регенеративные способности нейронов ЦНС впервые были продемонстрированы Матти, который в 1920-х годах рассек оптический нерв тритона и обнаружил, что зрение у этого животного было восстановлено в течение нескольких недель после операции1). В начале 1940- х годов Сперри, Стоун и их коллеги, используя эти регенеративные возможности, исследовали, по какому механизму формируются специфические соединения в нервной системе. Их эксперименты по регенерации зрительной системы лягушек и рыб подтвердили идею, согласно которой нейроны селективно иннервируют свои мишени уже во время регенерации, а не создают первичные случайные контакты, реорганизуемые позднее2). Позже детальные исследования, проведенные на пиявках, сверчках и речных раках, убедительно продемонстрировали, что аксоны идентифицированных нейронов безпозвоночных после перерезки способны найти и точно соединиться с исходными синаптическими партнерами, игнорируя множество других потенциальных мишеней. В противоположность этому, регенерация поврежденных нервных соединений в нервной системе взрослого млекопитающего либо является лишь частичной, либо отсутствует вовсе.
В этой главе мы опишем изменения, которые происходят в нейроне и окружающих глиальных клетках после пересечения аксона, а также эффекты денервации, развивающиеся в постсинаптических клетках-мишенях. Затем мы рассмотрим способность нейронов развивать новые аксоны, восстанавливать синаптические контакты с клетками-мишенями и компенсировать утраченные функции. Наконец, мы обсудим возможность восстановления нейронов, утраченных в результате травмы или заболевания.
§ 1. Изменения в аксотомированных нейронах и окружающих глиальных клетках
Валлеровская дегенерация
После перерезки чувствительных или двигательных волокон периферического нерва наблюдается характерная очередность морфологических и функциональных изменений (рис. 24.1)4). Прежде всего дегенерации подвергается листал ьная часть этого волокна, а также небольшой участок проксимальной части нерва. Шванновские клетки, формирующие миелиновую оболочку дистального сегмента нерва, дегенерируют, пролиферируют и вместе с макрофагами фагоцитируют аксональные и миелиновые остатки. Такая реакция названа перерождением Валлера по имени анатома девятнадцатого столетия Августа Валлера, впервые описавшего ее. Клеточное тело и ядро разбухают, ядро перемешается из своего типичного положения в центре на периферию. Кроме того, нарушается упорядоченное строение части шероховатого эндоплазматического ретикулума, которая называется субстанцией Ниссля Снижение интенсивности окраски субстанции Ниссля, следующее за аксотомией, известно как хроматолиз.
Через несколько часов после перерезки начинается рост новых аксональных отростков, происходящих от перерезанного конца нервного волокна, и процесс регенерации. Если нейрон успешно восстановил контакт с мишенью, клеточное тело приобретает исходный внешний вид. Хроматолиз происходит не только в периферических нервах, но также и после повреждения аксонов в центральной нервной системе.
В организме взрослых животных реакция нейронов, не восстановивших контактов со своими мишенями, может быть различной5· 6). Пересечение аксонов оптического нерва приводит к быстрой гибели ганглиозных клеток сетчатки. Большинство клеток переднего базального таламуса выживают после повреждений коры, хотя при этом они существенно атрофируются. Чувствительные нейроны задних корешков спинного мозга и мотонейроны после перерезки их аксонов в периферическом нерве, как правило, погибают. Немногие выжившие при этом клетки в значительной степени атрофируются. Большинство аксотомированных клеток автономного ганглия выживают, но они уменьшаются в размерах и становятся менее чувствительными к ацетилхолину.
Ретроградные транссинаптические эффекты аксотомии
Аксотомия может также вызывать изменения в нейронах, посылающих синаптический сигнал к поврежденной клетке. Например, по-
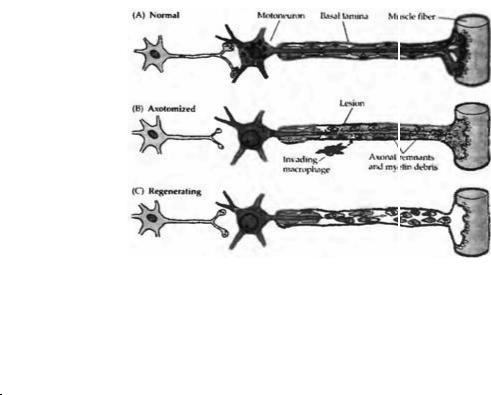
578 |
|
|
|
Раздел IV. Развитие нервной системы |
|
Рис. |
|
|
24.1. |
|
|
Дегенеративные |
|
|
|
||
изменения |
|
|
после |
|
|
аксотомии. |
|
|
(А) |
|
|
Типичный |
|
мотонейрон |
|
|
|
взрослого |
|
позвоночного. |
|
|
|
(В) После аксотомии |
|
|
|||
нервное |
|
окончание, |
|
|
|
дистальный |
|
участок |
|
|
|
аксона |
и |
|
короткий |
|
|
отрезок |
проксимального |
|
|
||
участка |
|
|
аксона |
|
|
подвергаются |
|
|
|
||
дегенерации. |
|
Шван |
|
|
|
новские клетки утрачивают |
|
|
|||
способность |
|
к |
|
|
|
дифференцировке, |
|
|
|||
пролиферируют и |
вместе |
|
|
||
с |
вторгшимися |
|
|
||
микроглиальными |
|
|
|
||
клетками |
и |
макрофагами |
|
|
|
фагоцитируют |
|
|
|
||
аксональные |
|
и |
|
|
|
миелиновые |
|
остатки. |
|
|
|
Аксотомирован |
ный |
колонок шванновских клеток внутри эндоневральной |
трубки и базальной |
||
нейрон |
|
подвергается |
мембраны, окружавшей исходный аксон. |
|
|
хроматолизу, |
|
|
Fig. 24.1 Degenerative Changes After Axotomy. (A) A typical |
motoneuron in an adult |
|
пресинаптические |
|
||||
окончания |
|
подвергаются |
vertebrate. (B) After axotomy, the nerve terminal, the distal segment of the axon, and a |
||
ретракции. |
|
|
|
short length of the proximal segment of the axon degenerate. Schwann cells |
|
Дегенеративные |
|
dedifferentiate, proliferate, and, together with invading microglial cells and |
|||
изменения |
|
|
могут |
macrophages, phagocytize the axonal and myelin remnants. The axotomized neuron |
|
происходить |
в |
пре- и |
undergoes chromatolysis, presynaptic terminals retract, and degenerative changes may |
||
постсинаптических |
occur in preand postsynaptic ceUs (C) The axon regenerates along the column of |
||||
клетках. |
|
(С) |
Аксон |
Schwann cells within the endoneurial tube and sheath of basal lamina that had |
|
регенерирует вдоль |
surrounded the original axon. |
||||
сле аксотомии клеток автономного ганглия цыпленка, крысы или морской свинки, синаптические сигналы в клетках ганглия становятся менее эффективными7)--9). Это отчасти является результатом сниженной чувствительности аксотомированной клетки к нейротрансмиттеру ацетилхолину. Кроме того, как результат ретроградных транссинаптических влияний, происходит ретракция пресинаптических окончаний, а оставшиеся терминали освобождают меньше квантов трансмиттера (рис. 24.2) 10). Таким образом, повреждение нейрона нарушает его способность поддерживать высокоэффективный пресинаптический сигнал. Ротшенкер показал и другой пример ретроградного транссинаптического влияния, наблюдаемый в мотонейронах лягушки и мыши11). После перерезки моторного нерва на одной стороне тела происходит формирование новых синапсов и спраутинг аксонов интактных мотонейронов, иннервируюших соответствующую мышцу другой стороны тела. Сигнал распространяется от аксотомированных нейронов, пересекает спинной мозг и воздействует на неповрежденные мотонейроны на другой стороне животного. Важно отметить, что мотонейроны, иннервирующие другие мышцы, при этом не затрагиваются.
Трофические субстанции и эффекты аксотомии
Ряд эффектов аксотомии — хроматолиз, атрофия нейронов и гибель клеток — является результатом утраты трофических веществ, продуцируемых тканями-мишенями и транспортируемых по аксону ретроградно с периферии по направлению к телу клетки12). Хорошим примером этого является действие фактора роста нервов (NGF) на сенсорные и симпатические нейроны, обсуждаемое в главе 23. Так, в автономном ганглии морской свинки эффекты аксотомии воспроизводятся подкожными инъекциями антител к фактору роста нервов или блокированием ретроградного транспорта в постганглионарных нервах. Напротив, эффекты аксотомии в значительной мере предотвращаются аппликацией NGF на ганглий13). Подобным же образом ретроградная транссинаптическая атрофия может быть результатом снижения продукции трофических факторов поврежденными нейронами.

Глава 24. Денервация и регенерация синаптических связей |
579 |
|
|||||||||
Рис. |
|
24.2. |
Атрофия |
|
|
клеток |
|
|
|
||
аксотомированного |
автономного |
|
|
|
|||||||
ганглия |
и потеря пресинаптических |
|
|
|
|||||||
входов. (А) |
|
Нормальный |
|
нейрон. |
|
|
|
||||
(В) |
Через |
несколько дней |
после |
|
|
|
|||||
аксотомии |
нейроны |
атрофируются |
|
|
|
||||||
большая |
|
часть |
дендритов |
|
|
|
|||||
приобретает |
|
варикозные |
|
|
|
||||||
расширения. |
|
|
|
Многие |
|
|
|
||||
пресинаптические |
|
окончания |
|
|
|
||||||
подвергаются |
ретракции, |
а |
|
|
|
||||||
оставшиеся |
|
освобождают |
меньше |
|
|
|
|||||
трансмиттера. |
(С) |
|
|
Если |
|
|
|
||||
постганглионарный |
|
|
|
аксон |
|
|
|
||||
регенерирует и реиннервирует свою |
|
|
|
||||||||
периферическую мишень, |
свойства |
|
|
|
|||||||
клетки |
и |
синаптических |
входов |
|
|
|
|||||
восстанавливаются. |
|
|
|
|
|
|
|
||||
Fig. |
24.2. |
Axotomized |
Autonomie |
|
|
|
|||||
Ganglion Cells Atrophy and Lose |
|
|
|
||||||||
Presynaptic Inputs. (A) Normal neuron. |
|
|
|
||||||||
(B) Within a few days after axotomy, |
|
|
|
||||||||
neurons atrophy and many dendrites |
|
|
|
||||||||
show |
|
large |
varicosities. |
|
Many |
|
|
|
|||
presynaptic |
terminals |
retract |
from |
|
|
|
|||||
dendrites; those that remain release |
|
|
|
||||||||
less |
|
transmitter. |
(C) |
|
If |
the |
|
|
|
||
postganglionic |
axon regenerates and |
|
|
|
|||||||
reinner vates its peripheral target the |
|
|
|
||||||||
cell and synaptic inputs recover. (After |
|
|
|
||||||||
Purves, 1975.) |
|
|
|
|
|
|
|
|
|||
§ 2. Эффекты денервации на постсинаптические клетки
Нервно-мышечный синапс является удобной моделью для изучения механизмов синаптической передачи, которые приложимы не только к периферическим, но и к центральным синапсам. Сходным образом процессы, происходящие в денервированных мышцах, могут быть хорошим аналогом того, к чему приводит устранение синаптических входов в нейронах ЦНС14).
Денервированная мышечная мембрана
В конце девятнадцатого столетия в денервированной скелетной мышце был обнаружен феномен спонтанных асинхронных сокращений, названных фибрилляциями. Фибрилляции инициировались самой мышечной мембраной, а не АХ15), хотя большинство спонтанных потенциалов действия, вызывающих фибрилляцию, исходило из участка бывшей концевой пластинки 16). Начало фибрилляций у крыс, морских свинок или кроликов наблюдалось через 2-5 дней после денервации, тогда как у обезьян и человека этот латентный период занимал более недели.
К моменту начала фибрилляций волокна мышц млекопитающих становятся гиперчувствительными к различным химическим агентам. Это значит, что концентрация веществ, требуемых для возбуждения мышцы, снижается в сотни или тысячи раз. Например, денервированная скелетная мышца млекопитающего примерно в 1000 раз более чувствительна к АХ, добавленному непосредственно в омывающий раствор или инъецированному в артерию, снабжающую мышцу, чем нормально иннервированная мышца17). Потенциал действия в денервированных мышцах также меняется, становясь более устойчивым к тетродотоксину, яду рыбы футу, который блокирует натриевые каналы (глава 3). Это изменение обусловлено повторным появлением тетродотоксинрезистентных натриевых каналов, которые являются превалирующей формой каналов в незрелой мышце18). В денервированной мышце происходят и другие изменения, такие как постепенная атрофия или опустошение мышечных волокон19)--21).
Глава 24. Денервация и регенерация синоптических связей |
581 |
Синтез и деградация рецепторов в денервированной мышце
Ценным методом для изучения распределения и реорганизации АХ рецепторов является их мечение радиоактивным α-бунгаротоксином, который прочно и с высокой специфичностью связывается с АХ рецепторами. Мечение нормальной и денервированной мыши α- бунгаротоксином подтвердило, что число и распределение центров связывания токсина изменяется после денервации25· 26). В постсинаптической мембране нормальной мышцы определяется около 104 сайтов связывания токсина на мкм2, в сравнении с менее чем 10/мкм2 во внесинаптической области. После денервации число АХ рецепторов во внесинаптических участках возрастает до 103/мкм2, тогда как в синаптической зоне плотность центров связывания α-бунгаротоксина меняется незначительно.
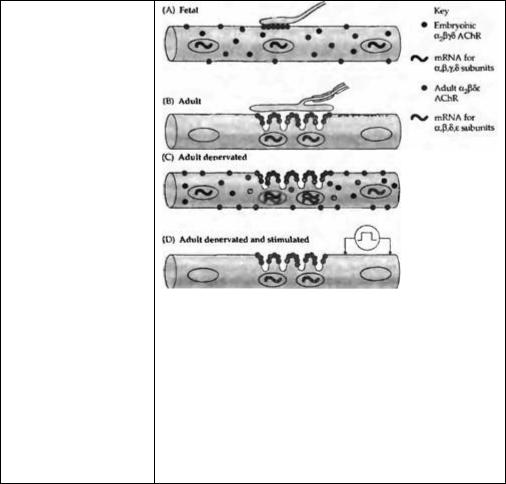
Рост числа АХ рецепторов в денервированной мышце может быть обусловлен их усиленным синтезом25· 27). Действительно, скорость появления новых рецепторов заметно повышается после денервации, и вещества, блокирующие синтез белка (такие как актиномицин или пуромииин), предупреждают этот эффект. Нозерн блоттинг и гибридизация in situ показывают, что в нормальной мышце мРНК для субъединиц АХ рецептора синтезируют только несколько ядер, локализующихся в непосредственной близи от концевой пластинки. В противоположность этому, при денервации гены АХ рецептора активируются по всей протяженности мышечного волокна (рис. 24.4) 28)--30).
Денервация оказывает также влияние на композицию субъединиц и скорость деградации АХ рецепторов. Во взрослой мышце синаптические и экстрасинаптические АХ рецепторы содержат ε-субъединицу с периодом полураспада около 10 дней31· 32). После денервации период полураспада рецепторов, содержащих ε-субъединицу и сохраняющихся в области концевой пластинки, уменьшается до 3 дней. Оборот рецепторов может быть вновь замедлен реиннервацией или повышением концентрации внутриклеточного цАМФ и последующей активацией протеинкиназы А33).
Новые рецепторы, синтезированные в денервированной мышие (синаптические или внесинаптические), похожи на эмбриональные. Они содержат γ-субъединицу и имеют оборот с периодом полураспада 1 день34· 35). Эта скорость оборота АХ рецепторов может быть снижена экзогенным АТФ, действующим через пуринергические рецепторы36).
Роль инактивации мышцы в денервационной гиперчувствительности
Каким образом перерезка двигательного нерва приводит к появлению новых АХ рецепторов
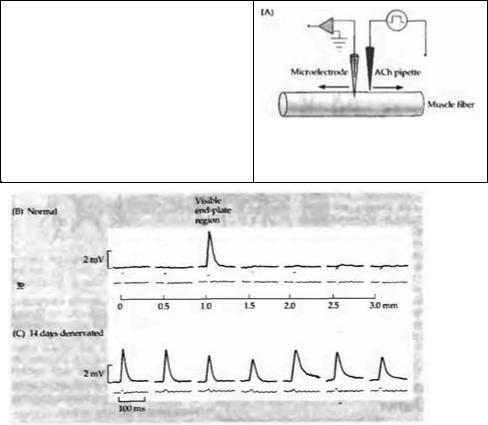
— через инактивацию мышцы или через какие-то другие механизмы? Для исследования этой проблемы Ломо и Розенталь37) блокировали проведение импульсов по двигательному нерву крысы аппликацией местного анестетика или дифтерийного токсина. Вещества апплицировались с помощью манжеты, наложенной на участок нерва на некотором расстоянии от мышцы. Этот метод приводил к эффективной инактивации мышцы, так как двигательные импульсы не проводились дальше манжеты. Тестовая стимуляция нерва дистальнее блокированного участка приводила к обычному сокращению мышцы. Кроме того, происходила нормальная генерация миниатюрных потенциалов концевой пластинки, свидетельствуя, что синаптическая передача была интактна. После 7 дней блока нерва мышца становилась гиперчувствительной (рис. 24.5). Другими экспериментами было показано, что новые внесинаптические рецепторы появляются тогда, когда нервно-мышечная передача блокирована долговременной аппликацией кураре или α-бунгаротоксина38). Эти результаты показали, что денервационная гиперчувствительность связана с потерей синаптической активации мышцы39).
Важность мышечной активности как фактора, контролирующего реакцию мышцы на АХ, была подтверждена в экспериментах, в которых гиперчувствительные денервированные мышцы крысы прямо стимулировали через имплантированные электроды. Повторяющаяся в течение нескольких дней стимуляция мышц сокращала область, чувствительную к АХ, до уровня исходного синаптического участка (рис. 24.4D и 24.6)37). Спонтанная сократительная активность мышцы в этих условиях была слишком низкой для того, чтобы обратить эффекты денервации на распределение АХ рецепторов25, 40).