
37_DFU_2.1 / DFU_Dopolnenie_2cr
.pdf
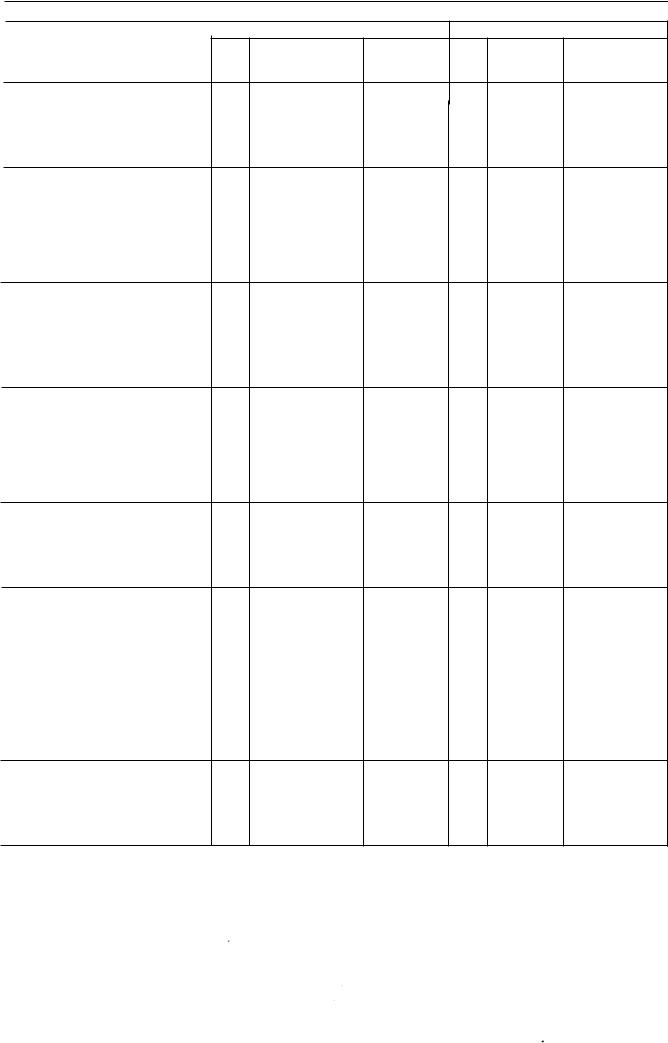
5.7. Таблиця фізичних характеристик радіонуклідів. наведених у Фармакопеї
Радіонуклід
Криmoн-8 1m |
(81"'Кr |
|
) |
Рубідій-8 \ (8 I Rb) У
рівновазі з Кrrиптоном-8 1 m
(8 mКr)
Стронцій-89 (KYSr)
У рівновазі з Iтрієм-89т (89mу )
Стронцій-90 CUSr) У рівновазі з Iтрієм-90 (90у)
Iтрій-90 CUY)
Молібден-99 (99мо) У рівновазі з
Технецієм-99т
(99mТе)
|
|
Емісія електронів |
|
|
|
Емісія фотонів |
|
|||
Період |
|
|
Імовірність |
|
|
|
Енергія |
Імовірність емісії |
|
|
напіврозпаду |
Тип |
Енергія (MeV) |
емісії (на 100 |
Тип |
|
|||||
(МеУ) |
(на 100 розпадів) |
|
||||||||
1 3. 1 0 (3) е |
ее |
|
розпадів) |
Х |
|
|||||
0. 1 76 |
26.4 |
|
0.01 2-0.0 14 |
1 7.0 |
|
|||||
|
|
0. 1 89 |
4.6 |
|
У |
0. 190 |
67.6 |
|
||
|
|
|
|
|
|
|||||
4.576 (5) год |
ел |
0.01 1 |
3 1 .3 |
|
Х |
0.01 3-0.0 14 |
57.2 |
|
||
|
ее |
0. 1 76 |
25.0 |
|
У |
0. \ 90 |
64 |
|
||
|
|
0. 188 |
4.3 |
|
|
|
|
0.446 |
23.2 |
|
|
|
|
|
|
|
|
|
0.457 |
3.0 |
|
|
+ |
0.253 (І) |
\ .8 |
|
|
|
|
0.5 10 |
5.3 |
|
(8 I mКr: \ 3. \ 0(3) е) |
|
0.447 (І) |
25.0 |
|
|
|
|
0.5 \ \ |
54.2 |
|
- |
0.583 (І) (макс: \ .492) |
|
|
|
|
|
0.538 |
2.2 |
|
|
50.53 (7) діб |
99.99 |
|
У |
|
|
|
|
|
||
|
|
0.909 |
0.0\ |
|
||||||
(89my: \6.J6 (4) e) |
. |
0. \ 96 (І) (макс: 0.546) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
28.74 (4) років |
1 00 |
|
|
|
|
|
|
|
||
(90у: 64. 10 (8) год) |
|
|
|
|
|
|
|
|
|
|
64. \ 0 (8) год |
. |
0.934« ) (макс: 2.280) |
\ 00 |
|
|
|
|
|
|
|
|
Х |
|
|
|
||||||
65.94 ( 1 ) год |
. |
0. 133 (І) |
1 6.4 |
|
0.0 18-0Ш 1 |
3.6 |
|
|||
|
|
|||||||||
|
|
0.290 (І) |
\ . \ |
|
|
|
|
|
|
|
|
|
0.443 (І) |
82.4 |
|
У |
0.04 \ |
\ . 1 |
|
||
|
|
|
|
|
0. \ 4 \ |
4.5 |
|
|||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
0. \ 8 \ |
6 |
|
|
|
|
|
|
|
|
|
0.366 |
\ .2 |
|
(99mТе: 6.0 \ ( 1 ) год) |
|
|
|
|
|
|
|
0.740 |
1 2 . \ |
|
|
|
|
|
|
|
|
|
0.778 |
4.3 |
|
6.01 ( \ ) год |
ее |
0.002 |
74 |
|
Х |
0.0 \ 8-0Ш \ |
7.3 |
|
||
|
|
|
|
|
|
|
|
|
|
|
Технецій-99m |
|
(99 |
m |
Те) |
|
Технецій -99 (99Те)
Pyreній-юз ('03Ru) у
рівновазі з
Родієм-1 03т |
||
( ' |
03m h |
) |
R |
||
Індій-1 1 0 ("Оlп)
2. 1 \ |
х \ 05 років |
||
39.26 (2) діб |
|||
( |
' |
3 |
ra h |
|
R : |
||
|
|
0 |
|
56. \ \4 (20) хв)
4.9 ( I ) год
ел
ее
+
ед+ее
ее
.
ед
0.01 5
0.1 20
0.137-0. 140
0.085 (І) (макс: 0.294)
0.0 1 7
0.030-0.039
0.03 1 |
(І) |
0.064 (1)
0.0 1 9
.
2. 1 |
У |
0. \ 4 \ |
89. \ |
9.4 |
|
|
|
1 .3 |
|
|
|
1 00 |
|
|
|
1 2 |
Х |
0.020-0.023 |
9.0 |
88.3 |
У |
0.497 |
9 1 |
|
|
М \ О |
5.8 |
6.6 |
|
|
|
92.2 |
|
|
|
1 3 .4 |
Х |
0.023-0.026 |
70.5 |
|
У |
0.642 |
25.9 |
|
|
0.658 |
98.3 |
|
|
0.885 |
92.9 |
|
|
0.938 |
68.4 |
|
|
0.997 |
1 0.5 |
|
|
|
|
(І) Середня енергія спектра.
(11' Максимальна імовірність емісії, відповідна загальній анігіляції у джерелі на ІОО розпадів.
1 94 |
ДЕРЖАВНА ФАРМАКОП ЕЯ УКРАЇНИ 1 .2 |
5.7. таблиця фізичних характеристик радіонуклідів, наведених у Фармакопеї
|
І |
|
І |
|
|
|
|
|
Емісія електронів |
|
|
|
|
|
|
|
|||||
|
Радіонуклід |
|
|
Період |
|
|
|
Імовірність |
||
|
напіврозпаду |
Тип |
|
Енергія (МеУ) |
емісії (на 100 |
|||||
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
розпадів) |
|
|
|
|
69. 1 (5) хв |
еА |
0.01 9 |
5.3 |
|||
|
|
|
|
|
||||||
|
Індій-1 10m |
|
|
|
|
+ |
|
1 .0 1 5 (І) |
6 1 |
|
|
("<tn |
Іп) |
|
|
|
|
|
|
|
|
|
|
|
2.8047 (5) діб |
еА |
|
0.0 1 9 |
1 5 .6 |
|||
|
Індій- І І |
І ( ' "Іп) |
|
|
|
|
ее |
|
0. 145 |
7.8 |
|
|
|
|
|
|
|
0.1 67-0. 1 7 1 |
1 .3 |
||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0.2 1 9 |
4.9 |
|
|
|
|
|
|
|
|
|
0.24 1 -0.245 |
1 .0 |
|
|
|
49.5 1 ( І ) діб |
ее |
|
0. 1 62 |
40 |
|||
|
|
|
|
|
||||||
|
Іццій-1 14m(" п) у |
|
|
|
|
|
|
0 . 1 86-0. 1 90 |
40 |
|
|
|
|
|
|
|
|
|
|
||
|
рівновазі з |
|
|
|
|
|
|
|
|
|
|
Індієм- 1 14 ( 1 14Iп) |
|
|
|
|
* + |
|
0.777 (І) (макс: 1 .985) |
95 |
|
|
|
|
1 |
In: |
71.9 (1) с) |
|
||||
|
|
|
|
|
|
|
||||
|
|
|
( |
14 |
|
|
|
|
|
|
|
|
|
1 54.0 (7) діб |
еА |
0.003 |
88.0 |
||||
|
Телур- 1 2 1 m |
|
|
|
|
|
0.022-0.023 |
7.4 |
||
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
||
|
(121тТе) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
у рівновазі з |
|
|
|
|
ее |
0.050 |
33.2 |
||
|
Телуром- 1 2 1 ('2Iте) ('2IТе: 19.16 (5) діб) |
|
0.077 |
40.0 |
||||||
|
|
|
|
|
|
|
|
0. 1 80 |
6. 1 |
|
|
|
|
* * 1 9. 1 6 (5) діб |
еА |
0.022 |
1 1 .6 |
||||
Тип
Х
У
Х
У
Х
у
Х
у
Х
Емісія фотонів
Енергія |
Імовірність емісії |
(MeV) |
(на 100 розпадів) |
0.023-0.026 |
27.8 |
0.5 1 J |
1 23.4 (11 ) |
0.658 |
97.8 |
2 . 1 29 |
2 . 1 |
0.003 |
6.9 |
0.023-0.026 |
82.3 |
0. l 7 1 |
90.2 |
0.245 |
94.0 |
0.023-0.027 |
36.3 |
0. 1 90 |
1 5 .6 |
0.558 |
3.2 |
0.725 |
3.2 |
0.026-0.03 1 |
50.5 |
0.2 1 2 |
8 1 .4 |
1 . 1 02 |
2.5 |
0.026-0.030 |
75.6 |
Телур121 |
(12IТе) |
|
|
|
|
1 3.27 (8) год |
ел |
0.023 |
1 2.3 |
|
|
ее |
0. 1 27 |
1 3.6 |
|
|
|
0. 1 54 |
1 . 8 |
Йод- 1 23 |
('231) |
|
0. 1 5 8 |
0.4 |
59.402 ( 14) діб |
еА+се |
0.004 |
80 |
Йод- 1 25 ( 1 251) |
|
0.023-0.035 |
33 |
|
|
|
(І) Середня енергія спектра.
(11) М аксимальна імовірність емісії, відповідна загальній анігіляції у джерелі на
у0.470
0.508
0.573
Х 0.004 0.027-0.03 1
У0. 159
0.346
0.440
0.505
0.529
0.538
Х0.004
0.027
0.03 1
У 0.035
1 ОО розпадів.
1 .4
1 7. 7
80.3
9.3
86.6
83.3
0. 1 0.4 0.3 1 .4 0.4
15.5
1 1 4
26
6.7
ДЕРЖАВ НА ФАРМАКОП ЕЯ УКРАЇН И 1 .2 |
1 95 |
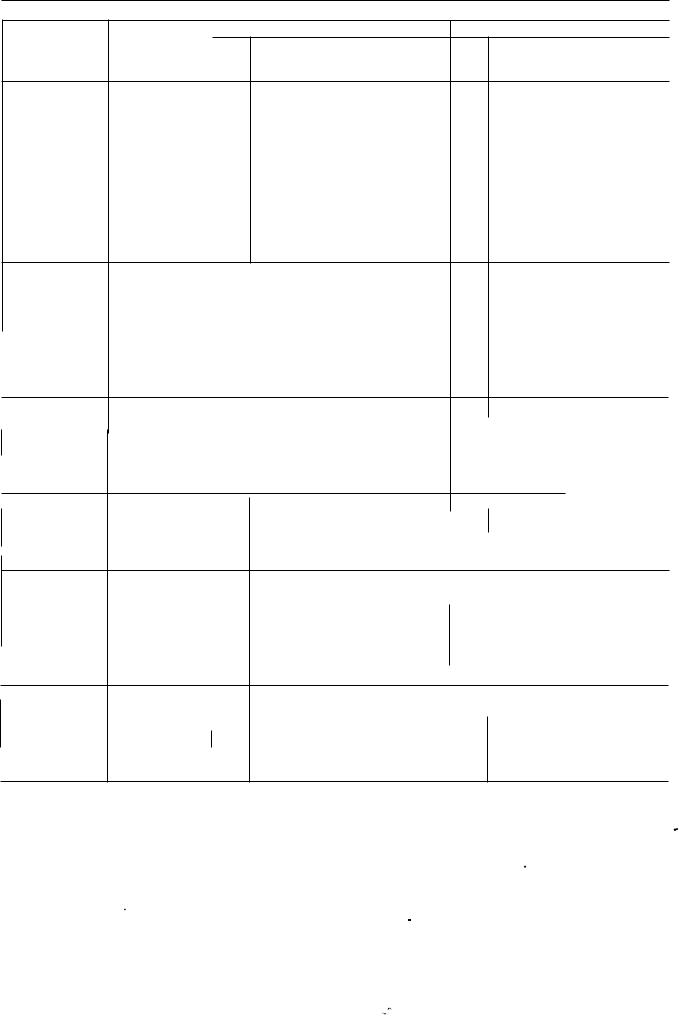
5.7. таблиця фізичних характеристик радіонуклідів, наведених у Фармакопеї
Радіонуклід
Йод126 eZ6I)
Йод- І З І еЗIІ)
Kcehoh-1 3lт(13I"'Хе)
Йод- І З3 еЗЗІ)
(розпадаcrься у радіоактивний
Ксенон-І 33)
Ксенон- 1 33 еЗЗХе)
Ксенон133т (13зmxе)
(розпадаcrься у радіоактивний
Ксенон- 1 33)
Період |
|
||
напіврозпаду |
Тип |
||
1 3. 1 1 (5) діб |
еА |
||
|
|
|
ее |
|
|
|
/3' |
8.02070 ( 1 1 ) діб |
/3+ |
||
ее |
|||
|
|
|
/3' |
1 1 .84 (7) діб |
еА |
||
|
|
|
ее |
|
|
|
|
|
|
|
|
20.8 ( І ) год |
|
/3' |
|
|
|
|
|
5 .243 ( 1 ) діб |
|
еА |
|
|
|
|
ее |
|
|
|
|
|
|
|
|
2 . 1 9 ( І ) діб |
|
|
/3' |
|
|
||
|
|
||
|
|
еА |
|
ее
Емісія електронів
|
Імовірність |
Енергія (МеУ) |
емісії (на 100 |
|
розпадів) |
0.023 |
6 |
0.354 |
0.5 |
0.634 |
0. 1 |
0. 109 (І) |
3.6 |
0.290 (І) |
32. 1 |
0.459 (І) |
8.0 |
0.530 (.) |
І |
0.46 |
3.5 |
|
|
0.330 |
1 .6 |
0.069 (І) |
2 . 1 |
0.097 (І) |
7.3 |
0. 1 92 (І) |
89.9 |
0.025 |
6.8 |
0. 1 29 |
6 1 |
0. 1 5 9 |
28.5 |
0. 163 |
8.3 |
0. 140 (1) |
3.8 |
0. 1 62 (І) |
3.2 |
0.299(1) |
4.2 |
0.44 1 (1) |
83 |
0.026 |
5.8 |
0.045 |
5 5 . 1 |
0.075-0.080 |
9.9 |
0. 1 0 1 (І) |
99.0 |
0.025 |
7 |
0. 1 99 |
64.0 |
0.228 |
20.7 |
0.232 |
4.6 |
|
|
Тип
Х
У
Х
У
Х
У
У
Х
У
Х
У
Емісія фотонів
Енергія |
|
Імовірність емісії |
|
(МеУ) |
|
(на 100 розпадів) |
|
0.027-0.03 1 |
|
42.2 |
|
0.388 |
|
34 |
|
0.49 1 |
|
2.9 |
|
0.5 1 1 |
|
2.3 ( 1 1 ) |
|
0.666 |
|
33 |
|
0.754 |
|
4.2 |
|
0.880 |
|
0.8 |
|
1 .420 |
|
0.3 |
|
0.029-0.030 |
|
3.9 |
|
0.080 |
|
|
|
|
|
2.6 |
|
0.284 |
|
|
6. 1 |
0.365 |
|
|
8 1 .7 |
|
|||
0.637 |
|
7.2 |
|
0.723 |
|
1 .8 |
|
0.004 |
|
8.3 |
|
0.030 |
|
44.0 |
|
0.034 |
|
1 0.2 |
|
0. 164 |
|
2.0 |
|
|
|||
0.530 |
|
|
|
|
87 |
||
0.875 |
|
4.5 |
|
1 .298 |
|
2.4 |
|
0.004 |
|
6.3 |
|
0.03 1 |
|
40.3 |
|
0.035 |
|
9.4 |
|
0.080 |
|
38.3 |
|
0.004 |
|
7.8 |
|
0.030 |
|
45.9 |
|
0.034 |
|
1 0.6 |
|
0.233 |
|
1 0.0 |
|
|
|
|
|
(/) Середня енергія /3 спектра.
(11) Максимальна імовірність емісії, відповідна загальній анігіляції у джерелі на 1 ОО розпадів.
1 96 |
ДЕРЖАВНА ФАРМАКОПЕЯ УКРАЇН И 1 .2 |
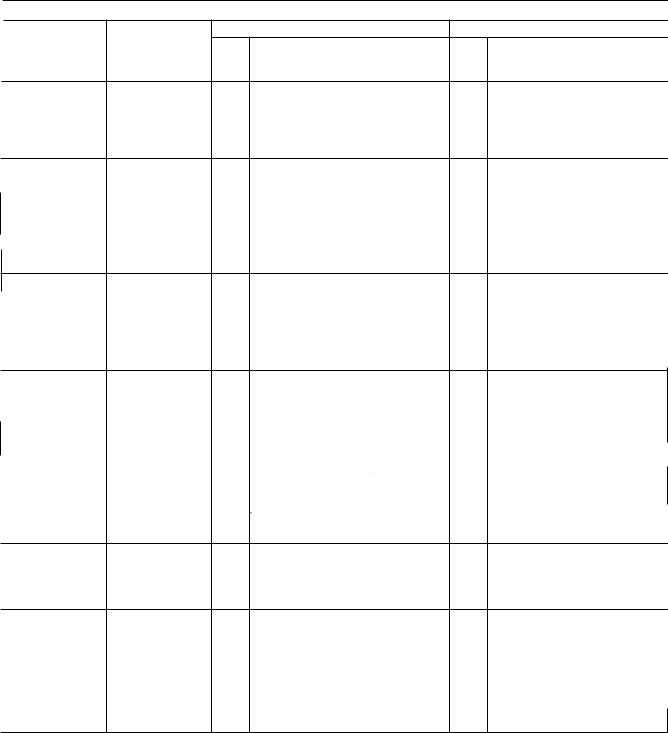
5.7. таблиця фізичних характеристик радіонуклідів, наведених у Фармакопеї
Радіонуклід
Йод-І ЗЗ (1331)
(розпадаcrься у радіоактивний Ксенон-1 ЗЗ)
Ксенон-І ЗЗ еЗЗХе)
Kcehoh13Зm(\33"'Хе) (розпадається у радіоактивний Ксенон-І ЗЗ)
Йод-І З5 еЗ51)
(розпадається у
радіоактивний Ксенон- 1 З5)
Період |
|
напіврозпаду |
Тип |
20.8 ( І ) год |
/3- |
5.24З ( І ) діб ел
се
/3- 2 . 19 ( І ) діб ел
се
6.57 (2) год |
/3- |
|
|
9. 1 4 (2) год |
се |
Ксенон- І З5 еЗ5Хе) |
/3- |
||
|
|
ЗО.04 (З) років |
ел |
Цезій-137 (137Cs)у |
- |
се |
|
рівновазі 1з""БарВaієм |
|
||
J37m( 3 |
) |
|
|
|
|
еЗ7"'Ва: 2.552 (І) хв) |
/3- |
|
|
|
|
Емісія електронів
|
Імовірність |
|
Енергія (MeV) |
емісії (на 100 |
|
0. 140 (І) |
розпадів) |
|
З.8 |
||
0. 1 62 (І) |
З.2 |
|
0.299(1) |
4.2 |
|
0.44 1 (1) |
8З |
|
0.026 |
5.8 |
|
0.045 |
55. 1 |
|
0.075-0.080 |
9.9 |
|
0. 1 0 1 (І) |
99.0 |
|
0.025 |
7 |
|
0. 1 99 |
64.0 |
|
0.228 |
20.7 |
|
0.2З2 |
4.6 |
|
|
||
0. 140 (1) |
7.4 |
|
0.2З7 (І) |
8 |
|
0.З07 (І) |
8.8 |
|
0.З52 (І) |
2 1 .9 |
|
0.З99 (І) |
8 |
|
0.444 (І) |
7.5 |
|
0.529 (І) |
2З.8 |
|
0.21 4 |
5.5 |
|
0. 1 7 1 |
З . І |
|
0.З08 |
96.0 |
|
0.026 |
0.8 |
|
0.624 |
8.0 |
|
0.656 |
1 .4 |
|
|
|
|
0. 1 74 (І) |
94.4 |
|
0.4 1 6 (І) |
5.6 |
Тип
У
Х
У
Х
У
У
Х
У
Х
У
Емісія фотонів
Енергія |
|
|
Імовірність емісії |
||
(MeV) |
|
|
(на 100 розпадів) |
||
0.5ЗО |
|
|
87 |
||
0.875 |
|
|
|
|
4.5 |
1 .298 |
|
|
|
|
2.4 |
0.004 |
|
|
|
|
6.З |
|
|
|
|||
0.ОЗ 1 |
|
|
40.З |
||
0.ОЗ5 |
|
9.4 |
|||
0.080 |
|
|
|
|
З8.З |
0.004 |
|
|
|
7.8 |
|
|
|
|
|||
|
|
||||
О.ОЗО |
|
45.9 |
|||
0.ОЗ4 |
|
10.6 |
|||
0.2ЗЗ |
|
1 0.0 |
|||
*0.527 |
|
|
|
|
І З.8 |
0.547 |
|
|
7.2 |
||
0.8З7 |
|
6.7 |
|||
I .ОЗ9 |
|
8.0 |
|||
1 . I З2 |
|
22.7 |
|||
1 .260 |
|
|
28.9 |
||
1 .458 |
|
|
8.7 |
||
|
|
|
|
|
|
1 .678 |
|
|
9.6 |
||
1 .79 1 |
|
|
7.8 |
||
0.ОЗ І -О.ОЗ5 |
|
5.0 |
|||
0.250 |
|
|
90.2 |
||
0.608 |
|
|
2.9 |
||
0.005 |
|
|
1 |
||
0.032-0.0З6 |
|
7 |
|||
0.662 |
|
|
85. 1 |
||
|
|
|
|
|
|
(І) Середня енергія /3 спектра.
(11)Максимальна імовірність емісії, відповідна загальній анігіляції у джерелі на 1 ОО розпадів.
ДЕРЖАВНА ФАРМАКОП ЕЯ УКРАЇН И 1 . 2 |
197 |
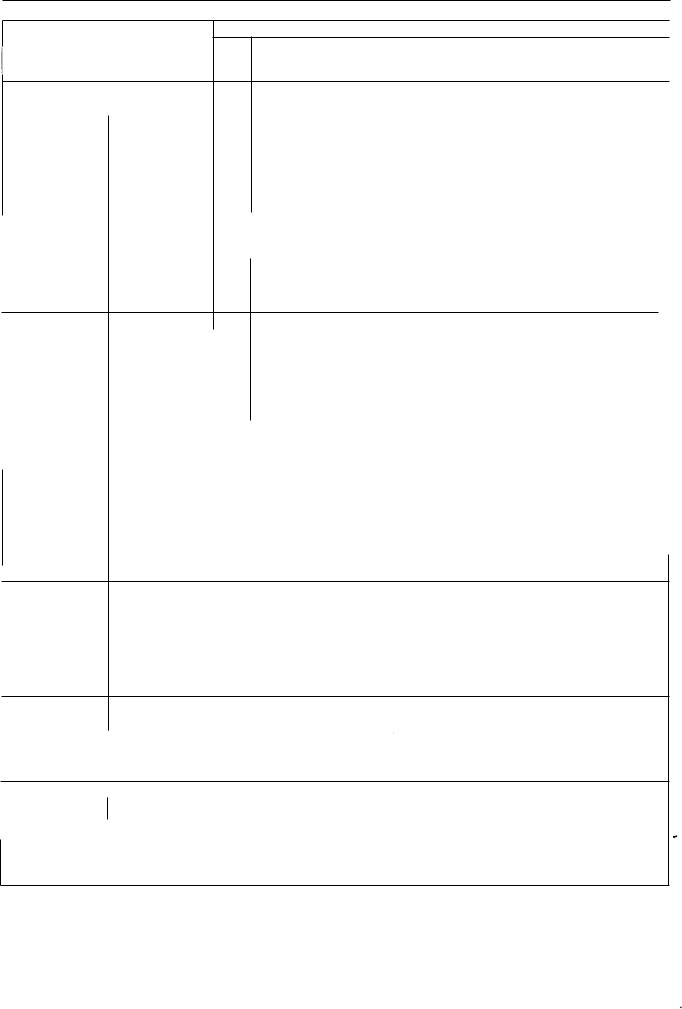
5.7. таблиця фізичних характеристик радіонуклідів, наведених у Фармакопеї
Радіонуклід |
Період |
|
напіврозпаду |
||
|
||
|
26. 1 (І) год |
|
|
|
Талій-200 (nТl)
9.33 (3) год
Свинець-20 1 еОIуРЬ) (розпадається радіоактивний Талій-201)
72.9 12 ( 1 7) год
Талій-20 1 (Ю1Тl)
12.23 (2) діб
Талій-202 (:ттl)
5 1 .873 (9) год
Свинець-203 еозрь)
Тип
ее
+
еА
ее
ее
еА
ее
ел
ее
Емісія електронів |
|
|
Емісія фотонів |
|||||
|
Імовірність |
|
Енергія |
|
Імовірність емісії |
|||
Енергія (MeV) |
емісії (на 100 |
Тип |
|
|||||
(MeV) |
|
(на 100 розпадів) |
||||||
|
розпадів) |
Х |
|
|||||
0.285 |
3.4 |
0.01 0 |
|
|
32.0 |
|
||
0.353 |
1 .4 |
|
0.069-0.07 1 |
|
|
63.3 |
|
|
0.495 (І) |
0.3 |
|
0.08 |
|
|
1 7.5 |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
||
|
|
У |
0.368 |
|
|
87.2 |
|
|
|
|
|
0.579 |
|
|
1 3.8 |
|
|
|
|
|
0.828 |
|
|
10.8 |
|
|
|
|
|
1 .206 |
|
|
29.9 |
|
|
|
|
|
1 .226 |
|
|
3.4 |
|
|
|
|
|
1 .274 |
|
|
3.3 |
|
|
|
|
|
1 .363 |
|
|
3.4 |
|
|
|
|
|
|
|
|
|
4.0 |
|
|
|
|
1 .5 1 5 |
|
||||
|
|
|
|
|
|
|
||
0.055 |
3 |
Х |
|
|
|
|
|
|
0.070-0.073 |
|
|
69 |
|
||||
|
|
|
0.083 |
|
|
1 9 |
|
|
|
|
|
|
|
|
|
|
|
0.246 |
8.5 |
У |
0.33 1 |
|
|
|
|
|
0.276 |
2 |
|
|
79 |
|
|||
0.3 1 6 |
2.3 |
|
0.36 1 |
|
|
9.9 |
|
|
|
0.406 |
|
|
|
||||
|
|
|
|
|
2.0 |
|
||
|
|
|
0.585 |
|
|
|
||
|
|
|
|
|
3.6 |
|
||
|
|
|
0.692 |
|
|
|
||
|
|
|
|
|
4.3 |
|
||
|
|
|
0.767 |
|
|
|
||
|
|
|
|
|
3.2 |
|
||
|
|
|
0.826 |
|
|
|
||
|
|
|
|
|
2.4 |
|
||
|
|
|
0.908 |
|
|
|
||
|
|
|
|
|
5.7 |
|
||
|
|
|
0.946 |
|
|
|
||
|
|
|
|
|
7.9 |
|
||
|
|
|
1 .099 |
|
|
|
||
|
|
|
|
|
1 .8 |
|
||
|
|
|
1 .277 |
|
|
|
||
|
|
|
|
|
1 .6 |
|
||
|
|
|
|
|
|
|
|
|
0.0 16-0.01 7 |
1 7.7 |
Х |
0.01 0 |
|
|
46.0 |
|
|
|
|
|
||||||
|
||||||||
0.027-0.029 |
4. 1 |
|
0.069-0.07 1 |
|
|
73.7 |
|
|
0.052 |
7.2 |
|
0.080 |
|
|
20.4 |
|
|
0.084 |
1 5.4 |
|
0.135 |
|
|
2.6 |
|
|
|
|
|
|
|||||
У |
|
|
|
|||||
0 . 153 |
2.6 |
|
|
|
||||
|
||||||||
|
|
|
0. 1 67 |
|
1 0.0 |
|
||
0.054 |
2.8 |
Х |
0.01 0 |
|
3 1 .0 |
|
||
|
|
|
0.069-0.07 1 |
|
6 1 .6 |
|
||
0.357 |
2.4 |
|
0.080 |
|
1 7 . 1 |
|
||
|
|
|
0.440 |
|
9 1 .4 |
|
||
|
|
У |
|
|
||||
0.055 |
3.0 |
Х |
0.01 0 |
|
37.0 |
|
||
|
|
|
0.07 1 -0.073 |
|
69.6 |
|
||
0. 1 94 |
1 3.3 |
|
0.083 |
|
1 9.4 |
|
||
|
|
У |
0.279 |
|
80.8 |
|
||
|
|
|
0.40 1 |
|
3.4 |
|
||
|
|
|
|
|
|
|
|
|
(І) Середня енергія спектра.
(ІІІ Максимальна iMOBi13HicTb емісії, відповідна загальній анігіляції у джерелі на 1ОО розпадів.
1 98 |
ДЕРЖАВНА ФАРМАКОПЕЯ УКРАЇНИ 1 .2 |

5.9. Поліморфізм
5.9. ПОЛІМОРФІЗМ
Поліморфізм (або кристалічний поліморфізм) - цеяви ще, характерне для твердого стану; здатність сполуки у твердому стані знаходитися у різних кристалічних формах, маючи при цьомутакий самий хімічний склад. Речовини, що знаходяться у некристалічному твердо му стані, називаються аморфними.
Коли це явище спостерігається для хімічнихелементів (наприклад, сірки), замість терміна поліморфізм ви користовується термін алотропія.
Термін псевдополіморфізм використовуєтьсядля опи cy сольватів (включаючи гідрати), у яких розчинник знаходиться в кристалічній решітці у стехіометричних співвідношеннях; термін також може бути поширений на сполуки, у яких розчинник зв'язується кристаліч ною решіткою в різних співвідношеннях. Оскільки термін «псевдополіморфізм» використовують зарізних обставин, його значення є неоднозначним. Тому кра ще використовувати терміни «сольвати» і «гідрати» .
Коли окрема стаття зазначає, що речовина проявляє поліморфізм, це може бути справжній кристалічний поліморфізм, наявність сольватів, алотропії або на явність аморфної форми.
Ідентичність хімічного складу означає, що всі крис талічні та аморфні форми даної речовини мають од накові хімічні властивості в розчині або в розплаві; на відміну від цього, Їх фізико-хімічні і фізичні власти вості (розчинність, твердість, здатність до стиснен ня, густина, температура плавлення та ін.), та відпов ідно їх реакційна здатність та біодоступність можуть відрізнятися.
Колиречовинапроявляє поліморфізм, форма, дляякої вільна ентальпія найменша при даній температурі і тиску, є найбільше термодинамично стабільною. Інші форми свідчать про наявність метастабільного стану. При нормальній температурі і тиску метастабільна форма може залишатися незмінною або може бути змінена в термодинамічно більш стабільну форму.
Якщо існує кілька кристалічних форм, одна форма є термодинамічно більш стабільною при даній темпера турі і тиску. Дана кристалічна форма може утворюва ти фазу, яка може досягати рівноваги з іншими TB P дими фазами, а також з рідкою і газовою фазами.
Якщо кожна кристалічна формабільш стабільна в ме жах даного температурного інтервалу, то перехід від однієї форми до іншої є зворотнім і це явище назива ють енантіотропією. Перехід з однієї фази до іншої є безперечно однозначно рівноважним, тому придано-
му тиску цей стан характеризується температурою переходу. Однак, якщо тільки одна з форм є стабіль ною за межами певного температурного інтервалу, зміна є незворотньою або монотропичною.
Різні кристалічні форми або сольвати можуть бути одержані за різних умов кристалізації (температура, тиск, природа розчинника, концентрація, швидкість кристалізації, наявність центру кристалізації, на явність і концентрація домішок та ін.)
Для вивчення поліморфізму можуть бути використані такі методи:
-Рентгенівська дифракція порошків;
-Рентгенівська дифракція монокристалів;
-Термічний аналіз (2.2.34) (диференціальна скануюча калориметрія, термогравіметрія, термомікроско п ія);
-Мікрокалориметрія;
-Вологоадсорбційний аналіз;
-Оптична та електронна мікроскопія;
-Ядерний магнітний резонанс твердих речовин;
-Абсорбційна спектрофотометрія в інфрачервоній
області (2.2.24);
-Раманівськаспектрометрія (спектрометрія комбіна ційного розсіювання);
-Визначення розчинності і характеристичної швидкості розчинення;
-Визначення густини.
Ці методи часто є доповнюючими один одного і важ ливо використовувати декілька з них.
Діаграми тиск/температура та енергія/температура побудовані на аналітичнихданих, є цінним інструмен том для повного розуміння енергетичних взаємозв' язків (енантіотропізму, монотропізму) і термодинамі ч ної стабільності і ндивідуальних модифікацій поліморфних сполук.
Для дослідження сольватів краще віддати перевагу диференціальній скануючій калориметрії і термогра віметрії у комбінації з визначенням розчинності, ха рактеристичної швидкості розчинення тарентгенівсь коїдифракції.
Для демонстраціії зон відносної стабільності гідратів визначають ізотерми сорбції/десорбції води.
Як правило, гідрати менше розчинні у воді, в по рівнянні з безводними формами, а сольвати, відпові дно, менше розчинні у відповідних розчинниках, ніж несольватні форми.
ДЕРЖАВНА ФАРМАКОП ЕЯ УКРАЇН И 1 .2 |
1 99 |

5. 10. Контроль домішок у субстанціях для фармацевтичного застосування
5. 10. КОНТРОЛЬ ДОМІШОК У СУБСТАНЦІЯХ ДЛЯ
ФАР ЕВТИЧНОГО
ЗАСТОСУВАННЯ
Вступ
Монографії Фармакопеї на субстанції для фармацев тичного застосування призначенідля забезпечення на лежної якості даних субстанцій для споживачів. Роль Фармакопеї в охороні здоров'я полягає у забезпеченні адекватного контролю домішок відповідно до вимог монографій. Вимоги якості базуються на наукових, технічних і регулюючих засадах.
Вимоги, що стосуються домішок, наведені в окремих монографіях і загальній монографії « Субстанції для
фармацевтичного застосування» . Окремі монографіїта
загальна монографія доповнюють одна одну: окремі монографії включають критерії прийнятності для до мішок, тоді як загальна монографія включає вимоги із кваліфікації, ідентифікаціїта інформування, що сто суються будь-яких органічних домішок, які наявні в
активних субстанціях.
Порогові значення для інформування, ідентифікації та кваліфікації, зазначені в загальній монографії «Суб
станціїдля фармацевтичного застосування>), застосовні
для всіх супровідніх домішок. Однак, якщо моногра фія не включає випробування на супровідні домішки, засноване на кількісному методі, будь-які нові домі шки, що містяться з перевищенням порогових зна чень, можуть бути не враховані, оскільки в процесі випробувань не можливо виявити ці домішки.
Вимоги розділу «Супровідні домішки>) загальної мо
нографії «Субстанціїдля фармацевтичного застосуван
ня» щодо порогових значень не поширюються на до поміжні речовини; також вимоги даного розділу не поширюються на: біологічні та біотехнологічні про дукти; пептиди, олігонуклеотиди; радіофармацевтичні препарати; продукти ферментації й одержані з них напівсинтетичні продукти; сировину тваринного та рослинного походження. Хоча для цих класів не зас тосовні вимоги загальної статті щодо порогових зна чень, загальні концепціїз інформування, ідентифікації (коли можливо) і кваліфікації домішок також засто совна для цих класів.
Основоположні принципи розробки монографій Фармакопеї
Монографії Фармакопеї, розроблені для субстанцій, що містяться в лікарських препаратах, дозволених компетентними уповноваженими органами учасників
Європейської Фармакопейної Конвенції(далі Конвенції).
Таким чином, дані монографії не обов'язково охоплю ють усі джерела субстанцій для фармацевтичного зас тосування, що використовуються на світовому ринку.
Органічні та неорганічні домішки, наявні у тих суб станціях, що пройшли оцінку якості компетентними
уповноваженими органами, кваліфіковані відносно безпеки у максимальному дозволеному кількісному вмісті (у максимальній добовій дозі), якщо тільки не стануть відомими нові дані щодо безпеки, які супро воджуються оцінкою, що обгрунтовує зниження меж.
Монографії Фармакопеї на субстанції для фармацев тичного застосування розроблені групами експертів і комісіями при співробітництві з національними фар макопейними уповноваженими органами, компетен тними уповноваженими органами торгового ліцензу вання, національними контрольними лабораторіями й Європейською Фармакопейною лабораторією. У розробці монографій також беруть участь виробники субстанций і/або фармацевтичні виробники, що ви користовують ці субстанції.
Контроль домішок у субстанциях ДЛЯ фармацевтичного
застосування
Якість субстанций за вмістом домішок контролюють шляхом проведення випробуваньу рамках монографії. Дані випробування призначені охопити органічні та неорганічні домішки, що відповідають джерелам ак тивних субстанций у дозволених лікарських препара тах.
Контроль залишкових кількостей органічних розчин ників проводять відповідно до загальної монографії
« Субстанції для фармацевтичного застосування» і за гальноїстатті 5. 4. «Залишкові кількості органічнихроз
чинників». У Сертифікаті відповідності монографії Європейській Фармакопеї для даного джерела суб станції зазначені залишкові кількості органічних роз чинників, контрольовані відповідно до затверджених критеріїв, і валідований метод контролю, якщо цей метод відрізняється від методу, описаного в загальній
статті 2.4.24. « Ідентифікація залишкових розчинників і контроль Їх кількостей».
Монографії на органічні хімічні препарати звичайно включають випробування «Супровідні домішки>), що охоплює основні органічні домішки. Це випробуван ня може бути доповнене окремими випробуваннями, якщо загальне випробування не контролює конкрет ну домішку або коли існують особливі причини (на ПРИКЛад, міркування безпеки) для тих домішок, що потребують окремого контролю.
Якщо в монографії відсутнє випробування на суп ровідні (або аналогічні) домішки, а включені лише
конкретні випробування, споживачі субстанций ма ють, проте, забезпечити відповідний контрольорганіч нихдомішок. Домішки, що містяться вище порогово- r го значення для ідентифікації, мають бути ідентифіковані (коли це можливо). Домішки, що зна ходяться вище порогового значення для кваліфікації, маютьбути кваліфіковані (див. також розділ « Рекомен дації користувачам монографій на активні суб станції»), за винятком обгрунтованих випадків.
Якщо вимоги монографії поширюються на субстанції з різними профілями домішок, монографія може включати єдине випробування на супровідні доміш-
200 |
ДЕРЖАВНА ФАРМАКОП ЕЯ УКРАЇН И 1 .2 |
5. 10. Контроль домішок у субстанціях для фармацевтичного застосування
ки, що охоплює всі домішки, які наведені у розділі «Домішки» , або можуть знадобитися кілька випробу ваньдля проведення контролю всіх відомих профілів. Відповідність може бути встановлена проведенням тільки тих випробувань, які відповідають відомому профілю домішокдляданогоджерела субстанції.
Вказівки про контроль домішок можуть бути вклю чені до розділу « Виробництво» монографії. Наприк лад, коли виробником має бути застосований аналі тичний метод, придатний для контролю лише конкретної домішки, тому що даний метод технічно складний для загального використання або не може бути застосовний для кінцевого лікарського засобу, і/або коли валідація процесу виробництва (включаю чи стадію очищення) забезпечує достатній контроль.
Розділ «Домішки» у монографіях на активні субстанції
Розділ «Домішки» монографій включає інформацію про відомі домішки (хімічна структура і назва, коли це можливо), як правило, органічні , що можуть бути виз начені з використанням випробувань, описаних у мо нографїі. Інформація грунтується на даних, отрима них під час розробки або перегляду монографії, і не обов'язково є вичерпною. Розділ включає специфіко вані домішки і, коли це зазначено, інші домішки, що виявляються.
Сnецифіковані домішки мають значення прийнятих критеріїв вмісту не більші за значення, затверджені компетентними уповноваженими органами.
Інші домішки, що виявляються є потенційними доміш
ками з описаною структурою. При цьому однозначно невідомо, чи присутні вони звичайно вище порогових значень для ідентифікації в субстанціях, використо вуванихулікарських препаратах, зареєстрованих ком петентними уповноваженими органами сторін Кон венції. Вони наводяться у розділі «Домішки» для інформації.
Якщо в активній субстанції виявлена домішка, відмінна від специфікованої, споживач субстанції зо бов'язаний проконтролювати, чи необхідна ідентифі кація/кваліфікація. Вибір залежить від кількісного вмісту, природи, максимальної добовоїдози та відпо відних порогових значень для ідентифікації/кваліфі кації відповідно до загальної монографії
розділ « Суп ровідні домішки» . Слід зазначити, що для субстанцій для ветеринарного застосування використовуються окремі порогові значення.
Інтерпретація результатів випробування на супровідні домішки у монографіях на активні субстанції
Конкретні монографії на субстанціїдля фармацевтич ного застосування повинні читатися й інтерпретува тися у взаємозв'язку із загальною монографією «Суб
станціїдля фармацевтичного застосування».
У тому випадку, коли загальний критерій прийнятності длядомішок (<<будь-яка інша домішка», «інші доміш-
ки», «будь-якадомішка» ), рівний номінальному вмісту перевищує порогове значення для ідентифікації (див. загальну монографію
він є дійсним тільки для специфі кованих домішок, зазначених у розділі «Домішки». Необхідність ідентифікації (коли це можливо), інфор мування, специфікаціїта кваліфікації іншихдомішок, що зустрічаються, має бути обrрунтована відповідно до вимог загальної монографії. Споживачі субстанції мають визначити обrpунтованість критеріїв прийнят ностідля домішок, не зазначених у розділі «Домішки» , та для зазначених, як інші домішки, що виявляються.
Критерії прийнятності для випробування на суп ровіднідомішки представлено по-різному у моногра фіях; схема рішення, представлена на РИС.5. 1 0- 1 , може бути використана для інтерпретації загальних кри теріїв прийнятності й інших питань, пов'язаних із роз ділом «Домішки» монографій.
Загальні критерії прийнятності для «інших» домішок виражають по-різному в монографіях: «будь-які інші домішки» , «іншідомішки» , «будь-які домішки» , «будь яка пляма» , «будь-яка смуга» та ін. Загальні критерії прийнятності можуть застосовуватися тільки до виз начених специфікованих домішок або до неспецифі кованих і визначених специфікованих домішок у за лежності від природи активної субстанції та застосовуваного порогового значення для ідентифі кації. Схема рішення (Рис. 5. 10- 1 ) може бути ВИкори станадля визначення критеріїв прийнятності з метою редакційноїадаптації вже опублікованих монографій, у яких використовується визначена термінологія.
Рекомендації користувачам монографій на активні
субстанції
У монографіях представлена специфікація для прий нятноїякості субстанцій із профілями домішок, відпо відними таким, що прийняті у процесі розробки і/або перегляду монографії. Споживач субстанціїзобов'яза ний проконтролювати, що монографія забезпечує адекватний контроль домішок у субстанції для фар мацевтичного застосування з даного джерела, пере важно використовуючи процедуру для сертифікації монографій на відповідність Європейській Фармако
пеї.
Монографія з випробуванням на супровідні домішки, заснованим на кількісному методі (такому, як рідинна хроматографія, газова хроматографія і капілярний електрофорез), забезпечує адекватний контроль дом ішок у субстанції з даного джерела, якщо домішки, наявні в кількостях, що перевищують застосовні по рогові значення для ідентифікації, є специфіковани ми домішками, зазначеними в розділі «Домішки» .
ЯКЩО субстанція міститьдомішки інші, ніж зазначені в розділі «Домішки», необхідно перевірити, що ці до мішки виявляються методом, наведеним у монографії. У протилежному разі має бути розроблена нова мето дика, і слід надіслати запит на перегляд монографії. У залежності від знайдених значень кількісного вмісту і
ДЕРЖАВНА ФАРМАКОП ЕЯ УКРАЇН И 1 .2 |
201 |

5. 10. Контроль домішок У субстанціях ДЛЯ фармацевтичного застосування
|
Загальні критерії прийнятності застосовуються до: |
Ні |
- усіх неспецифікованих домішок; |
|
- специфікованих домішок, за винятком тих, що |
|
мають власні критерії прийнятності в монографії. |
|
|
|
Загальні критерії прийнятності застосовуються до: |
Так |
- усіх неспецифікованих домішок; |
>------.., |
|
|
- специфікованих домішок, за винятком тих, що |
|
мають власні критерії прийнятності в монографії. |
|
|
Так
Загальні критерії прийнятності застосовуються до:
-специфікованих домішок, за винятком тих, котрі мають власні критерії прийнятності в монографії.
Для неспецифікованих домішок застосовують розділ
«Супровідні домішки» загальної монографії
«Субстанції для фармацевтичного застосування,)
Ні
|
Застосовують розділ « Супровідні домішки» |
|
|
|
|
|
загальної монографії «Субстанції для |
|
|
|
|
|
фармацевтичного застосування» |
|
|
|
|
|
|
|
|
|
|
Вимоги цього розділу застосовують до активних субстанцій, |
за винятком: біологічних і біотехнологічних продуктів; пеп |
.. |
|||
тидів, олігонуклеотидів; радіофармацевтичних препаратів; продуктів ферментації й отриманих з них напіВСj1нтетичних |
|||||
продуктів; сировини тваринного та рослинного походження . |
|
||||
.. При застосуванні розділу «Супровідні домішки» загальної монографії «Субстанції для фармацевтичного застосування,):
-індивідуальні критерії прийнятності мають бути визначені для будь-яких домішок, що можуть бути наявними у кількості, що перевищують порогові значення для ідентифікації;
-будь-яка домішка з- критерієм прийнятності вище порогових значень для ідентифікації має, якщо це можливо, бути ідентифікованою;
-будь-яка домішка із критерієм прийнятності вище порогових значень для кваліфікації має бути кваліфікована.
Рисунок 5. 1 0.- 1 . Схема рішень для інтерпретаціїзагальних критеріїв прийнятності для «інших» домішок умонографії
202 |
ДЕРЖАВНА ФАРМАКОПЕЯ УКРАЇН И 1 .2 |
5. 10. Контроль домішок У субстанціях для фармацевтичного застосування
запропонованих меж мають бути обrpунтовані іденти фiKaцiя і/або кваліфікація цих домішок.
Якщо тільки однє випробування на супровідні домі шки охоплює різні профілі домішок, у сертифікаті ана лізу слід зазначити тільки домішки для відомого про філю з одногоджерела, якщо тільки власник торгової ліцензії не використовує активні субстанції з різним профілем домішок.
Ідентифікація домішок (максимальне завдання)
Якшо монографія містить індивідуальну межу для до мішки, часто необхідно описати методику ідентифі кації, наприклад, використання стандартної речови ни , типової хроматограми або відносного утримування. Споживач субстанціїможе з'ясувати, що необхідно ідентифікувати домішки інші, ніж ті, для яких у монографії представлена методика ідентифі кації. Наприклад, що необхідно перевірити при датність специфікації для даного профілю домішок шляхом порівняння з розділом «Домішки» . За винят ком інформації, зазначеної в монографії, Європейсь каФармакопея не забезпечуєдля цих цілей стандартні речовини, типові хроматограми або інформацію про відносні утримування. Таким чином споживачі мають використовувати доступні наукові методикидля іден тифікації.
Нові домішки/Специфіковані домішки понад специфіковану межу
Якщо вводиться новий процес виробництва або відбу вається зміна у встановленому процесі, шо викликає появу новоїдомішки, необхідно використовувати по ложення загальної монографії «Субстанціїдля фарма
цевтичного застосування» щодо ідентифікації, квалі
фікації та перевірки придатності монографії для контролю даної домішки. Сертифікат відповідності є засобом для підтвердження для субстанції з даного джерела, що нова домішка в достатній мірі проконт рольована або що сертифікат містить методдля конт ролю з визначеним критерієм прийнятності. В остан ньому разі має бути ініційований перегляд монографії.
Якщо новий процес виробництва або зміна у встанов леному процесі викликають появу специфікованої домішки, вміст якої вище специфікованої межі, для питань, щодо кваліфікації необхідне використання
загальної монографії «Субстанції для фармацевтично го застосування».
Хроматографічні методи
Загальна стаття 2.2. 46. « Методи хроматографічного
розділення» розглядає питання, пов'язані з різними ас пектами контролю домішок.
Інформація про торгові назви колонок, реактиви і об ладнання, придатність використання яких обrрунто вана при розробці монографії, подана на EDQ М веб сайті (www.pheur.org) (коли це є доцільним).
ГЛОСАРІЙ
Межа домішок, які не враховують: у хроматографічних
випробуваннях, номінальний вміст при або менших значеннях якого піки/сигнали не враховують при роз рахунку суми домішок. Чисельні значеннядля меж, які не враховують, і порогові значення для інформування звичайно однакові.
Порогове значення для ідентифікації: граничне значен
ня, вище якого домішка має бути ідентифікована.
Ідентифікована домішка : домішка, для якої встанов
лена структура.
Домішка: будь-який компонент субстанціїдля фарма
цевтичного застосування, що не є визначеним хімічно як субстанція.
Номінальна концентрація: концентрація, розрахована на основі концентрації прийнятого стандарту й узята з розрахунком зазначеного поправкового коефіцієн
та.
Інші домішки, що виявляються: потенційні домішки з визначеною структурою, що можуть бути виявленими в результаті випробувань монографії, але невідомо, щоб вони звичайно були присутні понад порогових значень ідентифікації у субстанціях, використовува них у лікарських засобах, зареєстрованих компетент ними уповноваженими органами сторін Конвенції. Данїдомішки є неспецифікованими і, відповідно, нор муються за загальними критеріями.
Потенційна домішка: домішка, що теоретично може
утворитися при виробництві або зберіганні субстанції. Вона може або не може фактично бути виявленою у субстанції. Якщо можлива домішка може бути вияв леною випробуваннями монографії, але невідомо, чи присутня вона звичайно в субстанціях, використову ваних улікарських засобах, зареєстрованих компетен тними уповноваженими органами сторін Конвенції, домішку включаютьдорозділу«Домішки» підзаголов ком «Інші домішки, що ви:значаються» для інформації.
Кваліфікація:'процес одержання й оцінки даних, на підставі яких установлюють біологічну безпеку інди відуальноїдомішки абоданого профілю домішок при встановленому рівні(-ях).
Порогове значення для кваліфікації: граничне значен
ня, вище якого домішка має бути кваліфікована.
Супровідні домішки: термін, використовуваний у мо
нографіях на загальні випробування на органічні до мішки.
Пороroве значення для інформування: граничне значен-
ня, вище якого про домішку необхідно інформувати. Синонім: інформуючий рівень.
ДЕРЖАВНА ФАРМАКОП ЕЯ УКРАЇН И 1 .2 |
203 |
