
- •Міністерство освіти і науки України
- •Передмова
- •Робоча програма
- •Приклади виконання завдань
- •Контрольні завдання
- •Основні класи неорганічних сполук основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Термохімія та термохімічні розрахунки основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Ентропія, енергія гіббса та напрямленість процесів основні поняття та визначення
- •Приклади виконання завдань
- •Визначити можливість перебігу реакції
- •Визначити, за якої температури настане рівновага в системі
- •Контрольні завдання
- •Хімічна кінетика основні поняття та визначення
- •Приклади виконання завдань
- •Визначити швидкість реакції
- •Контрольні завдання
- •Хімічна рівновага основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •II модуль розчини. Концентрації розчинів основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Властивості розчинів неелектролітів. Основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Електролітична дисоціація ступінь та константа дисоціації основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Іонний добуток води. Водневий показник основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Іонна рівновага в гетерогенних системах добуток розчинності основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Реакції в розчинах електролітів основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Гідроліз солей основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Колоїдні розчини основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Будова атома основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •III модуль окисно-відновні реакції основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Гальванічні елементи основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Корозія металів основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Электроліз розплавів і водних розчинів електролітів основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Твердість води основні поняття та визначення
- •Приклади виконання завдань
- •Приклад 2. Визначення маси солі, розчиненої в певному об’ємі води, за величиною твердості води.
- •Контрольні завдання
- •Карбонатна рівновага. Форми існування со2 у воді. Основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Список рекомендованої літератури Основна література
- •Додаткова література
- •Додаток абудова речовини а1.Будова атома
- •А2.Періодична система елементів д. І.Менделєєва та електронна теорія будови атомів
- •Головна підгрупа Побічна група
- •Двох періодів.
- •Відносні електронегативності елементів(за шкалою Полінга)
- •А3. Хімічний зв’язок і будова молекул
- •2 Відштовхування rзв.Е, кДж/моль
- •Елементів д.І.Менделєєва
- •Навчальне видання
Термохімія та термохімічні розрахунки основні поняття та визначення
|
Термохімія
|
- розділ хімії, який вивчає теплові ефекти хімічних реакцій і фазових перетворень. |
|
Термохімічні рівняння
|
- рівняння процесів, в яких указані теплові ефекти та агрегатні стани речовин. |
|
Тепловий ефект |
- це кількість теплоти, яка виділяється або поглинається під час перебігу реакції при постійному тиску і об’ємі та рівності температур вихідних речовин і продуктів реакції (Твих =Тпрод). У Міжнародній системі одиниць (СІ) основною одиницею енергії затверджено Дж (Джоуль). Для вираження більшої кількості енергії використовують кДж (кілоДжоуль).
|
|
Ентальпія Н |
-
тепловміст системи, що включає внутрішню
енергію і роботу розширення.
|
|
Зміна ентальпії системи ΔН |
-
тепловий ефект реакції, виміряний при
сталому тиску і сталій температурі
(Р =const,
T = const):
|
|
Стандартна ентальпія реакції ΔН0 |
- тепловий ефект реакції за стандартних умов (Р = 101,3 кПа, Т=298К).
|
|
Екзотермічна реакція |
- реакція, що відбувається з виділенням теплоти Q > 0, тобто з пониженням ентальпії системи ΔН < 0.
|
|
Ендотермічна реакція |
- реакція, що відбувається з поглинанням теплоти Q < 0, тобто з підвищенням ентальпії системи ΔН > 0.
|
|
Стандартна
ентальпія (теплота) утворення
|
-
тепловий ефект реакції утворення 1
моль будь-якої сполуки з простих
речовин, стійких за даних умов. Теплота
утворення сполук, виміряна за стандартних
умов, називається стандартною теплотою
утворення
|
|
Закон Гесса |
- тепловий ефект реакції залежить від природи і стану вихідних речовин та продуктів реакції і не залежить від шляху перебігу реакції, тобто від числа і характеру проміжних стадій.
|
|
Перший наслідок із закону Гесса
|
- тепловий ефект (ентальпія) хімічної реакції дорівнює різниці між сумою теплот утворення продуктів реакції та сумою теплот утворення вихідних речовин з урахуванням стехіометричних коефіцієнтів:
|
|
Другий наслідок із закону Гесса |
- тепловий ефект (ентальпія) реакції дорівнює різниці між сумою теплот згоряння вихідних речовин і сумою теплот згоряння продуктів реакції з урахуванням стехіометричних коефіцієнтів:
|
|
Теплота (ентальпія) згоряння ΔНзг |
- тепловий ефект реакції окиснення 1 моль речовини киснем з утворенням вищих оксидів. Розмірність - кДж/моль.
|
|
Теплотворна здатність Q |
- теплота, яка виділяється при згорянні 1 кг твердого або рідкого палива та 1 м3 газоподібного палива. Розмірність – кДж/кг, кДж/м3. |
Приклади виконання завдань
При виконанні завдань цього розділу див. табл. 5.
Приклад 1. Визначення маси реагуючих речовин за величиною теплового ефекту реакції.
При
взаємодії алюмінію з йодом, виділилось
77 кДж теплоти. Які маси речовин
прореагували? Теплота утворення алюміній
іодиду дорівнює
![]() кДж/моль.
кДж/моль.
Розв’язання.
Записуємо термохімічне
рівняння, враховуючи, що
![]()
![]() .
.
На підставі термохімічного рівняння складаємо пропорції та розв’язуємо їх:
а) MAl=27 г/моль;
27 г Al реагують з виділенням 308 кДж теплоти;
х г Al реагують з виділенням 77 кДж теплоти.
Звідси
![]() .
.
б)
![]() = 254 г/моль;
= 254 г/моль;
![]() ,
,
381г J2 реагують з виділенням 308 кДж теплоти;
y г J2 реагують з виділенням 77 кДж теплоти.
Звідси
![]() .
.
Відповідь: Прореагувало 6,75 г алюмінію та 95,25 г йоду.
Приклад 2. Визначення об’єму і маси реагуючої речовини за величиною теплового ефекту реакції.
Визначити об’єм (н.у.) і масу вуглекислого газу, необхідного для реакції
![]() кДж,
кДж,
якщо при цьому виділяється 379,9кДж теплоти.
Розв’язання. Як видно з термохімічного рівняння, при взаємодії 1 моля, тобто 22,4 л (взятих за н.у.) вуглекислого газу з лугом, виділяється 170,2 кДж теплоти. Тому можемо скласти пропорції:
22,4 л СО2 реагують з виділенням 170,2 кДж теплоти,
х л СО2 реагують з виділенням 379,9 кДж теплоти.
Звідси
![]() .
.
Для знаходження маси СО2 необхідно знайти молярну масу:
![]()
Відповідно до першого наслідку із закону Авогадро маса 1 моля СО2 займає об’єм 22,4 л (за н.у.). Тоді масу СО2 можна розрахувати з пропорції:
44 г СО2 займають об’єм 22,4 л
y г СО2 займають об’єм 50 л.
Звідси
![]() .
.
Відповідь. Прореагувало 50 л СО2 масою 98,2 г.
Приклад 3. Визначення теплового ефекту реакції за масою реагуючої речовини.
Визначити кількість теплоти, яка виділяється при згорянні 10 кг амоніаку, якщо термохімічне рівняння має вигляд:
![]() кДж
кДж
Розв’язання.
Як видно з термохімічного
рівняння, при згорянні 4 моль амоніаку
виділяється 1168,8 кДж теплоти. Тобто ця
кількість теплоти виділяється при
згорянні амоніаку масою
![]()
Складаємо пропорцію:
0,068 кг NH3 згоряє з виділенням 1168,8 кДж теплоти
10 кг NH3 згоряє з виділенням х кДж теплоти.
Звідси
![]() кДж.
кДж.
Відповідь: При згорянні 10 кг амоніаку виділяється 171882,4 кДж теплоти.
Приклад 4. Визначення теплоти утворення складної речовини за відомим тепловим ефектом відповідної реакції.
Визначити теплоту утворення цинк сульфіду, якщо при взаємодії 0,25 г сірки з надлишком цинку за стандартних умов виділилось 1,6 кДж теплоти. Записати відповідне термохімічне рівняння.
Розв’язання.
Під теплотою утворення
(![]() )
розуміють зміну ентальпії реакції
утворення 1 моля складної речовини з
відповідних простих речовин, взятих у
стійкому при певних умовах стані. Тобто
)
розуміють зміну ентальпії реакції
утворення 1 моля складної речовини з
відповідних простих речовин, взятих у
стійкому при певних умовах стані. Тобто![]()
Записуємо відповідне рівняння реакції утворення ZnS:
![]() .
.
Як
видно з рівняння, кількість молів Sі ZnS
рівні:
![]() .
.
Через
відому масу сірки знаходимо
![]() .
.
Оскільки
![]() ,
то
,
то![]() .
.
Отже
теплота утворення ZnS(Т)
дорівнює =-205,1 кДж/моль,
або
![]()
Відповідь.
Теплота утворення
цинк сульфіду дорівнює
![]() кДж/моль.
кДж/моль.
Термохімічне рівняння має вигляд:
![]() кДж.
кДж.
Приклад 5. Розрахунок стандартної теплоти утворення за законом Гесса. Розрахувати теплоту утворення метану, користуючись такими термохімічними рівняннями:
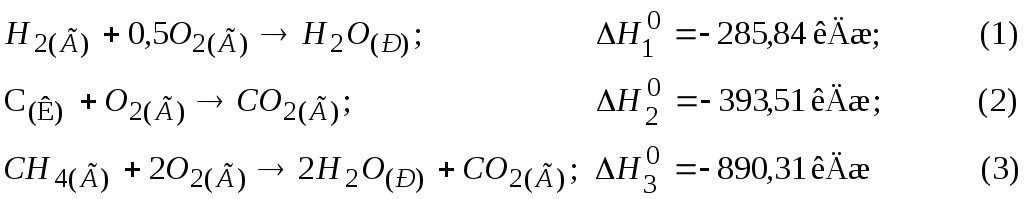
Розв’язання. Згідно до закону Гесса термохімічними рівняннями можна оперувати, як і алгебраїчними. Щоб одержати рівняння реакції утворення метану:
![]()
треба рівняння (1) помножити на 2, додати до нього рівняння (2) і від одержаної суми відняти рівняння (3). Отримуємо сумарне рівняння:
2Н2(Г) +О2(Г) + С(К) +О2(Г)– СН4(Г) –2О2(Г) →2Н2ОР)+СО2(Г)-2Н2ОР
–СО2(Г)
2Н2(Г)+ С(К) → СН4(Г).
Відповідні дії здійснюємо з тепловими ефектами реакцій:
ΔНР = 2ΔН1 + ΔН2– ΔН3= 2 (-285,84) + (-393,51) – (- 890,31) = 74,88 кДж.
Оскільки
![]() ,
то
,
то![]()
Відповідь:
![]() =
74,88 кДж/моль.
=
74,88 кДж/моль.
Приклад 6. Визначення теплового ефекту реакції за стандартними теплотами утворення речовин.
Визначити тепловий ефект реакції:
![]()
за
відомими величинами стандартних теплот
утворення речовин (![]() ).
).
Розв’язання: Для цього використовуємо перший наслідок із законуГесса:
![]()
![]()
Значення
![]() речовин беремо в таблиці 4:
речовин беремо в таблиці 4:
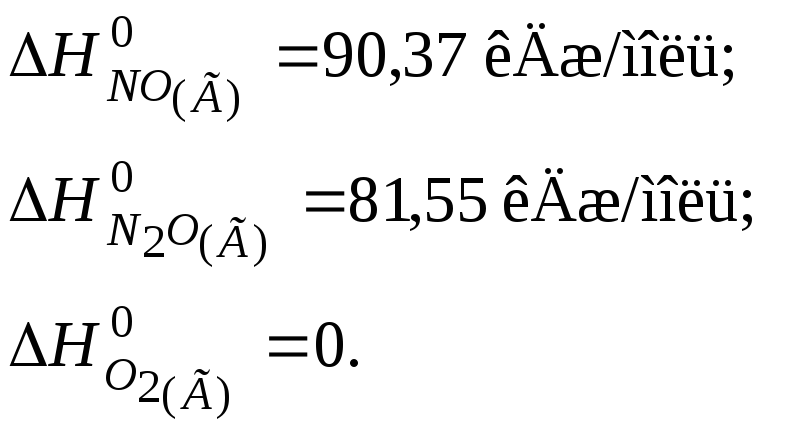
![]()
Відповідь: ΔНР = -198,38 кДж
