
- •Міністерство освіти і науки України
- •Передмова
- •Робоча програма
- •Приклади виконання завдань
- •Контрольні завдання
- •Основні класи неорганічних сполук основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Термохімія та термохімічні розрахунки основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Ентропія, енергія гіббса та напрямленість процесів основні поняття та визначення
- •Приклади виконання завдань
- •Визначити можливість перебігу реакції
- •Визначити, за якої температури настане рівновага в системі
- •Контрольні завдання
- •Хімічна кінетика основні поняття та визначення
- •Приклади виконання завдань
- •Визначити швидкість реакції
- •Контрольні завдання
- •Хімічна рівновага основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •II модуль розчини. Концентрації розчинів основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Властивості розчинів неелектролітів. Основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Електролітична дисоціація ступінь та константа дисоціації основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Іонний добуток води. Водневий показник основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Іонна рівновага в гетерогенних системах добуток розчинності основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Реакції в розчинах електролітів основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Гідроліз солей основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Колоїдні розчини основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Будова атома основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •III модуль окисно-відновні реакції основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Гальванічні елементи основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Корозія металів основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Электроліз розплавів і водних розчинів електролітів основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Твердість води основні поняття та визначення
- •Приклади виконання завдань
- •Приклад 2. Визначення маси солі, розчиненої в певному об’ємі води, за величиною твердості води.
- •Контрольні завдання
- •Карбонатна рівновага. Форми існування со2 у воді. Основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Список рекомендованої літератури Основна література
- •Додаткова література
- •Додаток абудова речовини а1.Будова атома
- •А2.Періодична система елементів д. І.Менделєєва та електронна теорія будови атомів
- •Головна підгрупа Побічна група
- •Двох періодів.
- •Відносні електронегативності елементів(за шкалою Полінга)
- •А3. Хімічний зв’язок і будова молекул
- •2 Відштовхування rзв.Е, кДж/моль
- •Елементів д.І.Менделєєва
- •Навчальне видання
Список рекомендованої літератури Основна література
Степаненко О.М., Рейтер Л.Т., Ледовських В.М., Іванов С.В. Загальна та неорганічна хімія: В 2ч.- К.: Педагогічна преса,- 2000. –Ч.1.- 520 с.
Романова Н.В. Загальна та неорганічна хімія.- К.; Ірпінь: ВТФ “Перун”,- 1998.- 480 с.
Глинка Н.Л. Общая химия.- Л.: Химия,- 1988.- 702 с.
Телегус В.С., Бодак О.І., Заречнюк О.С., Кінжибало В.В. Основи загальної хімії.- Львів: Світ,- 2000.- 424 с.
Коровин Н.В. Общая химия.- М.: Высш. шк.,- 1998.- 539 с.
Курс химии. Ч.2, Специальная для стр. институтов и факультетов./ под ред. Киреева В.А.- М.: Высш. шк.,- 1975.- 236 с.
Сухорукова Л.С., Григор’єва В.І., Коновалов О.М., Курова Т.І., Мальцева Н.І. та інш. Основи загальної хімії.- Харків, - 2002.- 153 с.
Додаткова література
Общая химия / Под ред. Соколовской Е.М. и Гузея Л.С.- М.: Изд-во МГУ,- 1989.- 640 с.
Ахметов Н.С. Общая и неорганическая химия.- М.: Высш. шк.,- 2002.- 743 с.
Глинка Н.Л. Задачи и упражнения по общей химии.- Л.: Химия,- 1986.- 279 с.
Каличак Я.М. Кінжибало В.В., Котур Б.Я. та інш. «Хімія», задачі, вправи, тести.- Львів: Світ,- 2001.- 176 с.
Гольбрайх З.Е. Сборник задач и упражнений по химии.- М.: Высш. шк.,- 1984.- 224 с.
Додаток абудова речовини а1.Будова атома
Уявлення про будову матерії та її властивості базуються на поняттях атом-но-молекулярного вчення, згідно з яким, усі речовини складаються з атомів.
Атоми — реально існуючі матеріальні об'єкти, що характеризуються певни-ми масою, розмірами, складом, зарядом ядра, будовою електронної оболонки та іншими властивостями.
Маси атомів мають дуже малі значення (в межах 10-27 — 10-25 кг). В хімії частіше їх виражають в атомних одиницях маси (1 а.о.м. = 1, 661·10-27 кг). Раді-уси атомів становлять близько 10-10 м.
Атом складається з позитивно зарядженого ядра і негативно заряджених електронів, що утворюють електронну оболонку, розміри якої обумовлюють розміри атома. В ядрі вміщується основна маса атома (приблизно 10-26 — 10-25 кг), хоча радіус його становить 10-15 — 10-14 м, тобто в 105 разів менший за радіус атома.
Ядро складається з нуклонів — протонів і нейтронів.
Протон (р) — це елементарна часточка з масою 1,672·10-27 кг (1,00730 а.о.м.) і позитивним зарядом, який дорівнює 1,602·10-19 Кл або +1 у відносних одиницях.
Нейтрон (n) — це електронейтральна елементарна часточка з масою
1, 674·10 -27 кг (1, 0087 а.о.м.).
Електрон (е) — це елементарна часточка з масою 9, 109·10-31 кг (у 1836 ра-зи менша за масу протону). Заряд електрона дорівнює 1, 602·10-19 Кл. Саме заряд електрона був прийнятий за одиницю елементарного електричного заряду. У цих одиницях заряд електрона (-1).
Оскільки атом електронейтральний, то число електронів в атомі дорівнює числу протонів у його ядрі.
Ядра атомів будь-якого хімічного елемента завжди містять однакове число протонів Z, яке визначається порядковим номером елемента в періодичній системі елементів Д.І.Менделєєва, число нейтронів може бути різним.
Загальне число протонів Z і нейтронів N, які містяться в ядрі атома, називають ядерним масовим числом А, або просто масовим числом:
А = Z + N.
Сукупність атомів одного виду, які мають однаковий заряд, але різне число нейтронів, а тому різні атомні маси, називають ізотопами. Вони позначаються символом хімічного елемента з двома індексами ліворуч: верхній показує масо-ве число, нижній — значення заряду ядра. Наприклад, у водню є три ізотопи: протій 11Н, дейтерій 21Н або D, тритій 31Н або Т. Наявність декількох ізотопів у елементів є причиною дробових значень їхніх атомних мас.
Атоми, що містять різне число протонів Z і нейтронів N, але мають однакове масове число А, називають ізобарами (4018 Ar, 4019 К, 4020 Са).
Будова електронних оболонок атомів. Усі електрони атома утворюють його електронну оболонку. Вони розташовуються навколо ядра шарами і мають різні енергії як при переході від шару до шару (різні енергетичні рівні), так і в межах одного шару (різні енергетичні підрівні).
В основі сучасної теорії будови атома лежить уявлення про двоїсту корпускулярно-хвильову природу електрона — властивості часточки (маса) та хвилі (інтерференція, дифракція, фотоелектричний ефект, тощо). Для електронів справедливе рівняння де Бройля, яке пов'язує масу (m) рухомої частки з відповідною довжиною хвилі (
![]() ,
,
де
![]() - стала Планка; v – швидкість руху частки.
- стала Планка; v – швидкість руху частки.
Електрон в атомі можна уявити як хмару з певною густиною негативного електричного заряду в певному об'ємі простору навколо ядра. Об'єм простору навколо ядра, в якому знаходження електрона найбільш ймовірне, називається орбіталлю (рис.1).
 Z
Z
Х
У
Рис.1. Електронна хмара атома Гідрогену.
Орбіталі можуть відрізнятися своїми розмірами, формою та орієнтацією у просторі.
Квантові числа.
Для описання стану електрона в атомі
користуються квантовими числами: n,
![]() ,
ml,
ms,
які одержані при рішенні хвильового
рівняння Шредінгера.
,
ml,
ms,
які одержані при рішенні хвильового
рівняння Шредінгера.
Головне квантове число n характеризує віддаленість електронної хмари від ядра і набуває цілочисельних значень 1, 2, 3, 4…Чим більше n, тим більша енергія електрона. Тому головне квантове число визначає енергію електрона і показує енергетичний рівень, на якому знаходиться електрон. Енергетичні рівні позначаються також великими літерами:
Значення n 1 2 3 4 5
Позначення K L M N Q
Орбітальне або побічне
квантове число
![]() характеризує форму електронної хмари.
Воно може набувати значень від 0 до (n
-1). Значення
характеризує форму електронної хмари.
Воно може набувати значень від 0 до (n
-1). Значення![]() = 0 відповідає електронній хмарі зі
сферичною симетрією;
= 0 відповідає електронній хмарі зі
сферичною симетрією;![]() = 1 — гантелеподібна форма електронної
хмари;
= 1 — гантелеподібна форма електронної
хмари;![]() = 2 — дві перекриті гантелі.
= 2 — дві перекриті гантелі.
Різна форма електронних хмар обумовлює зміну енергії електрона в межах одного енергетичного рівня, тобто розщеплення рівня на енергетичні підрівні. Енергетичні підрівні позначаються буквами:
Значення
![]() 0 1 2 3 4 5
0 1 2 3 4 5
Позначення s p d f g h
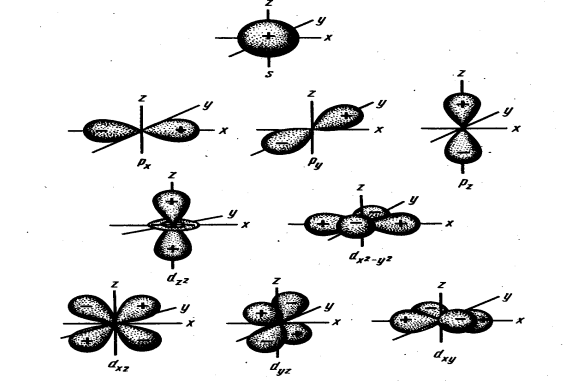 Форма
і просторова орієнтація деяких електронних
хмар наведена на рис.2.
Форма
і просторова орієнтація деяких електронних
хмар наведена на рис.2.
Рис.2. Форми і просторові орієнтації електронних хмар 1s-,2р- і 3d-електронів.
Магнітне
квантове число ml
визначає
просторову орієнтацію електронних хмар
і набуває значень від (-
![]() )
до (+
)
до (+![]() ),
всього 2
),
всього 2![]() +1
значень. Число значень магнітного
квантового числа вказує на число
орбіталей даної форми:
+1
значень. Число значень магнітного
квантового числа вказує на число
орбіталей даної форми:
s-орбіталь — одна,
тому що при
![]() = 0 m = 0;
= 0 m = 0;
p-орбіталь — три,
тому що при
![]() = 1 m = -1, 0, +1;
= 1 m = -1, 0, +1;
d-орбіталь —
п'ять, тому що при
![]() = 2 m = -2, -1, 0, +1, +2;
= 2 m = -2, -1, 0, +1, +2;
f-орбіталь — сім,
тому що при
![]() = 3 m = -3, -2, -1, 0, +1, +2, +3.
= 3 m = -3, -2, -1, 0, +1, +2, +3.
Загальне число
орбіталей на даному енергетичному рівні
визначається його головним квантовим
числом n і дорівнює n2.
Так, на I енергетичному рівні n = 1, загальне
число орбіталей — одна (
![]() = 0, s-орбіталь); на II енергетичному рівні
n = 2, загальне число орбіталей — чотири
(
= 0, s-орбіталь); на II енергетичному рівні
n = 2, загальне число орбіталей — чотири
(![]() = 0, s-орбіталь і
= 0, s-орбіталь і![]() = 1, три р-орбіталі) і т.ін.
= 1, три р-орбіталі) і т.ін.
Атомна електронна орбіталь
— це стан електрона в атомі, що
харак-теризується певними значеннями
квантових чисел n,
![]() і m, тобто певними розмірами, формою та
орієнтацією в просторі електронної
хмари.
і m, тобто певними розмірами, формою та
орієнтацією в просторі електронної
хмари.
Спінове квантове число
ms
обумовлене обертанням електрона навколо
своєї осі. Спінове квантове число набуває
два значення: +![]() і -
і -![]() .
.
У багатоелектронних атомах орбіталі заповнюються електронами в міру зростання їхньої енергії, доки не розмістяться всі електрони. Електронні оболонки формуються з обов'язковим дотриманням таких правил:
1) принципу найменшої енергії;
2) принципу Паулі;
3) правил Гунда і Клечковського.
Принцип найменшої енергії: електрони насамперед займають орбіталі з найнижчими рівнями енергії.
Принцип Паулі:
в атомі не може бути двох електронів з
однаковими значеннями всіх чотирьох
квантових чисел. Тобто на одній орбіталі
знаходиться не більше двох електронів,
які мають протилежні (антипаралельні)
спіни (ms
= ±![]() ).
За цим принципом можна розрахувати
максимальне число електронів на різних
енергетичних рівнях і підрівнях.
).
За цим принципом можна розрахувати
максимальне число електронів на різних
енергетичних рівнях і підрівнях.
Оскільки
на даному рівні n може бути n підрівнів,
а для кожного підрівня існує 2![]() +1
орбіталей, можна підрахувати, що
максимальна електронна ємність підрівня
— 2(2
+1
орбіталей, можна підрахувати, що
максимальна електронна ємність підрівня
— 2(2![]() +1)
електронів. Максимальне число електронів
Nе
на енергетичному рівні — 2n2.
+1)
електронів. Максимальне число електронів
Nе
на енергетичному рівні — 2n2.
Правило Гунда: стійкому стану атома відповідає такий розподіл електронів у межах енергетичного підрівня, при якому абсолютне значення сумарного спіна атома є максимальним. Тобто під час заповнення підрівня електрони посідають різні орбіталі (доти, доки це можливо) та спіни поодиноких електронів, що знаходяться на різних орбіталях, паралельні.
Правило
Клечковського:
зі збільшенням заряду ядра атома
послідовне заповнення електронних
орбіталей відбувається від орбіталей
з меншим значенням суми головного й
орбітального квантових чисел (n +
![]() )
до орбіталей з більшим значенням цієї
суми. За однакових значень суми (n + l)
заповнення орбіталей відбувається
послідовно в напрямку зростання головного
квантового числа.
)
до орбіталей з більшим значенням цієї
суми. За однакових значень суми (n + l)
заповнення орбіталей відбувається
послідовно в напрямку зростання головного
квантового числа.
Якщо розрахувати суми (n
+![]() )
для n = 1…7 і записати значення сум у
по-рядку їх зростання, то можна одержати
послідовність заповнення енергетичних
рівней і підрівней:
)
для n = 1…7 і записати значення сум у
по-рядку їх зростання, то можна одержати
послідовність заповнення енергетичних
рівней і підрівней:
1s2s®2p3s3p4s3d4р5s4d5p6s4f5d6p7s®5f6d...
За приведеними правилами можна для будь-якого атома скласти елект-ронну формулу, тобто записати розподіл електронів по орбіталях на енер-гетичних рівнях і підрівнях. Так, наприклад, електронна формула атома Гідрогену 1Н має вигляд 1s1, атома Карбону (6С) — 1s22s22p2, атома калію (19К) — 1s22s22p63s23p63d04s1, атома титану (22Ті )— 1s22s22p63s23p63d24s2.
Як видно з формул, велика цифра вказує на номер енергетичного рівня, літери s, p, d, f — енергетичний підрівень, маленька цифра над літерою праворуч — число електронів на цьому підрівні.

 Для наочного зображення
розподілу електронів в атомі використовують
електронографічні формули. При цьому
атомну орбіталь зображують у вигляді
клітинки (енергетичної комірки)
,
електрон на орбіталі позначають стрілкою
в енергетичній комірці . Якщо ж на
одній орбіталі перебувають два
Для наочного зображення
розподілу електронів в атомі використовують
електронографічні формули. При цьому
атомну орбіталь зображують у вигляді
клітинки (енергетичної комірки)
,
електрон на орбіталі позначають стрілкою
в енергетичній комірці . Якщо ж на
одній орбіталі перебувають два
електрони, то вони зображуються так: . Рівні розташовують один над одним відповідно до зміни енергії. Наприклад:
H C 1 2 6 s s р 1
1






s
