
- •Міністерство освіти і науки України
- •Передмова
- •Робоча програма
- •Приклади виконання завдань
- •Контрольні завдання
- •Основні класи неорганічних сполук основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Термохімія та термохімічні розрахунки основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Ентропія, енергія гіббса та напрямленість процесів основні поняття та визначення
- •Приклади виконання завдань
- •Визначити можливість перебігу реакції
- •Визначити, за якої температури настане рівновага в системі
- •Контрольні завдання
- •Хімічна кінетика основні поняття та визначення
- •Приклади виконання завдань
- •Визначити швидкість реакції
- •Контрольні завдання
- •Хімічна рівновага основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •II модуль розчини. Концентрації розчинів основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Властивості розчинів неелектролітів. Основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Електролітична дисоціація ступінь та константа дисоціації основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Іонний добуток води. Водневий показник основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Іонна рівновага в гетерогенних системах добуток розчинності основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Реакції в розчинах електролітів основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Гідроліз солей основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Колоїдні розчини основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Будова атома основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •III модуль окисно-відновні реакції основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Гальванічні елементи основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Корозія металів основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Электроліз розплавів і водних розчинів електролітів основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Твердість води основні поняття та визначення
- •Приклади виконання завдань
- •Приклад 2. Визначення маси солі, розчиненої в певному об’ємі води, за величиною твердості води.
- •Контрольні завдання
- •Карбонатна рівновага. Форми існування со2 у воді. Основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Список рекомендованої літератури Основна література
- •Додаткова література
- •Додаток абудова речовини а1.Будова атома
- •А2.Періодична система елементів д. І.Менделєєва та електронна теорія будови атомів
- •Головна підгрупа Побічна група
- •Двох періодів.
- •Відносні електронегативності елементів(за шкалою Полінга)
- •А3. Хімічний зв’язок і будова молекул
- •2 Відштовхування rзв.Е, кДж/моль
- •Елементів д.І.Менделєєва
- •Навчальне видання
Хімічна рівновага основні поняття та визначення
|
Оборотні реакції |
- реакції, які одночасно відбуваються у двох взаємно протилежних напрямках.
|
|
Хімічна рівновага
|
- стан системи, при якому швидкості прямої і зворотної реакцій однакові. |
|
Константа хімічної рівноваги К |
-
відношення константи швидкості прямої
реакції kпр
до константи швидкості зворотної
реакції kзв,
або відношення добутку
рівноважних концентрацій продуктів
реакції до добутку рівноважних
концентрацій вихідних речовин у
степенях, що дорівнюють їхнім
стехіометричним коефіцієнтам:
|
|
Зміщення хімічної рівноваги
|
- перехід реакційної системи з одного стану рівноваги в інший. |
|
Принцип Ле Шательє |
- якщо умови, за яких система знаходиться в рівновазі змінити, рівновага зміщується в напрямку процесів, які протидіють цій зміні. |
Приклади виконання завдань
Приклад 1. Розрахунок константи рівноваги реакції за рівноважними концентраціями реагуючих речовин і визначення їхніх вихідних концентрацій.
Розрахувати константу
рівноваги реакції
![]() ,
та вихідні концентрації SO2іO2, якщо на момент рівноваги
встановилися концентрації: [SO2] =
1,8 моль/л, [О2] = 0,9 моль/л, [SO3]
= 4,2 моль/л.
,
та вихідні концентрації SO2іO2, якщо на момент рівноваги
встановилися концентрації: [SO2] =
1,8 моль/л, [О2] = 0,9 моль/л, [SO3]
= 4,2 моль/л.
Розв’язання. Константа рівноваги К визначається відношенням добутку рівноважних концентрацій продуктів реакції до добутку рівноважних концентрацій вихідних речовин, взятих у степенях, рівних стехіометричним коефіцієнтам. Для даної реакції К розраховується за формулою:
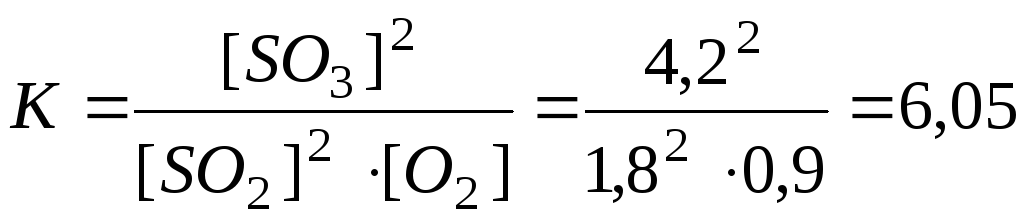
Вихідні концентрації сульфур(IV) оксиду і кисню знаходимо на підставі рівняння реакції та за формулою Свих=Среаг+Срівн.
Як видно з рівняння реакції з 2 моль SO2утворюється 2 моль SO3. Отже на утворення 4,2 моль SO3витрачається 4,2 моль SO2.
Тоді
![]() (моль/л).
(моль/л).
Розраховуємо
![]() .
Як видно з рівняння реакції 1 моль О2дає 2 моль SO3, тоді 4.2 моль SO3потребують 2,1 моль О2і
.
Як видно з рівняння реакції 1 моль О2дає 2 моль SO3, тоді 4.2 моль SO3потребують 2,1 моль О2і![]() =2,1+0,9=3,0
(моль/л).
=2,1+0,9=3,0
(моль/л).
Приклад 2. Визначення рівноважної концентрації за величиною константи рівноваги та обчислення вихідних концентрацій реагуючих речовин.
При деякій
температурі константа рівноваги реакції
![]() дорівнює0,415.Визначити рівноважну і вихідну
концентрації хлору та вихідну концентрацію
нітроген(II) оксиду,
якщо на момент рівноваги встановилися
концентрації: [NO] = 0,4моль/л,
[NOCl]=0,1моль/л.
дорівнює0,415.Визначити рівноважну і вихідну
концентрації хлору та вихідну концентрацію
нітроген(II) оксиду,
якщо на момент рівноваги встановилися
концентрації: [NO] = 0,4моль/л,
[NOCl]=0,1моль/л.
Розв’язання.
Оскільки константа рівноваги даної
реакції обчислюється через рівноважні
концентрації за формулою![]() , то рівноважна концентрація хлору
розраховується за формулою:
, то рівноважна концентрація хлору
розраховується за формулою:![]() ;
;
![]() (моль/л).
(моль/л).
Вихідні концентрації NO і Cl2пов’язані з рівноважними концентраціями співвідношенням: Свих = Среаг + Срівн.
Кількість NO і Cl2, що прореагували, знаходимо на підставі рівняння реакції. Як видно з рівняння для утворення 2 моль NOCl витрачається 2 моль NO, тоді для утворення 0,1 моль NOCl має прореагувати 0,1 моль NO. Таким чином
Свих NO = 0,1 +0,4 = 0,5 (моль/л).
Аналогічні
міркування і стосовно хлору. На утворення
2 моль NOCl витрачається 1 моль Cl2,
а на утворення 0,1 моль NOCl необхідно 0,05
моль Cl2.
Отже
![]() (моль/л).
(моль/л).
Приклад 3. Визначення напрямку зміщення хімічної рівноваги за принципом Ле Шательє.
Як треба змінити а) температуру, б) тиск, в) концентрації реагуючих речовин для зміщення рівноваги в системі
![]() кДж
кДж
в сторону утворення метанолу.
Відповідь. Напрямок зміщення рівноваги визначається за принципом Ле Шательє: якщо на систему, що перебуває у стані рівноваги, чиниться будь-який зовнішній вплив, то він сприяє перебігу тієї з двох протилежних реакцій, яка протидіє цьому впливу.
а) Оскільки реакція утворення СН3ОН (ΔН >0) ендотермічна, тобто супроводжується поглинанням теплоти, то для зміщення стану рівноваги в бік прямої реакції треба підвищити температуру.
б) Оскільки пряма реакція супроводжується зменшенням числа молей газоподібних речовин, тобто зменшенням тиску в системі, то для зміщення рівноваги в бік прямої реакції треба підвищити тиск.
в) Для зміщення рівноваги в бік утворення метанолу необхідно збільшити концентрації вихідних речовин СО2 і Н2 та зменшити концентрацію продукта реакції СН3ОН.
