
- •Міністерство освіти і науки України
- •Передмова
- •Робоча програма
- •Приклади виконання завдань
- •Контрольні завдання
- •Основні класи неорганічних сполук основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Термохімія та термохімічні розрахунки основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Ентропія, енергія гіббса та напрямленість процесів основні поняття та визначення
- •Приклади виконання завдань
- •Визначити можливість перебігу реакції
- •Визначити, за якої температури настане рівновага в системі
- •Контрольні завдання
- •Хімічна кінетика основні поняття та визначення
- •Приклади виконання завдань
- •Визначити швидкість реакції
- •Контрольні завдання
- •Хімічна рівновага основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •II модуль розчини. Концентрації розчинів основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Властивості розчинів неелектролітів. Основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Електролітична дисоціація ступінь та константа дисоціації основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Іонний добуток води. Водневий показник основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Іонна рівновага в гетерогенних системах добуток розчинності основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Реакції в розчинах електролітів основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Гідроліз солей основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Колоїдні розчини основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Будова атома основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •III модуль окисно-відновні реакції основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Гальванічні елементи основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Корозія металів основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Электроліз розплавів і водних розчинів електролітів основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Твердість води основні поняття та визначення
- •Приклади виконання завдань
- •Приклад 2. Визначення маси солі, розчиненої в певному об’ємі води, за величиною твердості води.
- •Контрольні завдання
- •Карбонатна рівновага. Форми існування со2 у воді. Основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Список рекомендованої літератури Основна література
- •Додаткова література
- •Додаток абудова речовини а1.Будова атома
- •А2.Періодична система елементів д. І.Менделєєва та електронна теорія будови атомів
- •Головна підгрупа Побічна група
- •Двох періодів.
- •Відносні електронегативності елементів(за шкалою Полінга)
- •А3. Хімічний зв’язок і будова молекул
- •2 Відштовхування rзв.Е, кДж/моль
- •Елементів д.І.Менделєєва
- •Навчальне видання
Твердість води основні поняття та визначення
|
Твердість
води
|
-
властивість води, зумовлена наявністю
іонів
|
|
Твердість води тимчасова
|
-
зумовлена наявністю гідрогенкарбонатів
кальцію і магнію
|
|
Твердість води некарбонатна (постійна) |
-
зумовлена наявністю сульфатів і
хлоридів кальцію і магнію ( |
Приклади виконання завдань
Приклад 1. Визначення твердості води за відомою масою розчинених солей твердості.
Визначити твердість води, якщо в 300 л її міститься 620 г Ca(HCO3)2.
Розв’язання. Оскільки твердість води показує число ммолей еквівалентів солей в 1 л її, розрахуємо твердість води за формулою:
![]() або
або
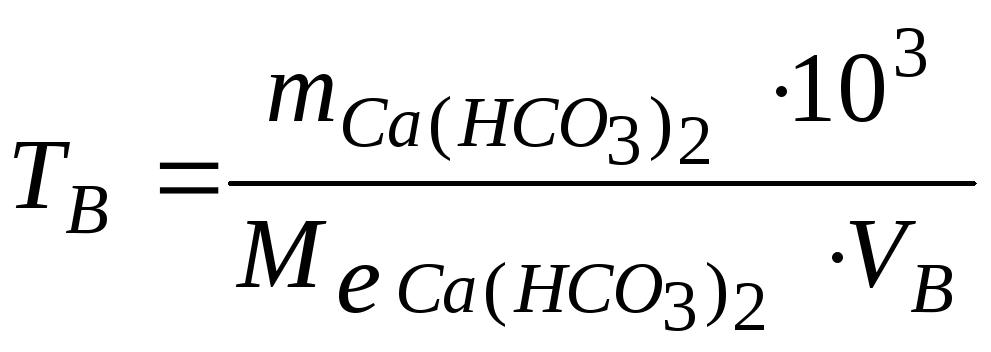
де
![]() -
число ммоль еквівалентів солей твердості;
-
число ммоль еквівалентів солей твердості;
![]() -
маса Ca(HCO3)2,
г;
-
маса Ca(HCO3)2,
г;
![]() - об’єм води, л;
- об’єм води, л;
103 – коефіцієнт перерахування моль е у ммоль е.
Для розрахунку молярної маси еквівалента Ca(HCO3)2 використовуємо формулу:
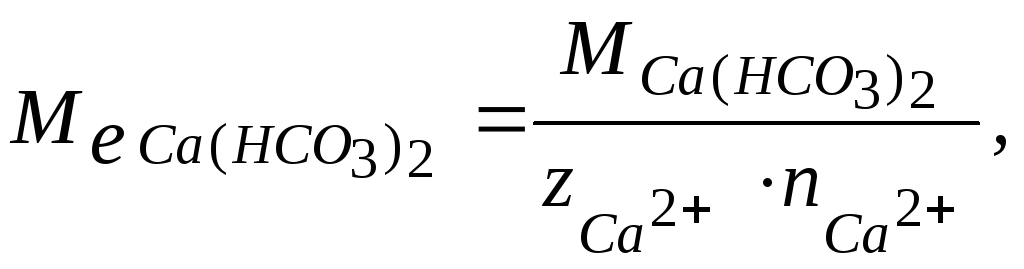
де
![]() -
молярна маса Ca(HCO3)2,
г/моль;
-
молярна маса Ca(HCO3)2,
г/моль;
![]() - заряд іона кальцію;
- заряд іона кальцію;
![]() -
кількість іонів
-
кількість іонів
![]() в
молекулі солі.
в
молекулі солі.
![]() (г/моль е)
(г/моль е)
Тоді твердість води дорівнює:
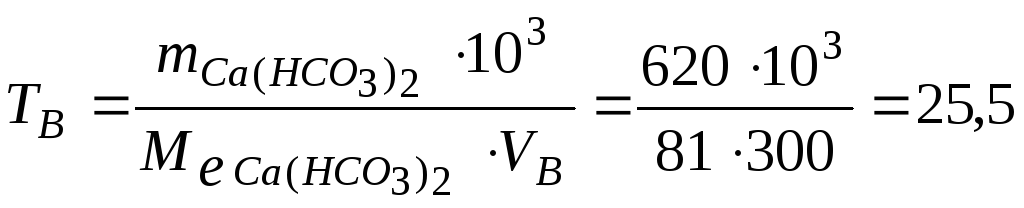 (ммоль е/л)
(ммоль е/л)
Відповідь: твердість води складає 25,5 ммоль е /л.
Приклад 2. Визначення маси солі, розчиненої в певному об’ємі води, за величиною твердості води.
Розрахувати масу кальцій сульфату, розчиненого в 10 м3 води, твердість якої становить 9 ммоль е/л.
Розв’язання. Твердість води показує скільки ммоль еквівалентів солей твердості знаходиться в 1 л води:
![]() або
або
![]() ,
,
де
![]() -
число ммоль еквівалентів солей твердості,
ммоль е;
-
число ммоль еквівалентів солей твердості,
ммоль е;
Vв – об’єм води, л;
![]() -
маса солі, г;
-
маса солі, г;
103 – коефіцієнт перерахування моль е у ммоль е.
Звідси знаходимо масу розчиненого CaSO4 за формулою
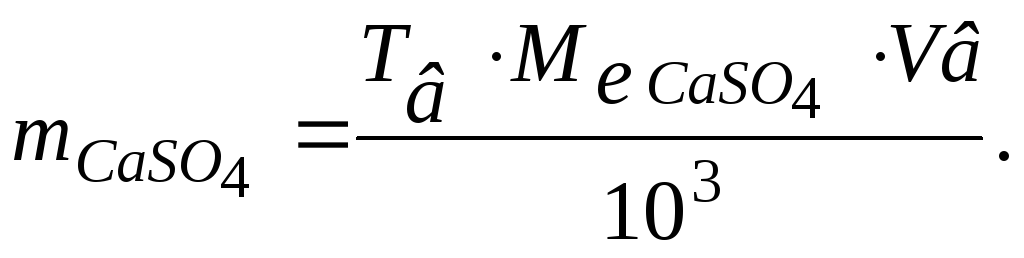
Молярна маса еквівалента солі розраховується за формулою:
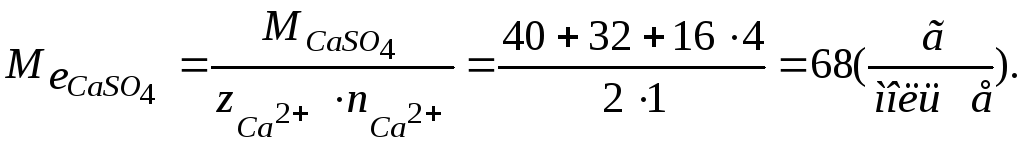
Знаходимо масу розчиненої солі:
![]()
Відповідь: маса розчиненої солі дорівнює 6,12 кг.
Приклад 3. Визначення об’єму води за величинами її твердості і маси розчиненої солі.
Розрахувати об’єм води, в якому міститься 16,6 г MgCl2, якщо твердість, обумовлена цією сіллю, дорівнює 3,5 ммоль е/л.
Розв’язання. Твердість води показує скільки ммоль еквівалентів солей твердості знаходиться в 1 л води:
![]() або
або
![]() (див. приклади 1,2).
(див. приклади 1,2).
Звідси
![]() .
.
Молярна маса еквівалента MgCl2 розраховується за формулою:
 .
.
Знаходимо об’єм води:
![]() .
.
Відповідь: об’єм води дорівнює 99,85 л.
Приклад 4. Розрахунок маси реагенту, необхідного для пом’якшення води. Визначити масу гашеного вапна, необхідну для пом’якшення 1 м3 води з тимчасовою твердістю 2,9 ммоль е/л.
Розв’язання.
Згідно
з законом еквівалентів розчинені у
воді солі твердості взаємодіють з
Са(ОН)2
в еквівалентних кількостях, тобто
![]() .
.
Виходячи
з твердості води
![]() ,
,
![]() .
.
Таким
чином,
![]()
Оскільки
![]() ,
то
,
то![]() .
.
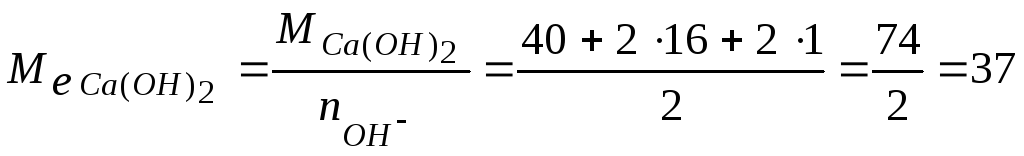 (г/моль е), тоді
(г/моль е), тоді
![]() (г).
(г).
Приклад 5. Розрахунок об’єму води, пом’якшеної певною масою реагента. Який об’єм води з загальною твердістю 3,8 ммоль е/л можна пом’якшити за допомогою 150 г Na3PO4?
Розв’язання.
Виходячи
з твердості води
![]() ,
,
знаходимо об’єм води за формулою:
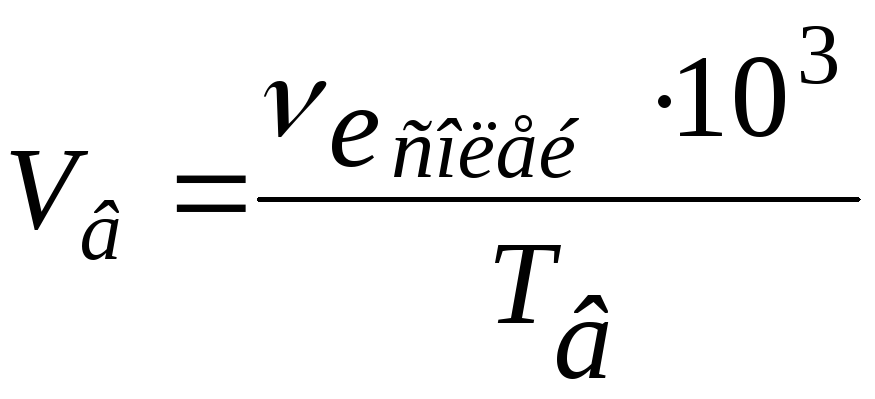
Згідно
з законом еквівалентів розчинені у воді
солі твердості взаємодіють з Na3PO4
в еквівалентних кількостях, тобто
![]() .
.
Розрахуємо кількість речовини Na3PO4, витраченої на пом’якшення води за формулою:
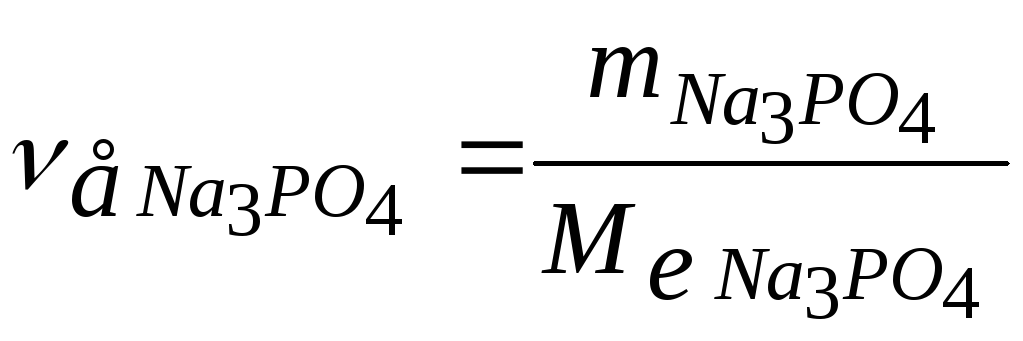 ,
,
де
![]() -
молярна маса еквівалента Na3PO4.
-
молярна маса еквівалента Na3PO4.
Знаходимо
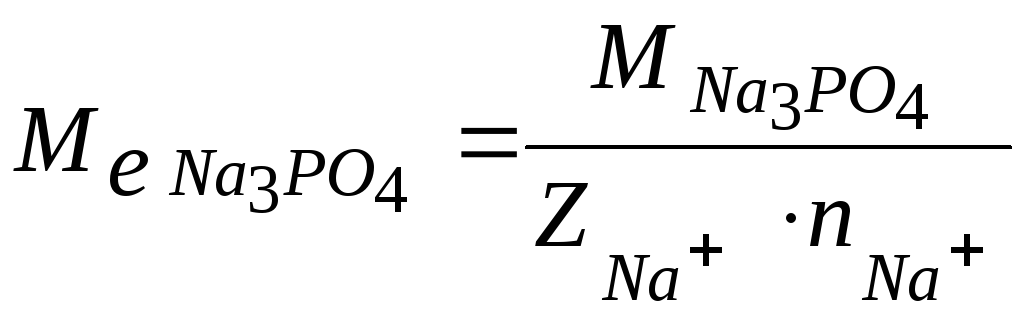 ,
,
![]()
і кількість речовини Na3PO4
![]() (моль е).
(моль е).
Виходячи із закону еквівалентів
![]() ,
,
тоді
![]() л.
л.
