
- •Міністерство освіти і науки України
- •Передмова
- •Робоча програма
- •Приклади виконання завдань
- •Контрольні завдання
- •Основні класи неорганічних сполук основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Термохімія та термохімічні розрахунки основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Ентропія, енергія гіббса та напрямленість процесів основні поняття та визначення
- •Приклади виконання завдань
- •Визначити можливість перебігу реакції
- •Визначити, за якої температури настане рівновага в системі
- •Контрольні завдання
- •Хімічна кінетика основні поняття та визначення
- •Приклади виконання завдань
- •Визначити швидкість реакції
- •Контрольні завдання
- •Хімічна рівновага основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •II модуль розчини. Концентрації розчинів основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Властивості розчинів неелектролітів. Основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Електролітична дисоціація ступінь та константа дисоціації основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Іонний добуток води. Водневий показник основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Іонна рівновага в гетерогенних системах добуток розчинності основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Реакції в розчинах електролітів основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Гідроліз солей основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Колоїдні розчини основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Будова атома основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •III модуль окисно-відновні реакції основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Гальванічні елементи основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Корозія металів основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Электроліз розплавів і водних розчинів електролітів основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Твердість води основні поняття та визначення
- •Приклади виконання завдань
- •Приклад 2. Визначення маси солі, розчиненої в певному об’ємі води, за величиною твердості води.
- •Контрольні завдання
- •Карбонатна рівновага. Форми існування со2 у воді. Основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Список рекомендованої літератури Основна література
- •Додаткова література
- •Додаток абудова речовини а1.Будова атома
- •А2.Періодична система елементів д. І.Менделєєва та електронна теорія будови атомів
- •Головна підгрупа Побічна група
- •Двох періодів.
- •Відносні електронегативності елементів(за шкалою Полінга)
- •А3. Хімічний зв’язок і будова молекул
- •2 Відштовхування rзв.Е, кДж/моль
- •Елементів д.І.Менделєєва
- •Навчальне видання
А2.Періодична система елементів д. І.Менделєєва та електронна теорія будови атомів
Найважливішою подією в хімії після розробки атомно-молекулярної теорії було відкриття періодичного закону.
Д.І.Менделєєв відкрив періодичний закон (1869 р.), створив періодичну систему елементів, але не з¢ясував причину періодичних змін подібності та відмінності властивостей елементів. Тільки теорія будови атома, створена в
ХХ ст., пояснила ці закономірності.
Сучасне визначення періодичного закону Д.І.Менделєєва: властивості хімічних елементів, а також утворених ними простих і складних речовин пере-бувають у періодичній залежності від величин зарядів ядер атомів елементів, тобто від порядкового номера елемента в періодичній системі.
Періодична система хімічних елементів — це табличний вираз періо-дичного закону. Відомо багато варіантів періодичної системи. Найчастіше ви-користовують скорочену форму таблиці.
Існує дві основні структурні одиниці періодичної системи: період і гру-па. Періодична система складається з семи періодів і восьми груп.
Період — це горизонтальна послідовність елементів, розташованих за зростанням заряду їхнього атомного ядра. Перший — третій періоди склада-ються з одного ряду і називаються малими. Четвертий — шостий періоди складаються з двох рядів і називаються великими. Сьомий період хоча і складається з одного ряду, але він теж великий. Починається період елементом, в атомі якого з¢являється s-електрон з новим значенням головного квантового числа. При цьому номер періоду збігається зі значенням n зовнішнього енергетичного рівня. Закінчується період інертним газом, атоми якого на зовнішньому рівні мають електронну конфігурацію ns2(He) або ns2np6(решта інертних газів). Таким чином, кожного разу через якусь кількість елементів, що визначається місткістю електронних оболонок, повторюється така сама електронна конфігурація. Періодичне повторення структури зовнішньої оболонки викликає періодичність у зміні хімічних властивостей атомів.
Група — це вертикальний стовпчик, що містить елементи, властивості яких подібні. Кожна група поділяється на дві підгрупи — головну й побічну.
Підгрупи, до складу яких входять елементи малих і великих періодів, називаються головними. Підгрупи, які містять лише елементи великих періодів, називаються побічними. Розподіл заснований на відмінності у заповненні електронами енергетичних рівнів. У кожній підгрупі поєднуються елементи, атоми яких мають подібну будову зовнішнього енергетичного рівня.
Наприклад, для ІV групи маємо:
Головна підгрупа Побічна група
C 1s22s22p2
Si 1s22s22p63s23p2 Ti ¼ 3s23p63d24s2
Ge ¼3s23p63d104s24p2 Cr ¼ 4s24p64d25s2
Sn ¼ 4s24p64d105s25p2 Hf ¼ 5s25p65d26s2
Атоми елементів головних підгруп містять на зовнішньому рівні валентні електрони, кількість яких дорівнює номеру групи. Побічні підгрупи містять елементи, атоми яких мають валентні електрони на s-підрівні останнього та d-підрівні передостаннього рівнів.
Таким чином, елементи однієї групи мають однакову кількість валент-них електронів, але їхній енергетичний стан різний (ns2np2 та (n-1)d2ns2).
Залежно від підрівня, на який надходить останній електрон розрізняють
s-, p-, d-, f-елементи.
В атомах s-елементів заповнюються s-орбіталі зовнішнього енергетичного рівня. Ці елементи знаходяться в головних підгрупах I, П груп. У вільному стані вони є металами (крім Гідрогену та Гелію).
В атомах p-елемегнтів заповнюються p-орбіталі зовнішнього рівня. Ці елементи знаходяться в головних підгрупах Ш-VШ груп. Їхні властивості залежно від кількості валентних електронів змінюються від металів до неметалів і інертних газів.
В атомах d-елементів заповнюються електронами d-орбіталі перед-останнього рівня. Усі вони належать до побічних підгруп і у вільному стані є металами. Ці елементи називають перехідними.
В атомах f-елементів заповнюються орбіталі 4f- або 5f-підрівнів.Усі вони у вільному стані є металами. Їх, як і d-елементи, називають перехідними.
У періоді зі збільшенням порядкового номера (тобто збільшенням заряду ядра) зменшується радіус атома і зростає кількість зовнішніх електронів. При цьому притягання зовнішніх електронів до ядра посилюється. Тому в періоді в кожного нового елемента поступово посилюються неметалічні властивості та послаблюються металічні.
У групі зі збільшенням порядкового номера зростають радіус атома і число енергетичних рівнів. При цьому притягання зовнішніх електронів до ядра послаблюється. Тому в групах зі збільшенням порядкового номера елементів їхні металічні властивості посилюються, а неметалічні послаблюються.
Звідси випливає, що найактивніші метали знаходяться в періодичній системі зліва внизу, а найактивніші неметали — справа зверху.
По діагоналі між типовими металами та неметалами знаходяться ам-фотерні елементи. Характер їхньої поведінки залежить від реагенту та умов перебігу процесу.
Для кількісної характеристики металічних і неметалічних властивостей використовують величини потенціалів іонізації, спорідненості до електрона та електронегативності.
Енергія іонізації (ЕІ) — це кількість енергії, необхідна для відриву від атома найбільш слабко зв¢заного з ним електрона. Енергію іонізації вимірюють в електрон-вольтах на атом (ев/атом), або в кілоджоулях на моль (кДж/моль). Багатоелектронні атоми мають декілька енергій іонізації ЕІ1, ЕІ2, ЕІ3¼, які відповідають відриву першого, другого і т.ін. електронів, при цьому ЕІ1<ЕІ2< ЕІ3¼, тому що, зі збільшенням кількості відданих електронів збільшується за-ряд утвореного позитивно зарядженого іона, який сильніше притягує електрон. Найменше значення енергії іонізації мають лужні метали. Енергія іонізації атомів виявляє періодичну залежність від порядкового номера елемента (рис. 3).
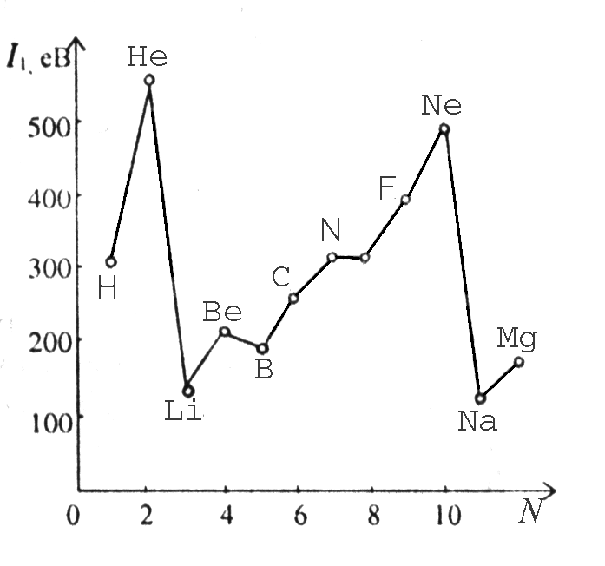
Рис. 3. Зміна перших потенціалів іонізації в ряду атомів елементів перших
