
- •Міністерство освіти і науки України
- •Передмова
- •Робоча програма
- •Приклади виконання завдань
- •Контрольні завдання
- •Основні класи неорганічних сполук основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Термохімія та термохімічні розрахунки основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Ентропія, енергія гіббса та напрямленість процесів основні поняття та визначення
- •Приклади виконання завдань
- •Визначити можливість перебігу реакції
- •Визначити, за якої температури настане рівновага в системі
- •Контрольні завдання
- •Хімічна кінетика основні поняття та визначення
- •Приклади виконання завдань
- •Визначити швидкість реакції
- •Контрольні завдання
- •Хімічна рівновага основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •II модуль розчини. Концентрації розчинів основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Властивості розчинів неелектролітів. Основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Електролітична дисоціація ступінь та константа дисоціації основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Іонний добуток води. Водневий показник основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Іонна рівновага в гетерогенних системах добуток розчинності основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Реакції в розчинах електролітів основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Гідроліз солей основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Колоїдні розчини основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Будова атома основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •III модуль окисно-відновні реакції основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Гальванічні елементи основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Корозія металів основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Электроліз розплавів і водних розчинів електролітів основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Твердість води основні поняття та визначення
- •Приклади виконання завдань
- •Приклад 2. Визначення маси солі, розчиненої в певному об’ємі води, за величиною твердості води.
- •Контрольні завдання
- •Карбонатна рівновага. Форми існування со2 у воді. Основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Список рекомендованої літератури Основна література
- •Додаткова література
- •Додаток абудова речовини а1.Будова атома
- •А2.Періодична система елементів д. І.Менделєєва та електронна теорія будови атомів
- •Головна підгрупа Побічна група
- •Двох періодів.
- •Відносні електронегативності елементів(за шкалою Полінга)
- •А3. Хімічний зв’язок і будова молекул
- •2 Відштовхування rзв.Е, кДж/моль
- •Елементів д.І.Менделєєва
- •Навчальне видання
Колоїдні розчини основні поняття та визначення
|
Дисперсна система |
- система, в якій одна речовина у вигляді дуже дрібних частинок рівномірно розподілена в об’ємі іншої. |
|
Дисперсна фаза |
- сукупність частинок рівномірно розподілених в об’ємі системи.
|
|
Дисперсійне середовище |
- середовище, в якому рівномірно розподілені частинки дисперсної фази.
|
|
Колоїдні розчини (золі) |
- ультрамікрогетерогенні дисперсні системи з розмірами частинок дисперсної фази 10-7-10-9 м.
|
|
Міцела |
- окрема частинка колоїдної системи.
|
|
Коагуляція |
- процес укрупнення колоїдних частинок внаслідок їхнього злипання під дією сил притягання, що приводить до руйнування колоїдної системи. Коагуляцію можна викликати різними факторами, особливо дією електролітів. Коагулюючими є іони, заряджені протилежно гранулі золю, дія яких зростає зі зростанням їхніх зарядів. |
Приклади виконання завдань
Приклад 1. Будова колоїдних частинок. Визначення коагулюючої здатності електроліту.
Написати формулу міцели золю аргентум іодиду, одержаного взаємодією калій іодиду з надлишком аргентум нітрату. Які іони спричинятимуть коагуляцію золю при додаванні до нього електролітів NaNO3, Na2SO4, Na3PO4?
Який з наведених електролітів має найбільшу коагулюючу здатність?
Відповідь. Напишемо рівняння реакції одержання золю аргентум йодиду
![]()
Формула міцели і заряд колоїдної частинки залежатиме від того, який з розчинів електролітів взято з надлишком ( AgNO3чи KJ). Якщо в надлишку взято аргентум нітрат, то будову міцели золю аргентум іодиду можна зобразити такою схемою:
![]()
![]()
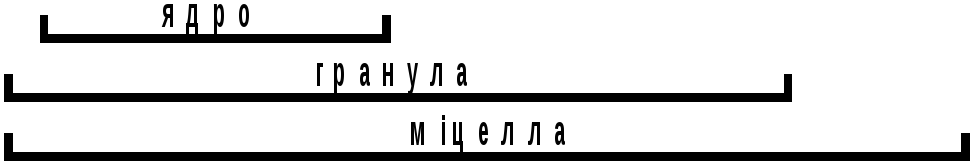
Будова міцели
золю
![]() (у надлишку
(у надлишку
![]() )
)
Одержані
в результаті реакції молекули нерозчинної
речовини AgІ злипаються, утворюючи
мікрокристалик – агрегат. Оскільки
розмір молекул дуже малий, для утворення
агрегату повинна об’єднатися
велика кількість молекул AgІ. Позначимо
його через [m
AgІ].
На поверхні агрегату переважно
адсорбуються йони, які знаходяться в
надлишку і які входять до складу агрегату.
У даному випадку це можуть бути іони
Ag+
або І-,
але не К+
або
![]() .
.
Якщо
в надлишку AgNO3,
на поверхні агрегату будуть адсорбуватися
n іонів Ag+,
які називаються потенціалвизначальними
іонами. Агрегат разом з адсорбованими
йонами Ag+
називають ядром. Ці іони електростатичними
силами утримують (n-x) протиіонів
![]() ,
утворюючи адсорбційний шар. Агрегат
разом з адсорбційним шаром утворює
гранулу. Вона має позитивний заряд, бо
n > (n - x). Заряд гранули дорівнює
алгебраїчній сумі зарядів усіх іонів,
що входять до складу адсорбційного
шару. В дисперсійному середовищі навколо
гранули розміщується дифузійний шар,
який складається з х протиіонів
,
утворюючи адсорбційний шар. Агрегат
разом з адсорбційним шаром утворює
гранулу. Вона має позитивний заряд, бо
n > (n - x). Заряд гранули дорівнює
алгебраїчній сумі зарядів усіх іонів,
що входять до складу адсорбційного
шару. В дисперсійному середовищі навколо
гранули розміщується дифузійний шар,
який складається з х протиіонів![]() .
Гранулу разом з навколишнім дифузійним
шаром називають міцелою. Міцела вцілому
електронейтральна, хоч містить заряджені
частинки.
.
Гранулу разом з навколишнім дифузійним
шаром називають міцелою. Міцела вцілому
електронейтральна, хоч містить заряджені
частинки.
Якщо в розглянутій реакції в надлишку взяти KІ, міцела буде мати іншу будову:
![]()
![]()
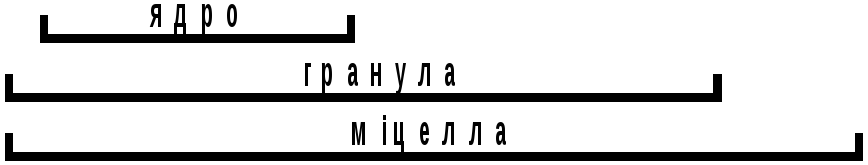
Будова
міцели золю
![]() (у
надлишку
(у
надлишку
![]() )
)
Необхідно звернути увагу на те, що при утворенні багатьох золів до адсорбційного шару входять багатозарядні іони. При складанні формул міцел таких золів треба враховувати багатозарядність іонів.
Наприклад, формула міцели золю барій сульфату, одержаного взаємодією натрій сульфату з надлишком барій хлориду матиме такий вигляд:
![]() .
.
Результатом порушення стійкості колоїдних розчинів є їхня коагуляція. Коагуляція – це процес збільшення колоїдних частинок внаслідок їхнього злипання під дією сил притягання. Коагуляцію можна викликати різними факторами, особливо дією електролітів. Коагулюючими є іони, заряджені протилежно гранулі золю, дія яких зростає зі зростанням їхніх зарядів.
Оскільки
у наведеному прикладі заряд гранули
золю аргентум іодиду позитивний, то
його коагуляцію викликатимуть негативно
заряджені іони
![]() і
і![]() ,
найбільшу коагулюючу здатність матиме
Na3PO4.
,
найбільшу коагулюючу здатність матиме
Na3PO4.
