
- •Міністерство освіти і науки України
- •Передмова
- •Робоча програма
- •Приклади виконання завдань
- •Контрольні завдання
- •Основні класи неорганічних сполук основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Термохімія та термохімічні розрахунки основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Ентропія, енергія гіббса та напрямленість процесів основні поняття та визначення
- •Приклади виконання завдань
- •Визначити можливість перебігу реакції
- •Визначити, за якої температури настане рівновага в системі
- •Контрольні завдання
- •Хімічна кінетика основні поняття та визначення
- •Приклади виконання завдань
- •Визначити швидкість реакції
- •Контрольні завдання
- •Хімічна рівновага основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •II модуль розчини. Концентрації розчинів основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Властивості розчинів неелектролітів. Основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Електролітична дисоціація ступінь та константа дисоціації основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Іонний добуток води. Водневий показник основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Іонна рівновага в гетерогенних системах добуток розчинності основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Реакції в розчинах електролітів основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Гідроліз солей основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Колоїдні розчини основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Будова атома основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •III модуль окисно-відновні реакції основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Гальванічні елементи основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Корозія металів основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Электроліз розплавів і водних розчинів електролітів основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Твердість води основні поняття та визначення
- •Приклади виконання завдань
- •Приклад 2. Визначення маси солі, розчиненої в певному об’ємі води, за величиною твердості води.
- •Контрольні завдання
- •Карбонатна рівновага. Форми існування со2 у воді. Основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Список рекомендованої літератури Основна література
- •Додаткова література
- •Додаток абудова речовини а1.Будова атома
- •А2.Періодична система елементів д. І.Менделєєва та електронна теорія будови атомів
- •Головна підгрупа Побічна група
- •Двох періодів.
- •Відносні електронегативності елементів(за шкалою Полінга)
- •А3. Хімічний зв’язок і будова молекул
- •2 Відштовхування rзв.Е, кДж/моль
- •Елементів д.І.Менделєєва
- •Навчальне видання
Гальванічні елементи основні поняття та визначення
|
Електрохімічні процеси
|
- процеси, при яких відбуваються перетворення хімічної енергії в електричну і навпаки. |
|
Рівняння Нернста для електродного потенціалу металу
|
-
де
Т - температура, К; n – число електронів, які приймають участь у процесі; F – число Фарадея, Кл/моль е;
|
|
Рівняння Нернста для розбавлених розчинів при Т=298К |
-
|
|
Стандартний потенціал металічного електрода
|
- електродний потенціал металу, зануреного в розчин власних іонів з активністю (концентрацією) 1 моль/л, виміряний за стандартних умов відносно стандартного водневого електрода. |
|
Гальванічний елемент
|
- прилад, в якому енергія хімічної окисно-відновної реакції перетворюється на електричну. |
|
Анод
|
- електрод, на якому відбувається процес окиснення. |
|
Катод
|
- електрод, на якому відбувається процес відновлення. |
|
Електрорушійна сила гальванічного елемента ЕРС |
-
ЕРС =
де
|
Приклади виконання завдань
Приклад 1. Розрахунок ЕРС гальванічного елемента.
Скласти схему, написати рівняння електродних процесів та розрахувати ЕРС гальванічного елемента, який складається з пластин заліза та цинку, що занурені в розчини своїх солей з концентраціями [Fe+] = 0,001 моль/л та [Zn2+]=0,01 моль/л
Розв’язання. Величина електродного потенціалу металу визначається за рівнянням Ернста, яке при Т=298 К має вигляд:
![]() ,
де
,
де
![]() -
стандартний електродний потенціал
металу (додаток, таблиця 10), В;
-
стандартний електродний потенціал
металу (додаток, таблиця 10), В;
![]() -
концентрація іонів металу в розчині
його солі, моль/л;
-
концентрація іонів металу в розчині
його солі, моль/л;
n – кількість електронів.
![]() =
-0,44В , то
=
-0,44В , то
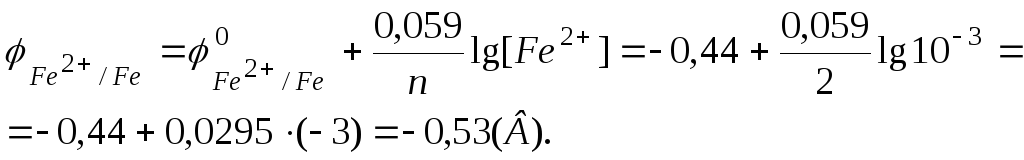
![]() В,
В,
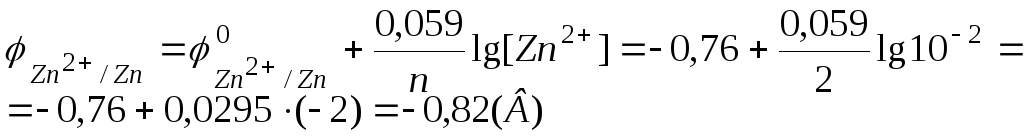
Оскільки
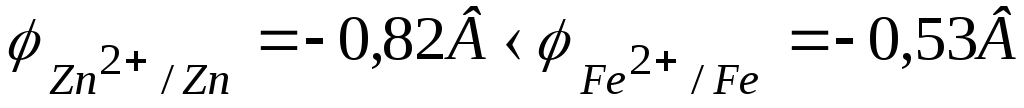 ,
то цинковий електрод буде анодом, на
якому відбувається процес окиснення,
а залізний електрод буде катодом, на
якому відбувається процес відновлення:
,
то цинковий електрод буде анодом, на
якому відбувається процес окиснення,
а залізний електрод буде катодом, на
якому відбувається процес відновлення:
![]()
Сумарний процес виражається рівнянням:
![]()
Схема гальванічного елемента має вигляд:
![]()
ЕРС гальванічного елемента визначається за формулою:
ЕРС=![]() (В).
(В).
Контрольні завдання
521. Скласти схему, написати рівняння електродних процесів та розрахувати ЕРС гальванічного елемента, який складається з пластин нікелю та магнію, що занурені в розчини своїх солей з концентраціями [Ni2+] = 0,1 моль/л та [Mg2+] = 0,01 моль/л.
Відповідь: 2,143 В.
522. Скласти схему, написати рівняння електродних процесів та розрахувати ЕРС гальванічного елемента, який складається з пластин свинцю та міді, що занурені в розчини своїх солей з концентраціями [Pb2+] = 0,001 моль/л та [Сu2+] = 0,1 моль/л.
Відповідь: 0,522 В.
523. Скласти схему, написати рівняння електродних процесів та розрахувати ЕРС гальванічного елемента, який складається з пластин хрому та кобальту, що занурені в розчини своїх солей з концентраціями [Cr3+] = 0,01 моль/л та [Со2+] = 0,1 моль/л.
Відповідь: 0,477 В.
524. Скласти схему, написати рівняння електродних процесів та розрахувати ЕРС гальванічного елемента, який складається з пластин міді та срібла, що занурені в розчини своїх солей з концентраціями [Сu2+] = 0,01 моль/л та [Ag+] = 0,1 моль/л.
Відповідь: 0,462 В.
525. Скласти схему, написати рівняння електродних процесів та розрахувати ЕРС гальванічного елемента, який складається з пластин алюмінію та цинку, що занурені в розчини своїх солей з концентраціями [Al3+] = 0,001 моль/л та [Zn2+] = 0,01 моль/л.
Відповідь: 0,899 В.
526. Скласти схему, написати рівняння електродних процесів та розрахувати ЕРС гальванічного елемента, який складається з пластин заліза та кадмію, що занурені в розчини своїх солей з концентраціями [Fe2+] = 0,01 моль/л та [Сd2+] = 0,1 моль/л.
Відповідь: 0,067 В.
527. Скласти схему, написати рівняння електродних процесів та розрахувати ЕРС гальванічного елемента, який складається з пластин срібла та цинку, що занурені в розчини своїх солей з концентраціями [Ag+] = 0,1 моль/л та [Zn2+] = 0,0001 моль/л.
Відповідь: 1,621 В.
528. Скласти схему, написати рівняння електродних процесів та розрахувати ЕРС гальванічного елемента, який складається з пластин титану та міді, що занурені в розчини своїх солей з концентраціями [Ti2+] = 0,01 моль/л та [Cu2+] = 0,1 моль/л.
Відповідь: 1,995 В.
529. Скласти схему, написати рівняння електродних процесів та розрахувати ЕРС гальванічного елемента, який складається з пластин хрому та кадмію, що занурені в розчини своїх солей з концентраціями [Cr2+] = 0,1 моль/л та [Cd2+] = 0,001 моль/л.
Відповідь: 0,451 В.
530. Скласти схему, написати рівняння електродних процесів та розрахувати ЕРС гальванічного елемента, який складається з пластин алюмінію та заліза, що занурені в розчини своїх солей з концентраціями [Al3+] = 0,001 моль/л та [Fe2+] = 0,1 моль/л.
Відповідь: 1,252 В.
531. Скласти схему, написати рівняння електродних процесів та розрахувати ЕРС гальванічного елемента, який складається з пластин нікелю та міді, що занурені в розчини своїх солей з концентраціями [Ni2+] = 0,001 моль/л та [Cu2+] = 0,1 моль/л.
Відповідь: 0,646 В.
532. Скласти схему, написати рівняння електродних процесів та розрахувати ЕРС гальванічного елемента, який складається з пластин олова та цинку, що занурені в розчини своїх солей з концентраціями [Sn2+] = 0,01 моль/л та [Zn2+] = 0,01 моль/л.
Відповідь: 0,627 В.
533. Скласти схему, написати рівняння електродних процесів та розрахувати ЕРС гальванічного елемента, який складається з пластин заліза та кобальту, що занурені в розчини своїх солей з концентраціями [Fe3+] = 0,001 моль/л та [Co2+] = 0,01 моль/л.
Відповідь: 0,241 В.
534. Скласти схему, написати рівняння електродних процесів та розрахувати ЕРС гальванічного елемента, який складається з пластин нікелю та ванадію, що занурені в розчини своїх солей з концентраціями [Ni2+] = 0,0001 моль/л та [V2+] = 0,1 моль/л.
Відповідь: 0,848 В.
535. Скласти схему, написати рівняння електродних процесів та розрахувати ЕРС гальванічного елемента, який складається з пластин цинку та міді, що занурені в розчини своїх солей з концентраціями [Zn2+] = 0,1 моль/л та [Cu2+] = 0,01 моль/л.
Відповідь: 1,071 В.
536. Скласти схему, написати рівняння електродних процесів та розрахувати ЕРС гальванічного елемента, який складається з пластин срібла та магнію, що занурені в розчини своїх солей з концентраціями [Ag+] = 0,1 моль/л та [Mg2+] = 0,001 моль/л.
Відповідь: 3,192 В.
537. Скласти схему, написати рівняння електродних процесів та розрахувати ЕРС гальванічного елемента, який складається з пластин хрому та нікелю, що занурені в розчини своїх солей з концентраціями [Сr2+] = 0,1 моль/л та [Ni2+] = 0,1 моль/л.
Відповідь: 0,663 В.
538. Скласти схему, написати рівняння електродних процесів та розрахувати ЕРС гальванічного елемента, який складається з пластин титану та цинку, що занурені в розчини своїх солей з концентраціями [Ti2+] = 0,01 моль/л та [Zn2+] = 0,1 моль/л.
Відповідь: 0,895 В.
539. Скласти схему, написати рівняння електродних процесів та розрахувати ЕРС гальванічного елемента, який складається з пластин алюмінію та кадмію, що занурені в розчини своїх солей з концентраціями [Al3+] = 0,001 моль/л та [Сd2+] = 0,1 моль/л.
Відповідь: 1,289 В.
540. Скласти схему, написати рівняння електродних процесів та розрахувати ЕРС гальванічного елемента, який складається з пластин свинцю та хрому, що занурені в розчини своїх солей з концентраціями [Pb+2] = 0,001 моль/л та [Сr3+] = 0,1 моль/л.
Відповідь: 0,549 В.
