
- •Міністерство освіти і науки України
- •Передмова
- •Робоча програма
- •Приклади виконання завдань
- •Контрольні завдання
- •Основні класи неорганічних сполук основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Термохімія та термохімічні розрахунки основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Ентропія, енергія гіббса та напрямленість процесів основні поняття та визначення
- •Приклади виконання завдань
- •Визначити можливість перебігу реакції
- •Визначити, за якої температури настане рівновага в системі
- •Контрольні завдання
- •Хімічна кінетика основні поняття та визначення
- •Приклади виконання завдань
- •Визначити швидкість реакції
- •Контрольні завдання
- •Хімічна рівновага основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •II модуль розчини. Концентрації розчинів основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Властивості розчинів неелектролітів. Основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Електролітична дисоціація ступінь та константа дисоціації основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Іонний добуток води. Водневий показник основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Іонна рівновага в гетерогенних системах добуток розчинності основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Реакції в розчинах електролітів основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Гідроліз солей основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Колоїдні розчини основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Будова атома основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •III модуль окисно-відновні реакції основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Гальванічні елементи основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Корозія металів основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Электроліз розплавів і водних розчинів електролітів основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Твердість води основні поняття та визначення
- •Приклади виконання завдань
- •Приклад 2. Визначення маси солі, розчиненої в певному об’ємі води, за величиною твердості води.
- •Контрольні завдання
- •Карбонатна рівновага. Форми існування со2 у воді. Основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Список рекомендованої літератури Основна література
- •Додаткова література
- •Додаток абудова речовини а1.Будова атома
- •А2.Періодична система елементів д. І.Менделєєва та електронна теорія будови атомів
- •Головна підгрупа Побічна група
- •Двох періодів.
- •Відносні електронегативності елементів(за шкалою Полінга)
- •А3. Хімічний зв’язок і будова молекул
- •2 Відштовхування rзв.Е, кДж/моль
- •Елементів д.І.Менделєєва
- •Навчальне видання
III модуль окисно-відновні реакції основні поняття та визначення
|
Окисно-відновні реакції
|
- реакції, які відбуваються зі зміною ступенів окиснення елементів, що входять до складу реагуючих речовин. |
|
Ступінь окиснення
|
- умовний заряд атома в молекулі, який розрахований, виходячи з припущення, що молекула складається з іонів. |
|
Окиснення
|
-
процес віддачі електронів атомом,
молекулою або іоном:
|
|
Відновлення
|
-
процес приєднання електронів атомом,
молекулою або іоном:
|
|
Окисники
|
-
атоми, молекули або іони, що приєднують
електрони. До них належать сполуки,
які містять атоми в найвищому ступені
окиснення, наприклад:
|
|
Відновники
|
-
атоми, молекули або іони, що віддають
електрони. До них належать сполуки,
які містять атоми в найнижчому ступені
окиснення, наприклад:
|
Приклади виконання завдань
Приклад 1. Визначення окисно-відновних властивостей сполук на підставі ступенів окиснення елементів.
Виходячи
зі ступенів окиснення Нітрогену і
Мангану в сполуках:
![]() ,
визначити, які з них можуть бути тільки
окисниками, тільки відновниками, а які
виявляють як окисні, так і відновні
властивості.
,
визначити, які з них можуть бути тільки
окисниками, тільки відновниками, а які
виявляють як окисні, так і відновні
властивості.
Відповідь. В окисно-відновних реакціях відновник віддає електрони (окиснюється ), а окисник приєднує електрони (відновлюється).
Атом в найвищому ступені окиснення не може віддавати електрони і тому виявляє тільки окисні властивості, а в найнижчому ступені окиснення не може приймати електрони і тому виявляє тільки відновні властивості.
Ступені окиснення Нітрогену у вищенаведених сполуках дорівнюють:
–3
(найнижчий) у сполуці
![]() ;
;
+3
(проміжний) у сполуці
![]() ;
;
+5
(найвищий) у сполуці
![]() .
.
Ступені окиснення Мангану дорівнюють:
+4
(проміжний) у сполуці
![]() ;
;
+7
(найвищий) у сполуці
![]() .
.
Тому
![]() може бути тільки відновником;
може бути тільки відновником;![]() і
і![]() -
тільки окисниками;
-
тільки окисниками;![]() і
і![]() можуть бути як окисниками, так і
відновниками, залежно від інших реагентів
та умов перебігу реакції.
можуть бути як окисниками, так і
відновниками, залежно від інших реагентів
та умов перебігу реакції.
Приклад 2. Визначення коефіцієнтів у рівняннях реакцій міжмолекулярного окиснення-відновлення.
Визначити коефіцієнти в рівнянні окисно-відновної реакції методами електронного та електронно-іонного балансів:
![]() .
.
Розв’язання. До реакцій міжмолекулярного окиснення-відновлення відносяться реакції в яких змінюються ступені окиснення атомів елементів в молекулах (іонах) різних речовин. Визначивши ступені окиснення всіх елементів, які входять до складу речовин, знаходимо, що в запропонованій реакції змінюють ступені окиснення атом Хрому (від +3 до +6) і атом Хлору (від 0 до -1):
![]()
Це означає, що стан атома Хрому відповідає втраті трьох електронів, а стан атома Хлору – приєднанню одного електрона.
Складаємо схему електронного балансу та визначаємо коефіцієнти перед окисником і відновником, виходячи з рівності числа електронів відданих відновником і приєднаних окисником:
-
відновник

2 процес окиснення
окисник

3 процес відновлення

6е
6е→ 2Сr+6 +6Cl–2Сr+3+
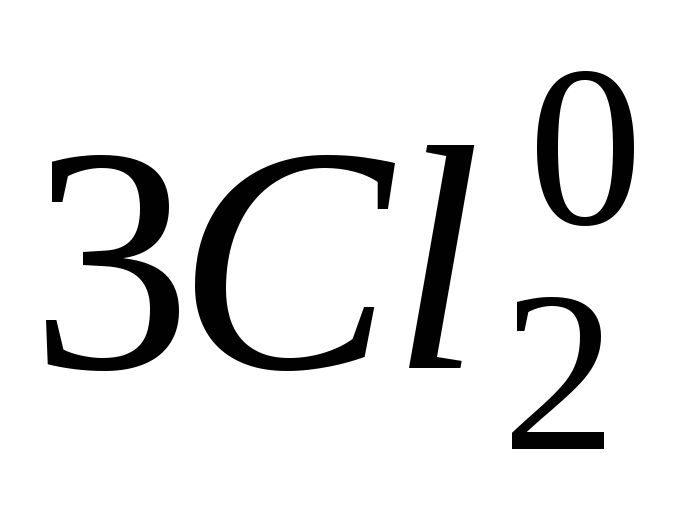 →2Cr+6
+
6Cl–.
→2Cr+6
+
6Cl–.
Одержані методом електронного балансу коефіцієнти розташовуємо перед відповідними речовинами в молекулярному рівнянні:
![]()
Додаткові коефіцієнти визначаємо порівнюючи з обох боків кількість нітрат- іонів, атомів Калію і атомів Гідрогену. Ознакою вірного вибору коефіцієнтів в рівнянні є однакове число атомів Оксигену в лівій та правій частинах рівняння. Рівняння реакції має вигляд:
![]()
При використанні електронно-іонного балансу зміну ступенів окиснення реагуючих речовин зображують за допомогою електронно-іонних схем реакцій. В електронно-іонну схему реакції окрім частинок, що окиснюються або відновлюються, включаються і молекули або іони, які характеризують середовище: кисле – іон Н+, лужне – іон ОН–, нейтральне – молекули Н2О.
Електронно-іонні рівняння складаються окремо для процесів окиснення і відновлення. Для даної реакції електронно-іонна схема має вигляд:
|
|
Процес окиснення |
|
|
Процес відновлення |
Число електронів, що віддає відновник, завжди дорівнює числу електронів, що приймає окисник.
Виходячи з рівності відданих та прийнятих електронів, визначаємо основні коефіцієнти рівняння та алгебраїчно складаємо два рівняння:
|
|
2 |
|
|
3 |
|
| |
|
| |
З урахуванням отриманих коефіцієнтів молекулярне рівняння реакції має вигляд:
![]()
Додатково визначаємо коефіцієнт перед калій нітратом порівнюючи з обох боків кількість атомів Калію, або нітрат-іонів.
Приклад 3. Визначення коефіцієнтів в рівняннях реакцій внутрішньомолекулярного окиснення – відновлення.
Визначити коефіцієнти в рівнянні окисно-відновної реакції методами електронного та електронно-іонного балансів:
![]()
Розв’язання. До реакцій внутрішньомолекулярного окиснення - відновлення відносяться реакції, в яких окисник і відновник входять до складу однієї й тієї самої молекули. Схема реакції окиснення – відновлення амоній дихромату:
![]()
Для рівнянь окисно-відновних реакцій, що відбуваються за відсутністю води, використовується тільки метод електронного балансу.
Схема електронного балансу даної реакції:
-
відновник
 6е
6е
процес окиснення
окисник
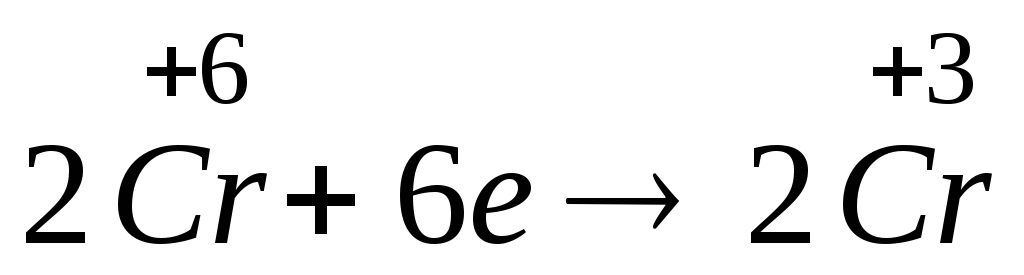
процес відновлення

6е +
+6е→ +2Cr+3
+2Cr+3
За
числом атомів гідрогену в молекулі
алюміній дихромату визначаємо, що при
розкладі однієї молекули
![]() утворюється 4 молекули води. Молекулярне
рівняння реакції має вигляд
утворюється 4 молекули води. Молекулярне
рівняння реакції має вигляд
![]() .
.
Приклад 4. Визначення коефіцієнтів в рівняннях окисно-відновних реакцій диспропорціонування.
Визначити коефіцієнти в рівнянні окисно-відновної реакції методами електронного та електронно-іонного балансів:
![]()
Розв’язання. Реакції диспропорціонування полягають у тому, що молекули однієї речовини реагують одна з одною як окисник і як відновник. Це відбувається тому, що в цих молекулах містяться атоми елементів з проміжним ступенем окиснення, які здатні віддавати і приймати електрони. Схема реакції диспропорціонування нітритної кислоти в молекулярному вигляді записується:
![]()
Знаходимо, що атом Нітрогену одночасно змінює ступінь окиснення від +3 до +5 (процес окиснення) та від +3 до +2 (процес відновлення).
Складаємо схему електронного балансу та визначаємо коефіцієнти перед окисником та відновником, виходячи з рівності числа електронів відданих відновником і приєднаних окисником:
-
відновник

1 процес окиснення
окисник

2 процес відновлення

2е+ +
+2е→
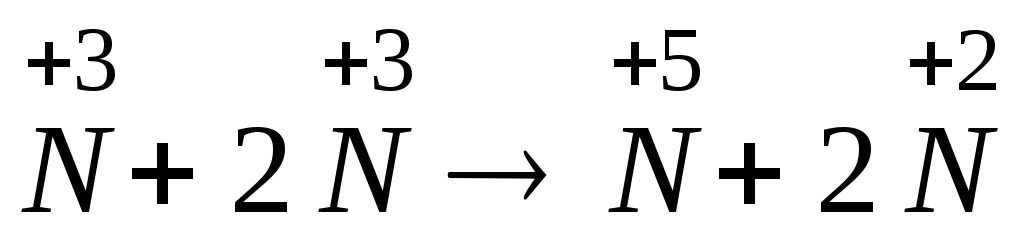 .
.
Одержані коефіцієнти розташовуємо перед відповідними речовинами в молекулярному рівнянні:
![]() ,
,
![]() .
.
Остаточно перевіряємо кількість атомів Гідрогену і Оксигену.
Для використання електронно-іонного балансу записуємо електронно-іонну схему реакції:
|
|
1 |
|
|
2 |
|
| |
|
| |
Таким чином, з кожних трьох молекул нітритної кислоти у двох Нітроген виявляє властивості окисника, а в одній – властивості відновника.
Молекулярне рівняння реакції диспропорціювання має вигляд:
![]() .
.
