
- •1.1. Вектори середньої швидкості та прискорення. Їх координатне та векторне представлення. Нормальне і тангенційне прискорення.
- •1.2. Закон електромагнітної індукції Фарадея. Індуктивний струм. Ерс індукції. Правило Ленца..
- •1.3. Енергія зв'язку ядра. Напівемпірична формула для енергії зв'язку ядра.
- •1.4. Охарактеризуйте педагогіку як науку,розкрийте її основні категорії та розв’язок з іншими науками. Складіть питання для індивідуальної бесіди з учнями (тема,вік учня на вибір студента).
- •1.5. Інструктажі з питань охорони праці
- •2.1. Закони Ньютона, їх узагальнення. Інтерпретація III закону Ньютона, у випадку рухомих зарядів. Границі застосування класичної механіки.
- •2.2. Електричне поле. Напруженiсть електричного поля. Теорема Остроградського-Гаусса. Різниця потенцiалiв.
- •2.3 Випромінювання Вавілова-Черенкова
- •2.4Обгрунтуйте важливість трудового виховання та професійної орієнтації учнів у навчально-виховній та позакласній роботі школи. Завдання фізичного виховання.
- •1. Інструктажі з питань охорони праці
- •3.1. Закон всесвітнього тяжіння у векторній формі. Напруженість і потенціал гравітаційного поля. Закони Кеплера.
- •3.2. Магнітне поле в речовині. Механізми намагнічування середовищ. Типи магнетиків. Вектор намагнічування.
- •3.3 Природа і властивості х-випромінювання.
- •3.4. Охарактерезуйте організаційні форми виховної роботи. З’ясуйте місце класного керівника в реалізації завдань економічного виховання школярів.
- •3.5. Мета та завдання профілактики нещасних випадків професійних захворювань і отруєнь на виробництві.
- •4.1. Сили інерції, які діють на нерухомі і рухомі тіла в обертових неінерціальних системах відліку. Сила Коріоліса.
- •4.2. Квазістаціонарний змінний струм. Активний опір, індуктивність і ємність в колі змінного струму.
- •4.3. Природна та штучна радіоактивність. Статистичний характер розпаду. Закон радіоактивного розпаду.
- •4.4. Виділіть головні національні обряди, звичаї та традиції і їх роль у вихованні школярів. Запропонуйте фрагмент виховного заходу з використанням народних знань.
- •4.5. Основні заходи по запобіганню травматизму та професійним захворюванням.
- •5.3. Альфа- розпад, спектри альфа- частинок. Елементи теорії альфа- розпаду.
- •5.4.Доведіть роль спадковості, середовища та виховання на формування та розвиток особистості школяра. Розробіть структуру комбінованого типу уроку (на конкретній темі за вибором).
- •5.5. Основні причини виробничих травм та професійних захворювань. Розподіл травм за ступенем тяжкості.
- •6.4. Охарактеризувати зміст освіти загальноосвітньої школи та нормативні документи, що його визначають. Розробіть план проведення класних зборів (клас і тема за вибором).
- •2. Вплив шуму на організм людини. Нормування шуму
- •7.1. Рух рідин і газів. Рівняння неперервності. Рівняння Бернулі як закон збереження енергії в гідродинаміці.
- •7.3. Взаємодія нейтронів з речовиною. Уповільнення нейтронів. Теплові резонансні нейтрони.
- •7.4.Розкрийте методику екологічного виховання на всіх етапах навчання дитини в школі. Роль вашої фахової дисципліни в екологічному вихованні.
- •7.5. Контроль параметрів шуму, вимірювальні прилади. Методи та засоби колективного та індивідуального захисту від шуму.
- •8.1. Основні положення кінематичної теорії газів. Обч. Тиску газів за кінематичною теорію. Закони ідеального газу.
- •8.3. Реакцiя подiлу важких ядер. Ланцюгова ядерна реакцiя. Коеф. Розмноження. Ядернi реактори, енергетика.
- •8.4 Охарактеризуйте суть процесу навчання, його завдання та структурні елементи. Розробіть план виховної бесіди з учнями 9-го класу на тему "я і моя професія".
- •8.5. Дія електричного струму на організм людини. Електричні травми. Чинники, що впливають на наслідки ураження електричним струмом.
- •2. Фактори, що впливають на наслідки ураження людини електричним струмом
- •9.1. Газ в полі тяжіння. Барометрична формула Больцмана.
- •9.3. Проблеми керованого термоядерного синтезу.
- •9.4. Розкрийте основні функції навчання та їх взаємозв'язок. Визначте реалізацію функцій навчання при вивченні одної із тем вашої дисципліни.
- •9.5. Безпечна експлуатація електроустановок: електрозахисні засоби і заходи. Надання першої допомоги при ураженні електричним струмом.
- •10.1. Перше начало термодинамiки. Поняття функції стану I функціоналу. Робота газу при рiзнux процесах.
- •10.2. Дифракція на багатомірних гратках. Дифракція рентгенівських променів. Методи рентгеноструктурного аналізу.
- •10.3.Бета-розпад. Види Бетарозпаду. Енергетичнi спектри електронiв. Експерuментальний доказ iснування нейтрино.
- •10.4. Дайте характеристику методів навчання з групи " Організації та здійснення навчально-пізнавальної діяльності". Розробіть план диспуту "Природа і людина".
- •Словесні методи навчання
- •Робота з підручником
- •10.5. Виробничі джерела, іонізуючого випромінювання, класифікація і особливості їх використання.
- •11.1 Цикл Карно. Hepiвність Клаузiуса. Поняття ентропї та розрахунок її змiни при рiзнux процесах.
- •11.2. Явище повного відбивання світла
- •11.3. Космічні промені. Первинне космічне випромінювання. Проходження космічного випромінювання крізь атмосферу.
- •Елементи уроку
- •11.5. Типові методи та засоби захисту персоналу від іонізуючого випромінювання у виробничих умовах.
- •12.1. Рівняння стану реального газу. Ізотерми реального газу.
- •12.2. Закони теплового випромінювання. Індуковане випромінювання. Лазери.
- •12.3. Ядерна ізомерія. Внутрішня конверсія електронів. Ефект Мессбауера.
- •12.4. Виділіть основні принципи навчання та розкрийте їх значення у професійній діяльності вчителя. Розробіть проведення тижня науки з Вашого фаху.
- •12.5. Інструктажі з питань охорони праці. Види інструктажів. Порядок проведення інструктажів для працівників.
- •13.1. Типи міжатомної взаємодії в кристалах. Кристалічні гратки. Дефекти в кристалах.
- •13.2. Дiелектрuкu в електростатuчному nолi. Явuще nолярuзацiї. Типи nолярuзацiї. Неnолярнi I nолярнi дiелектрuкu.
- •13.3. Аномальний ефект Зеємана.
- •13.4. Охарактеризуйте види, функції та методи контролю навчання учнів та основні вимоги до них. Розробіть план проведення батьківських зборів (клас і тема за вибором).
- •13.5. Інструктажі з питань охорони праці для вихованців, учнів, студентів.
- •14.1. Гармонічні коливання. Рівняння гармонічних коливань. Частота власних коливань. Повна енергія гармонічних коливань.
- •14.3. Досліди Штерна – Герлаха. Спін електрона.
- •14.4. На конкретному прикладі вивчення однієї з тем Вашого фаху покажіть застосування методів навчання. Доведіть їх доцільність.
- •14.5. Мета та завдання профілактики нещасних випадків професійних захворювань і отруєнь на виробництві.
- •15.1. Фазові перетворення 1 – го та 2 – го роду. Рів. Клайперона – Клаузіуса. Фазова діаграма. Потрійна точка.
- •15.2. Внутрішня і зовнішня контактна різниця потенціалів. Явище термо-ерс. Ефект Пельтьє.
- •15.3 Борівська теорія атома водню.
- •15.4. Розкрийте освітню, виховну та розвивальну функцію оцінки знань учнів. Критерії оцінки. Розробіть основні напрямки роботи гуртка, який би Ви могли організувати в школі.
- •15.5.Основні заходи по запобіганню травматизму та професійним захворюванням.
- •16.1. Дифузiя газiв. Закони Фiка. Коефiцiєнm дифузiї при сmацiонарнiй дифузiї.
- •16.3. Розподіли Максвела-Больцмана, Фермі-Дірака і Бозе-Ейнштейна
- •16.4. Дайте визначення національного виховання учнів. Сформулюйте мету та визначте завдання розумового і морального виховання учнів у сучасній школі.
- •16.5. Основні причини виробничих травм та професійних захворювань. Розподіл травм за ступенем тяжкості.
- •17.1. Постулати спеціальної теорії відносності. Перетворення Лорентца. Кінематичні наслідки з перетворень Лорентца.
- •17.2 Поляризація світла. Подвійне променезаломлення
- •17.3 Поняття про явище надпровідності.
- •17.4. Виділіть основні методи та засоби навчання, що найчастіше використовуються при викладанні Вашого предмета. Охарактеризуйте їх дидактичні можливості.
- •17.5. Класифікація шумів за походженням, за характером, спектром та часовими характеристиками. Нормування шумів.
- •1. Шум, його характеристика, види шуму
- •2. Вплив шуму на організм людини. Нормування шуму
- •18.1 Закони збереження в механіці
- •18.2 Природне обертання площини поляризації. Ефект Фарадея.
- •1. Феноменологічне пояснення
- •18.3. Експериментальні дані про властивості складних атомів. Структура атомів
- •18.4. Розкрийте структуру та особливості педагогічної діяльності учителя. Роль кваліфікаційної характеристики та професіограми вчителя у підготовці педагогічних кадрів.
- •18.5. Контроль параметрів шуму, вимірювальні прилади. Методи та засоби колективного та індивідуального захисту від шуму.
- •19.2. Електрорушійна сила. Сторонні сили. Закон Ома для ділянки кола, що містить ерс. Правила Кірхгофа.
- •19.3. Спектри Гелію. Ортогелій і парагелій. Принцип Паулі.
- •19.4. Розкрийте систему освіти в Україні та принципи її побудови, визначені Законом України "Про освіту". Розробіть план комбінованого уроку (клас і тема за вибором студента).
- •19.5. Дія електричного струму на організм людини. Електричні травми. Чинники, що впливають на наслідки ураження електричним струмом.
- •20.2. Класична електронна теорія провідності і її труднощі. Поняття про квантову теорію електропровідності.
- •20.3. Магнітні властивості атомів: орбітальний та спіновий магнітний момент. Магнетон Бора. Фактор Ланде.
- •20.4 Назвіть основних педагогів-класиків та значення їх спадщини. Дайте коротку характеристику одного із буковинських педагогів (ю.Федькович, о.Попович, або ін.)
- •20.5Безпечна експлуатація електроустановок: електрозахисні засоби і заходи. Надання першої допомоги при ураженні електричним струмом.
- •21.3. Дейтрон. Його основні характеристики. Спінова залежність ядерних сил.
- •21.4. Дайте поняття "педагогічної майстерності", розкрийте її структуру та основні шляхи формування.
- •21.5. Типові методи та засоби захисту персоналу від іонізуючого випромінювання у виробничих умовах.
- •22.2 Властивості лазерного випромінювання: монохроматичність, напрямленість, потужність, лазерні стекла.
- •22.3 Експериментальнi обгрунтування сучасної теорії атомiв: дослiди Резерфорда по розсiюванню α-часток.
- •22.4 Доведіть роль спадковості, середовища та виховання на формування та розвиток особистості школяра. Розробіть структуру комбінованого типу уроку (на конкретній темі за вибором).
- •22.5 Основні засоби і заходи забезпечення пожежної безпеки виробничого об’єкту. Пожежна сигналізація. Засоби пожежогасіння.
- •23.1 Теплопровідність, закон Фур’є для теплопровідності. Механізми протікання теплопровідності в різних речовинах.
- •23.2 Фізичні принципи голографії.
- •1. Фізичні принципи
- •2. Джерела світла
- •3. Історія голографії
- •23.3 Проходження мікрочастинок через потенціальний бар’єр. Тунельний ефект.
- •23.4. Виділіть основні принципи навчання та розкрийте їх значення у професійній діяльності вчителя. Розробіть проведення тижня науки з Вашого фаху.
- •23.5 Засоби пожежогасіння. Дії персоналу при виникненні пожежі.
- •24.1 Поняття ентропії системи та розрахунок її зміни при різних процесах. Фізична суть ентропії.
- •1. Теорія
- •1.1. Модель взаємодії з осцилятором
- •1.2. Спектральний склад
- •3. Застосування
- •24.5 Забезпечення та контроль стану пожежної безпеки на виробничих об’єктах.
11.1 Цикл Карно. Hepiвність Клаузiуса. Поняття ентропї та розрахунок її змiни при рiзнux процесах.
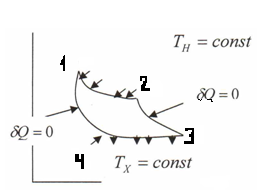
Найбiльш простим по суті, але бiльш важливим є циклiчний процес, який скл. з двох iзотермiчних i двох адiабатичних дiлянок. Цей цикл наз. циклом Карно. Газ iзотермiчного розширення весь час отримує теплоту вiд нагрiвника i всю її перетворює в роботу. QH=A12=mRTH lnV2 >0
μ V1
На дiлянцi 23 виконує додатню роботу за рахунок зменшення внутрiшньої eнергії, при цьому зменшується Т вiд TH до TХ.
A23= -ΔU23= і mR(TХ - TH) >0
2 μ
На ділянці 34 газ ізотермічно стискається і віддає при цьому відповідну кількість теплоти QХ=A34=mRTХ lnV4 >0
μ V3
Точка 4 вибирається таким чином, що адiабатичним стисненням газ можна повернути у початковий стан. На дiлянцi 41 газ iз-за адiабатичного стиснення збiльшує свою Т i виконує при цьому вiд'ємну роботу. A41= -ΔU41= і mR(TH-TХ) >0
2 μ
Теорема Карно: ККД теплової машини, яка працює при певних значеннях TХ,TH не може бути більшим ніж ККД теплової машини, яка працює за циклом Карно при тих самих TХ,TH. η= TH-TХ / TH
∫δQ ≤0 – нерівність Клаузіуса. Тут = для оборотних процесів,
Т < - для необоротних кругових процесів. Величина δQ/Т є функцією стану, бо її зміна при переході з одного стану в інший не залежить від способу переходу, а визначається початковим і кінцевим станом. δQ/Т =dS, де S- ентропія. Розрахуемо змiну ентропiї при рiзних процесах: 1. Нагрiвання тiл. Щоб змiнити Т системи на dT їй необхiдно надати δQ=cmdT , тодi змiна ентропiї вiд Т1 до Т2 ΔS=S1-S2=∫2 δQ =∫2 cmdT =cm lnТ2, 1Т 1Т Т1 при зростаючій ентропії збільшується Т, при її зниженні Т падає. 2. Фазові переходи 1 роду (зміна агрегатного стану). Фазові переходи протікають при фіксованій Т - Т фазового переходу і супроводжуються поглинанням (виділенням) теплоти. δQ=q0dm, q0- питома теплота фазового переходу, показує, яку к-ть теплоти потрібно надати одиниці маси, щоб величина зазнала фазового переходу.
ΔS=S1-S2=∫2 q0dT = q0m
1 Т Т 3.Ізопроцеси в ідеал. газі.
ΔS=S1-S2=∫2 δQ =∫2 dU+δA = ∫2m/μ* CvdT+pdV= m Cv lnТ2 + m R lnТ2
1 Т 1 Т 1 Т μ Т1 μ Т1
загальне співвідношення для зміни ентропії ідеал. газу.
а ) Т=соnst, pV=соnst, p1V1= p2V2. ΔS= m R lnV2= m R lnP1
μ V1 μ P2
б ) V= соnst, p1 /Т1= p2 /Т2. ΔS= m Cv lnТ2= m Cv ln P2
μ Т1 μ P1
в ) Р= соnst, V1 /Т1= V2 /Т2. ΔS= m Cv lnТ2+ m R ln V2→
μ Т1 μ V1
ΔS= m lnТ2(Cv+R)= m Cp lnТ2
μ Т1 μ Т1
г ) δQ=0, δQ/Т=0, при адіабатному процесі ентропія залишається не змінною із-за цього адіабатичний процес наз. ізоентропійним.
