
- •Заняття №16
- •Самостійна позааудиторна робота
- •Контрольні питання
- •Самостійна аудиторна робота
- •1.1.3. Мірний посуд
- •1.2. Аналітичні терези та методи зважування на них
- •1.2.1. Будова аналітичних терезів
- •1.2.2. Вимоги, які висуваються до аналітичних терез
- •1.2.3. Правила роботи з терезами
- •1.2.4. Техніка зважування
- •Завдання 2. Приготування стандартних розчинів хлоридної кислоти та натрію гідроксиду
- •2.1. Приготування робочого титрованого розчину кислоти
- •2.1.1. Приготування стандартного розчину хлоридної кислоти із концентрованого розчину
- •2.1.2. Встановлення молярної концентрації еквіваленту розчину хлоридної кислоти
- •2.1.3. Встановлення концентрації хлоридної кислоти за бурою
- •2.1.4. Встановлення молярної концентрації еквіваленту розчину хлоридної кислоти за натрію карбонатом
- •2.1.5. Приготування стандартних розчинів хлоридної кислоти різних концентрацій із концентрованих розчинів
- •2.1.6. Приготування розчину хлоридної кислоти із фіксаналу
- •2.2. Приготування робочого титрованого розчину лугу
- •2.2.1. Робочі розчини лугів
- •2.2.2. Вихідні речовини
- •2.2.3. Встановлення концентрації розчину натрію гідроксиду за оксалатною кислотою
- •2.2.4. Встановлення концентрації розчину NaОн за оксалатною кислотою
- •2.2.5. Встановлення концентрації розчину NaOh за робочим титрованим розчином хлоридної кислоти
- •2.2.6.Приготування стандартних розчинів лугу різних концентрацій
- •Літературa
- •Заняття №17
- •Самостійна позааудиторна робота
- •Контрольні питання
- •Самостійна аудиторна робота
- •1.3. Приготування стандартного розчину оксалатної кислоти
- •1.4. Встановлення концентрації розчину NaOh за оксалатною кислотою
- •1.5. Титрування досліджуваного розчину hCl розчином NaOh
- •Літературa
- •Заняття №18
- •Самостійна позааудиторна робота
- •Контрольні питання
- •Самостійна робота на занятті
- •Експериментальна частина Завдання 1. Визначення ацетатної кислоти
- •Хід аналізу
- •Завдання 2. Визначення ортоборатної кислоти
- •Хід аналізу
- •Завдання 3. Визначення аміаку
- •Хід аналізу
- •Літературa
- •Заняття №19
- •Самостійна позааудиторна робота
- •Контрольні питання
- •Самостійна робота на занятті
- •1.2. Визначення вмісту ортофосфатної кислоти
- •Хід аналізу
- •Літературa
- •Заняття №20
- •Самостійна позааудиторна робота
- •Контрольні питання
- •Самостійна аудиторна робота
- •Експериментальна частина Завдання 1. Визначення натрію карбонату та натрію гідрокарбонату при їх одночасній присутності в розчині
- •Хід аналізу
- •Завдання 2. Визначення ортофосфатної і сульфатної кислот при їх одночасній присутності в розчині
- •Хід аналізу
- •Літературa
- •Заняття №21
- •Самостійна позааудиторна робота
- •Контрольні питання
- •Самостійна аудиторна робота
- •Літературa
- •Заняття №22
- •Самостійна позааудиторна робота
- •Контрольні питання
- •Самостійна аудиторна робота
- •Експериментальна частина Завдання 1. Приготування приблизно 0,1н розчину калію перманганату
- •Завдання 2. Приготування вихідного розчину оксалатної кислоти
- •Завдання 3. Титрування розчину оксалатної кислоти (або натрію оксалату) розчином калію перманганату
- •Завдання 4. Визначення калію дихромату перманаганатометричним методом
- •Хід аналізу
- •Завдання 5. Визначення феруму в розчині солі Мора
- •Завдання 6. Визначення процентного складу гідрогену пероксиду в розчині
- •30 Г н2о2 міститься в 100 г 30%-го розчину н2о2
- •0,17 Г н2о2 міститься в х г 30%-го розчину н2о2.
- •Літературa
- •Заняття №23
- •Самостійна позааудиторна робота
- •Контрольні питання
- •Самостійна аудиторна робота
- •Завдання 2. Приготування розчину калію дихромату
- •Завдання 3. Встановлення концентрації розчину натрію тіосульфату за калію дихроматом
- •Завдання 4. Приготування вихідного розчину йоду
- •Завдання 5. Приготування розчину крохмалю
- •Завдання 6. Йодометричне визначення відновників методом прямого титрування
- •Завдання 7. Визначення сульфітів методом зворотнього титрування
- •Завдання 8. Визначення формаальдегіду у формаліні
- •Завдання 9. Визначення аскорбінової кислоти
- •Літературa
- •Заняття №24
- •Самостійна позааудиторна робота
- •Контрольні питання
- •Самостійна аудиторна робота
- •Експериментальна частина
- •Завдання 1. Приготування 0,1н розчину калію бромату(калію йодату). Стандартизація розчинів за натрію тіосульфатом
- •Завдання 2. Визначення фенолу та його похідних
- •Хід аналізу
- •Завдання 3. Визначення Магнію реакцією
- •Завдання 4. Визначення масової частки стрептоциду у препараті
- •Завдання 5. Титрування калію йодатом
- •Хід аналізу
- •Літературa
- •Заняття №25
- •Самостійна позааудиторна робота
- •Контрольні питання
- •Самостійна аудиторна робота
- •Експериментальна частина Завдання 1. Приготування 0,1м розчину аргентуму нітрату
- •Завдання 2. Приготування 0,01м розчину натрію хлориду
- •Завдання 3. Стандартизація 0,1м розчину аргентуму нітрату за натрію хлоридом
- •Завдання 4. Визначення процентного вмісту Хлору в зразку кухонної солі за методом Мора
- •Завдання 5. Визначення масової частки натрію хлориду в препараті за методом Фаянса-Ходакова
- •Завдання 6. Визначення масової частки калію йодиду в препараті за методом Фаянса-Ходакова
- •Літературa
- •Заняття №26
- •Самостійна позааудиторна робота
- •Контрольні питання
- •Самостійна аудиторна робота
- •Експериментальна частина Завдання 1. Приготування 0,1м розчину амонію роданіду
- •Завдання 2. Стандартизація 0,1м розчину амонію роданіду за стандартним розчином аргентуму нітрату
- •Завдання 3. Визначення вмісту хлоридної кислоти в розчині за методом Фольгарда
- •Завдання 4. Визначення вмісту NaBr в сухій солі за методом Фольгарда
- •Літературa
- •Заняття №27
- •Самостійна позааудиторна робота
- •Контрольні питання
- •Самостійна аудиторна робота
- •Експериментальна частина Завдання 1. Приготування 0,05н розчину трилону б
- •Завдання 2. Стандартизація 0,05н розчину трилону б за цинком металічним
- •Завдання 3. Методика визначення катіонів комплексонометричним методом
- •3.1. Алюміній
- •3.2. Бісмут
- •Розрахунки:
- •Завдання 5. Визначення загальної твердості води.
- •Літературa
- •Заняття №28
- •Самостійна позааудиторна робота
- •Контрольні питання
- •Самостійна аудиторна робота
- •Експериментальна частина Завдання 1. Визначення масової частки гігроскопічної вологи в природних технічних продуктах
- •Результати аналізу вологи в речовині
- •Літературa
- •Заняття №29
- •Самостійна позааудиторна робота
- •Контрольні питання
- •Самостійна аудиторна робота
- •Експериментальна частина Завдання1. Визначення сульфатів у природних і стічних водах.
- •Чистота осаду
- •Фільтрування
- •Висушування та прожарювання
- •Розрахунок результатів аналізу:
- •Завдання 2. Визначення вмісту Барію в технічному зразку BaCl2•2h2o
- •Розрахунок наважки
- •Зважування наважки та її розчинення
- •Розрахунок кількості осаджувача
- •Осаджування
- •Фільтрування і промивання осаду
- •Висушування і прожарювання осаду
- •Завдання 3. Визначення вмісту Феруму в солі Мора
- •Виконання аналізу
- •Літературa
- •Заняття №30
- •Самостійна позааудиторна робота
- •Контрольні питання
- •Самостійна аудиторна робота
- •Літературa
Самостійна позааудиторна робота
1.Способи класифікації титриметричних методів аналізу: а) за типом реакції; б) за способом титрування. Відповідь обґрунтуйте та запишіть.
2.У чому суть методу визначення аміаку в солях амонію титруванням за заміщенням. Напишіть хімізм реакцій. Поясніть, як розраховують процентний вміст аміаку у препараті.
3.Чому при титруванні ортофосфатної кислоти лугом (індикатор фенолфталеїн) бажано додавати натрію хлорид?
4.Скільки грамів ортофосфатної кислоти міститься в даному розчині, якщо на титрування його з метиловим оранжевим використано 24,50 см3 розчину натрію гідроксиду з молярною концентрацією 0,2000 моль/дм3?
5.Напишіть, яка з сполук: KOH, KHCO3, K2CO3 міститься в даному розчині, якщо: а) на титрування його з фенолфталеїном і метиловим оранжевим витрачається однакова кількість HCl; б) на титрування з фенолфталеїном йде вдвоє менше розчину HCl, ніж на титрування з метиловим оранжевим; в) розчин не дає лужної реакції з фенолфталеїном, але може бути від титрований з метиловим оранжевим.
Контрольні питання
1.Особливості титрування багатоосновних кислот.
2.Які існують способи вираження концентрації розчинів?
3.Які робочі розчини застосовують у методі нейтралізації та як їх готують? Відповідь обґрунтуйте та запишіть.
4.Криві титрування багатоосновних кислот. Від чого залежить фактор еквівалентності багатоосновних кислот? Наведіть приклади.
5.Як можна протитрувати ортофосфатну кислоту як триосновну?
6.З яким індикаторами можна титрувати ортофосфатну кислоту? Як змінюється молярна маса еквіваленту ортофосфатної кислоти при титруванні її з різними індикаторами?
7.Які вимоги до реакцій, що можуть використовуватися в титриметричному аналізі?
8.До наважки плюмбуму (II) оксиду масою 0,1167 г додали 20 см3 0,1012М розчину нітратної кислоти. Надлишок кислоти відтитрували 9,75 см3 0,1050М розчину натрію гідроксиду. Розрахуйте відсотковий вміст плюмбуму (II) оксиду у досліджуваному зразку.
9.Розрахувати похибку титрування 0,1000 моль/дм3 розчину аміаку 0,1000 моль/дм3 розчином хлоридної кислоти в присутності індикаторів: а) метилового оранжевого (рТ = 4,0); б) фенолфталеїну (рТ = 9,0); в) метилового червоного (рТ = 5,5).
10.Розрахувати похибку титрування 0,1000 моль/дм3 розчину ацетатної кислоти 0,1000 моль/дм3 розчином натрію гідроксиду з індикаторами: а) метиловим оранжевим (рТ = 4,0); б) фенолфталеїном (рТ = 9,0).
Самостійна робота на занятті
1.Ознайомитись з методом титрування слабких кислот та слабких основ за допомогою дослідів, описаних у даних методичних вказівках.
2.Виготовляти стандартні розчини методу нейтралізації.
3.Виконати лабораторні роботи, вказані в цих методичних матеріалах.
4.Оформити та захистити протокол.
5.Відповідати на запитання, запропоновані викладачем, з використанням записів на дошці.
6.Розв'язувати розрахункові задач, запропоновані викладачем.
Експериментальна частина
Завдання 1. Визначення вмісту багатоосновних кислот
1.1. Визначення вмісту H2SO4 в технічній кислоті
Визначення сульфатної кислоти основане на титруванні її розчинів стандартним розчином NaOH. Як індикатор застосовують метиловий оранжевий, метиловий червоний або фенолфталеїн. Нейтралізація сульфатної кислоти відбувається у дві стадії:
H2SO4+NaOH=NaHSO4+H2O,
NaHSO4+NaOH=Na2SO4+H2O.
Однак, оскільки H2SO4 і HSO4- досить сильні кислоти, то при титруванні водних розчинів сульфатної кислоти спостерігається тільки одна точка еквівалентності.
Хід аналізу
Перш за все вимірюють густину розчину H2SO4. Якщо вихідна кислота дуже концентрована, то її наважку розраховують за формулою:
![]() .
.
Якщо кислота розведена, то наважку її збільшують у відповідності з концентрацією.
При зважуванні кислот дотримуються певних правил обережності. Спочатку зважують кислоту в бюксі, в який попередньо наливають 10 см3 води, потім точно зважують на аналітичних терезах, стараючись, щоб сульфатна кислота не попала ні на терези, ні на зовнішню сторону бюкса. Якщо вихідна кислота не концентрована, то воду в бюкс не наливають.
Для того, щоб взяти точну наважку, бюкс з водою ставлять на ліву чашку технічних терезів і тарують. Після цього на праву частину терезів ставлять різноважки, а потім у бюкс краплями додають обережно сульфатну кислоту до тих пір, поки чашки терезів не зрівноважаться. Зважену кислоту переносять за допомогою лійки в мірну колбу на 250 см3, в яку попередньо налито 100-150 см3 води. Бюкс і лійку декілька раз ополіскують водою і нею ж доводять об’єм у мірній колбі до мітки. Піпеткою відбирають із колби 25 см3 розчину в конічну колбу, додають 2-3 краплі розчину фенолфталеїну і титрують 0,1М розчином лугу.
Масову частку сульфатної кислоти визначають за формулою:
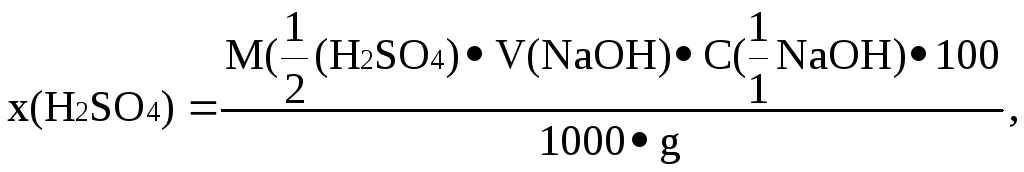
де
![]() – молярна маса еквіваленту H2SO4;
– молярна маса еквіваленту H2SO4;
![]() –об’єм
лугу, що пішов на титрування;
–об’єм
лугу, що пішов на титрування;
![]() –молярна
концентрація еквіваленту NaOH;
–молярна
концентрація еквіваленту NaOH;
g – наважка кислоти, г.
