
- •Печатается согласно редакционно-издательскону плану Военно-медицинской академии имени с. М. Кирова, утвержденному начальником Главного военно-медицинского управления
- •Глава 6. Антидоты. Общие принципы оказания неотложной помощи отравленным
- •Глава 11. Отравляющие и высокотоксичные вещества цитотоксического действия
- •Глава 12. Отравляющие и высокотоксичные вещества нейротоксического действия
- •Часть II. Радиобиология 337
- •Раздел IV. Военная радиобиология 380
- •Глава 17. Факторы, вызывающие поражения личного состава войск при ядерных
- •Глава 18. Лучевые поражения в результате внешнего облучения (н. В. Бутомо) 385
- •ГЛава 19. Лучевые поражения в результате общего (тотального) облучения
- •Глава 20. Медицинская защита от внешнего облучения (а. Н. Гребенюк,
- •Глава 21. Местные лучевые поражения (а. Н. Гребенюк, н. В. Бутомо) 418
- •Глава 22. Поражения в результате внутреннего радиоактивного заражения
- •Глава 23. Сочетанные и комбинированные радиационные поражения
- •Часть III. Средства и методы профилактики химических
- •Глава 24. Технические средства индивидуальной и коллективной защиты
- •Глава 25. Специальная обработка в подразделениях и частях медицинской службы
- •Глава 26. Радиационная и химическая разведка в частях и подразделениях
- •Часть I токсикология
- •Глава 1. Предмет, цель, задачи и структура токсикологии
- •1.1. Предмет токсикологии
- •Часть I. Токсикология
- •1.2L Цель и задачи токсикологии
- •Глава 1. Предмет, цель, задачи и структура токсикологии
- •1.3. Структура токсикологии
- •Часть I. Токсикология
- •Глава 2. Основные понятия токсикологии
- •2.1. Токсикант (яд)
- •2.2. Токсический процесс
- •Глава 3. Токсикометрия
- •Глава 4. Токсикокинетика
- •Признаки специфического транспорта
- •Транспорт веществ путем цитозов
- •1.2. Резорбция
- •Часть I. Токсикология
- •4.4.1. Экскреция
- •4.5» Количественные характеристики токсикокинетики
- •Глава 5. Токсикодинамика
- •5.1. Механизм токсического действия
- •5.1.1. Химизм реакции токсикант — рецептор
- •5.1.2. Взаимодействие токсикантов с белками
- •5.1.3» Взаимодействие токсикантов с нуклеиновыми кислотами
- •5.1.4. Взаимодействие токсикантов с липидами мембран
- •5.1.5. Взаимодействие с реактивными структурами возбудимых мембран
- •5.2. Общие механизмы цитотоксичности
- •5.2.1. Нарушение процессов биоэнергетики
- •5.2.2. Активация свободнорадикальных процессов в клетке
- •Энзиматическая и неэнзиматическая защита клеток ► супероксиддисмутаза ♦ катапаза ♦ gsh-пероксидаза ♦ gssg-редуктаза ♦ аскорбат ♦ глутатион ♦ мочевая кислота ♦ токоферол
- •Манифестация активации свободнорадикальных процессов
- •5.2.3* Повреждение мембранных структур
- •Экзогенные фосфолипазы (змеиные яды)
- •Фосфолипиды (гидролиз)
- •5.2*4. Нарушение гомеостаза внутриклеточного кальция
- •Часть I. Токсикология
- •5.2.5. Повреждение процессов синтеза белка и клеточного деления
- •Возможные точки приложения повреждающего действия токсикантов на процессы синтеза белка и клеточного деления
- •2. Синтез рнк. Транскрипция " .
- •5.3. Развитие токсического процесса
- •Глава 6. Антидоты. Общие принципы оказания неотложной помощи отравленным
- •6.1. Характеристика современных антидотов
- •Глава 6. Антидоты. Общие принци11ы оказании ньШлижпии I шмцщи и I гаш ItnnWm
- •6.2. Применение противоядий
- •6.3. Разработка новых антидотов
- •6.4. Основные принципы оказания первой, доврачебной и первой врачебной помощи при острых отравлениях
- •Раздел II. Военная токсикология
- •Глава 7. Основные понятия военной токсикологии
- •7.1. Предмет, цели, задачи военной токсикологии
- •7.2. Отравляющие и высокотоксичные вещества (овтв)
- •Часть I. Токсикология
- •Глава 7. Основные понятия военной токсикологии
- •7М. Медицинская противохимическая защита
- •Глава 8. Отравляющие
- •8.1. Общая характеристика
- •8.2. Физико-химические свойства. Токсичность
- •8.3. Методы изучения раздражающего действия
- •8.4. Основные проявления поражения
- •Часть I. Токсикология
- •Глава 8. Отравляющие и высокотоксичныь ньщсыок тдцт,»™—- „
- •8.5. Патогенез токсического процесса. Механизм действия
- •Часть I. Токсикология
- •Глава 8. Отравляющие и высоко! окютныь вьщьо I на гмцгплшщи и д_и_ I вин
- •8.6. Оказание помощи. Медицинская защита
- •Глава 9. Отравляющие
- •1Э«1» Основные формы
- •Перечень овтв, вызывающих раздражение и воспалительные процессы в дыхательных путях
- •Овтв, вызывающие отек легких
- •9.2. Овтв удушающего действия
- •9.2.1. Характеристика отдельных представителей овтв удушающего действия
- •9.2.1.2. Хлор
- •9.2.1.3. Оксиды азота
- •9.2.1.4. Паракват
- •Токсичность (ld50) параквата для грызунов, мг/кг
- •9.2.2. Диагностика поражения овтв удушающего действия
- •9.2.3. Медицинская защита
- •Показания к принятию решений по оказанию помощи пораженным овтв удушающего действия
- •Часть I. Юксикология
- •Глава 9. Отравляющие и высокотоксичные вещьсiьаi iyj IbMuhu I цксичьскцго действия
- •Глава 10. Отравляющие
- •Часть I. Iuitwvmujiui ия
- •Глава 10. Отравляющие и высокотоксичные вещества общеядовитого действия
- •10.1. Овтв, нарушающие кислородтранспортные функции крови
- •10.1.1. Овтв, нарушающие функции гемоглобина
- •Глава 10. Отравляющие и высокотоксичные вещества общеядовитого действия
- •10.1.1.1. Овтв, образующие карбоксигемоглобин
- •10*1.1.1.1. Карбонилы металлов
- •10.1.1.1.2. Оксид углерода (со)
- •10.1.1.2. Овтв, образующие метгемоглобин
- •10.1.1.2.1. Нитро- и аминосоединения ароматического ряда
- •10.1.1.2.2. Нитриты
- •Глава 10. Отравляющие и высокотоксичные вещества общеядовитого действия
- •Глава 10. Отравляющие и высокотоксичные вещества общеядовитого действия
- •10.1.12.3. Взрывные (пороховые) газы
- •Часть I. Токсикология
- •10.1.2. Овтв, разрушающие эритроциты (гемолитики)
- •Глава 10. Отравляющие и высоко I рКиичньи: вьщьо I ва ирщспццри ил и цсии I от»
- •10.1.21.1. Мышьяковистый водород (Арсин — AsH3)
- •10.2. Овтв, нарушающие тканевые процессы биоэнергетики
- •10.2.1. Ингибиторы ферментов цикла Кребса
- •10.2.1.1. Фторорганические соединения
- •10.2.1.2. Фторуксусная кислота
- •Часть I. Юксикология
- •Глава 10. Отравляющие и высокотоксичные вещества общеядовитого действия
- •10.21.2!. Ингибиторы цепи дыхательных ферментов
- •10.2.2.1. Синильная кислота и ее соединения
- •Глава 10. Отравляющие и высокотоксичные вещества общеядовитого действия
- •10.2.3. Разобщители тканевого дыхания
- •10.2.3.1. Динитро-орто-крезол Физико-химические свойства. Токсичность
- •Глава 11. Отравляющие
- •11.1.1.1. Иприты
- •Глава 11. Отравляющие и высокотоксичные вещества цит0т0ксическ0г0 действия
- •Глава 11. Отравляющие и высокотоксичные вещества цитотоксического действия
- •11.1.2. Ингибиторы синтеза белка, не образующие аддукты днк и рнк
- •Глава 11. Отравляющие и высокотоксичные вещества цитотоксического действия
- •11.2. Тиоловые яды
- •11.2.1. Соединения мышьяка
- •11.2.1.1. Неорганические соединения мышьяка
- •11.2.1.2. Галогенированные алифатические арсины
- •11.2.1.3. Галогенированные ароматические арсины
- •Глава 11. Отравляющие и высокотоксичные вещества цитотоксического действия
- •11.3. Токсичные модификаторы пластического обмена
- •11.3.1. Диоксины
- •Токсичность диоксина для разных видов животных при внутрибрюшинном введении
- •11.3.2. Полихлорированные бифенилы (пхб)
- •Глава 12. Отравляющие
- •12.1. Вещества, вызывающие преимущественно функциональные нарушения со стороны нервной системы
- •12.11. Отравляющие и высокотоксичные вещества нервно-паралитического действия
- •Возможные общие механизмы генерации судорожного синдрома
- •12.1.1.1. Отравляющие и высокотоксичные вещества судорожного действия
- •12.1.1*1.1.1. Ингибиторы холинэстеразы
- •0,006 Г/человека
- •Часть I. I и кии кили I ни
- •Глава 12. Отравляющие и высокотоксичные вещества неиротоксического действия
- •Основные направления разработки средств медицинской защиты от фосфорорганических отравляющих веществ (по с. Н. Голикову и соавт., 1972)
- •Основные направления патогенетической и симптоматической терапии
- •Группы препаратов
- •12.1.1.1.2.3. Антагонисты гамк
- •12.1.1.2. Отравляющие и высокотоксичные вещества паралитического действия
- •12.1.1*2.1. Пресинаптические блокаторы высвобождения ацетилхолина
- •12.1.2. Отравляющие и высокотоксичные вещества психодислептического действия
- •Химическая классификация психодислептиков
- •12.1.2.2. Делириогены
- •«Психотомиметические» дозы некоторых холинолитиков
- •12.1.2.2.2. Фенциклидин (сернил)
- •12.2. Вещества, вызывающие органические повреждения нервной системы
- •12.2.1. Таллий
- •12.2.2. Тетраэтилсвинец (тэс)
- •Часть II радиобиология
- •Раздел III. Общап радиобиология
- •Глава 13. Предмет, цель и задачи радиобиологии
- •Глава 14. Виды ионизирующих излучений и их свойства
- •14.1. Электромагнитные ионизирующие излучения
- •14.2. Корпускулярные ионизирующие излучения
- •Глава 15. Радионуклиды как источник радиационной опасности
- •15.1. Радиоактивность.
- •15.2. Количество радиоактивных веществ. Радиометрия
- •15.3. Источники радионуклидов. Радионуклиды в природе и народном хозяйстве
- •Глава 16. Радиобиологические эффекты
- •Глава 16.
- •16.1 Классификация радиобиологических эффектов
- •16.1.1. Уровень формирования
- •16.1.2» Сроки появления
- •16.1.3. Локализация
- •16.1.4. Характер связи с дозой облучения
- •16.1.5» Значение для судьбы облученного организма
- •16.2. Начальные этапы биологической стадии в действии ионизирующих излучений
- •16.2.1. Первичные стадии в действии излучений
- •16.2.2. Молекулярные механизмы лучевого повреждения биосистем
- •16.3. Реакции клеток на облучение
- •16.3.1, Биологическое усиление радиационного поражения
- •16.3.2. Репарация лучевых повреждений
- •16.3.3. Судьба облученной клетки
- •16.3.4. Количественные характеристики лучевого поражения клеток
- •16.4. Действие излучений на ткани, органы и системы. Радиочувствительность тканей
- •16.4.1. Радиационное поражение системы крови
- •16.4.2. Радиационное поражение органов желудочно-кишечного тракта
- •16.4.3. Лучевое поражение центральной нервной системы
- •Раздел IV. Военная радиобиология
- •Глава 17. Факторы, вызывающие поражения личного состава войск при ядерных взрывах и радиационных авариях
- •17.1. Поражающие факторы ядерного взрыва
- •17.1.1. Радиационные поражающие факторы ядерного взрыва
- •17.1.2. Нерадиационные поражающие факторы ядерного взрыва
- •17.21. Характеристика лучевых поражений
- •Глава 18. Лучевые поражения в результате внешнего облучения
- •18.1. Классификация лучевых поражений от внешнего облучения в зависимости от вида и условий воздействия
- •18.2. Зависимость эффекта облучения от его продолжительности
- •18.3. Зависимость эффекта облучения от распределения поглощенной дозы в объеме тела
- •Глава 19. Лучевые поражения в результате общего (тотального) облучения
- •19.1. Острая лучевая болезнь
- •19.1.2. Кишечная форма острой лучевой болезни
- •19.1.3. Токсемическая форма острой лучевой болезни
- •19.1.1. Церебральная форма острой лучевой болезни
- •19.2. Особенности поражений нейтронами
- •19.3. Отдаленные последствия общего (тотального) облучения
- •19.3.1. Неопухолевые отдаленные последствия облучения
- •19.3.2. Канцерогенные эффекты облучения
- •19.3.3. Сокращение продолжительности жизни
- •Глава 20. Медицинская защита от внешнего облучения
- •20.1. Радиопротекторы
- •20.1.1. Показатели защитной эффективности радиопротекторов
- •20.1.2. Механизмы радиозащитного действия
- •20.1.3. Краткая характеристика и порядок применения радиопротекторов, имеющих наибольшее практическое значение
- •20.2. Средства длительного поддержания повышенной радиорезистентности организма
- •Глава 20. Медицинская защита от внешнего облучения
- •20.3. Средства профилактики общей первичной реакции на облучение
- •Глава 20. Медицинская защита от внешнего облучения
- •20.4. Средства профилактики ранней преходящей недееспособности
- •20.5. Средства раннего (догоспитального) лечения острой лучевой болезни
- •Глава 21.
- •21.1. Местные лучевые поражения кожи
- •21.2. Местные лучевые поражения слизистых оболочек
- •21.3. Особенности местных лучевых поражений в результате наружного заражения кожных покровов р адионуклидами
- •Глава 22. Поражения в результате внутреннего радиоактивного заражения
- •22.1. Кинетика радионуклидов
- •22.1.1. Поступление радионуклидов в организм
- •22.1.2. Судьба радионуклидов, проникших в кровь
- •22.1.3. Выведение радионуклидов из организма
- •22.2. Биологическое действие радиоактивных веществ
- •22.2.2. Влияние на развитие поражения активности инкорпорированных радионуклидов и продолжительности их пребывания в организме
- •22.2.3. Последствия поступления
- •22.2.4. Лучевые поражения в результате алиментарного и ингаляционного поступления продуктов ядерного деления
- •Глава 22. Поражения в результате внутреннего радиоактивного заражения
- •22.3. Профилактика поражений радионуклидами. Медицинские средства защиты и раннего лечения
- •22.3.1. Специальные
- •Глава 22. Поражения в результате внутреннего радиоактивного заражения
- •22.3.2. Медицинские средства защиты и раннего (догоспитального) лечения при внутреннем заражении радиоактивными веществами
- •22.4. Ранняя диагностика и эвакуационные мероприятия при внутреннем заражении радиоактивными веществами
- •Глава 23. Сочетанные и комбинированные радиационные поражения
- •23.1* Сочетанные радиационные поражения
- •23.2. Комбинированные радиационные поражения
- •Глава 24. Технические средства индивидуальной и коллективной защиты
- •24.1. Средства индивидуальной защиты
- •24,1.1. Средства индивидуальной защиты органов дыхания
- •24.1.1.2. Факторы, определяющие порядок использования средств защиты органов дыхания
- •24.1.1.3. Использование сизод для защиты раненых и больных
- •24.1.2. Средства индивидуальной защиты кожи
- •24.1.2.1. Эксплуатационная характеристика
- •24.1.2.2. Факторы, определяющие порядок использования средств защиты кожных покровов
- •24*1.3. Средства индивидуальной защиты глаз
- •24.2. Коллективные средства защиты
- •Глава 25. Специальная обработка в подразделениях и частях медицинской службы
- •25.1. Основные понятия
- •25.2. Частичная специальная обработка
- •25.2.1. Средства, используемые
- •25.2.2. Организация и проведение частичной специальной обработки в медицинском пункте батальона
- •25.2.3. Организация и проведение частичной специальной обработки в медицинском пункте полка
- •25.3. Полная специальная обработка. Организация работы отделения специальной обработки (0с0)
- •Глава 26. Радиационная и химическая разведка в частях и подразделениях медицинской службы
- •26.1. Средства и методы радиационной разведки и контроля
- •26.2. Средства и методы химической разведки и контроля
- •26.3. Организация и проведение радиационной и химической разведки в подразделениях и частях медицинской службы
- •26.4. Организация и проведение контроля доз облучения личного состава, раненых и больных на этапах медицинской эвакуации
- •26.5. Организация и проведение экспертизы воды и продовольствия на зараженность отравляющими, высокотоксичными и радиоактивными веществами
- •Военная токсикология, радиобиология и медицинская защита
- •9785939290821Лицензия ид № 01081 от 28.02.2000 ооо «Издательство фолиант»
- •Ооо «Издательство фолиант»
- •190020, Санкт-Петербург, Нарвский пр., 18, оф. 501 тел./факс: (812) 325-39-86, 186-72-36 e-mail: foliant@peterlink.Ru
10.1.1.2.1. Нитро- и аминосоединения ароматического ряда
Нитро- и аминосоединения ароматического ряда, характерными представителями которых являются соответственно нитробензол и анилин, по механизму действия и картине острого отравления весьма сходны. Действие на кровь сопровождается появлением в эритроцитах метгемоглобина, сульфгемоглобина, телец Гейнца. Спустя несколько суток после воздействия развивается гемолиз. Кроме того, для веществ характерно действие на центральную нервную систему (наркотический эффект), поражение печени и почек.
Включение хлора в бензольное кольцо анилина или нитробензола приводит к усилению действия веществ на кровь. Введение алкильной группы — уменьшает острую токсичность. Присутствие карбоксильной группы, сульфогруппы резко уменьшает токсичность аналогов анилина и нитробензола.
Анилин
Физико-химические свойства
Анилин представляет собой вязкую, бесцветную, маслянистую жидкость, темнеющую на воздухе и на свету. Плохо растворяется в воде (до 4% при 20° С), хорошо — в органических растворителях, спирте, жирах. Летуч: насыщающая концентрация паров в воздухе при 25° С — 1,8 г/м3. Имеет характерный запах. Горюч. Взрывоопасен при температуре выше 40° С.
Анилин — один их наиболее крупнотоннажных продуктов органического синтеза. Мировое производство — более 1 млн тонн в год. Применяется в производстве лекарственных веществ, антиоксидантов, фотоматериалов, красителей и т. д. Ряд продуктов на основе анилина используют в качестве ракетных топлив.
При авариях анилин образует зоны стойкого химического заражения.
Токсичность
Чувствительность людей к анилину варьирует в широких пределах. Концентрация паров в воздухе 0,3-0,6 г/м3, как правило, переносится в течение часа без последствий. Действие вещества в более высоких концентрациях приводит к отравлению. При приеме через рот анилина в количестве 1 г может развиться смертельное отравление. При поступлении через кожу вещество еще более опасно.
Токсикокинетика
В виде паров действует через кожу с такой же скоростью, как и через дыхательные пути. В жидком виде всасывается через кожу в 1000 раз быстрее, чем в парообразном состоянии, при этом в организм проникает более 90% апплицированного вещества (высокая опасность кожной резорбции). Хорошо всасывается слизистой оболочкой желудочно-кишечного тракта. Попав в кровь, достаточно равномерно распределяется в органах и тканях.
Анилин, как и другие ароматические амины, подвергается биотрансформации. Процесс проходит в два этапа, главным образом в печени. На первом — происходит окислительное гидроксилирование бензольного кольца или N-гидроксилирование аминогруппы при участии моноокси-геназной системы эндоплазматического ретикулума гепатоцитов. В результате гидрокислирования ароматического кольца в орто- или пара-положении по отношению к аминогруппе образуются о- и п-аминофенолы. Образующиеся аминофенолы, по-видимому, способны превращаться в хинонимины. В результате N-гидроксилирования образуются промежуточные продукты — фенилгидроксиламин и нитрозобензол, способные к взаимному превращению по типу обратимой реакции (рис. 28).
NH2 NHOH
анилин фенилгидроксиламин
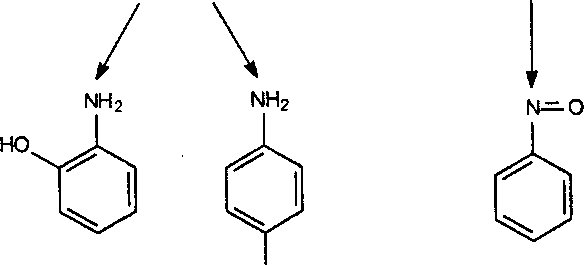
ОН
о-аминофенол п-аминофенол нитрозобензол
Рис. 28. Схема метаболизма анилина
Образовавшиеся в печени промежуточные продукты могут поступать в кровь и оказывать токсическое действие на эритроциты.
На втором этапе промежуточные продукты биопревращения, за счет главным образом фенольных групп, вступают в реакции конъюгации с глюкуроновой, серной кислотами и глутатионом, а также в реакцию N-ацетилирования. Конъюгаты — высокополярные, нетоксичные соединения — выводятся из организма с мочой. За сутки из организма в форме метаболитов выводится около 98% от введенного количества анилина (период полуэлиминации — 3,5 ч).
Нитробензол
Физико-химические свойства
Бесцветная или слегка желтоватая жидкость с характерным запахом горького миндаля (порог восприятия — 0,01 г/м3), плохо растворимая в воде (до 0,2% при 20° С), хорошо — в органических растворителях, спирте, жирах. Нитробензол медленно испаряется при температуре окружающего воздуха более 20° С. Смесь паров с воздухом взрывоопасна (нижний предел взрывоопасное™ смеси 1,8%).
При авариях нитробензол образует зоны стойкого химического заражения.
Токсичность
Ингаляция паров в концентрации 0,5 г/м3 в течение часа может привести к развитию острой интоксикации. При нанесении на кожу смертельная доза вещества для кошек составляет 0,5 г/кг. Человек более чувствителен к нитробензолу, чем лабораторные животные. Токсические дозы вещества для человека при приеме через рот неизвестны. Имеются данные, согласно которым несколько капель нитробензола, принятого внутрь, могут оказать смертельное действие.
Токсикокинетика
Нитробензол в виде пара и аэрозоля способен проникать в организм через органы дыхания и неповрежденную кожу. Высокая температура \ окружающего воздуха повышает вероятность ингаляционного отравле- | ния. Вещество хорошо всасывается в желудочно-кишечном тракте. После 1 поступления в кровь относительно равномерно распределяется между 1 тканями. 1
Нитросоединения, и в их числе нитробензол, восстанавливаются в op- | ганизме до аминосоединений при участии ферментов растворимой фрак- I ции митохондрий и гладкого эндоплазматического ретикулума печени. | Восстановление нитрогруппы протекает через ряд стадий с промежуточ- I ным образованием нитрозо- и гидрокисламинпроизводных: ArN02 — \ ArNO - ArNHOH - ArNH3. В результате одновременно протекающего ; гидрокислирования ароматического кольца в орто- или пара-положении : по отношению к нитрогруппе образуются о- и п-аминофенолы. Последние вступают в реакцию конъюгации с глюкуроновой и серной кислота- | ми и в форме конъюгатов выводятся с мочой из организма.
Механизм токсического действия
Механизм действия нитро- и аминосоединений неразрывно связан с их метаболизмом. По-видимому, образование метгемоглобина является следствием активации свободнорадикальных процессов в эритроцитах, «запускаемых» метаболитами нитро- и аминосоединений, включающимися в клетках-мишенях в окислительно-восстановительный цикл.
Свободные радикалы, такие как ArNO*, ArNHOH*, образующиеся в процессе восстановления нитрозогруппы в гидроксиламиногруппу, хинонимины, возникающие при окислении аминофенолов и др., могут активировать молекулярный кислород путем одновалентного восстановления последнего до супероксид-аниона (62*). Супероксид при взаимодействии с водой с большой скоростью дисмутирует с образованием перекиси водорода (Н2Ог). Действие супероксидного радикала и перекиси водорода на железо гемоглобина приводит к его окислению (метгемоглобинообра-зование):
окисленная
-». 02* + 02* + 2Н+ —Нр2+ 02
Ог* + гНгОг + 2Fe++ —*" 2*он + 20Н —Fe+++ + Ог
![]()
форма ксенобиотика
клеточная ~* / система -V
энзиматической е А активации f \
восстановленная форма ксенобиотика
Очевидно, что если действие ксенобиотика продолжается в течение достаточно длительного времени, механизмы антирадикальной защиты истощаются и происходит значительное повреждение гемоглобина. Наряду с другими компонентами противорадикальной защиты в эритроцитах отравленных снижается уровень восстановленного глутатиона. Поскольку этот трипептид выполняет функцию стабилизатора эритроцитар-ных мембран, истощение его пула сопровождается развитием гемолиза.
Полагают, что с учетом скорости накопления каждого из упомянутых выше активных метаболитов в организме и их активности относительное значение фенилгидроксиламина, о-аминофенола и п-аминофенола в образовании метгемоглобина при отравлении, в частности, анилином может быть оценено, соответственно, как 100:4:1.
Кроме метгемоглобинообразующих свойств метаболиты анилина и нитробензола рассматриваются и как мутагены, тератогены и канцерогены, вызывающие рак мочевого пузыря.
Считается, что бластомогенный и мутагенный эффекты, а также специфические очаговые некрозы печени, развивающиеся под влиянием веществ, обусловлены ковалентным связыванием активных радикалов веществ с молекулами ДНК, белками гепатоцитов, а также элементами микросомальной системы клеток.
Алкоголь значительно усиливает острую токсичность анилина и его производных. Это связывают со способностью этилового спирта индуцировать образование активных метаболитов (преимущественно N-гидро-ксилирование) в первой фазе биопревращения анилина и угнетать вторую фазу его метаболизма.
