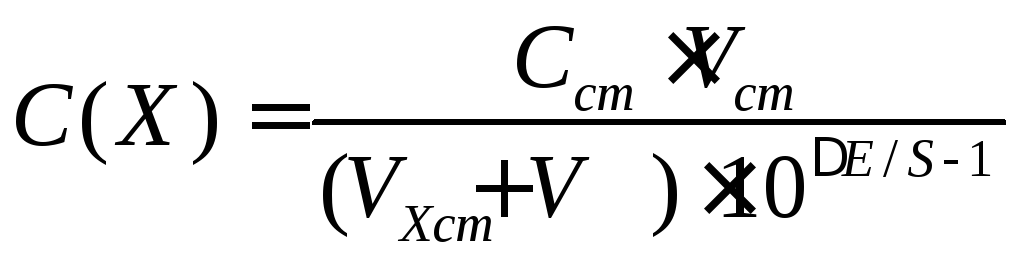- •1. Коhдуктометрия. Аhализ по электрической проводимости.
- •1.1. Теоретические основы
- •1.2. Кондуктометрическое титрование
- •2. Высокочастhое коhдуктометрическое титроваhие
- •2.1. Сущность метода
- •2.2. Практические работы
- •1. Аппаратура, материалы и реактивы
- •3. Выполнение работы
- •1) Установка точной концентрации титранта
- •1. Аппаратура, материалы и реактивы
- •2) Проведение титрования.
- •2.3. Вопросы и задачи
- •3. Потеhциометрия
- •3.1. Теоретические основы метода
- •3.1.1. Электродный потенциал
- •3.1.2. Сущность потенциометрического метода анализа
- •3.1.3. Индикаторные электроды
- •3.1.4. Электроды сравнения
- •3.1.5. Измерение потенциала индикаторного электрода
- •3.2. Прямые потенциометрические измерения
- •3.2.1. Измерение рH (активной кислотности среды)
- •3.2.2. Определение активности (концентрации) ионов с помощью ионоселективных электродов
- •3.2.3. Практические работы
- •1. Аппаратура, материалы и реактивы
- •2. Выполнение работы
- •3. Окончание работы
- •1. Аппаратура, материалы и реактивы
- •2.Выполнение работы
- •3.2.4. Вопросы и задачи
- •3.3. Потеhциометрическое титроваhие
- •3.3.1. Сущность метода
- •3.3.2. Способы нахождения точки эквивалентности
- •3.3.3. Практические работы
- •1. Аппаратура, материалы и реактивы
- •1. Аппаратура, материалы и реактивы
- •1. Аппаратура, материалы и реактивы
- •3.3.4. Вопросы и задачи
- •4. Вольтамперометрия
- •4.1. Полярография постоянного тока (классическая)
- •4.2. Теоретические основы полярографии
- •4.3. Электроды, применяемые в полярографии
- •4.4. Полярография переменного тока
- •4.5. Инверсионная вольтамперометрия.
- •4.5. Практические работы
- •1. Аппаратура, материалы и реактивы
- •1. Аппаратура, материалы и реактивы
- •2. Ход анализа
- •2. Проведение анализа по методу ива
- •2.1. Запись вольтамперных кривых (вольтамперограмм).
- •4.7. Вопросы и задачи
- •5. Амперометрическое титроваhие
- •5.1. Теоретические основы метода
- •5.2. Практические работы
- •1. Аппаратура, материалы и реактивы
- •2. Подготовка установки к работе
- •3. Выполнение работы
- •4. Окончание работы
- •5.3. Вопросы и задачи
- •125080, Москва, Волоколамское ш., 11
3.2. Прямые потенциометрические измерения
Прямая потенциометрия (рH-метрия, ионометрия) применяется для:
а) измерения рH растворов (активной кислотности среды);
б) измерения окислительно-восстановительного потенциала среды (ОВП) или характеристики окислительно-восстановительных свойств среды по показателю rH2
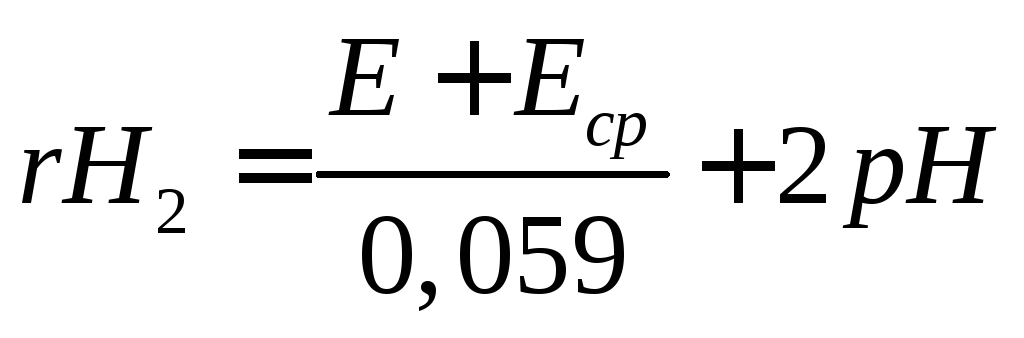
rH2 — отрицательный десятичный логарифм концентрации молекулярного водорода; Е — потенциал платинового электрода; Е ср — потенциал электрода сравнения относительно стандартного водородного электрода;
в) определения активности (концентрации) ионов в среде с помощью ионоселективных электродов.
3.2.1. Измерение рH (активной кислотности среды)
Для измерения рH можно использовать стандартный водородный электрод (см. раздел 3.1.4), т.к. его потенциал зависит от активности ионов водорода в растворе
![]() (3.10)
(3.10)
Так как Е°(2H+/H2)= 0 (см. раздел 3.1.4), рH = - lg a (H+), то
то
Е (2H+/H2)= - 0,059 рH (3.11)
Если для измерения рH взят в качестве индикаторного стандартный водородный электрод, а в качестве электрода сравнения - каломельный, то ЭДС составленного гальванического элемента
ЭДС = E (Hg2 Cl2 / Hg↓Cl-) - Е (2H+/H2) (3.12)
ЭДС = E (Hg2 Cl2 / Hg↓Cl-) + 0,059pH (3.13)
Значит
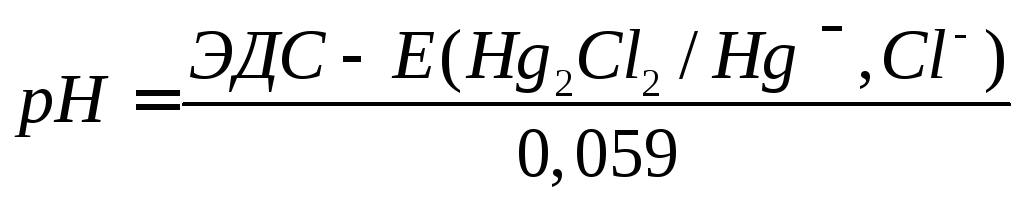 (3.14)
(3.14)
Однако применять стандартный водородный электрод в лабораторной практике очень трудно, поэтому для измерения рH растворов обычно используют в качестве индикаторного рH-стеклянный электрод.
Е ст.эл. = Е°ст.эл. - 0,059 рH
Схема гальванической цепи:
-
Стеклянный
рН-электрод
Исследуемый раствор
Хлорсеребряный электрод
сравнения
Eст.эл. Eср
Поскольку Е ст.эл. неизвестен, при использовании заводских рH-метров сначала проводят настройку приборов по стандартным буферным растворам, т.к. шкала рH-метров проградуирована в единицах рH. Затем измеряют рH исследуемого раствора.
3.2.2. Определение активности (концентрации) ионов с помощью ионоселективных электродов
При
достаточно высокой селективности
ионоселективного электрода в соответствии
с уравнением (3.7) потенциал ионоселективного
электрода Е ИСЭ
(при
25°С)

Е° ИСЭ — константа, зависящая от свойств ионоселективного электрода. В эту величину входит, в частности, потенциалы Е1 и Е2 (см. рис. 3.6).
ЭДС гальванического элемента, составленного из ионоселективного электрода и электрода сравнения, помещенных в исследуемый раствор, зависит, таким образом, от активности потенциалопределяющих ионов.
Поскольку ЕИСЭ зависит от активности потенциалопределяющих ионов в растворе, можно считать, что расчетным методом в прямой потенциометрии является использование уравнения электродного потенциала. По этому уравнению на основании измерения ЭДС соответствующих гальванических элементов можно вычислить активность потенциалопределяющего компонента. Однако, применение прямого расчетного метода сопряжено с трудностями, из которых можно выделить следующие:
1) стандартный потенциал мембранного электрода является достаточно сложной функцией ряда факторов, и поэтому трудно определяем;
2) результаты расчетов получают в значениях активности (а), а не концентрации (С), как это требуется при решении аналитических задач. Следовательно, надо знать коэффициенты активности (f)*, которые трудно установить для систем сложного и неизвестного состава.
______________
* a = f C
Если исходить из предположения, что в растворах с одинаковой ионной силой коэффициент активности индивидуального иона остается постоянным, то можно использовать концентрационную зависимость потенциала мембранного электрода: Е=f(-lgCi), где Ci — концентрация потенциалопределяющего иона. Поэтому наиболее распространенным в ионометрии является способ приготовления растворов как стандартных, так и исследуемых с постоянной и достаточно высокой ионной силой.
Прежде чем применить ионоселективный электрод для аналитической цели, необходимо провести его электрохимическое изучение, которое предусматривает установление основных характеристик — обратимости и селективности электрода.
Методом построения градуировочного графика определяют следующие основные параметры электрода: 1) область прямолинейной концентрационной зависимости потенциала; 2) угловой коэффициент наклона прямой Е = f(рСi) — крутизну электродной функции (S). S показывает, на сколько мВ изменяется потенциал электрода при изменении активности (концентрации) иона в растворе в 10 раз. Теоретические значения S для однозарядных ионов 59 мВ, для двухзарядных - 29,5 мВ при 25°С; 3) коэффициенты селективности относительно различных ионов; 4) время отклика электрода, т.е. время достижения равновесного или стационарного потенциала.
Методы количественного анализа
Метод градуировочного графика. Градуировочный график представляет зависимость между потенциалом электрода и активностью или концентрацией определяемых ионов. Строят градуировочный график в координатах Е — -lg a i или Е — -lg C i (рис. 3.7); угол наклона зависит от заряда иона и свойств электрода. Градуировочный график можно получить двумя способами. Первый из них предусматривает применение чистых растворов какой-либо полностью диссоциированной соли определяемого иона в пределах изучаемых концентраций. Для более сложных систем необходимо применять стандартные растворы, близкие по составу к исследуемым растворам или содержащие избыток индиферентного электролита (для поддержания постоянной ионной силы раствора).
Для построения градуировочного графика используют серию стандартных растворов с различной концентрацией определяемого иона.

Рис. 3.7. Градуировочный график для определения ионов натрия в растворе с помощью рNa-электрода.
Метод добавок. Этот метод рекомендуется использовать для определения ионов в сложных системах, содержащих высокие концентрации посторонних веществ.
Измеряют потенциал индикаторного электрода в исследуемом растворе. Затем в пробу исследуемого раствора вводят порцию стандартного раствора с таким условием, чтобы добавка не вызывала заметного изменения ионной силы раствора. При выполнении этого условия небольшим изменением коэффициента активности (fx) определяемого иона можно пренебречь, а наблюдаемое изменение ЭДС считать зависимым от концентрации (Сх) определяемого иона.
Потенциал электрода в исследуемом растворе
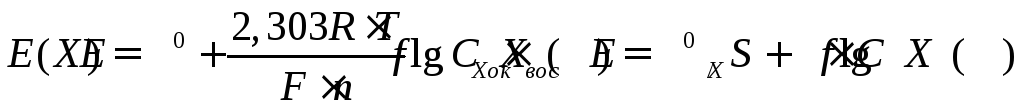 (3.16)
(3.16)
Потенциал электрода после введения добавки
EI(Х) = E° + S lg fХ (Cx + ΔC),
где Е(Х) и ЕI(Х) - потенциалы электрода в испытуемом растворе до и после добавления стандарта соответственно; S - крутизна электродной функции, полученная экспериментально на серии стандартных растворов в измеряемом диапазоне концентраций; С(Х) - концентрация определяемого иона; ΔС - приращение концентрации определяемого иона после введения добавки.
Тогда
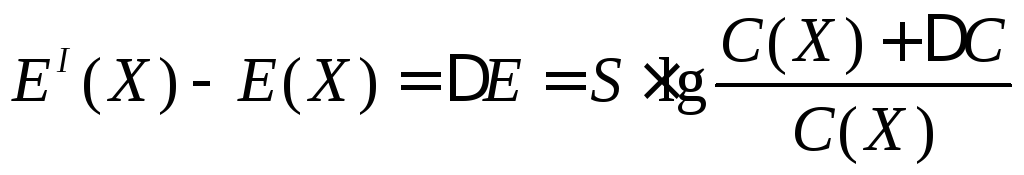
Решая уравнение относительно первоначальной концентрации иона в растворе, получим
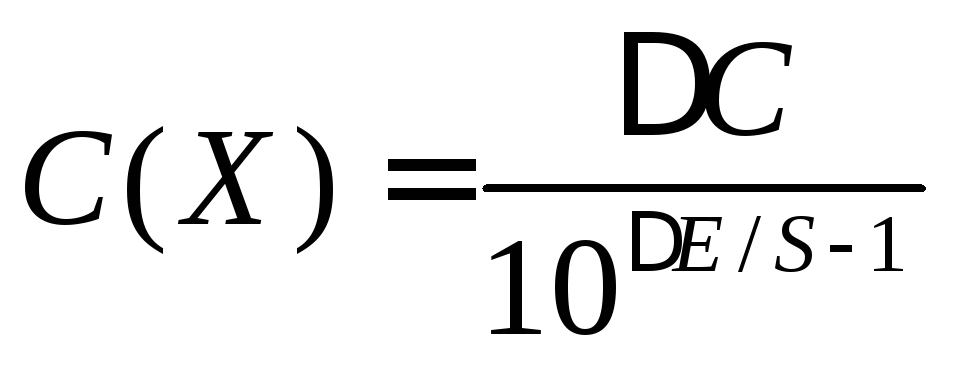
Выразив ΔС через концентрацию стандартного раствора Сст, приходим к выражению

где Vст - объем добавленной порции стандартного раствора; Vx - начальный объем испытуемого раствора.
Уравнение справедливо при условии, что объем Vст незначителен по сравнению с Vx. При необходимости учета разбавления от внесенной добавки общее уравнение для расчетов по методу добавок приобретает следующий вид: