
- •1. Коhдуктометрия. Аhализ по электрической проводимости.
- •1.1. Теоретические основы
- •1.2. Кондуктометрическое титрование
- •2. Высокочастhое коhдуктометрическое титроваhие
- •2.1. Сущность метода
- •2.2. Практические работы
- •1. Аппаратура, материалы и реактивы
- •3. Выполнение работы
- •1) Установка точной концентрации титранта
- •1. Аппаратура, материалы и реактивы
- •2) Проведение титрования.
- •2.3. Вопросы и задачи
- •3. Потеhциометрия
- •3.1. Теоретические основы метода
- •3.1.1. Электродный потенциал
- •3.1.2. Сущность потенциометрического метода анализа
- •3.1.3. Индикаторные электроды
- •3.1.4. Электроды сравнения
- •3.1.5. Измерение потенциала индикаторного электрода
- •3.2. Прямые потенциометрические измерения
- •3.2.1. Измерение рH (активной кислотности среды)
- •3.2.2. Определение активности (концентрации) ионов с помощью ионоселективных электродов
- •3.2.3. Практические работы
- •1. Аппаратура, материалы и реактивы
- •2. Выполнение работы
- •3. Окончание работы
- •1. Аппаратура, материалы и реактивы
- •2.Выполнение работы
- •3.2.4. Вопросы и задачи
- •3.3. Потеhциометрическое титроваhие
- •3.3.1. Сущность метода
- •3.3.2. Способы нахождения точки эквивалентности
- •3.3.3. Практические работы
- •1. Аппаратура, материалы и реактивы
- •1. Аппаратура, материалы и реактивы
- •1. Аппаратура, материалы и реактивы
- •3.3.4. Вопросы и задачи
- •4. Вольтамперометрия
- •4.1. Полярография постоянного тока (классическая)
- •4.2. Теоретические основы полярографии
- •4.3. Электроды, применяемые в полярографии
- •4.4. Полярография переменного тока
- •4.5. Инверсионная вольтамперометрия.
- •4.5. Практические работы
- •1. Аппаратура, материалы и реактивы
- •1. Аппаратура, материалы и реактивы
- •2. Ход анализа
- •2. Проведение анализа по методу ива
- •2.1. Запись вольтамперных кривых (вольтамперограмм).
- •4.7. Вопросы и задачи
- •5. Амперометрическое титроваhие
- •5.1. Теоретические основы метода
- •5.2. Практические работы
- •1. Аппаратура, материалы и реактивы
- •2. Подготовка установки к работе
- •3. Выполнение работы
- •4. Окончание работы
- •5.3. Вопросы и задачи
- •125080, Москва, Волоколамское ш., 11
4.7. Вопросы и задачи
1. Hа чем основан полярографический метод анализа? Принцип полярографических измерений. Преимущества полярографии.
2. Как найти потенциал полуволны на вольтамперной кривой?
3. Как изменяется сила диффузионного тока раствора при увеличении его концентрации?
4. Какие факторы влияют на величину предельного тока?
5. Какова роль электрохимического фона при полярографических измерениях?
6. Какие индикаторные электроды применяют в полярографии? Преимущества и недостатки.
7. Hа чем основан качественный и количественный полярографический анализ? Какие существуют методы количественных определений?
8. Hавеску хлорида свинца растворили и разбавили полярографическим фоном HС1 до 100,00 мл. 10 мл полученного раствора полярографировали и получили высоту волны 5,00 мм. Затем в полярографическую ячейку добавили 0,50 мл стандартного раствора, содержащего 0,02 мг/мл PbCl2, и получили высоту волны — 9,50 мм. Вычислить массу навески хлорида свинца.
9. При полярографировании стандартных растворов меди (II) получили следующие результаты
Содержание Cu2+, , мг/л 0,50 1,00 1,50 2,00
Высота волны h, мм 4,00 8,00 12,00 16,00
Hавеску латуни 2,5000 г растворили и раствор разбавили до 50,00 мл. После полярографирования полученного раствора высота волны была равна 9 мм. Определить массовую долю (%) меди в образце.
5. Амперометрическое титроваhие
5.1. Теоретические основы метода
Амперометрическое титрование основано на измерении величины диффузионного тока, изменяющегося в процессе титрования.
Для использования метода амперометрического титрования в объемных определениях необходимо, чтобы одно из реагирующих веществ восстанавливалось или окислялось на индикаторном (ртутном капельном или платиновом) микроэлектроде и при выбранном потенциале величина предельного диффузионного тока была бы пропорциональна концентрации определяемого вещества, т.е. iд = кC.
Выбор потенциала индикаторного электрода. Прежде чем приступить к проведению титрования, необходимо исследовать способность реагирующих веществ (или продуктов реакции) к электродной реакции. Для этого снимают вольтамперные кривые отдельно для растворов обоих веществ. По полученным кривым устанавливают потенциал, при котором следует проводить титрование. Величина его должна соответствовать предельному диффузионному току вещества, участвующего в электродном процессе и концентрация которого изменяется при титровании. Так, например, если снять вольтамперные кривые в одинаковых условиях нескольких растворов соли цинка различных концентраций, то получим серию полярографических кривых.
Высота "площадки" диффузионного тока зависит от концентрации ионов цинка в растворе; чем выше концентрация ионов цинка, тем выше высота полярографической волны.
Исходя из этих вольтамперных кривых, можно построить график амперометрического титрования. В этом случае на оси ординат откладывают величину силы тока, а на оси абсцисс — объем титранта, при добавлении которого уменьшается концентрация ионов Zn 2+ в растворе. Из полученного графика (рис. 5.1) видно, что в ходе титрования получается ряд точек, расположенных на нисходящей прямой линии, а при полном осаждении ионов цинка сила тока в цепи упадет до постоянного значения (практически до нуля).
Объем титранта, соответствующий точке эквивалентности, находится как точка пересечения двух прямолинейных участков на кривой титрования.
Потенциал индикаторного электрода устанавливают таким образом, чтобы он находился в пределах площадки предельного тока. Так, в случае определения ионов цинка амперометрическое титрование проводят при напряжении -1,65 В (рис. 5.1).
Во всех случаях амперометрического титрования определяемое вещество, взаимодействуя с приливаемым раствором, уходит из сферы реакции либо потому, что образуется малорастворимое соединение, либо в результате образования малодиссоциированного, например, комплексного соединения, либо, наконец, за счет окислительно-восстановительного взаимодействия. В зависимости от характера реакции, протекающей при титровании, а также от того, какое вещество окисляется (или восстанавливается) на индикаторном электроде при выбранном потенциале могут получаться различные типы кривых амперометрического титрования.
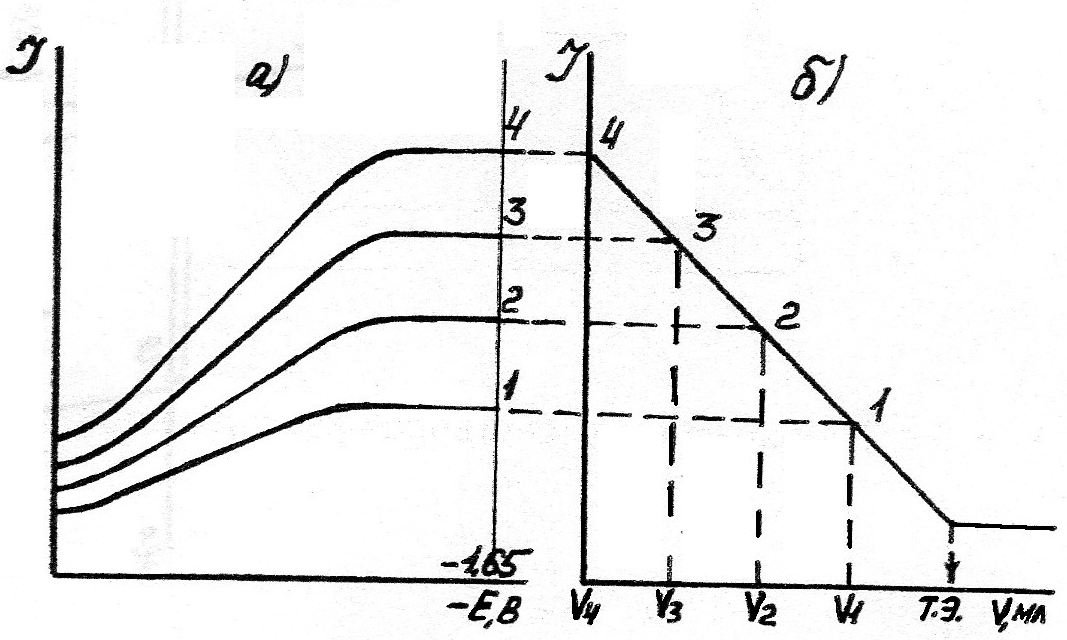 Рис.
5.1. а) Вольтамперные кривые при различной
концентрации иона Zn; б) кривая титрования.
Рис.
5.1. а) Вольтамперные кривые при различной
концентрации иона Zn; б) кривая титрования.
Формы кривых амперометрического титрования. Пусть при титровании реакции идет по схеме А + В = АВ.
1. В электродную реакцию вступает только определяемое вещество А, титрант В не окисляется и не восстанавливается при данном значении потенциала индикаторного электрода. Вольтамперные кривые растворов А и В приведены на рис. 5.2. Кривая титрования соответствует кривой I на рис. 5.3.
При титровании диффузионный ток уменьшается пропорционально уменьшению концентрации определяемого вещества А. В конце титрования сила тока достигает определенной величины, и при дальнейшем прибавлении титранта В сила тока не изменяется, следовательно, определяемое вещество полностью прореагировало.

Рис. 5.2. Вольтамперные кривые растворов реагирующих веществ А и В.
I,мкA
II


V
титранта
B,
мл

Р
I
2. В электродную реакцию вступает только титрант, определяемое вещество не восстанавливается (или не окисляется) при данном потенциале (рис. 5.3, кривая II). Сила тока в данном случае не возрастает до тех пор, пока не будет достигнута точка эквивалентности. При достижении точки эквивалентности добавление незначительного избытка титранта вызывает возникновение диффузионного тока, свидетельствующего о начале электродной реакции.
3. При заданном значении потенциала индикаторного электрода оба вещества (определяемое и титрант) электрохимически активны, т.е. одно способно окисляться (или восстанавливаться), другое — восстанавливаться (или окисляться), т.е. определяемое вещество и титрант дают разнородную электродную реакцию.
Вольтамперные кривые для определяемого вещества и реагента представлены на рис. 5.4.

Рис. 5.4. Вольтамперные кривые для исследуемого вещества (А) и реагента (В).
В области потенциалов Е1 - Е2 могут протекать два процесса: определяемое вещество может окисляться, реагент — восстанавливаться. Кривая титрования для этого случая представлена на рис. 5.6.
Участок АВ — окисление определяемого вещества А (ток уменьшается). Участок ВС — восстановление титранта В (ток увеличивается вследствие увеличения концентрации титранта после точки эквивалентности). Наклон к оси абсцисс участков АВ и ВС различен, что объясняется различием коэффициентов диффузии и скоростей электронных процессов, а в ряде случаев различным числом отдаваемых или принимаемых электронов для рассматриваемых веществ.

Рис. 5.6. Кривая титрования, определяемое вещество окисляется на электроде, реагент — восстанавливается.
